SNTESIS DE HETEROCICLOS Departamento de Qumica Orgnica Sntesis
































































- Slides: 122

SÍNTESIS DE HETEROCICLOS Departamento de Química Orgánica

Síntesis de Heterociclos Hexagonales

Síntesis de Piridinas

Síntesis de Piridinas 1, 5 -DICARBONILO + NH 3 (o AMINA) H+ -OH- -H+ [O] -H+ -H 2 Piridina Dihidropiridina -OH-

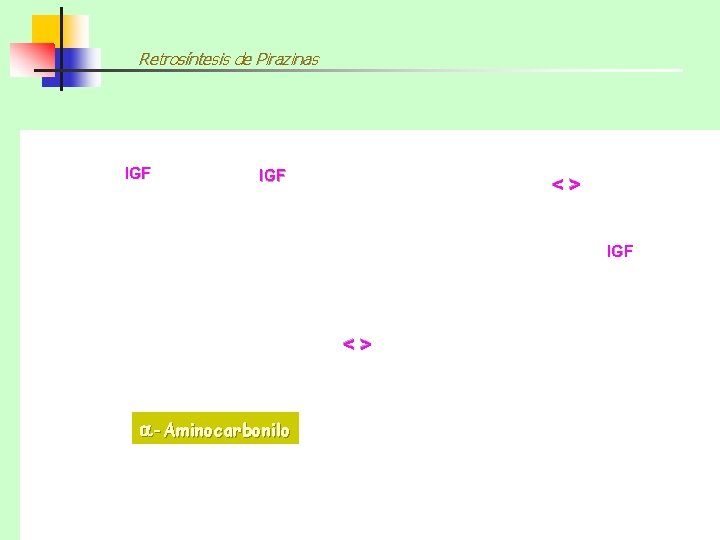
Retrosíntesis de Piridinas IGF <> 1, 5 -Dicarbonilo <> Amoníaco

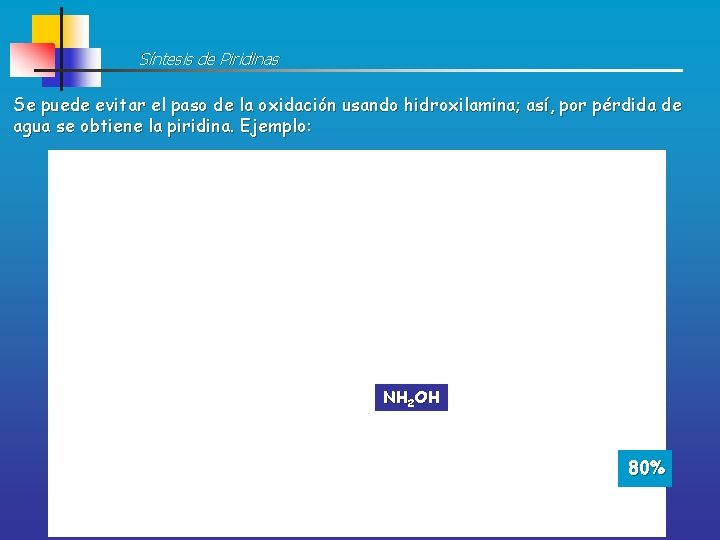
Síntesis de Piridinas Se puede evitar el paso de la oxidación usando hidroxilamina; así, por pérdida de agua se obtiene la piridina. Ejemplo: HNO 3 NH 2 OH 60% 80%

Síntesis de Piridinas SÍNTESIS DE HANTZSCH IGF Se obtienen piridinas simétricas por oxidación de las dihidropiridinas correspondientes El mecanismo que conduce a la dihidropiridina no se conoce con seguridad, parecen estar implicadas las siguientes etapas: - condensación aldólica entre el 1, 3 -dicarbonilo y el aldehído - adición de Michael - ciclación Dos posibles variantes mecanísticas

Síntesis de Piridinas Adición de Michael del enolato del 1, 3 -dicarbonilo para dar lugar al 1, 5 -dicarbonilo que por reacción con NH 3 conduce a la dihidropiridina

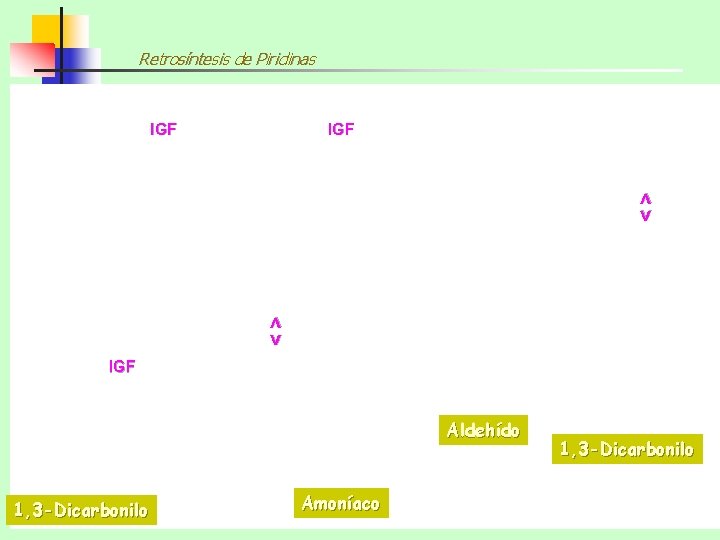
Retrosíntesis de Piridinas Amoníaco IGF <> <> <> IGF 1, 3 -Dicarbonilo Aldehído 1, 3 -Dicarbonilo

Síntesis de Piridinas Ejemplos: 83% Dos dihidropiridinas antagonistas del Ca 2+: Felodipino Nifedipino

Síntesis de Piridinas Adición de Michael de la enaminocetona, generada por reacción entre el 1, 3 -dicarbonilo y el NH 3 , conduce a la dihidropiridina

Retrosíntesis de Piridinas IGF <> <> IGF Aldehído 1, 3 -Dicarbonilo Amoníaco 1, 3 -Dicarbonilo

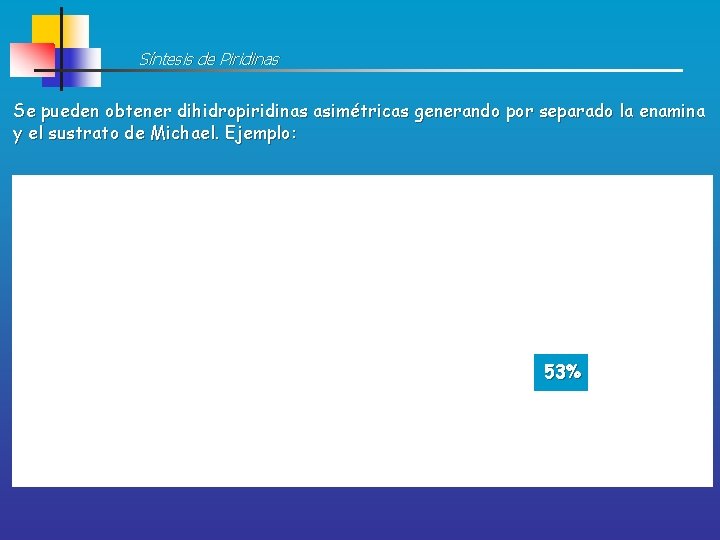
Síntesis de Piridinas Se pueden obtener dihidropiridinas asimétricas generando por separado la enamina y el sustrato de Michael. Ejemplo: 53%

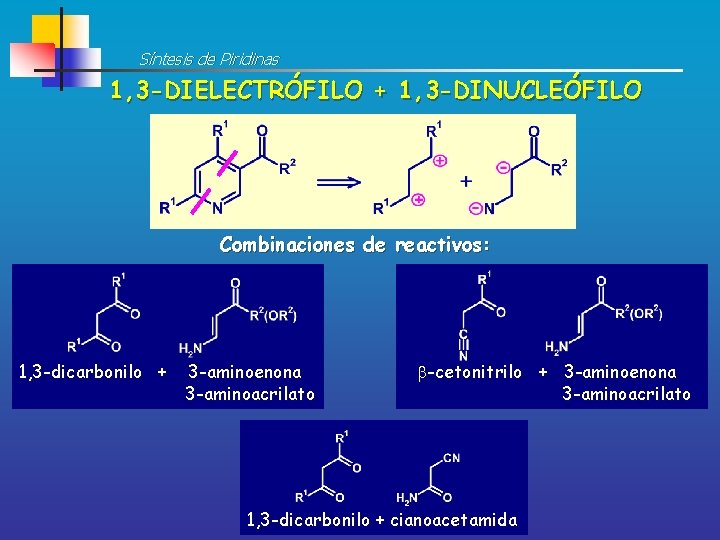
Síntesis de Piridinas 1, 3 -DIELECTRÓFILO + 1, 3 -DINUCLEÓFILO Combinaciones de reactivos: 1, 3 -dicarbonilo + 3 -aminoenona 3 -aminoacrilato -cetonitrilo + 3 -aminoenona 3 -aminoacrilato 1, 3 -dicarbonilo + cianoacetamida

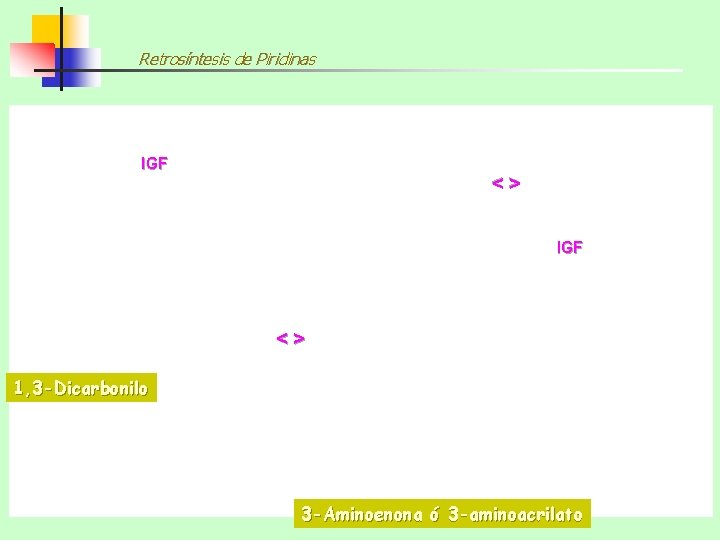
Retrosíntesis de Piridinas IGF <> 1, 3 -Dicarbonilo 3 -Aminoenona ó 3 -aminoacrilato

Síntesis de Piridinas 1, 3 -DICARBONILO + ENAMINA (3 -aminoenona o 3 -aminoacrilato) El mecanismo no se conoce con seguridad, una posibilidad es: H+ imina -H+ H+ enamina -OH- -H+

Síntesis de Piridinas Esta es la síntesis más versátil: permite el acceso a piridinas no simétricas a partir de precursores relativamente sencillos El 1, 3 -dicarbonilo más sencillo, el propanodial (malonaldehído) es demasiado inestable pero se genera a partir de su presursor, el dietilacetal-enoléter: 30%

Síntesis de Piridinas 1, 3 -DICARBONILO + CIANOACETAMIDA Se obtienen 3 -CIANO-2 -PIRIDONAS, es la síntesis de Guareschi: H+ -OH- -H 2 O -H+

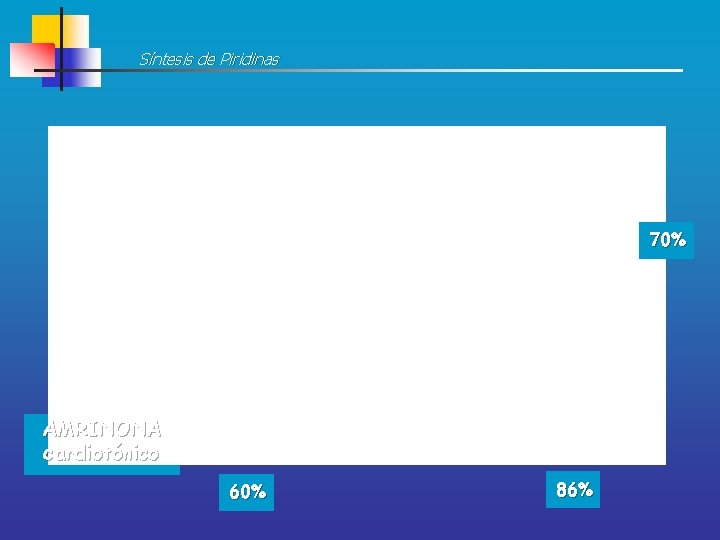
Síntesis de Piridinas 70% AMRINONA cardiotónico 60% 86%

Síntesis de Piridinas -CETONITRILO + ENAMINA (3 -aminoenona o 3 -aminoacrilato) Se obtienen 2 -AMINOPIRIDINAS: imina enamina imina

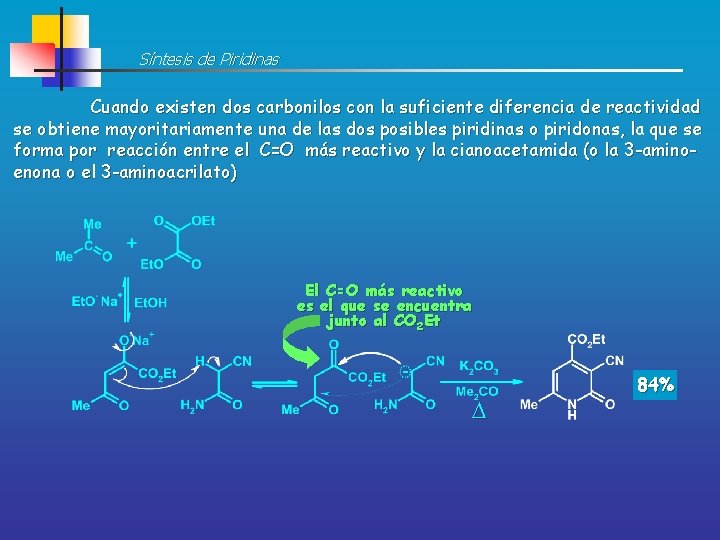
Síntesis de Piridinas Cuando existen dos carbonilos con la suficiente diferencia de reactividad se obtiene mayoritariamente una de las dos posibles piridinas o piridonas, la que se forma por reacción entre el C=O más reactivo y la cianoacetamida (o la 3 -aminoenona o el 3 -aminoacrilato) Aldehído más reactivo que cetona 60%

Síntesis de Piridinas Cuando existen dos carbonilos con la suficiente diferencia de reactividad se obtiene mayoritariamente una de las dos posibles piridinas o piridonas, la que se forma por reacción entre el C=O más reactivo y la cianoacetamida (o la 3 -aminoenona o el 3 -aminoacrilato) El C=O más reactivo es el que se encuentra junto al CO 2 Et 84%

Síntesis de Piridinas Un método de preparación de la PIRIDOXINA (vitamina B 6) construye el anillo de piridona por síntesis de Guareschi: Et. OH, 40% PIRIDOXINA Vitamina B 6 81% 32%

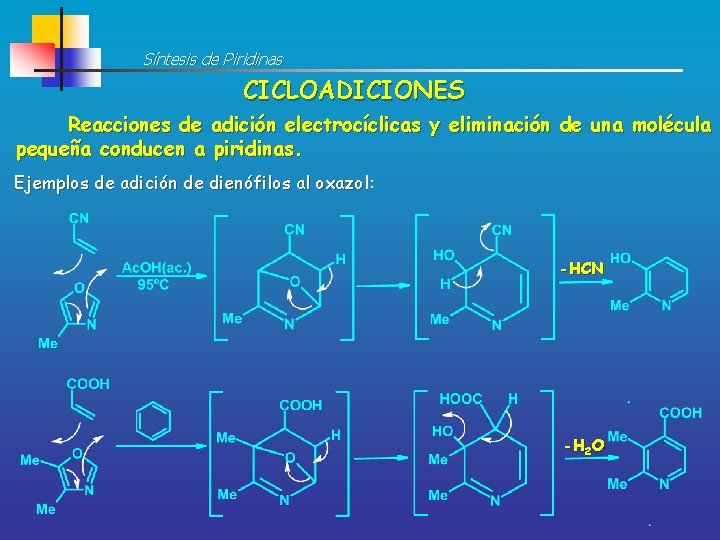
Síntesis de Piridinas CICLOADICIONES Reacciones de adición electrocíclicas y eliminación de una molécula pequeña conducen a piridinas. Ejemplos de adición de dienófilos al oxazol: -HCN -H 2 O

Síntesis de Quinolinas

Síntesis de Quinolinas 1, 3 -DINUCLEÓFILO + 1, 3 -DIELECTRÓFILO Combes Conrad-Limpach-Knorr Skraup 1, 4 - + 1, 2 - ELECTRÓFILO-NUCLEÓFILO Friedländer

Retrosíntesis de Quinolinas Combes Conrad-Limpach-Knorr (Quinolonas) IGF <> <> Anilina 1, 3 -Dicarbonilo

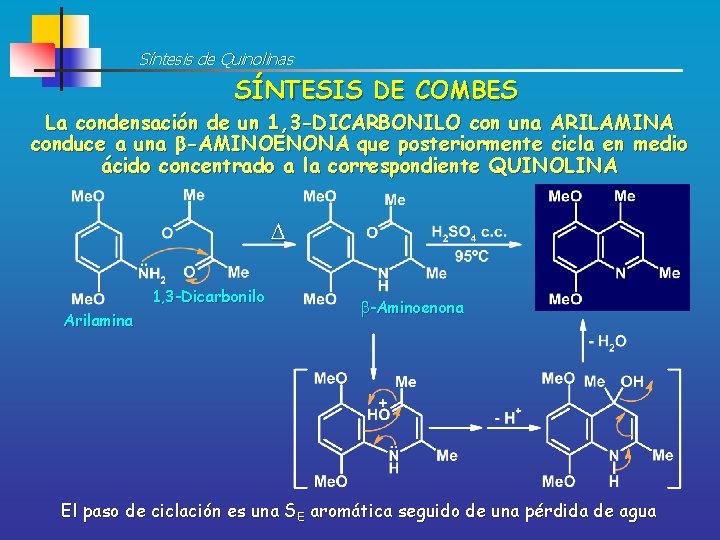
Síntesis de Quinolinas SÍNTESIS DE COMBES La condensación de un 1, 3 -DICARBONILO con una ARILAMINA conduce a una -AMINOENONA que posteriormente cicla en medio ácido concentrado a la correspondiente QUINOLINA 1, 3 -Dicarbonilo Arilamina -Aminoenona El paso de ciclación es una SE aromática seguido de una pérdida de agua

Síntesis de Quinolinas SÍNTESIS DE CONRAD-LIMPACH-KNORR Utiliza un -CETOÉSTER como 1, 3 -dicarbonilo y como 1, 3 -dinucleófilo una ARILAMINA y origina QUINOLONAS A bajas temperaturas, se obtiene el producto de control cinético, el -aminoacrilato, por reacción entre el -NH 2 y el carbonilo cetónico (el más reactivo). Su ciclación a alta temperatura conduce a la 4 -quinolona: -Aminoacrilato 70% A altas temperaturas, se forma, el producto de control termodinámico, la amida (más estable) que por calefacción conduce a la 2 -quinolona: Amida 50%

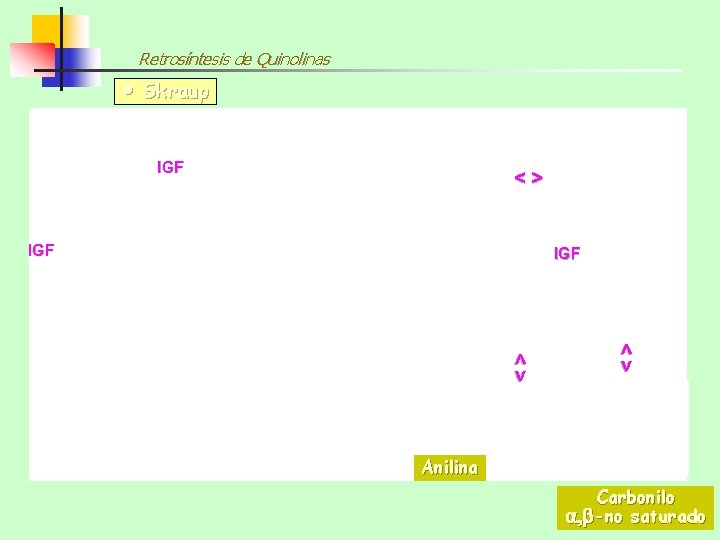
Retrosíntesis de Quinolinas Skraup IGF <> <> Anilina Carbonilo , -no saturado

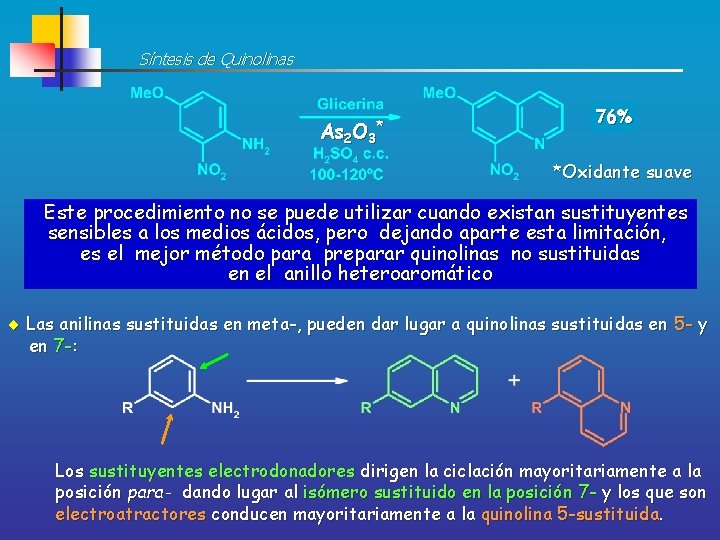
Síntesis de Quinolinas SÍNTESIS DE SKRAUP Por calefacción de anilina, glicerina, ácido sulfúrico concentrado y un oxidante suave como el nitrobenceno se obtiene la QUINOLINA La glicerina se deshidrata y genera “in situ” ACROLEINA (1, 3 -dielectrófilo):

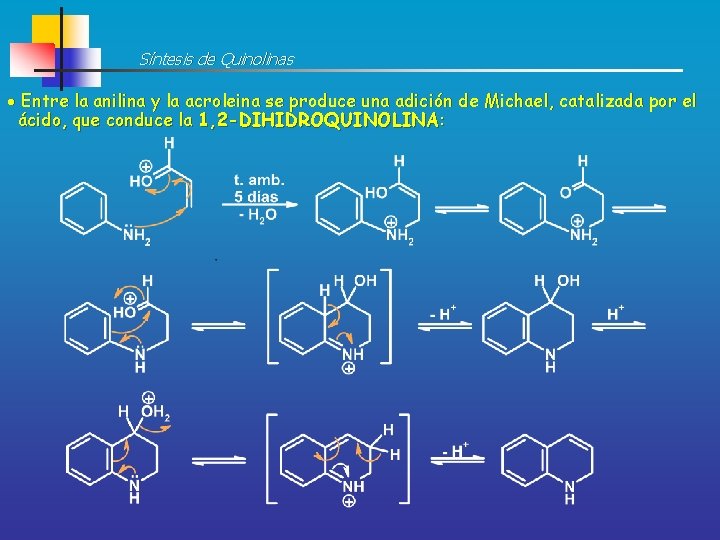
Síntesis de Quinolinas Entre la anilina y la acroleina se produce una adición de Michael, catalizada por el ácido, que conduce la 1, 2 -DIHIDROQUINOLINA:

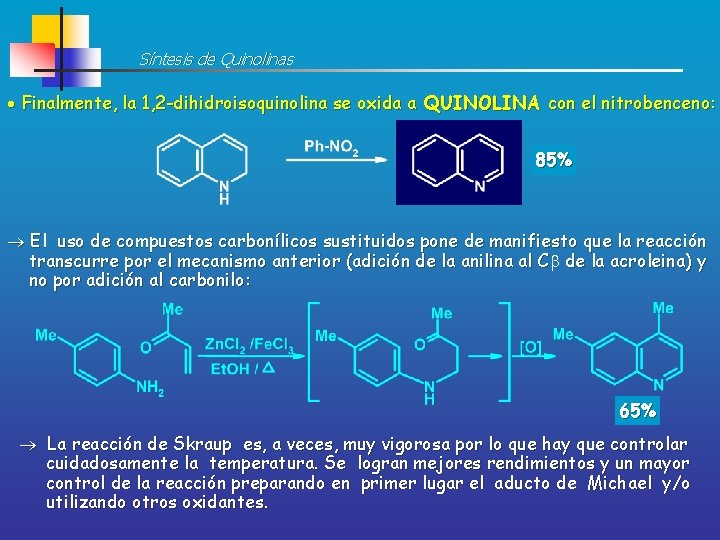
Síntesis de Quinolinas Finalmente, la 1, 2 -dihidroisoquinolina se oxida a QUINOLINA con el nitrobenceno: 85% El uso de compuestos carbonílicos sustituidos pone de manifiesto que la reacción transcurre por el mecanismo anterior (adición de la anilina al C de la acroleina) y no por adición al carbonilo: 65% La reacción de Skraup es, a veces, muy vigorosa por lo que hay que controlar cuidadosamente la temperatura. Se logran mejores rendimientos y un mayor control de la reacción preparando en primer lugar el aducto de Michael y/o utilizando otros oxidantes.

Síntesis de Quinolinas * As 2 O 3 76% *Oxidante suave Este procedimiento no se puede utilizar cuando existan sustituyentes sensibles a los medios ácidos, pero dejando aparte esta limitación, es el mejor método para preparar quinolinas no sustituidas en el anillo heteroaromático Las anilinas sustituidas en meta-, pueden dar lugar a quinolinas sustituidas en 5 - y en 7 -: Los sustituyentes electrodonadores dirigen la ciclación mayoritariamente a la posición para- dando lugar al isómero sustituido en la posición 7 - y los que son electroatractores conducen mayoritariamente a la quinolina 5 -sustituida.

Retrosíntesis de Quinolinas Friedländer IGF <> <> orto-Acilanilina Carbonilo enolizable

Síntesis de Quinolinas SÍNTESIS DE FRIEDLÄNDER Se utiliza una orto-ACILANILINA como 1, 4 -electrófilo-nucleófilo y un CARBONILO ENOLIZABLE como 1, 2 -electrófilo-nucleófilo La orientación en la condensación y por tanto en el cierre del anillo depende de las condiciones utilizadas En medio básico a bajas temperaturas (control cinético) la reacción transcurre más rápidamente por el enolato menos impedido estéricamente: 71% H más ácidos ENOLATO MENOS IMPEDIDO

Síntesis de Quinolinas

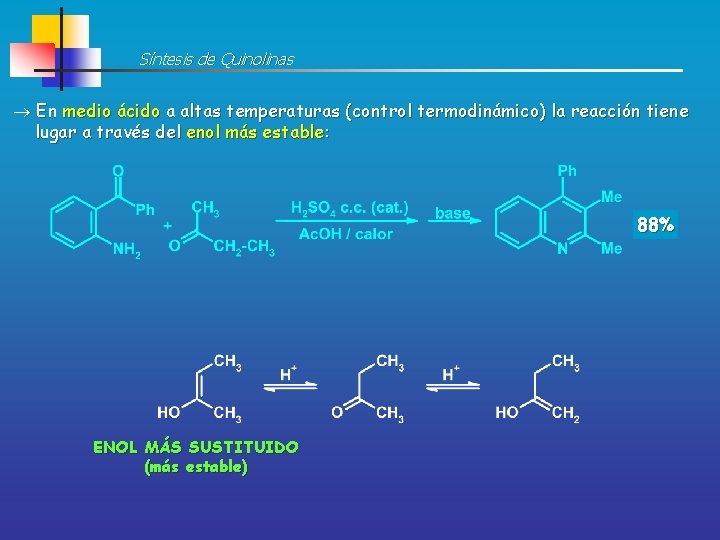
Síntesis de Quinolinas En medio ácido a altas temperaturas (control termodinámico) la reacción tiene lugar a través del enol más estable: 88% ENOL MÁS SUSTITUIDO (más estable)

Síntesis de Quinolinas

Síntesis de Isoquinolinas

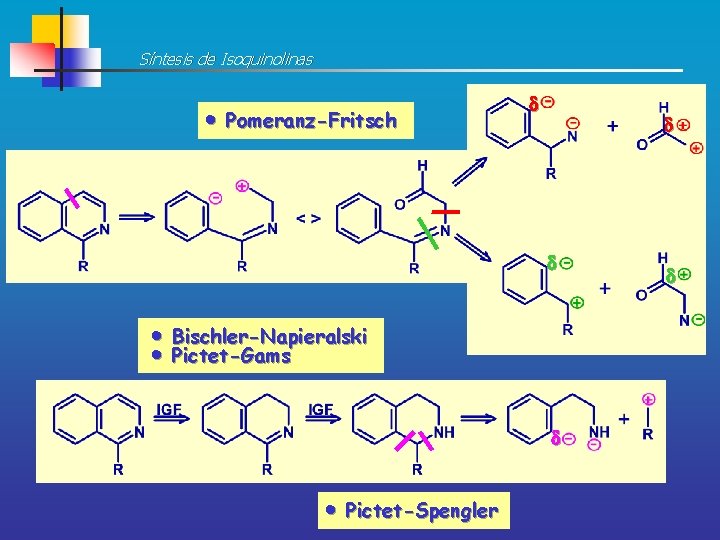
Síntesis de Isoquinolinas Pomeranz-Fritsch d d d Bischler-Napieralski Pictet-Gams d Pictet-Spengler d

Retrosíntesis de Isoquinolinas Pomeranz-Fritsch IGF R=H <> IGF <> <> Aldehído aromático -Aminoaldehído

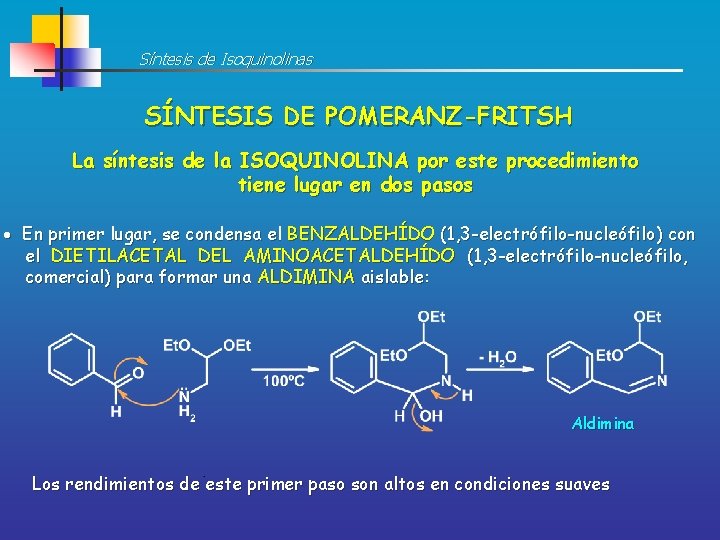
Síntesis de Isoquinolinas SÍNTESIS DE POMERANZ-FRITSH La síntesis de la ISOQUINOLINA por este procedimiento tiene lugar en dos pasos En primer lugar, se condensa el BENZALDEHÍDO (1, 3 -electrófilo-nucleófilo) con el DIETILACETAL DEL AMINOACETALDEHÍDO (1, 3 -electrófilo-nucleófilo, comercial) para formar una ALDIMINA aislable: Aldimina Los rendimientos de este primer paso son altos en condiciones suaves

Síntesis de Isoquinolinas A continuación, la aldimina cicla con ácido fuerte a una IMINA que por eliminación de etanol conduce a ISOQUINOLINA Imina 45% Un proceso competitivo que reduce el rendimiento del proceso es la hidrólisis de la imina Este segundo paso es una SEAr y esto explica el hecho de que la reacción vaya mejor con sustituyentes electrodonadores y peor con electroatractores, a pesar de ello es el mejor procedimiento para obtener isoquinolinas con R electroatractores en el anillo carboaromático:

Síntesis de Isoquinolinas 30% 89% Los grupos electrodonadores en posición m- respecto al grupo formilo son los que más aceleran la reacción (deslocalizan carga en las dos posiciones orto- al –CHO) dirigiendo la ciclación a la posición p- con respecto a ellos dando lugar a isoquinolinas 7 -sustituidas: Posición impedida Posición reactiva R = electrodonador Este método de síntesis no permite acceder fácilmente a isoquinolinas sustituidas en C-1 pues el primer paso implicaría formar una cetenimina a partir del dietilacetal del aminoacetaldehído y una cetona, y este proceso no está favorecido (el C=O cetónico es menos E+ y está más impedido)

Retrosíntesis de Isoquinolinas Pomeranz-Fritsch (variante para R H en C-1) <> R H IGF <> Bencilamina Glioxal

Síntesis de Isoquinolinas Se pueden preparar isoquinolinas sustituidas en C-1 con una variante que utiliza una BENCILAMINA adecuadamente sustituida como 1, 4 -dinucleófilo y el DIETILACETAL DEL GLIOXAL como 1, 2 -dielectrófilo: Imina 75% 50% Ni el método de Pomeranz-Fritsch ni su variante, permiten preparar isoquinolinas sustituidas en C-3 ni en C-4, es decir, que estos no son métodos útiles para sintetizar isoquinolinas con sustituyentes en el anillo heteroaromático

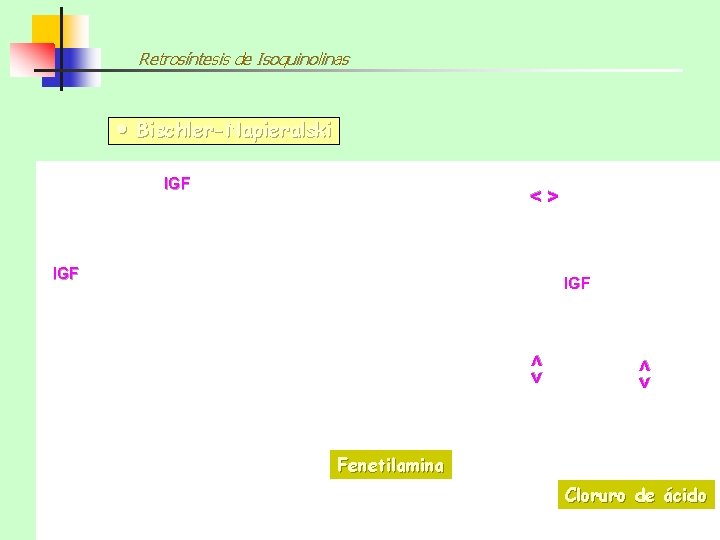
Retrosíntesis de Isoquinolinas Bischler-Napieralski IGF <> <> IGF Fenetilamina Cloruro de ácido

Síntesis de Isoquinolinas SÍNTESIS DE BISCHLER-NAPIERALSKI Este procedimiento implica la reacción de una FENETILAMINA (1, 5 -dinucleófilo) con un CLORURO O UN ANHIDRIDO DE ÁCIDO (electrófilo) para formar una AMIDA cuya ciclación con pérdida de agua conduce a una 3, 4 -DIHIDROISOQUINOLINA que se puede deshidrogenar (oxidarse) a la ISOQUINOLINA correspondiente con paladio, azufre o disulfuro de difenilo 95% 83% 93% Los agentes de ciclación más comúnmente utilizados son: P 2 O 5 (pentóxido de fósforo) POCl 3 (oxicloruro de fósforo) y SOCl 2 (cloruro de tionilo)

Síntesis de Isoquinolinas El paso de ciclación es una SEAr y por tanto se verá favorecido por sustituyentes electrodonadores en el anillo aromático de la fenetilamina. Las fenetilaminas m- sustituidas conducen exclusivamente a isoquinolinas sustituidas en C-6 pues la ciclación ocurre en pdel grupo activante: Posición más impedida 88% SÍNTESIS DE PICTET-GAMS Es una modificación de la síntesis de Bischler-Napieralski, se utilizan FENETILAMINAS potencialmente insaturadas obteniéndose así el HETEROCICLO totalmente AROMÁTICO y siendo, por tanto, innecesario el paso de oxidación: 77%

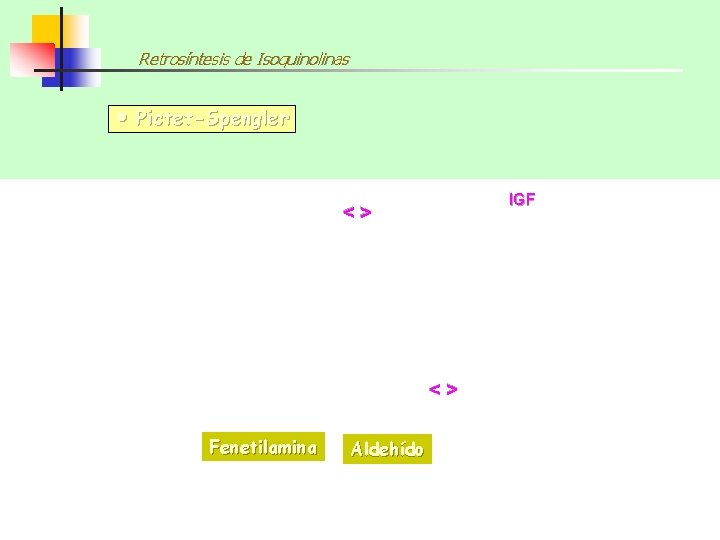
Retrosíntesis de Isoquinolinas Pictet-Spengler IGF <> <> Fenetilamina Aldehído

Síntesis de Isoquinolinas SÍNTESIS DE PICTET-SPENGLER Las FENETILAMINAS también pueden reaccionar con ALDEHÍDOS fácilmente y con buenos rendimientos dando ALDIMINAS que pueden ciclar en medio ácido a 1, 2, 3, 4 -TETRAHIDROISOQUINOLINAS 80% De nuevo la ciclación es una SEAr y se verá favorecida por sustituyentes electrodonadores

Síntesis de Isoquinolinas La ciclación precisa de sustituyentes activantes colocados adecuadamente, es decir, activando las posiciones orto- al grupo aminoetilo El cierre del anillo siempre sucede en para- respecto al grupo activante Cuando el anillo aromático está muy activado con sustituyentes hidroxílicos, el cierre del anillo se produce en condiciones muy suaves (“fisiológicas”): 84%

Síntesis de Diazinas

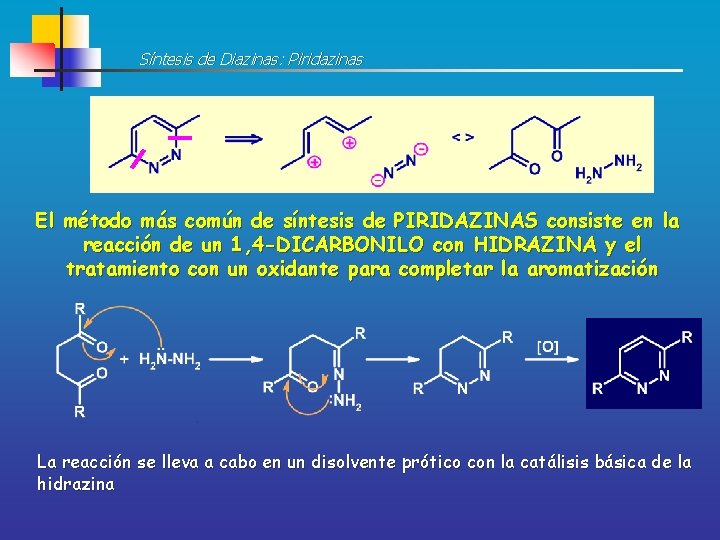
Síntesis de Diazinas: Piridazinas El método más común de síntesis de PIRIDAZINAS consiste en la reacción de un 1, 4 -DICARBONILO con HIDRAZINA y el tratamiento con un oxidante para completar la aromatización La reacción se lleva a cabo en un disolvente prótico con la catálisis básica de la hidrazina

Retrosíntesis de Piridazinas IGF <> 1, 4 -Dicarbonilo Hidrazina

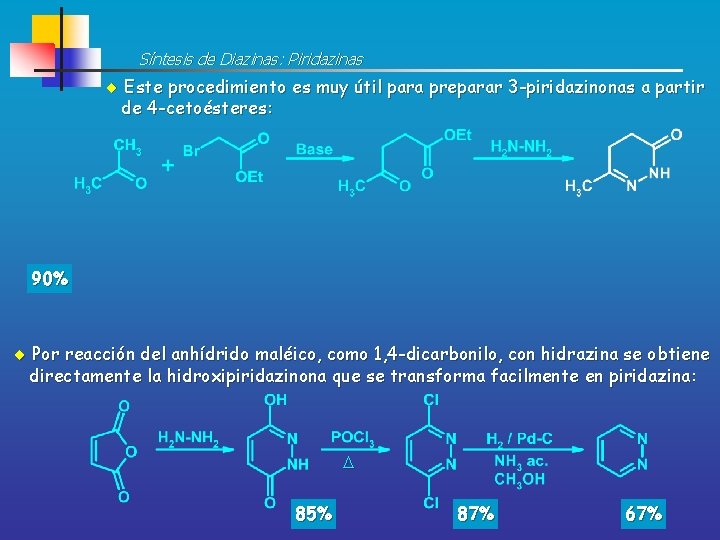
Síntesis de Diazinas: Piridazinas Este procedimiento es muy útil para preparar 3 -piridazinonas a partir de 4 -cetoésteres: 90% Por reacción del anhídrido maléico, como 1, 4 -dicarbonilo, con hidrazina se obtiene directamente la hidroxipiridazinona que se transforma facilmente en piridazina: 85% 87% 67%

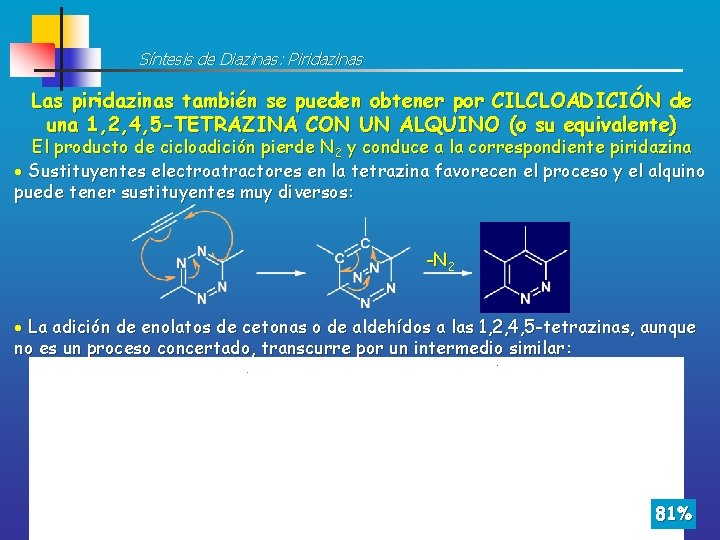
Síntesis de Diazinas: Piridazinas Las piridazinas también se pueden obtener por CILCLOADICIÓN de una 1, 2, 4, 5 -TETRAZINA CON UN ALQUINO (o su equivalente) El producto de cicloadición pierde N 2 y conduce a la correspondiente piridazina Sustituyentes electroatractores en la tetrazina favorecen el proceso y el alquino puede tener sustituyentes muy diversos: -N 2 La adición de enolatos de cetonas o de aldehídos a las 1, 2, 4, 5 -tetrazinas, aunque no es un proceso concertado, transcurre por un intermedio similar : 81%

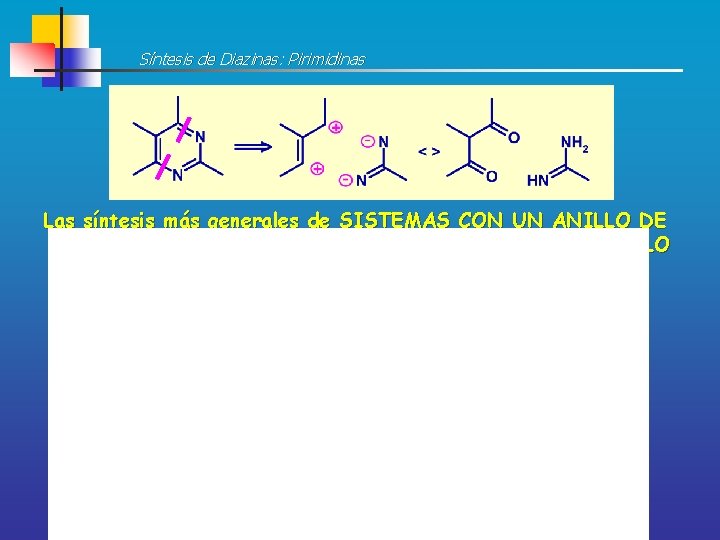
Síntesis de Diazinas: Pirimidinas Las síntesis más generales de SISTEMAS CON UN ANILLO DE PIRIMIDINA suponen la combinación de un 1, 3 -DICARBONILO con un FRAGMENTO N-C-N

Retrosíntesis de Pirimidinas IGF <> 1, 3 -Dicarbonilo N-C-N

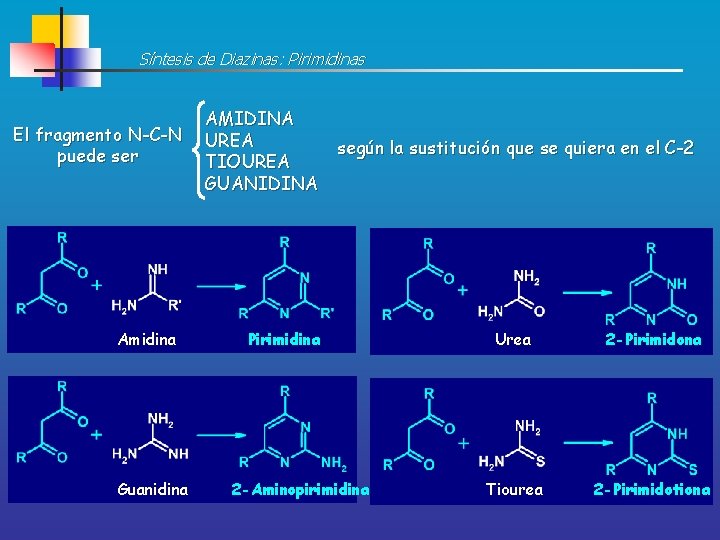
Síntesis de Diazinas: Pirimidinas El fragmento N-C-N puede ser Amidina Guanidina AMIDINA UREA TIOUREA GUANIDINA según la sustitución que se quiera en el C-2 Pirimidina 2 -Aminopirimidina Urea 2 -Pirimidona Tiourea 2 -Pirimidotiona

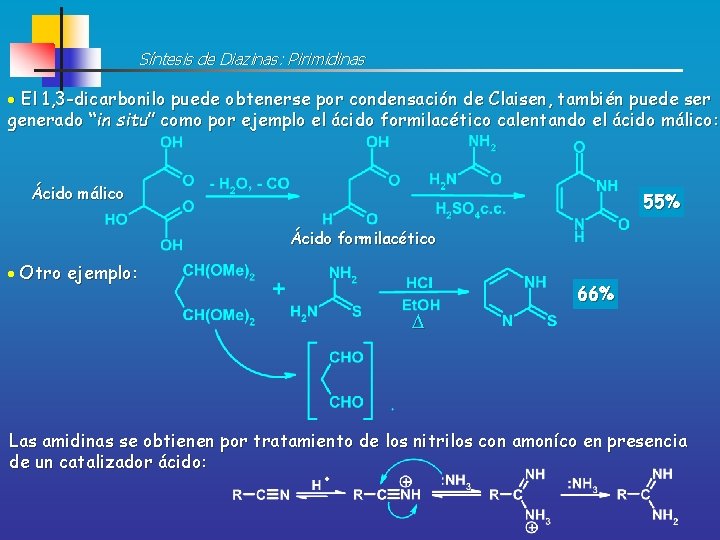
Síntesis de Diazinas: Pirimidinas El 1, 3 -dicarbonilo puede obtenerse por condensación de Claisen, también puede ser generado “in situ” como por ejemplo el ácido formilacético calentando el ácido málico: Ácido málico 55% Ácido formilacético Otro ejemplo: 66% Las amidinas se obtienen por tratamiento de los nitrilos con amoníco en presencia de un catalizador ácido:

Síntesis de Diazinas: Pirimidinas Un nitrilo también puede servir como equivalente de un carbonilo: 87% Otro ejemplo: 80% Las pirimidinas también se pueden obtener por CICLOADICIÓN entre una 1, 3, 5 -TRIAZINA y un ALQUINO -HCN

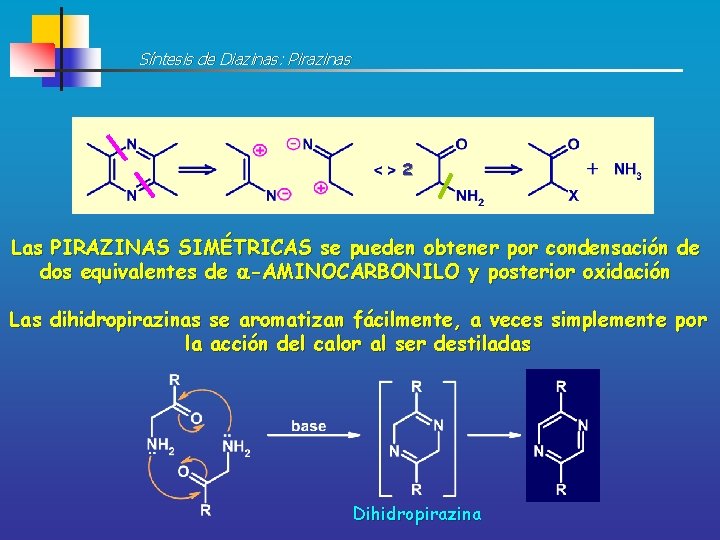
Síntesis de Diazinas: Pirazinas 2 Las PIRAZINAS SIMÉTRICAS se pueden obtener por condensación de dos equivalentes de -AMINOCARBONILO y posterior oxidación Las dihidropirazinas se aromatizan fácilmente, a veces simplemente por la acción del calor al ser destiladas Dihidropirazina

Retrosíntesis de Pirazinas IGF <> -Aminocarbonilo

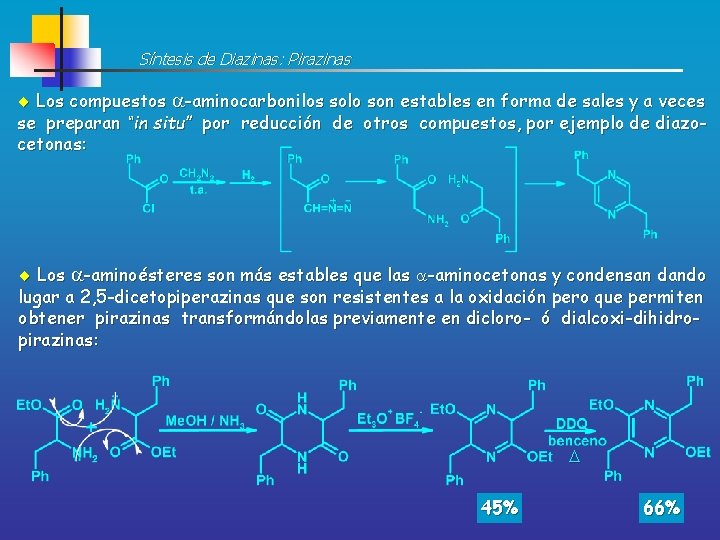
Síntesis de Diazinas: Pirazinas Los compuestos -aminocarbonilos solo son estables en forma de sales y a veces se preparan “in situ” por reducción de otros compuestos, por ejemplo de diazocetonas: Los -aminoésteres son más estables que las -aminocetonas y condensan dando lugar a 2, 5 -dicetopiperazinas que son resistentes a la oxidación pero que permiten obtener pirazinas transformándolas previamente en dicloro- ó dialcoxi-dihidropirazinas: 45% 66%

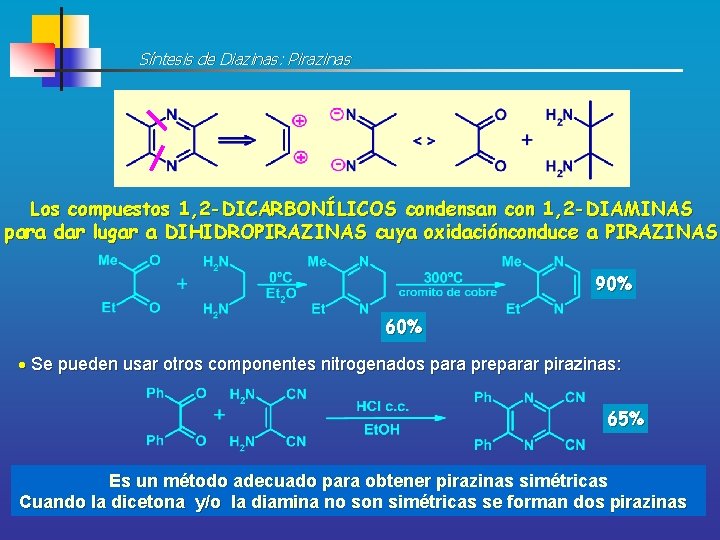
Síntesis de Diazinas: Pirazinas Los compuestos 1, 2 -DICARBONÍLICOS condensan con 1, 2 -DIAMINAS para dar lugar a DIHIDROPIRAZINAS cuya oxidaciónconduce a PIRAZINAS 90% 60% Se pueden usar otros componentes nitrogenados para preparar pirazinas: 65% Es un método adecuado para obtener pirazinas simétricas Cuando la dicetona y/o la diamina no son simétricas se forman dos pirazinas

Retrosíntesis de Pirazinas IGF <> IGF 1, 2 -Dicarbonilo <> <> IGF 1, 2 -Diamina

Síntesis de Heterociclos Pentagonales PIRROLES

Retrosíntesis de Pirroles IGF <> 1, 4 -Dicarbonilo <> IGF Amina 1 aria ó NH 3

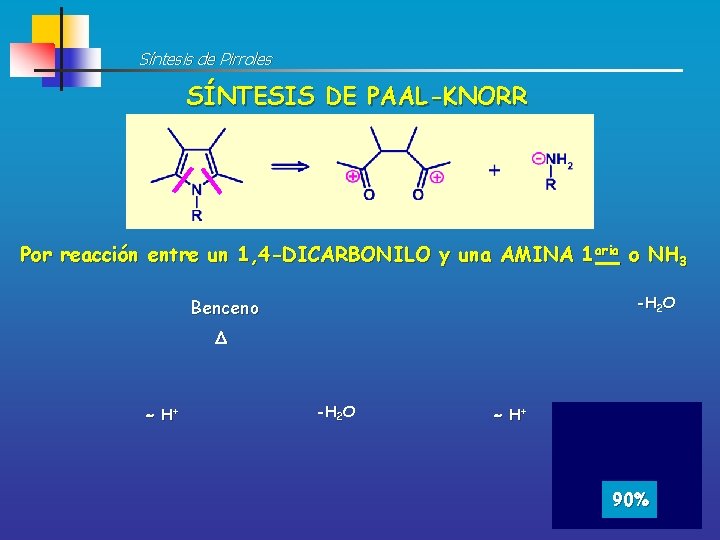
Síntesis de Pirroles SÍNTESIS DE PAAL-KNORR Por reacción entre un 1, 4 -DICARBONILO y una AMINA 1 aria o NH 3 -H 2 O Benceno D H+ -H 2 O H+ 90%

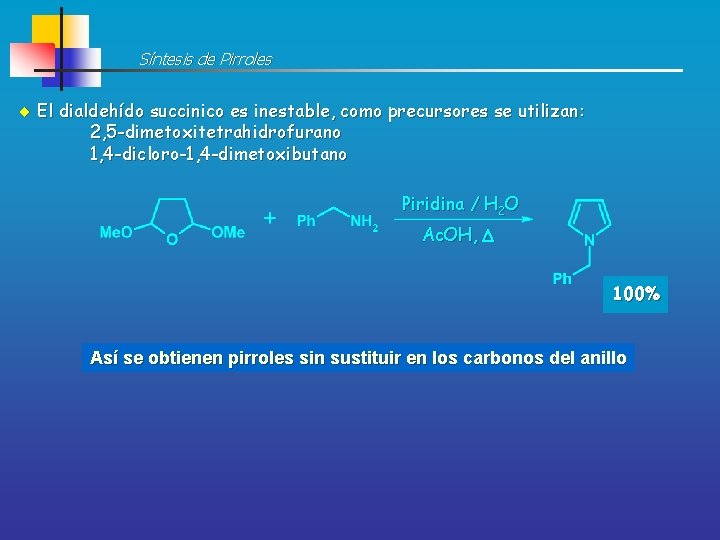
Síntesis de Pirroles El dialdehído succinico es inestable, como precursores se utilizan: 2, 5 -dimetoxitetrahidrofurano 1, 4 -dicloro-1, 4 -dimetoxibutano Piridina / H 2 O Ac. OH, D 100% Así se obtienen pirroles sin sustituir en los carbonos del anillo

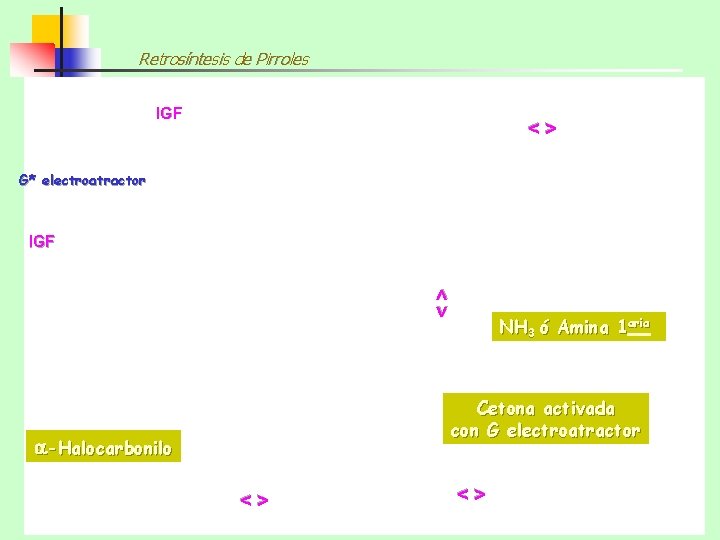
Retrosíntesis de Pirroles IGF <> G* electroatractor <> IGF -Aminocarbonilo Cetona activada con G electroatractor

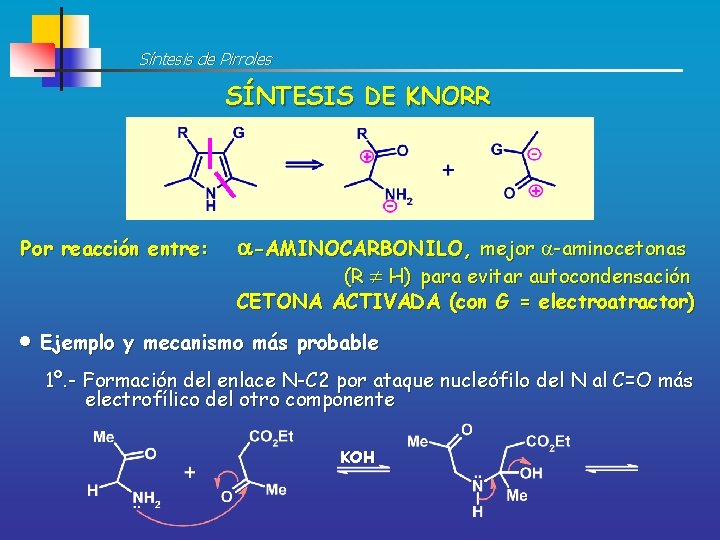
Síntesis de Pirroles SÍNTESIS DE KNORR Por reacción entre: -AMINOCARBONILO, mejor -aminocetonas (R H) para evitar autocondensación CETONA ACTIVADA (con G = electroatractor) Ejemplo y mecanismo más probable 1º. - Formación del enlace N-C 2 por ataque nucleófilo del N al C=O más electrofílico del otro componente KOH

Síntesis de Pirroles 2º. - Formación del enlace C 3 -C 4 por ataque de la enamina como nucleófilo sobre el C=O más electrofílico imina H+ enamina -H 2 O H+ Así se obtienen pirroles con grupos electroatractores en C-3 y sustituidos en los carbonos C-2 y C-4

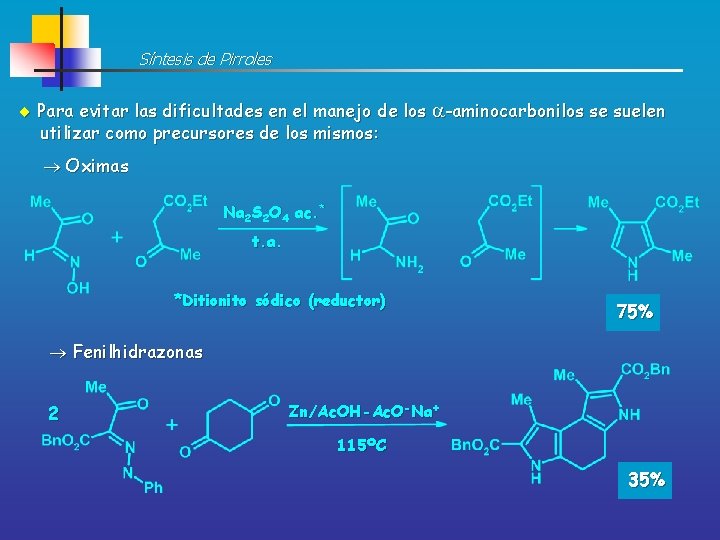
Síntesis de Pirroles Para evitar las dificultades en el manejo de los -aminocarbonilos se suelen utilizar como precursores de los mismos: Oximas Na 2 S 2 O 4 ac. * t. a. *Ditionito sódico (reductor) 75% Fenilhidrazonas 2 Zn/Ac. OH-Ac. O-Na+ 115ºC 35%

Retrosíntesis de Pirroles IGF <> G* electroatractor <> IGF NH 3 ó Amina 1 aria Cetona activada con G electroatractor <> -Halocarbonilo <>

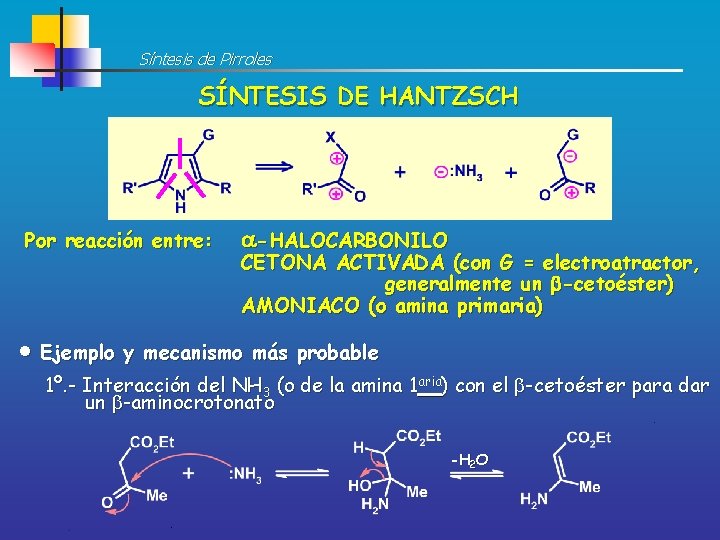
Síntesis de Pirroles SÍNTESIS DE HANTZSCH Por reacción entre: -HALOCARBONILO CETONA ACTIVADA (con G = electroatractor, generalmente un -cetoéster) AMONIACO (o amina primaria) Ejemplo y mecanismo más probable 1º. - Interacción del NH 3 (o de la amina 1 aria) con el -cetoéster para dar un -aminocrotonato -H 2 O

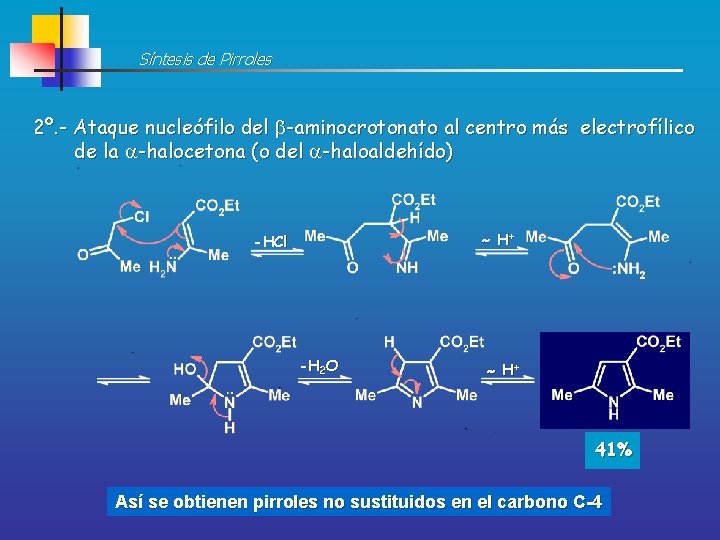
Síntesis de Pirroles 2º. - Ataque nucleófilo del -aminocrotonato al centro más electrofílico de la -halocetona (o del -haloaldehído) H+ -HCl -H 2 O H+ 41% Así se obtienen pirroles no sustituidos en el carbono C-4

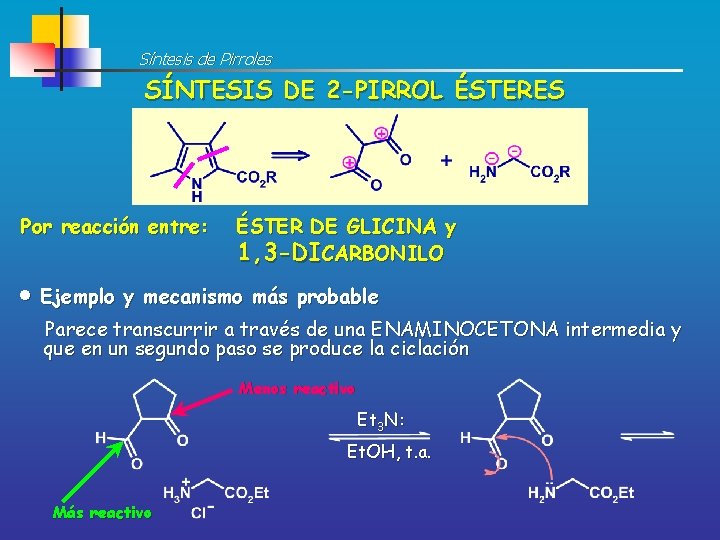
Retrosíntesis de Pirroles IGF <> <> IGF 1, 3 -Dicarbonilo Éster de Glicina

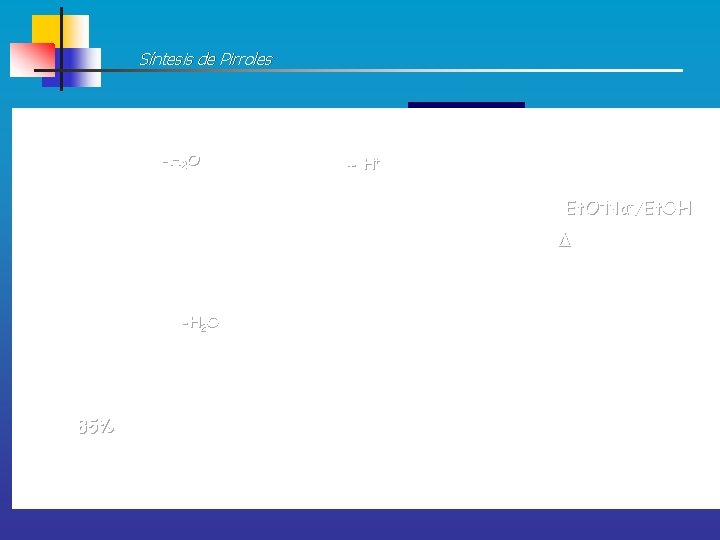
Síntesis de Pirroles SÍNTESIS DE 2 -PIRROL ÉSTERES Por reacción entre: ÉSTER DE GLICINA y 1, 3 -DICARBONILO Ejemplo y mecanismo más probable Parece transcurrir a través de una ENAMINOCETONA intermedia y que en un segundo paso se produce la ciclación Menos reactivo Et 3 N: Et. OH, t. a. Más reactivo

Síntesis de Pirroles -H 2 O H+ CONDENSACIÓN ALDÓLICA Et. O-Na+/Et. OH ENAMINOCETONA -H 2 O 85% Así se obtienen pirroles con grupos electroatractores en el carbono C-2

Síntesis de Heterociclos Pentagonales TIOFENOS

Retrosíntesis de Tiofenos IGF <> <> IGF 1, 4 -Dicarbonilo Fuente de Azufre

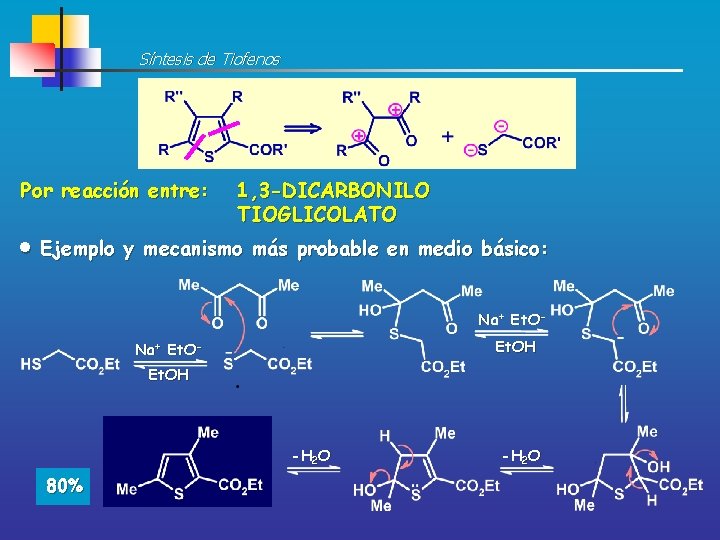
Síntesis de Tiofenos Por reacción entre: 1, 4 -DICARBONILO FUENTE DE AZUFRE • Sulfuros de fósforo P 2 S 10 • Reactivo Lawesson’s (LR) Ejemplo y mecanismo más probable Parece transcurrir a través de una bis-TIOCETONA LR Tolueno D -H 2 S 80%

Retrosíntesis de Pirroles <> IGF 1, 2 -Dicarbonilo Tiodiacetatos (R=OR’) ó Tiobis(metiléncetonas)

Síntesis de Tiofenos SÍNTESIS DE HINSBERG Por reacción entre: 1, 2 -DICARBONILO TIODIACETATOS (R’ = OR’’) o TIOBIS(METILÉNCETONAS) Ejemplo y mecanismo más probable El proceso implica dos condensaciones aldólicas consecutivas y se lleva a cabo con t. Bu. O-K+ como base: K+ t. Bu. OH

Síntesis de Tiofenos K+ t. Bu. O- -H 2 O t. Bu. OH -H 2 O Así se obtienen tiofenos con grupos electroatractores en los carbono C-2 y C-5

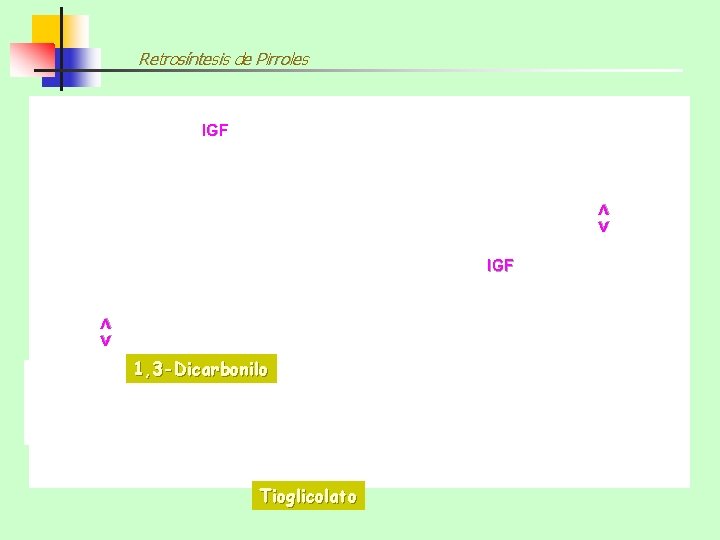
Retrosíntesis de Pirroles <> IGF 1, 3 -Dicarbonilo Tioglicolato

Síntesis de Tiofenos Por reacción entre: 1, 3 -DICARBONILO TIOGLICOLATO Ejemplo y mecanismo más probable en medio básico: Na+ Et. OEt. OH -H 2 O 80% -H 2 O

Síntesis de Tiofenos Estos procesos también transcurren en medio ácido y se puede utilizar como compuestos dicarbonílicos cetoaldehídos; la reacción se completa con un tratamiento final en medio básico: 30%

Síntesis de Heterociclos Pentagonales FURANOS

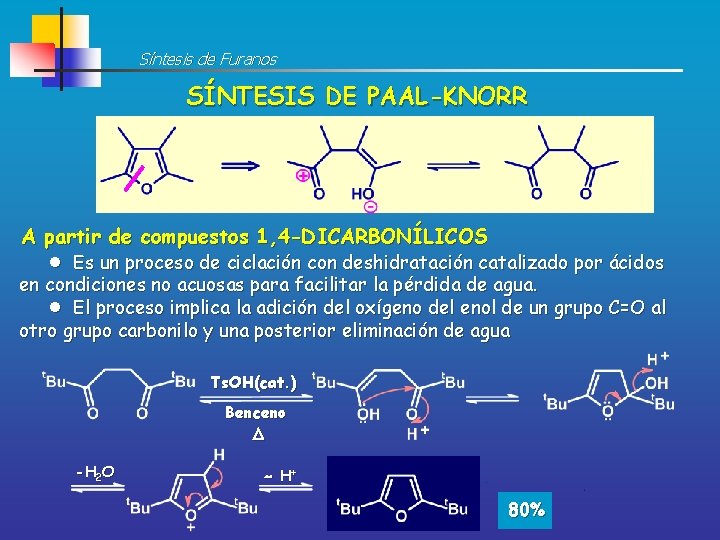
Retrosíntesis de Furanos IGF <> 1, 4 -Dicarbonilo

Síntesis de Furanos SÍNTESIS DE PAAL-KNORR A partir de compuestos 1, 4 -DICARBONÍLICOS Es un proceso de ciclación con deshidratación catalizado por ácidos en condiciones no acuosas para facilitar la pérdida de agua. El proceso implica la adición del oxígeno del enol de un grupo C=O al otro grupo carbonilo y una posterior eliminación de agua Ts. OH(cat. ) Benceno D -H 2 O H+ 80%

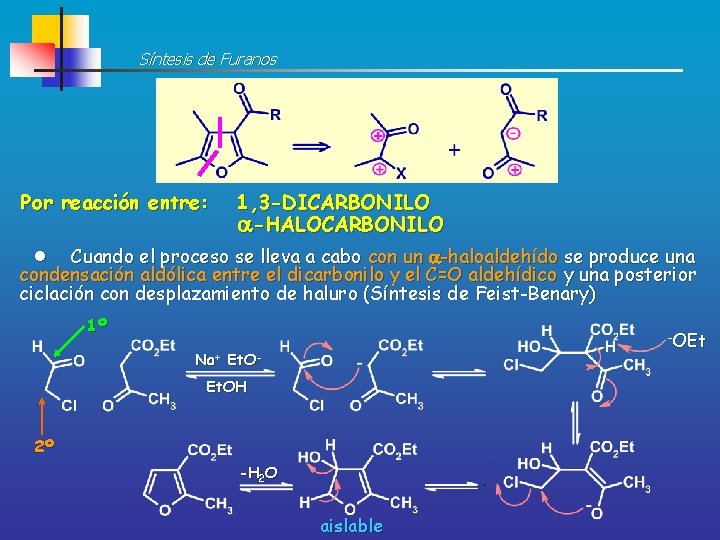
Retrosíntesis de Furanos IGF <> <> -Halocarbonilo 1, 3 -Dicarbonilo

Síntesis de Furanos Por reacción entre: 1, 3 -DICARBONILO -HALOCARBONILO Cuando el proceso se lleva a cabo con un -haloaldehído se produce una condensación aldólica entre el dicarbonilo y el C=O aldehídico y una posterior ciclación con desplazamiento de haluro (Síntesis de Feist-Benary) 1º -OEt Na+ Et. OH 2º -H 2 O aislable

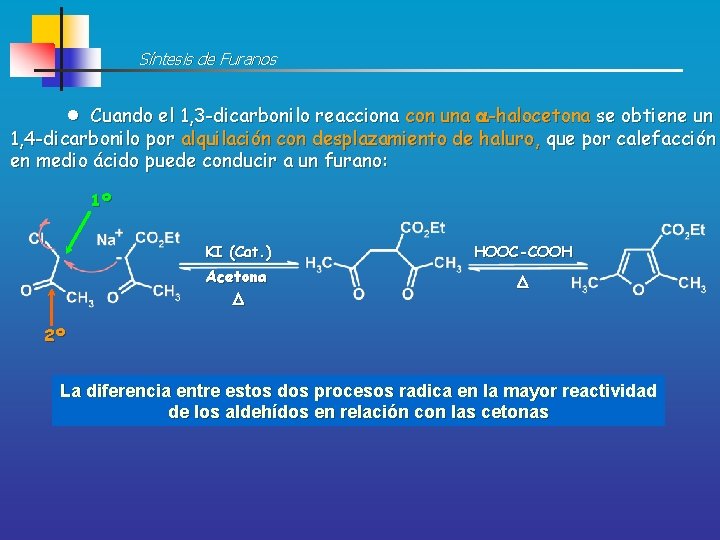
Síntesis de Furanos Cuando el 1, 3 -dicarbonilo reacciona con una -halocetona se obtiene un 1, 4 -dicarbonilo por alquilación con desplazamiento de haluro, que por calefacción en medio ácido puede conducir a un furano: 1º KI (Cat. ) HOOC-COOH Acetona D D 2º La diferencia entre estos dos procesos radica en la mayor reactividad de los aldehídos en relación con las cetonas

Síntesis de Heterociclos Pentagonales INDOLES

Síntesis de Indoles Generalmente se preparan por reacciones de ciclación sobre compuestos bencénicos adecuadamente sustituidos También se pueden preparar: a partir de pirroles construyendo el anillo homocíclico aromático y por deshidrogenación de indolinas Debido al interés de los indoles en la síntesis de productos naturales y en Química Farmacéutica, se han desarrollado un gran número de métodos de preparación para estos compuestos

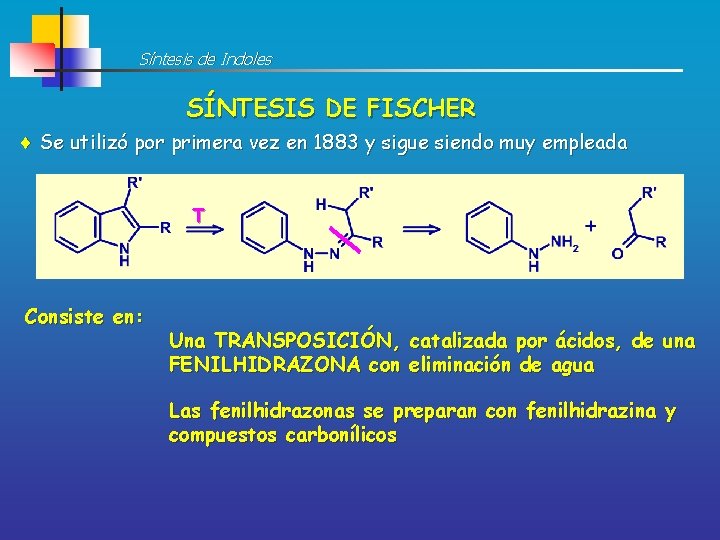
Síntesis de Indoles SÍNTESIS DE FISCHER Se utilizó por primera vez en 1883 y sigue siendo muy empleada T Consiste en: Una TRANSPOSICIÓN, catalizada por ácidos, de una FENILHIDRAZONA con eliminación de agua Las fenilhidrazonas se preparan con fenilhidrazina y compuestos carbonílicos

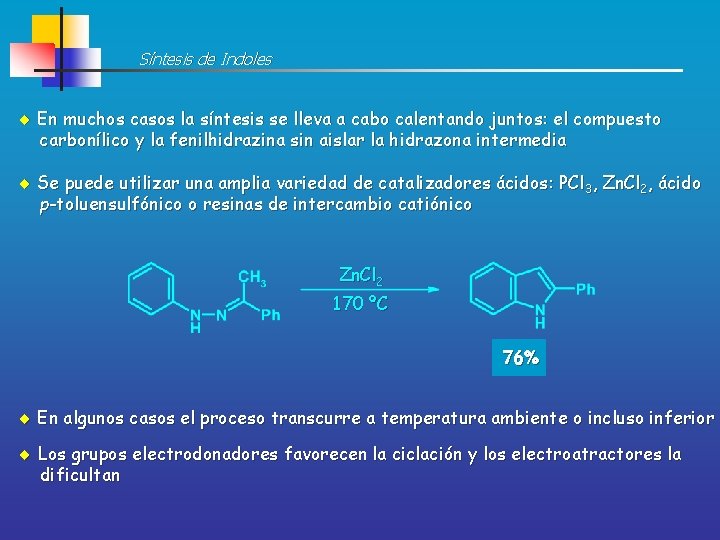
Síntesis de Indoles En muchos casos la síntesis se lleva a cabo calentando juntos: el compuesto carbonílico y la fenilhidrazina sin aislar la hidrazona intermedia Se puede utilizar una amplia variedad de catalizadores ácidos: PCl 3, Zn. Cl 2, ácido p-toluensulfónico o resinas de intercambio catiónico Zn. Cl 2 170 ºC 76% En algunos casos el proceso transcurre a temperatura ambiente o incluso inferior Los grupos electrodonadores favorecen la ciclación y los electroatractores la dificultan

Síntesis de Indoles El mecanismo no se conoce con seguridad pero existen evidencias que avalan el que se propone a continuación: -H+ -NH 3 El paso en que se forma el enlace C-C es electrocíclico y análogo a la transposición de Claisen de alilfeniléteres

Síntesis de Indoles Con cetonas asimétricas, la ciclación de la hidrazona puede conducir a dos indoles isómeros en distintas proporciones según las condiciones utilizadas, en medios fuertemente ácidos parece predominar el indol menos sustituido: * * Ac. OH PPA Me. SO 3 H, P 4 O 10 100 50 22 : : : 0 50 78 Cuando existen sustituyentes en meta- al nitrógeno de la hidrazona, la ciclación puede tener lugar en dos posiciones que conducen a dos indoles isómeros: G electroatractor: G electrodonador: los 2 isómeros (4 - y 6 -) en proporción mayoritario el isómero sustituido en 6 -

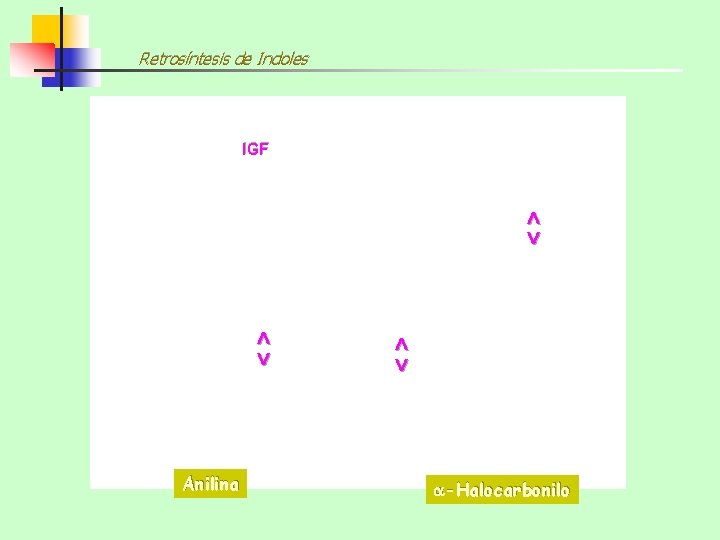
Retrosíntesis de Indoles IGF <> <> <> Anilina -Halocarbonilo

Síntesis de Indoles SÍNTESIS DE BISCHLER Consiste en: Una CICLACIÓN, catalizada por ácidos, de una -ARILAMINOCETONA que se prepara a partir de una ANILINA y un -HALOCARBONILO Mecanismo más probable: -XH

Síntesis de Indoles -H+ -H 2 O -H+ Utilizando -arilaminocetonas N-aciladas la ciclación es más controlable y permite obtener indoles sustituidos en el anillo heterocíclico PPA 120 ºC KOH 64%

Retrosíntesis de Indoles IGF <> orto-(2 -oxoalquil)anilinas IGF <> orto-alquiltoluididas <> orto-alquinilanilinas

Heterociclos Pentagonales: 1, 3 -AZOLES Síntesis de 1, 3 -Azoles Los métodos sintéticos utilizados son similares para los tres sistemas heterociclos: imidazol, tiazol y oxazol

Retrosíntesis de 1, 3 -Azoles IGF <> <> -Halocarbonilo Y = S, NH

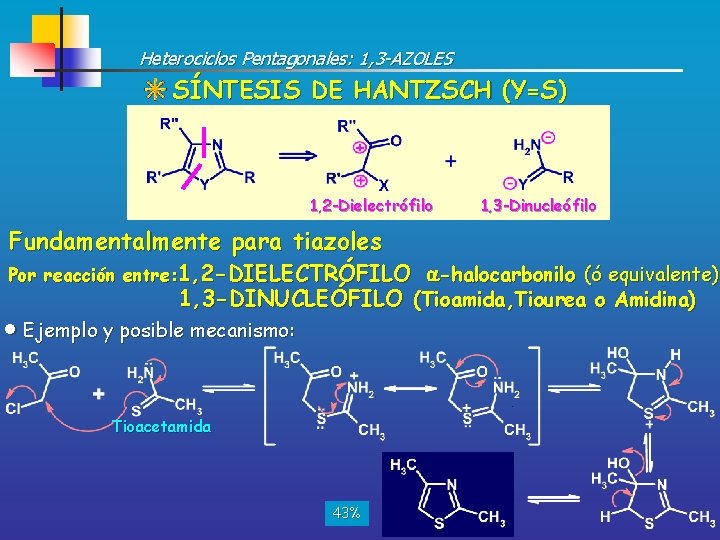
Heterociclos Pentagonales: 1, 3 -AZOLES SÍNTESIS DE HANTZSCH (Y=S) 1, 2 -Dielectrófilo 1, 3 -Dinucleófilo Fundamentalmente para tiazoles Por reacción entre: 1, 2 -DIELECTRÓFILO -halocarbonilo (ó equivalente) 1, 3 -DINUCLEÓFILO (Tioamida, Tiourea o Amidina) Ejemplo y posible mecanismo: Tioacetamida 43%

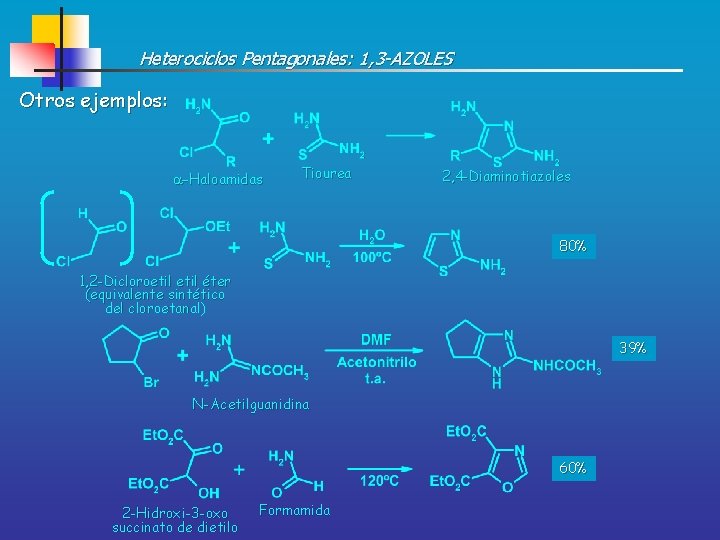
Heterociclos Pentagonales: 1, 3 -AZOLES Otros ejemplos: -Haloamidas Tiourea 2, 4 -Diaminotiazoles 80% 1, 2 -Dicloroetil éter (equivalente sintético del cloroetanal) 39% N-Acetilguanidina 60% 2 -Hidroxi-3 -oxo succinato de dietilo Formamida

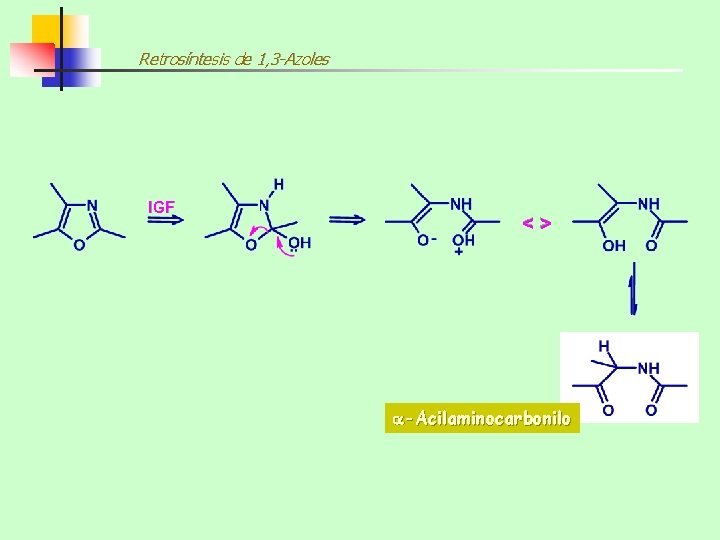
Retrosíntesis de 1, 3 -Azoles <> IGF -Acilaminocarbonilo

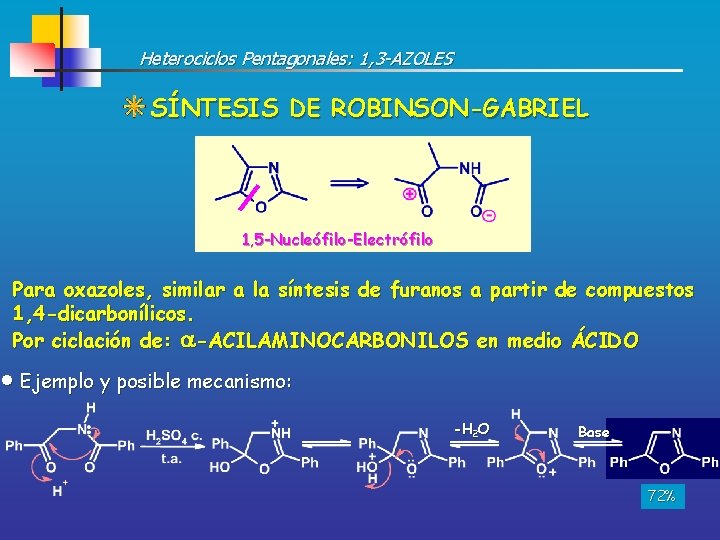
Heterociclos Pentagonales: 1, 3 -AZOLES SÍNTESIS DE ROBINSON-GABRIEL 1, 5 -Nucleófilo-Electrófilo Para oxazoles, similar a la síntesis de furanos a partir de compuestos 1, 4 -dicarbonílicos. Por ciclación de: -ACILAMINOCARBONILOS en medio ÁCIDO Ejemplo y posible mecanismo: -H 2 O Base 72%

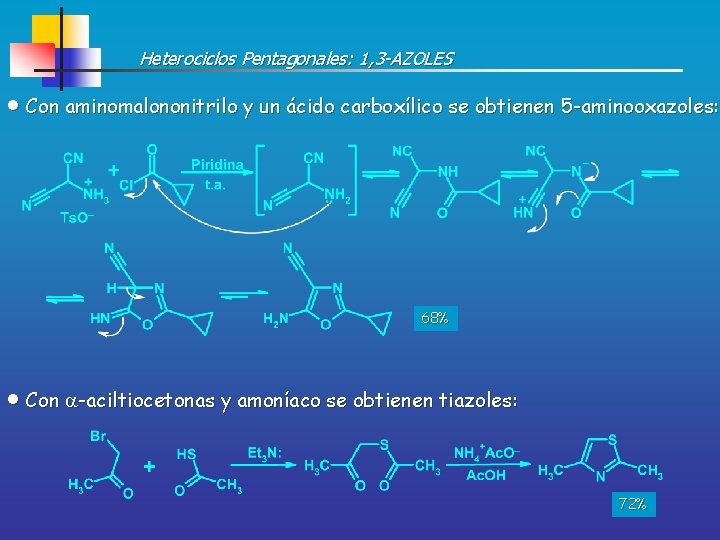
Heterociclos Pentagonales: 1, 3 -AZOLES Con aminomalononitrilo y un ácido carboxílico se obtienen 5 -aminooxazoles: 68% Con -aciltiocetonas y amoníaco se obtienen tiazoles: 72%

Heterociclos Pentagonales: 1, 2 -AZOLES Síntesis de 1, 2 -Azoles

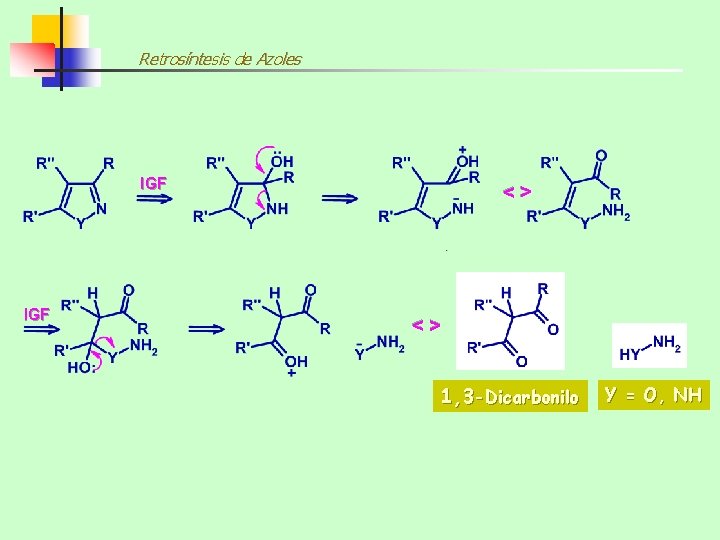
Retrosíntesis de Azoles IGF <> <> IGF 1, 3 -Dicarbonilo Y = O, NH

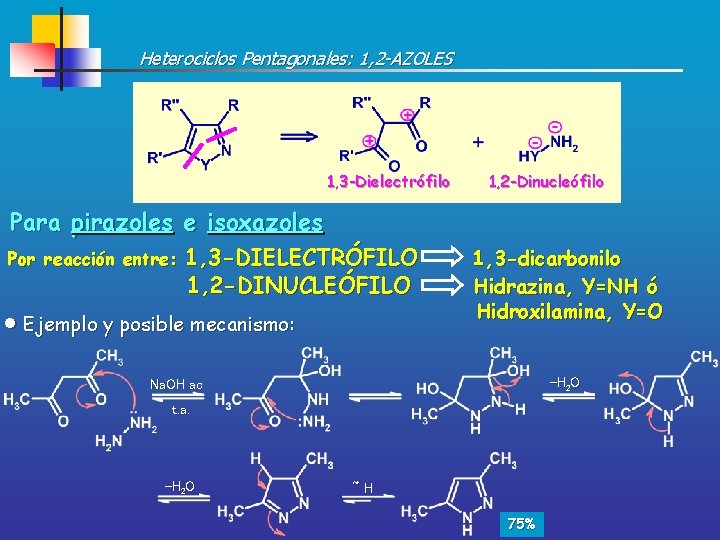
Heterociclos Pentagonales: 1, 2 -AZOLES 1, 3 -Dielectrófilo 1, 2 -Dinucleófilo Para pirazoles e isoxazoles Por reacción entre: 1, 3 -DIELECTRÓFILO 1, 2 -DINUCLEÓFILO Ejemplo y posible mecanismo: 1, 3 -dicarbonilo Hidrazina, Y=NH ó Hidroxilamina, Y=O -H 2 O Na. OH ac t. a. -H 2 O ~H 75%

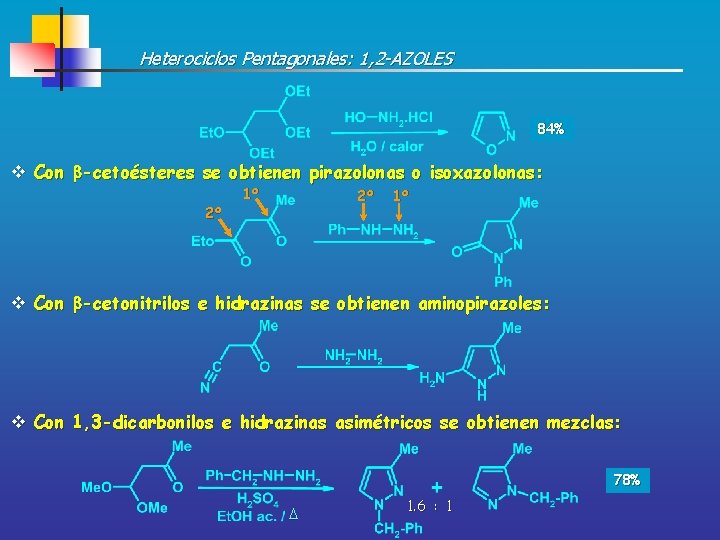
Heterociclos Pentagonales: 1, 2 -AZOLES 84% v Con -cetoésteres se obtienen pirazolonas o isoxazolonas: 2º 1º v Con -cetonitrilos e hidrazinas se obtienen aminopirazoles: v Con 1, 3 -dicarbonilos e hidrazinas asimétricos se obtienen mezclas: 78% 1. 6 : 1

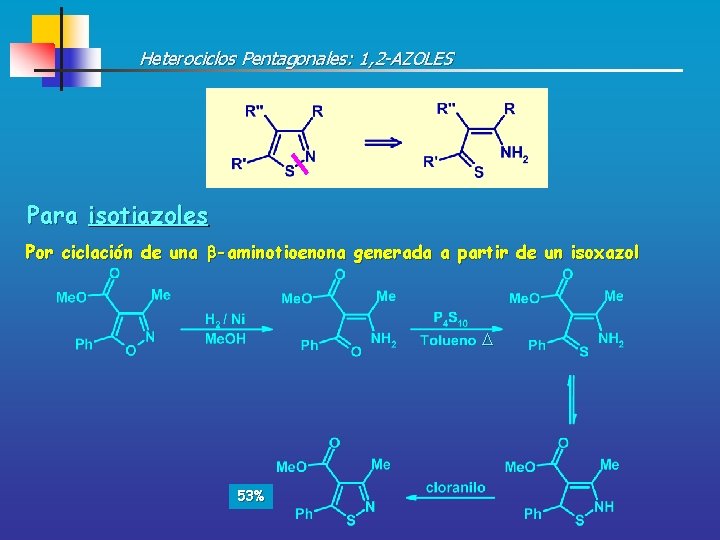
Heterociclos Pentagonales: 1, 2 -AZOLES Para isotiazoles Por ciclación de una -aminotioenona generada a partir de un isoxazol 53%

Heterociclos Pentagonales: 1, 2 -AZOLES CICLOADICIONES DIPOLARES Para pirazoles e isoxazoles Nitrilimina Oxido de nitrilo Y=O, NH 1, 3 -Dipolo Dipolarófilo

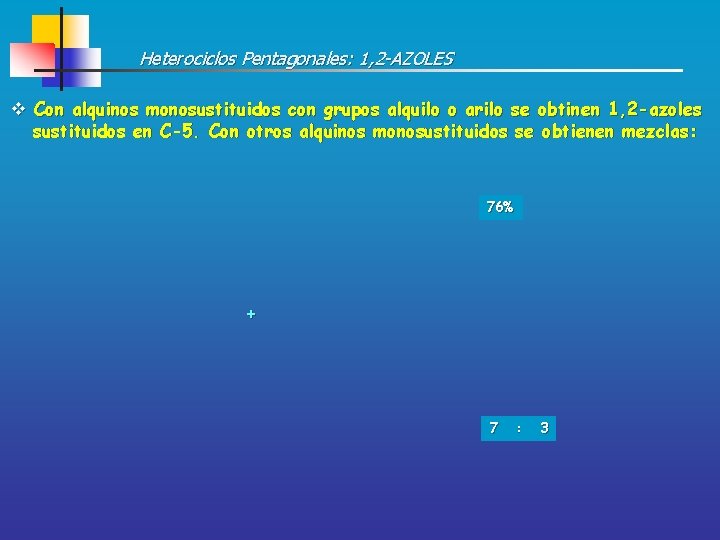
Heterociclos Pentagonales: 1, 2 -AZOLES v Con alquinos monosustituidos con grupos alquilo o arilo se obtinen 1, 2 -azoles sustituidos en C-5. Con otros alquinos monosustituidos se obtienen mezclas: 76% + 7 : 3

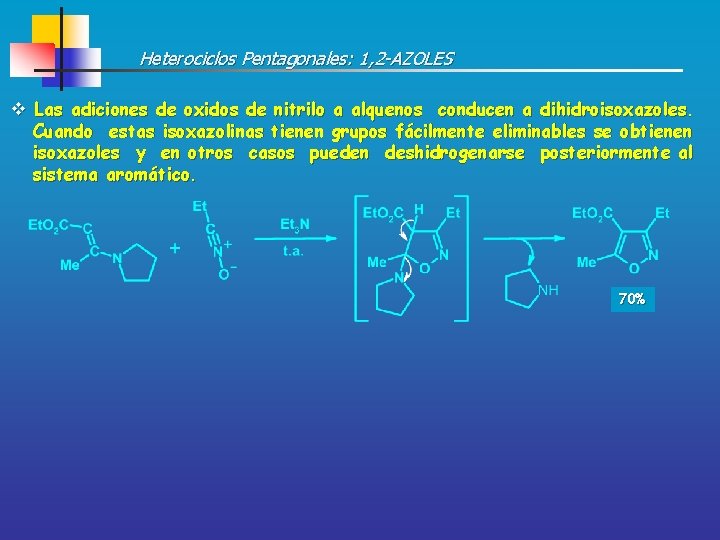
Heterociclos Pentagonales: 1, 2 -AZOLES v Las adiciones de oxidos de nitrilo a alquenos conducen a dihidroisoxazoles. Cuando estas isoxazolinas tienen grupos fácilmente eliminables se obtienen isoxazoles y en otros casos pueden deshidrogenarse posteriormente al sistema aromático. 70%
 Evangelios del nuevo testamento
Evangelios del nuevo testamento Sntesis
Sntesis Sntesis
Sntesis Sntesis
Sntesis Sintesis formal
Sintesis formal Resumen como se hace
Resumen como se hace Sntesis
Sntesis Sesc - departamento nacional
Sesc - departamento nacional Organización del departamento de enfermería
Organización del departamento de enfermería Potencialidad productiva de cochabamba
Potencialidad productiva de cochabamba La señora guajardo compra un departamento
La señora guajardo compra un departamento Organigrama de departamento de contabilidad
Organigrama de departamento de contabilidad El significado de departamento
El significado de departamento Instituto suel
Instituto suel Objetivos del departamento de enfermería
Objetivos del departamento de enfermería Departamento solicitante
Departamento solicitante Vclima
Vclima Departamento forestal
Departamento forestal Finestra terapeutica
Finestra terapeutica Zootecnia ufpr
Zootecnia ufpr Departamento ceres
Departamento ceres Entidad debil modelo relacional
Entidad debil modelo relacional Departamento de marketing organigrama
Departamento de marketing organigrama Universidad ixil
Universidad ixil Unidad 1 el departamento de recursos humanos
Unidad 1 el departamento de recursos humanos Departamento de investigación en una agencia de publicidad
Departamento de investigación en una agencia de publicidad Departamento ceres
Departamento ceres Departamento de economia
Departamento de economia Departamento de higiene de los alimentos
Departamento de higiene de los alimentos Departamento housekeeping
Departamento housekeeping Bachillerato abierto puebla
Bachillerato abierto puebla Teoria de thomson
Teoria de thomson Notação de lewis
Notação de lewis Qumica
Qumica Lista de atomos
Lista de atomos Qumica
Qumica Qumica
Qumica Penumbra
Penumbra Qumica
Qumica Celdas
Celdas (ch3)3cch3 tipo de hidrocarburo
(ch3)3cch3 tipo de hidrocarburo Formula general de los eteres
Formula general de los eteres Qumica
Qumica Poluição das águas
Poluição das águas Qumica
Qumica Qumica
Qumica Ejemplo de fuerza ion ion
Ejemplo de fuerza ion ion Qumica
Qumica Cloro aplicaciones
Cloro aplicaciones Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Funcion quimica y grupo funcional
Funcion quimica y grupo funcional Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica As interações entre os íons produzem aglomerados
As interações entre os íons produzem aglomerados Qumica
Qumica Orbitais
Orbitais Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Nomenclatura das bases
Nomenclatura das bases Qumica
Qumica Propiedades quimicas de los alquenos
Propiedades quimicas de los alquenos Setas curvas
Setas curvas Qumica
Qumica Ley de lavoisier
Ley de lavoisier Qumica
Qumica Qumica
Qumica Qumica
Qumica Mistura quimica
Mistura quimica Clivagem oxidativa de alcenos
Clivagem oxidativa de alcenos Qumica
Qumica Qumica
Qumica Qumica
Qumica Qué son las propiedades intensivas
Qué son las propiedades intensivas Qumica
Qumica Etapas da gravimetria
Etapas da gravimetria Teoria cinetica molecular
Teoria cinetica molecular Reaccion de condensacion
Reaccion de condensacion Stoicheon
Stoicheon Entalpia
Entalpia Qumica
Qumica Qumica
Qumica Enlace dativo
Enlace dativo Qumica
Qumica Istopos
Istopos Qumica
Qumica Formula estrutural
Formula estrutural Tabla qumica
Tabla qumica Qumica
Qumica Ejemplos de epimeros
Ejemplos de epimeros Qumica
Qumica Hidrocarbonetos
Hidrocarbonetos Na y cl
Na y cl Qumica
Qumica Qumica
Qumica Qumica
Qumica Numero magnetico de spin
Numero magnetico de spin Haleto organico
Haleto organico Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Carbono primario secundario y terciario
Carbono primario secundario y terciario Como se calcula el factor gravimetrico
Como se calcula el factor gravimetrico Qumica
Qumica Qumica moderna
Qumica moderna Qumica
Qumica Ciclano
Ciclano Solubilidad quimica
Solubilidad quimica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Gás carbônico e oxigênio
Gás carbônico e oxigênio Qumica
Qumica