Qumica Clculo Estequiomtrico Qumica Stoicheon elemento Estequiometria metron












- Slides: 14

Química

Cálculo Estequiométrico Química Stoicheon = elemento Estequiometria metron = medida É o estudo das relações quantitativas (átomos, moléculas, massa, volume) entre as substâncias que participam de uma reação química.

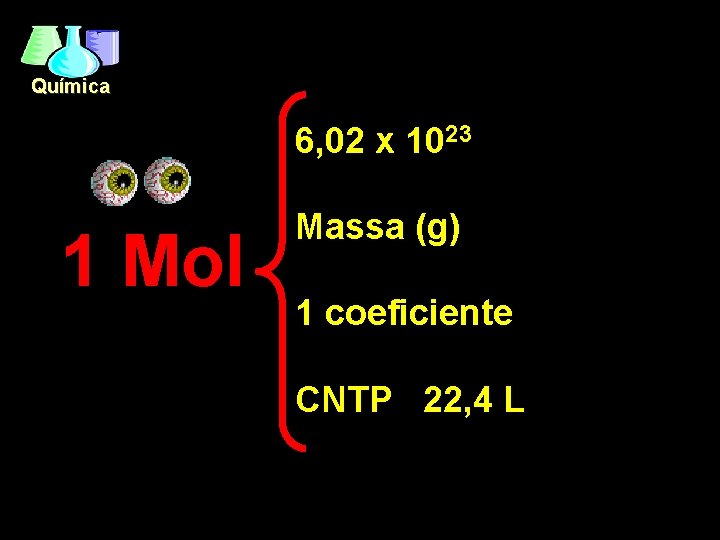
Química 6, 02 x 1023 1 Mol Massa (g) 1 coeficiente CNTP 22, 4 L

Relações Molares Química N 2 + Mol 1 Mol + 3 Mol - Moléculas- 6 x 1023 Massa 3 H 2 + 18 x 1023 - 28 g + 6 g Volume – 2 NH 3 2 Mol 12 x 1023 34 g 22, 4 L + 67, 2 L 44, 8 L

Cálculo Estequiométrico Química Para resolver uma questão envolvendo cálculo estequiométrico devemos seguir três passos: 1º conhecer a equação; 2º Ajustar os coeficientes; 3º Armar uma Regra de três;

Relação Massa-Massa Química Ex. : produzida a partir de 8 g de hidrogênio gás? 1º ® H 2 + O 2 ® H 2 O 2º ® 2 H 2 + O 2 ® 2 H 2 O 3º ® 4 g ® 36 g 8 g ® x x = 8. 36 = 72 g 4

Relação Massa-Moléculas Química Ex. : Quantas Moléculas de água são produzidas a partir de 16 g de oxigênio gás? 1º ® H 2 + O 2 ® H 2 O 2º ® 2 H 2 + O 2 ® 2 H 2 O 3º ® 32 g ® 12, 04 x 1023 16 g ® x x = 16. 12, 04 x 1023 = 6, 02 x 1023 32

Relação Massa-Volume Química x = 12. 44, 8 = 89, 6 L 6

Relação Mol -Volume Química Ex. : Quantos Moles de CO 2 são produzidos a partir de 44, 8 L de CO? 1º ® CO + O 2 ® CO 2 2º ® CO + ½O 2 ® CO 2 3º ® 22, 4 L ® 1 Mol 44, 8 L ® x x = 44, 8. 1 = 2 Mol 22, 4 L

Química http: //blog. educacional. com. br/profmariaantonia /

Química http: //www. ftdsistemadeensino. com. br/

Química

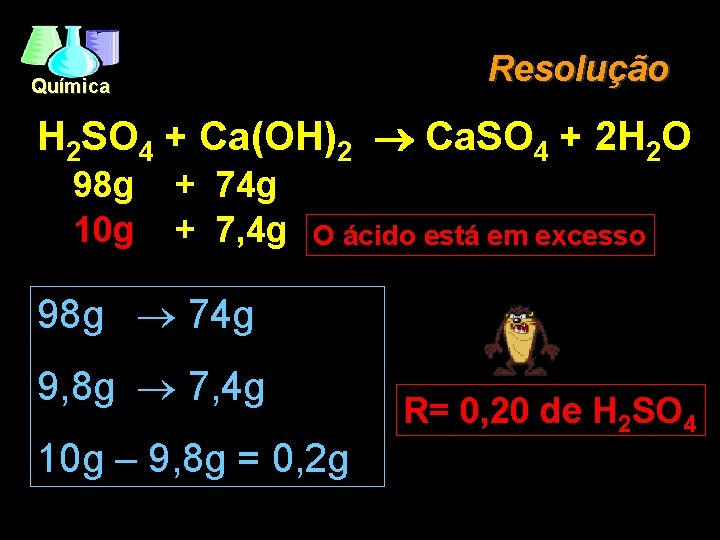
Reagente Limitante Química EX. : (PUCSP/96) - 10, 00 g de ácido sulfúrico são adicionados a 7, 40 g de hidróxido de cálcio. Sabe-se que um dos reagentes está em excesso. Após completar a reação, restarão: H 2 SO 4 + Ca(OH)2 ® Ca. SO 4 + 2 H 2 O a) 0, 02 g de H 2 SO 4 b) 0, 20 g de H 2 SO 4 c) 0, 26 g de Ca(OH)2 d) 2, 00 g de H 2 SO 4 e) 2, 00 g de Ca(OH)2.

Resolução Química H 2 SO 4 + Ca(OH)2 Ca. SO 4 + 2 H 2 O 98 g 10 g + 74 g + 7, 4 g O ácido está em excesso 98 g ® 74 g 9, 8 g ® 7, 4 g 10 g – 9, 8 g = 0, 2 g R= 0, 20 de H 2 SO 4