Qumica Geral 20182019 Professor Valentim Nunes Unidade Departamental



















- Slides: 20

Química Geral - 2018/2019 Professor Valentim Nunes, Unidade Departamental de Engenharia - Secção de Química email: valentim@ipt. pt Gabinete: J 207 Pág. Web: http: //www. docentes. ipt. pt/valentim/ensino/quimica 1. htm

Ferramentas básicas da Química (Termoquímica) Todas as reacções químicas obedecem a duas leis fundamentais: lei da conservação da massa (já estudada!) e lei da conservação da energia. Energia: conceito abstracto, definido normalmente como a capacidade para realizar trabalho. Ao contrário da massa, apercebemos-nos da energia através dos seus efeitos!

Formas de Energia cinética: energia do movimento Energia potencial: energia armazenada ou disponível como consequência da posição de um objecto. A energia química é uma forma de energia potencial armazenada nas substâncias químicas devido ás posições relativas e arranjo dos átomos nessas substâncias Energia radiante ou solar: provém do Sol e é a fonte de energia primária da Terra. Energia térmica: é a energia cinética associada ao movimento aleatório dos átomos e das moléculas (translaccionais, rotacionais e vibracionais)

Energia Lei da Conservação da Energia Embora a energia possa assumir formas diferentes e interconvertíveis, não pode ser criada ou destruída! A quantidade total de Energia do Universo permanece constante.

Variação de Energia em Reacções Químicas A variação de energia em reacções química é tão importante como as relações mássicas anteriormente derivadas. Por exemplo, quando queimamos propano num fogão doméstico é mais importante a energia térmica libertada do que os produtos da combustão! Quase todas as reacções químicas absorvem ou libertam energia, geralmente na forma de calor. Calor: é a transferência de energia térmica entre dois corpos que estão a temperaturas diferentes. O estudo do calor posto em jogo em reacções químicas chama-se Termoquímica.

Sistema & vizinhanças Numa reacção química os reagentes e produtos são o sistema. Um sistema é uma parte específica do Universo que nos interessa. O resto do Universo, fora do sistema designa-se por vizinhança. Tipos de sistemas: (a) aberto ; (b) fechado; (c) isolado

Entalpia Uma grande parte das transformações ocorre a pressão constante. Para quantificar o fluxo de calor para dentro ou para fora de um sistema a química utiliza o conceito de entalpia, H. A variação de entalpia, H, é a diferença entre a entalpia dos produtos e a entalpia dos reagentes: A variação de entalpia numa transformação é igual ao calor libertado ou absorvido quando esta ocorre a pressão constante!

Entalpia de reacções A entalpia da reacção pode ser positiva ou negativa. Para um processo endotérmico (é absorvido calor pelo sistema a partir da vizinhança), H é positivo, H > 0. Para um processo exotérmico (é libertado calor para a vizinhança) o H é negativo, H < 0. CH 4(g) + 2 O 2(g) H = - 890. 4 k. J CO 2(g) + 2 H 2 O(l) H 2 O(s) H 2 O(l) H = 6. 01 k. J

Equações termoquímicas As equações termoquímicas mostram as variações de entalpia assim como as relações de massa. 1. Ao escrever equações termoquímicas devemos indicar os estados de agregação: CH 4(g) + 2 O 2(g) CO 2(g) + 2 H 2 O(g) H = - 802. 4 k. J 2. Quando se inverte uma equação o valor de H permanece o mesmo, mas o sinal muda: H 2 O(l) H 2 O(s) H = - 6. 01 k. J 3. Se multiplicarmos ambos os lados de uma equação por um factor n então H deve vir multiplicado pelo mesmo factor: 2 H 2 O(s) 2 H 2 O(l) H = 2 6. 01 = 12. 02 k. J

Calorimetria O calor posto em jogo em processos físicos e químicos mede-se com um calorímetro. Calor específico, c: é a quantidade de calor necessária para elevar em 1 °C a temperatura de 1 g de substância; unidades: J. g-1. K-1 Capacidade calorífica, C: é a quantidade de calor necessária para elevar em 1 °C a temperatura de uma dada quantidade da substância. Se for um mole é a capacidade calorífica molar; unidades: J. mol-1. K-1 Q é a quantidade de calor, m é a massa, n é o número de moles e t é a variação de temperatura.

Calores específicos Subst. c / J. g-1. K-1 Al 0. 900 Au 0. 129 C(graf. ) 0. 720 C(diam) 0. 502 Cu 0. 385 Fe 0. 444 Hg 0. 139 H 2 O 4. 184 etanol 2. 460 Uma amostra de 466 g de água é aquecida de 8. 50 °C até 74. 60 °C. Qual a quantidade de calor absorvida pela água? Q = mc t Q = 466 g 4. 184 J. g-1. K-1 (74. 60 - 8. 50) K Q = 1. 29 105 J ou Q 130 k. J O sinal positivo indica que o calor é absorvido pela água.

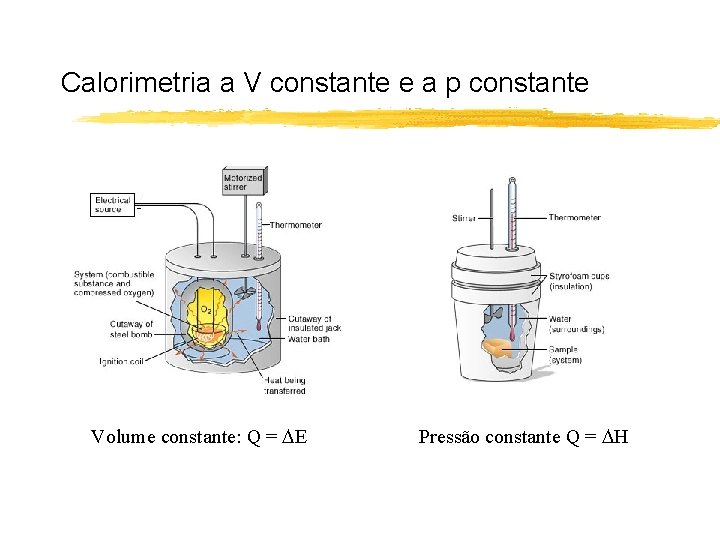
Calorimetria a V constante e a p constante Volume constante: Q = E Pressão constante Q = H

Alguns cálculos Não havendo perda de massa e calor para o exterior temos: Qsist = Qágua + Qbomba + Qreacção = 0 Qreacção = - (Qbomba + Qágua) Qágua = mágua 4. 184 J. g-1. K-1 t Qbomba = Cbomba t Fez-se a combustão de 1. 922 g de metanol num calorímetro de bomba a volume constante. A temperatura da água subiu 4. 20 °C. Calcular o calor molar de combustão do metanol sabendo que a capacidade calorífica da bomba mais a água é 10. 4 k. J/°C. Qreacção = - (10. 4 k. J. °C-1 4. 20 °C) = - 43. 68 k. J Qreacção = -43. 68 k. J 32 g. mol-1 (1/1. 922 g) - 727 k. J. mol-1

Outro exemplo Misturou-se 100 m. L de HCl 0. 5 M, com 100 m. L de Na. OH 0. 5 M, num calorímetro a pressão constante com capacidade calorífica, Cbomba = 335 J. K-1. A temperatura inicial das soluções era 22. 5 °C e a temperatura final da mistura foi 24. 9 °C. Calcular o calor da reacção de neutralização, por mole. Admitir que as soluções têm a densidade e calor específico da água. Qreacção = - (Qsol + Qbomba) Qsol = (100 g + 100 g) 4. 184 J. K-1. g-1 (24. 9 - 22. 5 ) K = 2. 01 103 J Qbomba = 335 J. K-1 (24. 9 - 22. 5 ) K = 804 J Qreacção = - (2. 01 103 + 804) J - 2. 81 k. J Qreacção = - 2. 81 k. J / 0. 05 mol -56. 2 k. J. mol-1

Entalpias de formação padrão A entalpia de formação padrão, H°f , é a variação de entalpia quando se forma um mole de composto a partir dos seus elementos à pressão de 1 bar ( 1 atm). Por convenção, a entalpia de formação padrão de qualquer elemento na sua forma mais estável é zero a qualquer temperatura. H°f(O 2) = 0; H°f (O 3) 0; H°f (C, grafite) = 0; H°f (C, diamante) 0 H 2(g) + 1/2 O 2(g) H 2 O(l) H°f = -286 k. J/mol 3/2 H 2(g) + 1/2 N 2(g) NH 3(g) H°f = - 46 k. J/mol 2 C(s) + H 2(g) C 2 H 2(g) H°f = + 227 k. J/mol

Entalpias de reacção padrão Uma vez conhecidos os valores das entalpias de formação padrão podemos calcular a entalpia de reacção padrão, H°r Para uma reacção acertada, a A + b B c. C+d. D H°r = c H°f (C) + d H°f (D) - a H°f (A) + b H°f (B) 4 NH 3(g) + 5 O 2(g) 4 NO (g) + 6 H 2 O(g) H°r = 4 H°f (NO) +6 H°f (H 2 O) - 4 H°f (NH 3) + 5 H°f (O 2) H°r = 4 90 +6 (- 286) - 4 (- 46) + 5 0 H°r - 1172 k. J

Lei de Hess Muitos compostos não podem ser preparados directamente a partir dos seus elementos. Como obter o H°f ? Método indirecto! Lei de Hess: Quando reagentes são convertidos em produtos, a variação de entalpia é a mesma quer a reacção se dê num passo ou numa série de passos.

Lei de Hess - outro exemplo Calcular a entalpia de formação padrão do metano, a partir das seguintes entalpias de reacção: C(grafite) + O 2(g) CO 2(g) H°r = -393. 5 k. J 2 H 2(g) + O 2(g) 2 H 2 O(g) H°r = -571. 6 k. J CH 4(g) + 2 O 2(g) CO 2(g) + 2 H 2 O(g) H°r = - 890. 4 k. J A reacção pretendida é: C(grafite) + 2 H 2(g) CO 2(g) + 2 H 2 O(g) C(grafite) + O 2(g) CH 4(g) + 2 O 2(g) CH 4(g) H°r = + 890. 4 k. J H°r = -393. 5 k. J 2 H 2(g) + O 2(g) 2 H 2 O(g) H°r = -571. 6 k. J _____________________________ C(grafite) + 2 H 2(g) CH 4(g) H°r = - 74. 7 k. J

Calores de solução O calor ou entalpia de solução, H°sol, é o calor libertado ou absorvido quando uma certa quantidade de soluto se dissolve numa dada quantidade de solvente. H 2 O Na. Cl(s) Na+(aq) + Cl-(aq) H°sol = ? H°sol = Urede + H°hidrat H°sol = 788 + ( - 784 ) k. J H°sol = 4 k. J. mol-1 Neste caso o processo é endotérmico!

Recomendações Finais A Termoquímica faz parte de um tema mais lato chamado Termodinâmica (irão estudar o assunto no 2º semestre do Curso e, provavelmente, apanham o mesmo Prof!) Utilizem estes “slides” em conjuntos com as vossa notas da lição! Complementem o vosso estudo com a leitura do Capítulo 6 do Chang (R. Chang, Química, 11ª ed. , Mc. Graw-Hill, Lisboa, 2013) Resolvam os exercícios da 1ª série! Boa semana!
 Aldo valentim
Aldo valentim Promotion from associate professor to professor
Promotion from associate professor to professor Filomena nunes
Filomena nunes Joni nunes
Joni nunes Danielle nunes forny
Danielle nunes forny Elizabete nunes
Elizabete nunes Patrick nunes leite
Patrick nunes leite Transsudat et exsudat
Transsudat et exsudat Elisa aline nunes
Elisa aline nunes Secretaria de salud departamental del valle
Secretaria de salud departamental del valle Centralización departamental
Centralización departamental Organizacion departamental
Organizacion departamental Fonasa departamental
Fonasa departamental Organizacion departamental
Organizacion departamental Ministerio de educacion santa ana
Ministerio de educacion santa ana Rama ejecutiva municipal
Rama ejecutiva municipal Gobernacion del valle educacion
Gobernacion del valle educacion Gestion departamental
Gestion departamental Departamentar
Departamentar Quando jesus passar eu quero estar
Quando jesus passar eu quero estar Constante de boltzmann unidade
Constante de boltzmann unidade