Qumica Geral 20182019 Professor Valentim Nunes Unidade Departamental













- Slides: 20

Química Geral - 2018/2019 Professor Valentim Nunes, Unidade Departamental de Engenharia - Secção de Química email: valentim@ipt. pt Gabinete: J 207 Pág. Web: http: //www. docentes. ipt. pt/valentim/ensino/quimica 1. htm

O Estado Gasoso Substâncias que existem como gases: H 2, F 2, He, Xe. . Os compostos iónicos não são gases em condições PTN Os compostos moleculares podem ser gases (CO, CO 2, NH 3, CH 4), mas a maioria são líquidos ou sólidos. Ao serem aquecidos transformam-se mais facilmente em gases, vaporizando a temperaturas baixas.

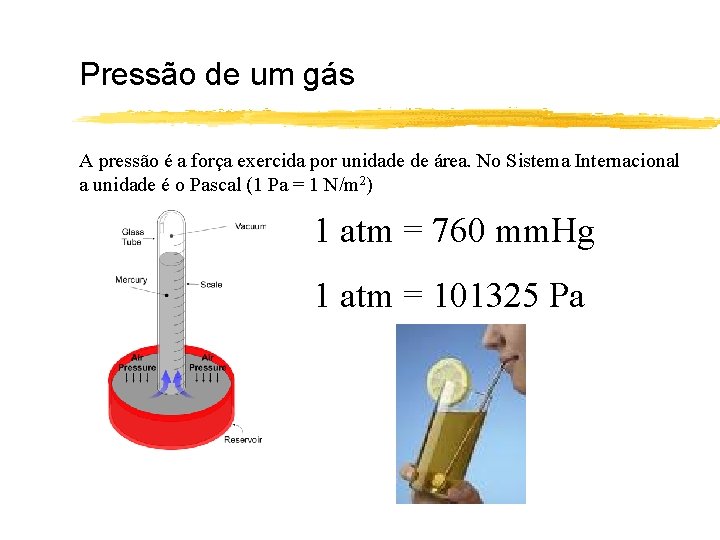
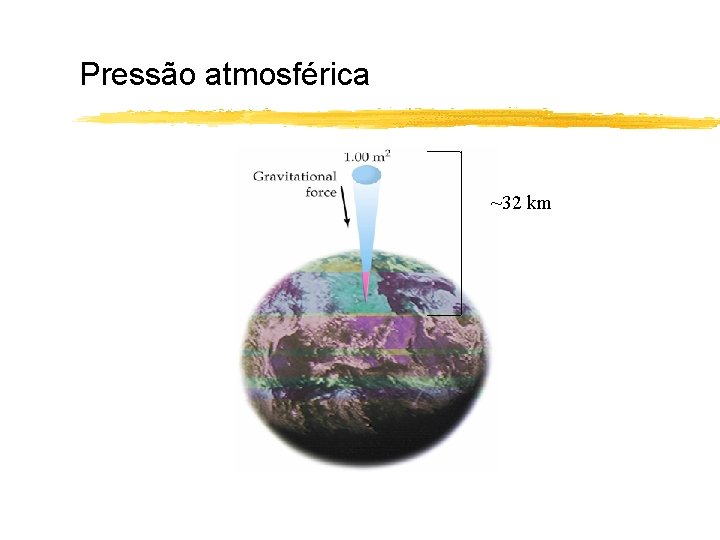
Pressão de um gás A pressão é a força exercida por unidade de área. No Sistema Internacional a unidade é o Pascal (1 Pa = 1 N/m 2) 1 atm = 760 mm. Hg 1 atm = 101325 Pa

Pressão atmosférica ~32 km

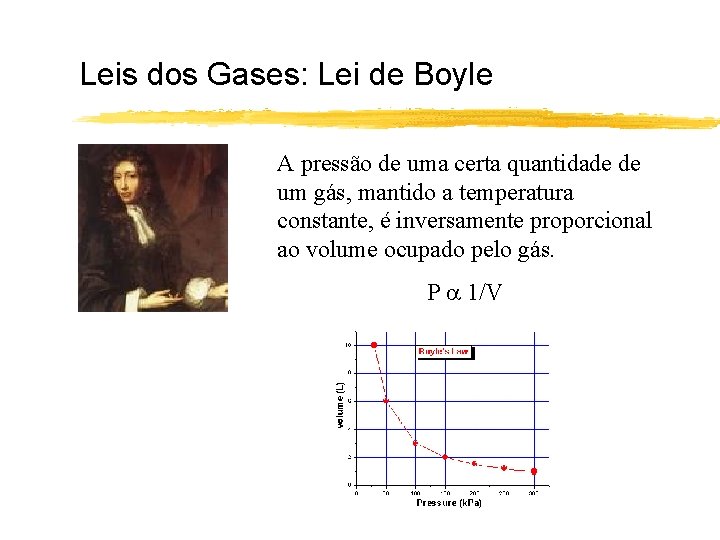
Leis dos Gases: Lei de Boyle A pressão de uma certa quantidade de um gás, mantido a temperatura constante, é inversamente proporcional ao volume ocupado pelo gás. P 1/V

Leis dos Gases: Lei de Charles e Gay-Lussac Volume/L A pressão constante, o volume ocupado por um gás é directamente proporcional à temperatura: V α T A volume constante, a pressão é directamente proporcional à temperatura: p α T. Temperatura/ºC

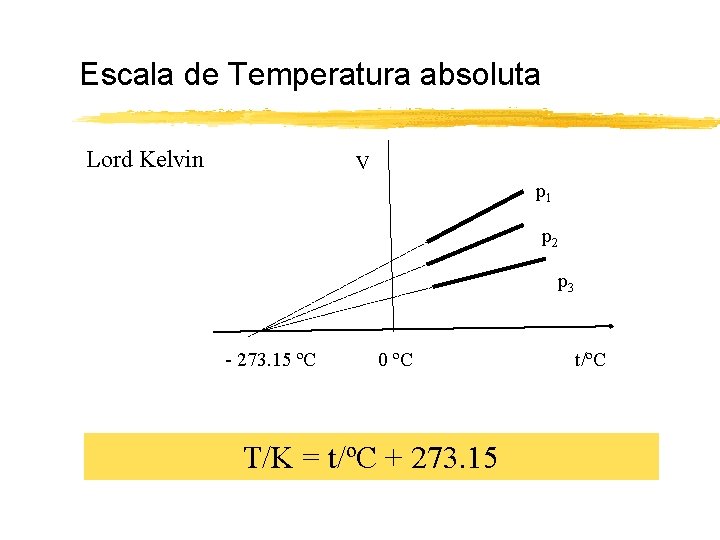
Escala de Temperatura absoluta Lord Kelvin V p 1 p 2 p 3 - 273. 15 ºC 0 ºC T/K = t/ºC + 273. 15 t/ºC

Leis dos Gases: Lei de Avogadro À mesma temperatura e pressão, o volume ocupado por um gás é directamente proporcional ao número de moles: V α n.

Equação dos Gases Perfeitos R = 8. 314 J. K-1. mol-1 R = 0. 0821 atm. L. K-1. mol-1 Qual o volume ocupado por um mole de gás perfeito em condições PTP? p. V = n. RT/p V = (1 mol × 0. 082 atm. L. mol-1. K-1 × 273. 15 K)/ 1 atm V 22. 414 L

Volumes molares de alguns gases a PTP

Cálculos de Densidade Rearranjando a equação dos gases perfeitos (ou gases ideais) obtemos: Calcular a densidade do brometo de hidrogénio (HBr) gasoso, em gramas por litro, a 733 mm. Hg e 46 ºC. ρ = (0. 964 atm × 80. 9 g. mol-1) / (0. 0821 atm. L. mol-1. K-1 × 319. 15 K) ρ 2. 98 g/L

Estequiometria envolvendo gases A azida de sódio (Na. N 3) é utilizada nos airbag de automóveis. Calcular o volume de azoto que se liberta quando reagem 60 g de azida a 21 ºC e quando a pressão é 823 mm. Hg. A reacção é: 2 Na. N 3(s) 2 Na(s) + 3 N 2(g) n azida = 60 g/65 g. mol-1 0. 92 mol n azoto = (3 mol azoto/ 2 mol azida) × 0. 92 mol azida 1. 38 mol de azoto V azoto = (1. 38 mol × 0. 082 atm. L. mol-1. K-1 × 294. 15 K)/(823/760) atm V azoto 30. 8 L

Lei de Dalton das pressões parciais A pressão total de uma mistura de gases é a soma das pressões que cada gás exerceria se ocupasse sozinho o mesmo volume.

Aplicando a Lei de Dalton PO 2 0. 2 atm valor “óptimo” para o nosso organismo! Ar contém aproximadamente 20% em oxigénio. Em profundidade, por exº, quando P = 2 atm: Utiliza-se hélio para diluir o oxigénio!

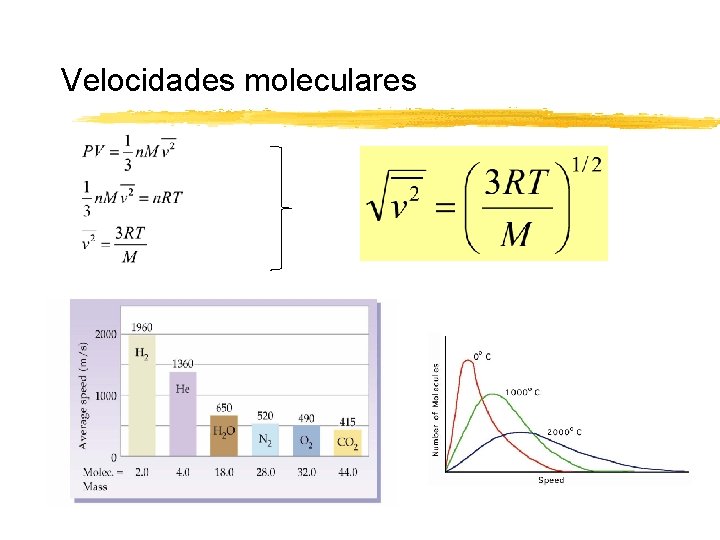
Teoria Cinética de Gases As leis ajudam a compreender o comportamento macroscópico dos gases, mas não explicam o que acontece à escala molecular! Moléculas percorrem grandes distâncias, sem interacções. Ocupam volume desprezável. Não existem forças atractivas nem repulsivas. Efectuam apenas colisões elásticas. E cinética = ½ mv 2 α T Ludwig Boltzmann

Velocidades moleculares

Lei de Graham da efusão A efusão consiste na passagem de moléculas de um gás através de um orifício à escala molecular. Qual o factor de separação entre o uranio-238 e uranio-235, necessário ao enriquecimento do urânio, a partir do hexafluoreto de urânio, UF 6 (g)? S = (238+6× 19/(235+6× 19))1/2 1. 004

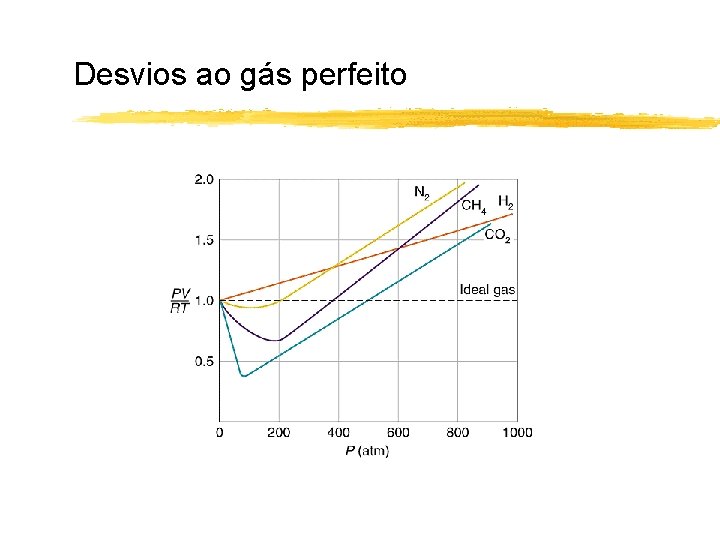
Desvios ao gás perfeito

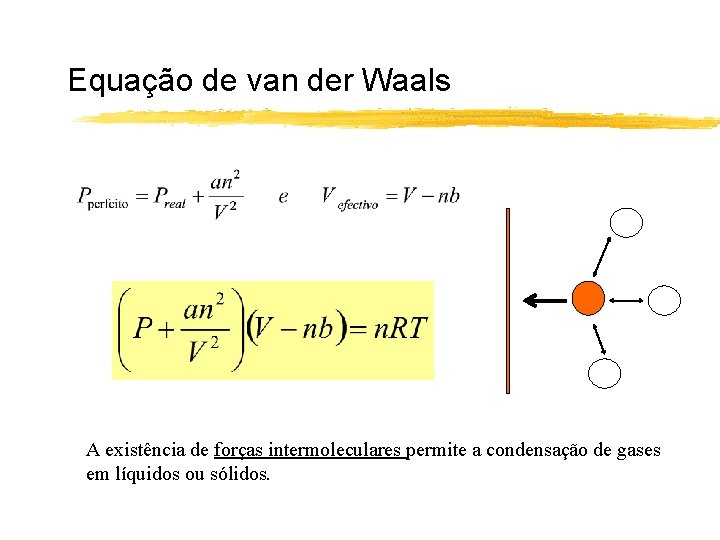
Equação de van der Waals A existência de forças intermoleculares permite a condensação de gases em líquidos ou sólidos.

Recomendações Finais Utilizem estes “slides” em conjuntos com as vossa notas da lição! Complementem o vosso estudo com a leitura do Capítulo 5 do Chang (R. Chang, Química, 11ª ed. , Mc. Graw-Hill, Lisboa, 2013) Resolvam os exercícios da 3ª série! Boa semana!
 Aldo valentim
Aldo valentim Promotion from assistant to associate professor
Promotion from assistant to associate professor Elizabete nunes
Elizabete nunes Pedagogia areas de atuação
Pedagogia areas de atuação Squeaks pneumologie
Squeaks pneumologie Elisa aline nunes
Elisa aline nunes Filomena nunes
Filomena nunes Dr joni nunes
Dr joni nunes Onfalocele
Onfalocele Departamental de educación santa ana
Departamental de educación santa ana Organizacion departamental
Organizacion departamental Orden departamental de la rama ejecutiva
Orden departamental de la rama ejecutiva Gobernacion del valle educacion
Gobernacion del valle educacion Gestion departamental
Gestion departamental Desenho departamental
Desenho departamental Descentralización vertical
Descentralización vertical Secretaria de salud departamental del valle
Secretaria de salud departamental del valle Modelo departamental
Modelo departamental Fonasa departamental
Fonasa departamental Massa atomica e massa molecular
Massa atomica e massa molecular Simbolo unidade de medida
Simbolo unidade de medida