Qumica Geral 20142015 Professor Valentim Nunes Unidade Departamental

















- Slides: 24

Química Geral - 2014/2015 Professor Valentim Nunes, Unidade Departamental de Engenharia email: valentim@ipt. pt Gabinete: J 207 Pág. Web: http: //www. docentes. ipt. pt/valentim/ensino/quimica 1. htm (é bastante útil a consulta desta página!)

Why study chemistry? • Porque é necessário para obter a graduação em Engenharia!!! • Pela inúmeras aplicações no nosso dia-a-dia • Diferentes disciplinas dependem da Química: materiais, reacção química, energia, ambiente, bioquímica, etc. • Compreensão de aspectos ambientais: camada de ozono, chuva ácida, reacções nucleares, medicamentos, reciclagem, etc. Ver lição de apresentação!

Planificação das aulas teóricas 1ª Semana 2ª Semana 18/09 25/09 Apresentação; Química e o nosso futuro Ferramentas da Química I 3ª Semana 02/10 Ferramentas da Química II 4ª Semana 09/10 Ferramentas da Química III - Termoquímica 5ª Semana 6ª Semana 7ª Semana 8ª Semana 9ª Semana 10ª Semana 11ª Semana 12ª Semana 13ª Semana 14ª Semana 16/10 23/10 30/10 06/11 13/11 20/11 27/11 04/12 11/12 18/12 Estrutura Atómica Tabela Periódica Ligação Química Estados da Matéria - Estado Gasoso (Cont. )Líquidos, Sólidos e Mudanças de Fase Propriedades Físicas das Soluções Equilíbrio Químico - Lei da Acção de Massas (Cont. ) Equilíbrio Ácido-Base (Cont. ) Equilíbrio de Solubilidade Revisões

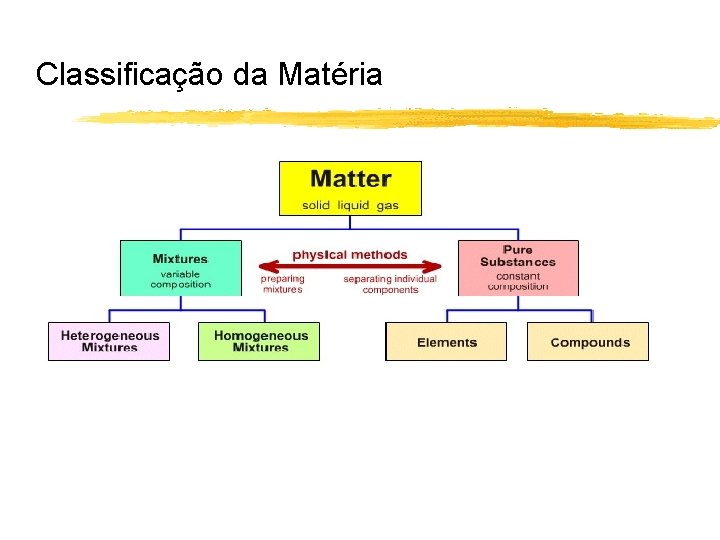
Ferramentas básicas da Química - É uma Ciência experimental que se ocupa do estudo da Matéria e das transformações que nela ocorrem. Matéria: Tudo o que possui massa e ocupa espaço. Substância pura: forma de matéria composição bem definida e propriedades próprias. Exº: H 2 O, ouro, O 2, etc. . Elementos: blocos básicos da matéria! Não podem ser decompostos por meios químicos em substâncias mais simples Compostos: combinação de dois ou mais elementos unidos quimicamente em proporções bem definidas e constantes. Misturas: combinação de duas ou mais substâncias que mantêm a sua identidade. Homogéneas: Constituídas por uma única fase uniforme Heterogéneas: múltiplas fases.

Classificação da Matéria

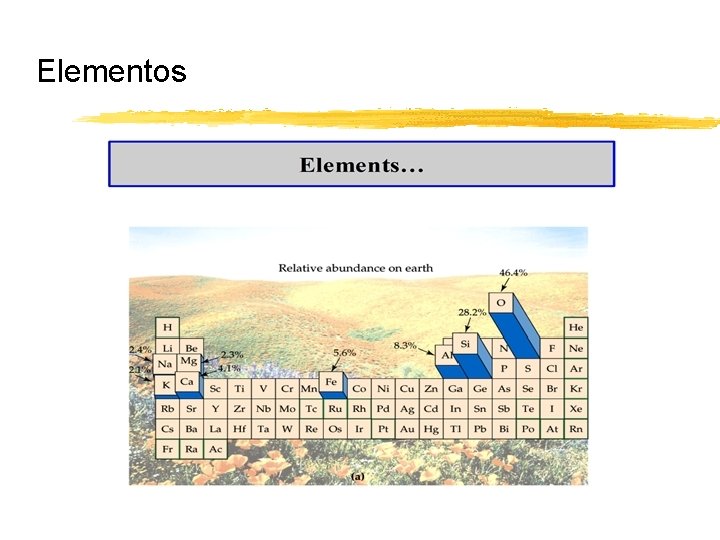
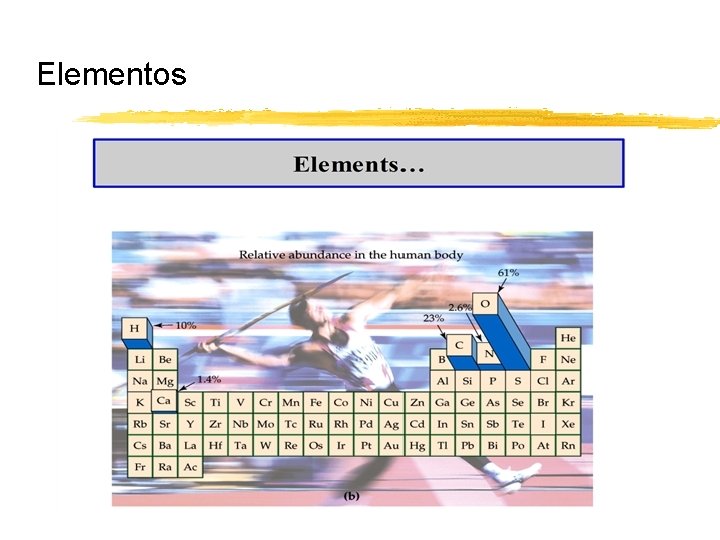
Elementos

Elementos

Estados da Matéria Todas as substâncias podem, em princípio, existir em três estados: Sólido Líquido Gasoso

Unidades do Sistema Internacional (SI) Unidades de Base: comprimento (m); massa (kg); tempo (s), corrente (A); Temperatura (K); intensidade luminosa (cd); quantidade de substância (mol). Unidades derivadas: exº volume (m 3); força (N); energia (J), etc. Conversão de unidades --> método do factor unitário = 1300 kg/m 3 = 1300 kg/ m 3 (1 m 3/ 1 106 cm 3) (1000 g/ 1 kg) = 1. 3 g/ cm 3

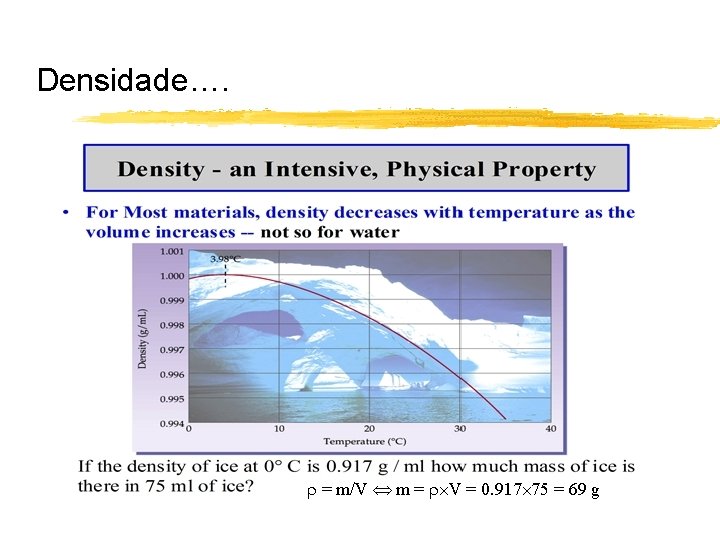
Propriedades dos materiais Propriedades intensivas: não dependem da quantidade de matéria: exº densidade, temperatura… Propriedades extensivas: dependem da quantidade de matéria: exº massa, volume… Propriedades físicas: características que não alteram a composição química do material: exº ponto de fusão, temperatura, dureza, condutividade, . . Propriedades químicas: envolvem a mudança de composição química: exº reactividade química, combustão, polimerização, explosividade, ….

Densidade…. = m/V m = V = 0. 917 75 = 69 g

Teoria atómica Dalton: elementos são constituídos por partículas pequenas, chamados átomos. Os átomos de um dado elemento são iguais, indivisíveis e indestrutíveis (Not true!!) Estrutura do átomo Thomson: electrões Rutherford: protões e o núcleo. Chadwick: neutrões.

Relações mássicas Número atómico, Z: número de protões do núcleo. Número de massa, A: número de protões + número de neutrões do núcleo. Um átomo X é designado por Isótopos: átomos de um mesmo elemento mas com diferente número de massa. Unidade de massa atómica: propriedade fundamental dos átomos. Por Convenção Internacional 1 u. m. a. é igual a 1/12 da massa de um átomo de carbono 12, Massa atómica: é a massa média pesada de um elemento, tendo em conta a abundância natural relativa dos isótopos desse elemento.

Relações mássicas Mole, mol: Quantidade de substância que contem o mesmo número de entidades elementares (átomos, moléculas, iões ou outras partículas) quantos os átomos existentes em exactamente 12 g de carbono-12. 1 mol contem sempre o mesmo número de partículas. Constante de Avogadro: NA 6. 022 1023 mol-1 Massa molar: a massa em gramas de 1 mol de átomos de um elemento. A massa molar é a quantidade em gramas numericamente igual à massa atómica em u. m. a.

Moléculas, Iões e seus compostos Molécula: agregado de pelo menos dois átomos ligados por forças químicas. É a mais pequena entidade em que uma substância pura, como o açúcar ou água, pode ser dividida e ainda reter a composição e propriedades químicas da substância. São representadas por fórmulas: molecular: C 2 H 6 O condensada: CH 3 CH 2 OH estruturais: Iões: Um ião é um átomo ou grupo de átomos que tem uma carga positiva ou negativa - monoatómicos ou poliatómicos. Catiões: Al 3+, Cu 2+, NH 4+, …. . Aniões: O 2 -, F-, CO 32 -, ….

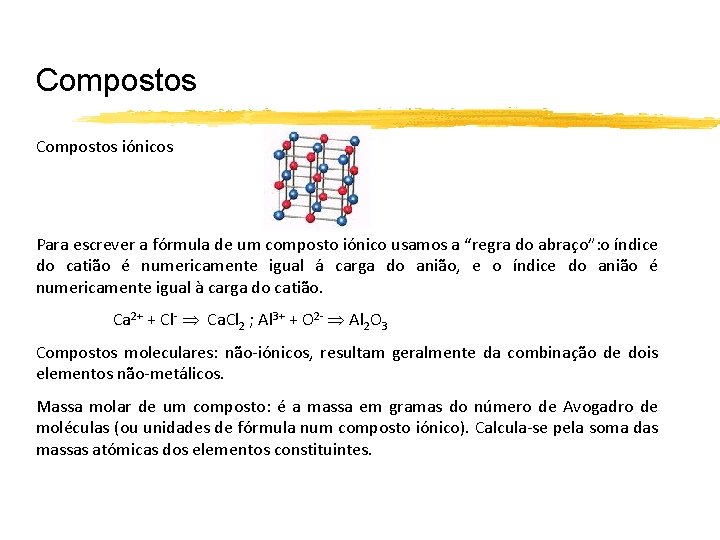
Compostos iónicos Para escrever a fórmula de um composto iónico usamos a “regra do abraço”: o índice do catião é numericamente igual á carga do anião, e o índice do anião é numericamente igual à carga do catião. Ca 2+ + Cl- Ca. Cl 2 ; Al 3+ + O 2 - Al 2 O 3 Compostos moleculares: não-iónicos, resultam geralmente da combinação de dois elementos não-metálicos. Massa molar de um composto: é a massa em gramas do número de Avogadro de moléculas (ou unidades de fórmula num composto iónico). Calcula-se pela soma das massas atómicas dos elementos constituintes.

Composição percentual dos Compostos Composição percentual de um composto: é a percentagem em massa de cada elemento num composto. Exº NH 3 %N = (massa N/massa de NH 3) x 100 = (14. 007/17. 031)x 100 = 82. 24% %H = (3 xmassa de H/massa de NH 3)x 100 = 17. 76% Obtenção de fórmulas empíricas e moleculares: --> converter massa em % --> converter massa em número de moles --> encontrar a razão entre o número de moles de cada elemento (permite obter a fórmula empírica) --> a partir da massa molar, obter a fórmula molecular

Nomenclatura de compostos Inorgânicos Compostos iónicos: muitos compostos iónicos são binários ou formados apenas por dois elementos. O primeiro elemento nomeado é o anião não-metálico, seguido do catião. O nome do anião obtém-se adicionando a terminação “eto” A terminação em “eto” é também usada para alguns grupos aniónicos com elementos diferentes como o ião cianeto (CN-). Com excepção do ião amónio (NH 4+), todos os catiões com interesse resultam de átomos de metais e recebem o nome dos seus elementos. Exemplos: Na. Cl : cloreto de sódio KBr : brometo de potássio Zn. I 2 : iodeto de zinco Al 2 O 3 : óxido de alumínio (!)

Nomenclatura de compostos Inorgânicos Nomes e fórmulas de alguns catiões e aniões inorgânicos comuns Catião Anião _________________________________ Amónio, NH 4+ Carbonato, CO 32 - Bário, Ba 2+ Clorato, Cl. O 3 - Cádmio, Cd 2+ Cálcio, Ca 2+ Césio, Cs+ Chumbo(II), Pb 2+ Crómio, Cr 3+ Cobre(I) ou cuproso, Cu+ Cobre(II) ou cúprico, Cu 2+ Ferro(II) ou ferroso, Fe 2+ Ferro(III) ou férrico, Fe 3+ Lítio, Li+ Potássio, K+ Sódio, Na+ Zinco, Zn 2+ Cloreto, Cl. Cromato, Cr. O 42 Fe. Cl 2: cloreto de ferro (II) 2 Dicromato, Cr 2 O 7 Fe. Cl 3: cloreto de ferro (III) Fluoreto, FHidreto, HHidrogenocarbonato ou bicarbonato, HCO 3 Iodeto, INitrato, NO 3 Nitreto, N 3Óxido, O 2 Peróxido, O 22 Sulfato, SO 42 Sulfureto, S 2 - Sistema de Stock: ______________________________________________________

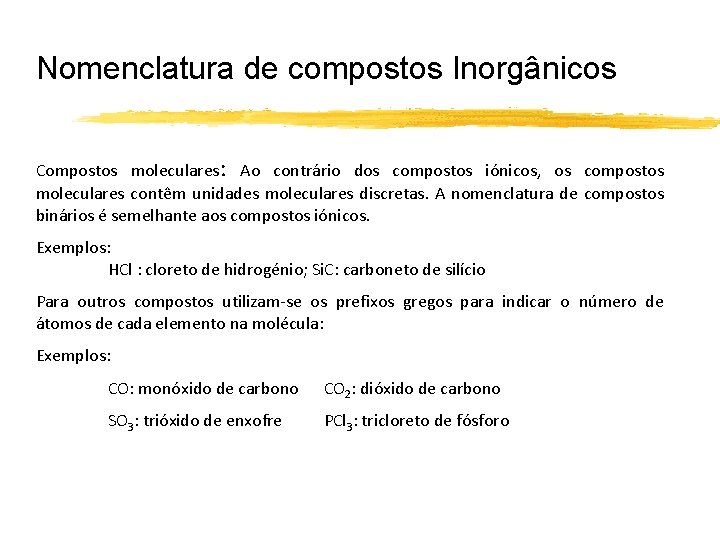
Nomenclatura de compostos Inorgânicos Compostos moleculares: Ao contrário dos compostos iónicos, os compostos moleculares contêm unidades moleculares discretas. A nomenclatura de compostos binários é semelhante aos compostos iónicos. Exemplos: HCl : cloreto de hidrogénio; Si. C: carboneto de silício Para outros compostos utilizam-se os prefixos gregos para indicar o número de átomos de cada elemento na molécula: Exemplos: CO: monóxido de carbono CO 2: dióxido de carbono SO 3: trióxido de enxofre PCl 3: tricloreto de fósforo

Nomenclatura de compostos Inorgânicos Ácidos e Bases: um ácido pode ser descrito como uma substância que liberta iões de hidrogénio, H+, quando dissolvida em água, enquanto uma base pode ser descrita como uma substância que cede iões hidróxido, OH-, quando dissolvida em água. Aniões cujo nome termina em “eto” formam ácidos com uma terminação em “ico” Exemplos: F- , fluoreto HF, ácido fluorídrico Cl-, cloreto HCl, ácido clorídrico CN-, cianeto HCN, ácido cianídrico

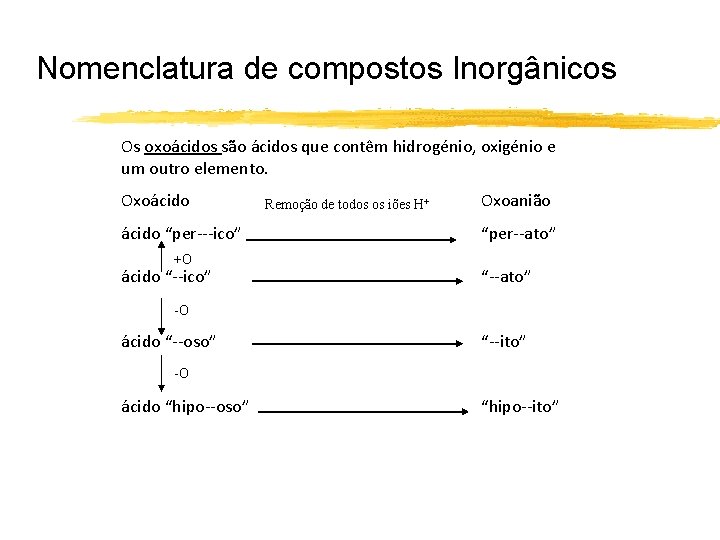
Nomenclatura de compostos Inorgânicos Os oxoácidos são ácidos que contêm hidrogénio, oxigénio e um outro elemento. Oxoácido “per---ico” +O ácido “--ico” Remoção de todos os iões H+ Oxoanião “per--ato” “--ato” -O ácido “--oso” “--ito” -O ácido “hipo--oso” “hipo--ito”

Nomenclatura de compostos Inorgânicos Ácido HCl. O 4 (ácido perclórico) HCl. O 3 (ácido clórico) HCl. O 2 (ácido cloroso) HCl. O (ácido hipocloroso) Anião Cl. O 4 - (perclorato) Cl. O 3 - (clorato) Cl. O 2 - (clorito) Cl. O- (hipoclorito) Hidratos: são compostos que possuem um número específico de moléculas de água ligadas a si. Exemplos: Ba. Cl 2 · 2 H 2 O Mg. SO 4 · 7 H 2 O dihidrato de cloreto de bário heptahidrato de sulfato de magnésio

Recomendações Finais Utilizem estes “slides” em conjuntos com as vossa notas da lição! Complementem o vosso estudo com a leitura do Capítulo 1 e 2 do Chang (R. Chang, Química, 11ª ed. , Mc. Graw-Hill, Lisboa, 2013) Resolvam os exercícios da 1ª série! Boa semana!
 Aldo valentim
Aldo valentim Promotion from assistant to associate professor
Promotion from assistant to associate professor Filomena nunes
Filomena nunes Joni nunes
Joni nunes Onfalocele
Onfalocele Pessoas essenciais
Pessoas essenciais [email protected]
[email protected] Hilario nunes
Hilario nunes Elisa aline nunes
Elisa aline nunes Ministerio de educación departamental
Ministerio de educación departamental Centralizacion de desempeño
Centralizacion de desempeño Modelo departamental
Modelo departamental Gobernacion del valle del cauca secretaria de educacion
Gobernacion del valle del cauca secretaria de educacion Organizacion departamental
Organizacion departamental Secretaria de salud departamental del valle
Secretaria de salud departamental del valle Orden departamental de la rama ejecutiva
Orden departamental de la rama ejecutiva Gestion departamental
Gestion departamental Fonasa departamental
Fonasa departamental Departamentar
Departamentar Massa molar
Massa molar Simbolo unidade de medida
Simbolo unidade de medida Unidade de ensino superior dom bosco
Unidade de ensino superior dom bosco Densidade unidade
Densidade unidade Tkm 50
Tkm 50 Conversao de unidades
Conversao de unidades