QUMICA GERAL UNIDADE 1 INTRODUO QUMICA GERAL Prof






- Slides: 17

QUÍMICA GERAL UNIDADE 1 - INTRODUÇÃO À QUÍMICA GERAL Prof. Cristian Berto da Silveira

Química Geral UNIDADE 1 - INTRODUÇÃO À QUÍMICA GERAL 1. 1 - Histórico Estrutura da Matéria Grécia Antiga: Existiam apenas quatro elementos ÁGUA, TERRA, AR e FOGO. Aristóteles (384 a. C à 322 a. C): acreditava que cada elemento resultava da combinação de duas qualidades, quente, frio, úmido e seco. (3) “ O que acontece quando quebramos uma porção de matéria em pedaços cada vez menores? ” Leucipo (≈ 500 a. C): acreditava que a matéria podia ser dividida até chegar a uma pequena partícula indivisível chamada de ÁTOMO (A = NÃO; TOMO = PARTE) Princípio da Descontinuidade.

Química Geral Alquimia: Grécia até 1100 d. C. Transmutação – conversão de um elemento em outro, por exemplo: converter chumbo em ouro. Cientista Inglês John Dalton (1803) : A matéria é constituída de átomos. Hipótese Atômica: 1 - Todos a matéria é composta de partículas fundamentais, o átomos; 2 - Os átomos são permanentes e indivisíveis, não podem ser criados nem destruídos; 3 - Todos os átomos de um certo elemento são idênticos em todas as suas propriedades e átomos de elementos diferentes tem propriedades diferentes; 4 - Uma alteração química consiste em uma combinação, separação ou rearranjo de átomos; 5 - Os compostos são constituídos de átomos e elementos diferentes em proporções fixas; (3)

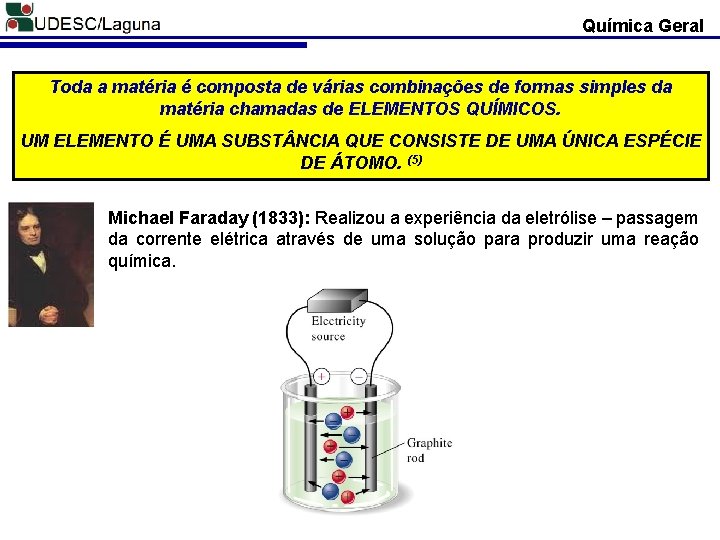
Química Geral Toda a matéria é composta de várias combinações de formas simples da matéria chamadas de ELEMENTOS QUÍMICOS. UM ELEMENTO É UMA SUBST NCIA QUE CONSISTE DE UMA ÚNICA ESPÉCIE DE ÁTOMO. (5) Michael Faraday (1833): Realizou a experiência da eletrólise – passagem da corrente elétrica através de uma solução para produzir uma reação química.

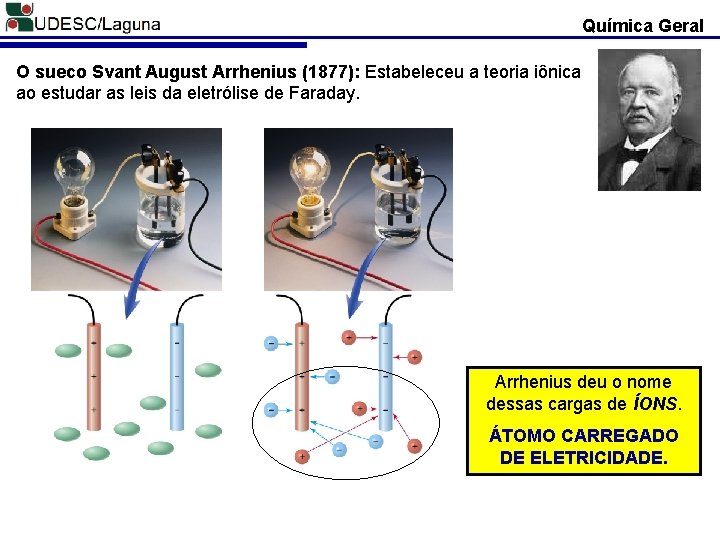
Química Geral O sueco Svant August Arrhenius (1877): Estabeleceu a teoria iônica ao estudar as leis da eletrólise de Faraday. Arrhenius deu o nome dessas cargas de ÍONS. ÁTOMO CARREGADO DE ELETRICIDADE.

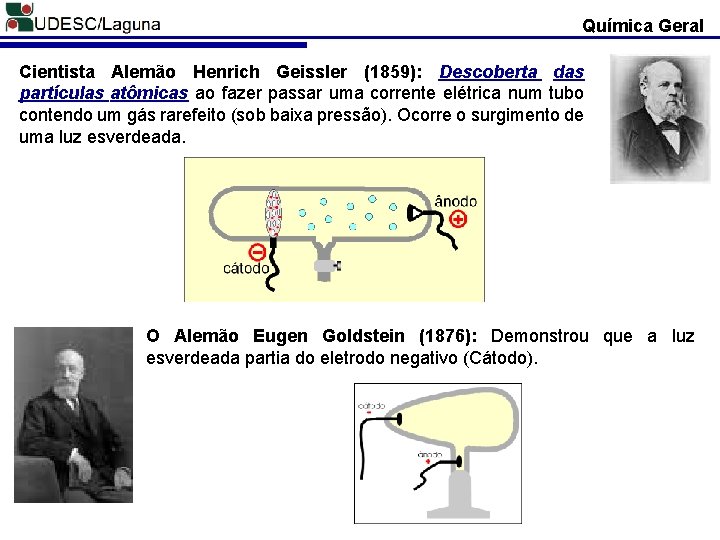
Química Geral Cientista Alemão Henrich Geissler (1859): Descoberta das partículas atômicas ao fazer passar uma corrente elétrica num tubo contendo um gás rarefeito (sob baixa pressão). Ocorre o surgimento de uma luz esverdeada. O Alemão Eugen Goldstein (1876): Demonstrou que a luz esverdeada partia do eletrodo negativo (Cátodo).

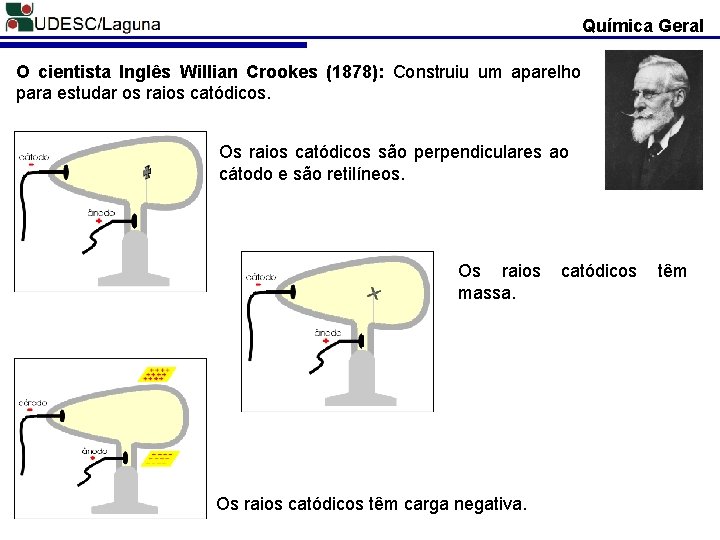
Química Geral O cientista Inglês Willian Crookes (1878): Construiu um aparelho para estudar os raios catódicos. Os raios catódicos são perpendiculares ao cátodo e são retilíneos. Os raios massa. Os raios catódicos têm carga negativa. catódicos têm

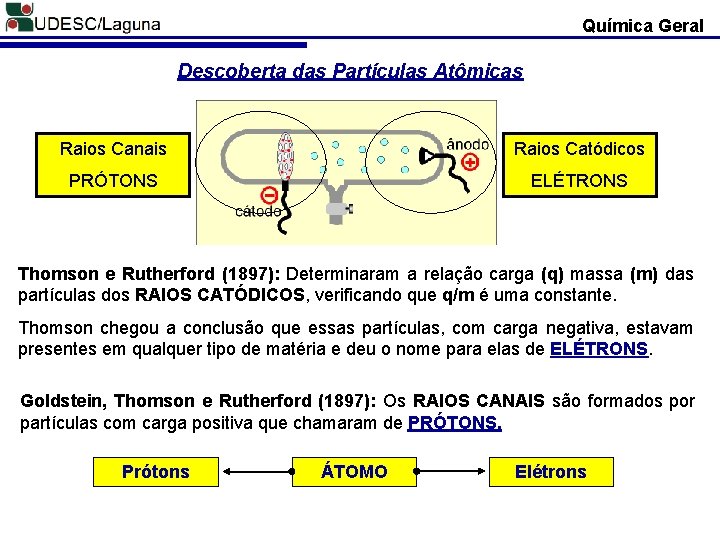
Química Geral Descoberta das Partículas Atômicas Raios Canais Raios Catódicos PRÓTONS ELÉTRONS Thomson e Rutherford (1897): Determinaram a relação carga (q) massa (m) das partículas dos RAIOS CATÓDICOS, verificando que q/m é uma constante. Thomson chegou a conclusão que essas partículas, com carga negativa, estavam presentes em qualquer tipo de matéria e deu o nome para elas de ELÉTRONS. Goldstein, Thomson e Rutherford (1897): Os RAIOS CANAIS são formados por partículas com carga positiva que chamaram de PRÓTONS. Prótons ÁTOMO Elétrons

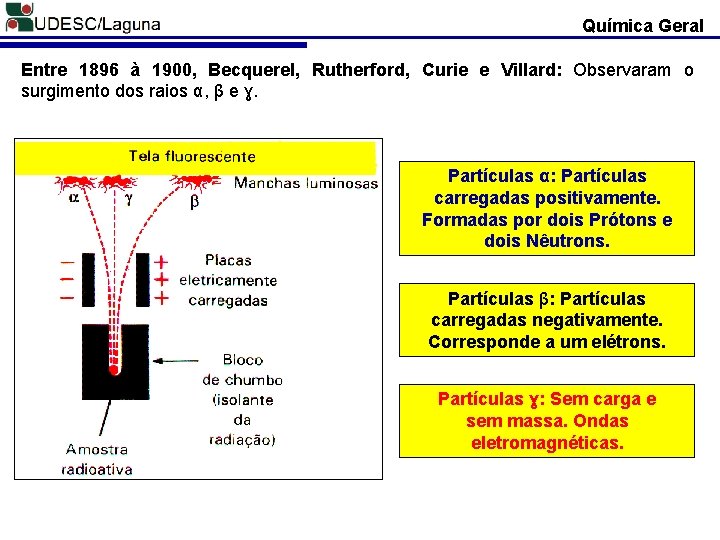
Química Geral Entre 1896 à 1900, Becquerel, Rutherford, Curie e Villard: Observaram o surgimento dos raios α, β e ɣ. Partículas α: Partículas carregadas positivamente. Formadas por dois Prótons e dois Nêutrons. Partículas β: Partículas carregadas negativamente. Corresponde a um elétrons. Partículas ɣ: Sem carga e sem massa. Ondas eletromagnéticas.

Química Geral MODELO ATÔMICO DE THOMSON Thomson (1904): Teoria sobre a estrutura Atômica. Segundo Thomson o átomo era uma esfera positiva que, para tornar-se netura, apresentava elétrons (partículas negativas) incrustadas na superfície. Esse modelo atômico ficou conhecido como Pudim de Ameixa.

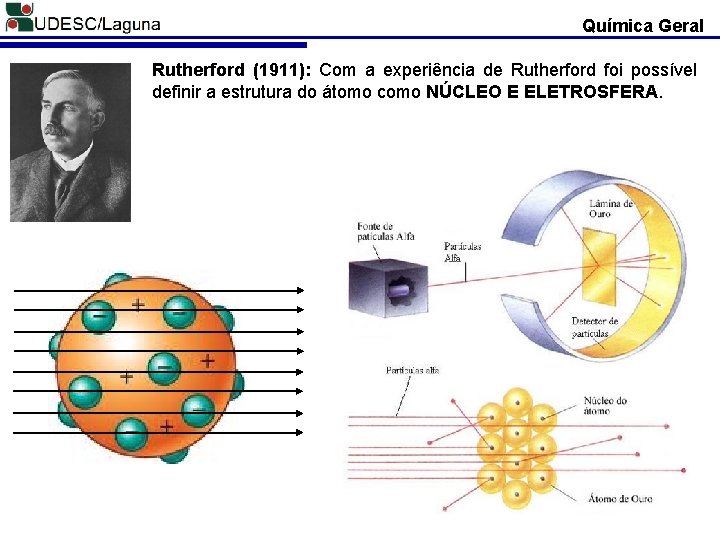
Química Geral Rutherford (1911): Com a experiência de Rutherford foi possível definir a estrutura do átomo como NÚCLEO E ELETROSFERA.

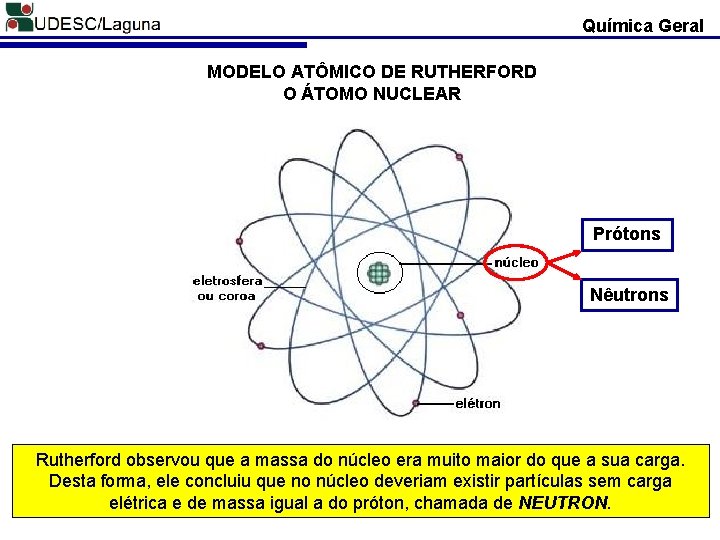
Química Geral MODELO ATÔMICO DE RUTHERFORD O ÁTOMO NUCLEAR Prótons Nêutrons Rutherford observou que a massa do núcleo era muito maior do que a sua carga. Desta forma, ele concluiu que no núcleo deveriam existir partículas sem carga elétrica e de massa igual a do próton, chamada de NEUTRON.

Química Geral MODELO ATÔMICO DE BOHR Bohr (1913): Elaborou a teoria sobre a distribuição e o movimento dos elétrons. Postulados de Bohr Postulado 1: Os elétrons descrevem ao redor do núcleo orbitas circulares com energia determinada; Postulado 2: Os elétrons movimentam-se nas orbitas estacionárias e, nesse movimento, não emitem energia espontaneamente; Postulado 3: Quando um elétron recebe energia, ele tende a pular para outra órbita. Após ele receber esta energia ele tende a voltar a órbita original emitido a energia recebida;

Química Geral Arnold Johannes Wilhelm Sommerfeld (1914): Admitiu que além da das orbitas circulares, o elétron descreve uma orbita elíptica ao redor do núcleo do átomos. Essas orbitas, circulares e elípticas, com diferentes excentricidade apresentam diferentes conteúdos de energia, CHAMODAS DE CAMADAS. De Broglie (1923): Desenvolveu uma equação na qual demonstrava que qualquer corpo em movimento está associado à fenômenos ondulatórios. O ELÉTRONS apresenta a natureza de uma PARTÍCULA-ONDA. Werner Heisenberg (1927): Anunciou o Princípio da Incerteza. “ É impossível determinar simultaneamente a posição exata e a velocidade de uma partícula onda num dado instante”

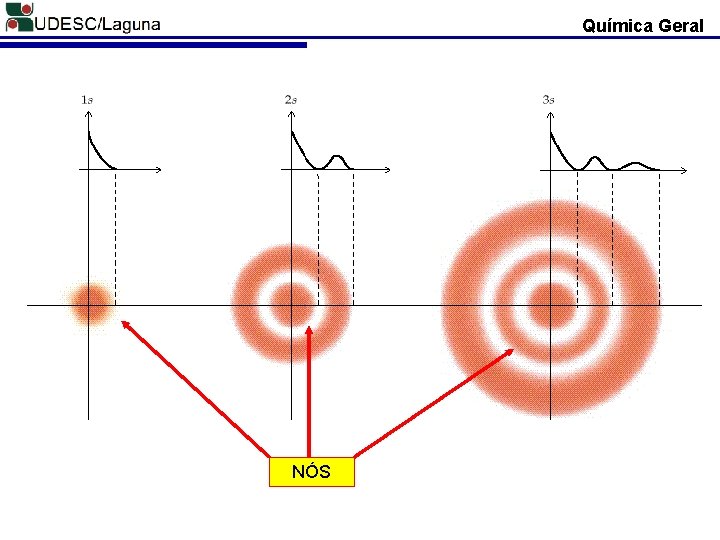
Química Geral Erwin Schrödinger (1926): Propôs a teoria chamada de Mecânica Ondulatória. ESTABELECEU O CONCEITO DE ORBITAL. Ψv = [2/L]1/2. sen [n πk/L] n = NÚMERO QU NTICO n = 1, 2, 3. . . ORBITAL É O ESPCAÇO AO REDOR DO NÚCLEO EM QUE É MUITO GRANDE A PROPABILIDADE DE SE LOCALIZAR O ELÉTRON. MODELO ATÔMICO ONDULATÓRIO

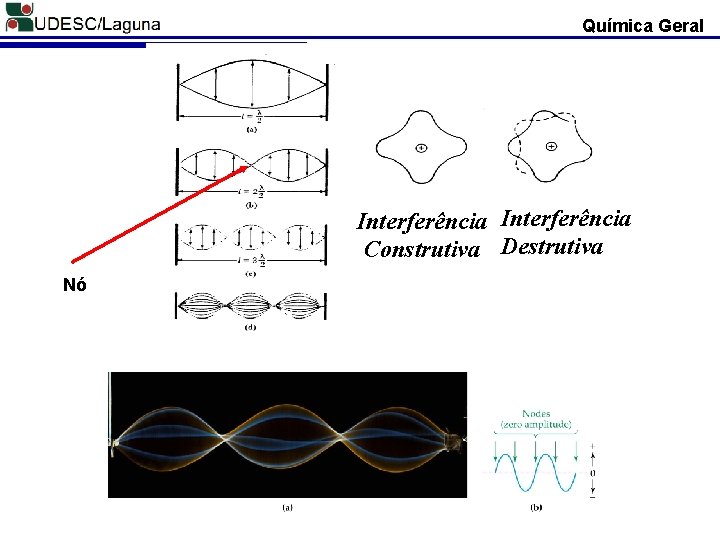
Química Geral Interferência Construtiva Destrutiva Nó

Química Geral NÓS