QUMICA GERAL UNIDADE 1 INTRODUO QUMICA GERAL Prof






- Slides: 15

QUÍMICA GERAL UNIDADE 1 - INTRODUÇÃO À QUÍMICA GERAL Prof. Mário Pinheiro

UNIDADE 1 - INTRODUÇÃO À QUÍMICA GERAL 1. 1 - Histórico Estrutura da Matéria Grécia Antiga: Existiam apenas quatro elementos ÁGUA, TERRA, AR e FOGO. Aristóteles (384 a. C à 322 a. C): acreditava que cada elemento resultava da combinação de duas qualidades, quente, frio, úmido e seco. (3) “ O que acontece quando quebramos uma porção de matéria em pedaços cada vez menores? ” Leucipo/demócrito (≈ 300 a. C): acreditava que a matéria podia ser dividida até chegar a uma pequena partícula indivisível chamada de ÁTOMO (A = NÃO; TOMO = PARTE)

Alquimia: Grécia até 1100 d. C. Transmutação – conversão de um elemento em outro, por exemplo: converter chumbo em ouro. Cientista Inglês John Dalton (1803) : A matéria é constituída de átomos. Hipótese Atômica: 1 - Todos a matéria é composta de partículas fundamentais, o átomos; 2 - Os átomos são permanentes e indivisíveis, não podem ser criados nem destruídos; 3 - Todos os átomos de um certo elemento são idênticos em todas as suas propriedades e átomos de elementos diferentes tem propriedades diferentes; 4 - Uma alteração química consiste em uma combinação, separação ou rearranjo de átomos; 5 - Os compostos são constituídos de átomos e elementos diferentes em proporções fixas; (3)

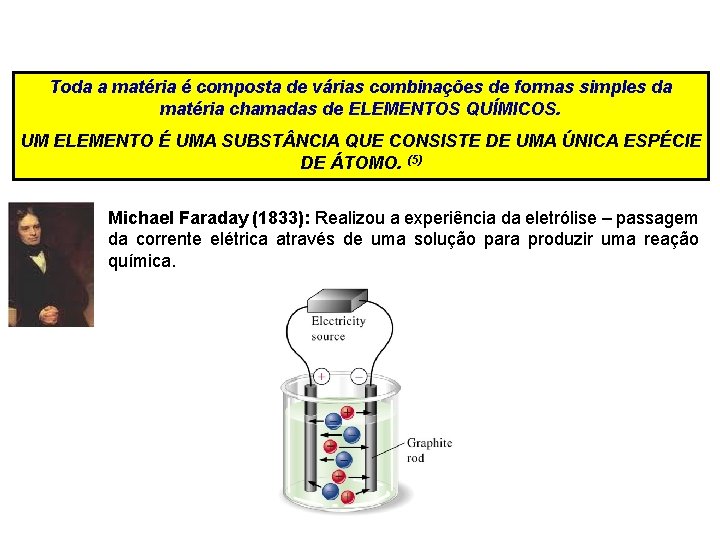
Toda a matéria é composta de várias combinações de formas simples da matéria chamadas de ELEMENTOS QUÍMICOS. UM ELEMENTO É UMA SUBST NCIA QUE CONSISTE DE UMA ÚNICA ESPÉCIE DE ÁTOMO. (5) Michael Faraday (1833): Realizou a experiência da eletrólise – passagem da corrente elétrica através de uma solução para produzir uma reação química.

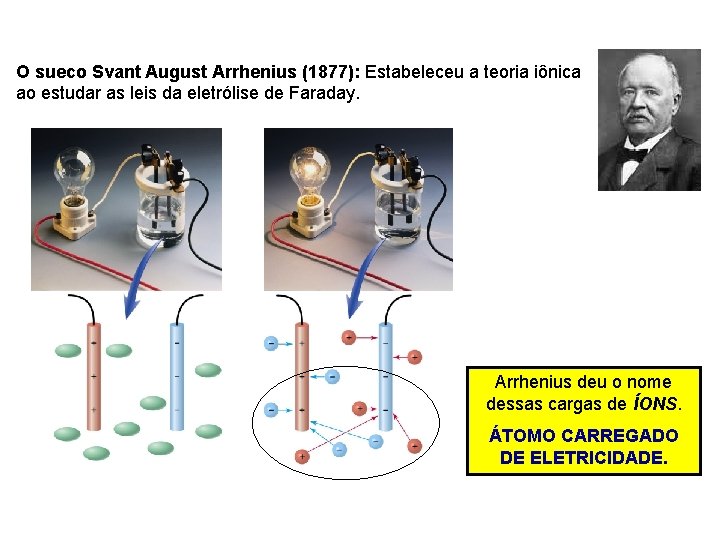
O sueco Svant August Arrhenius (1877): Estabeleceu a teoria iônica ao estudar as leis da eletrólise de Faraday. Arrhenius deu o nome dessas cargas de ÍONS. ÁTOMO CARREGADO DE ELETRICIDADE.

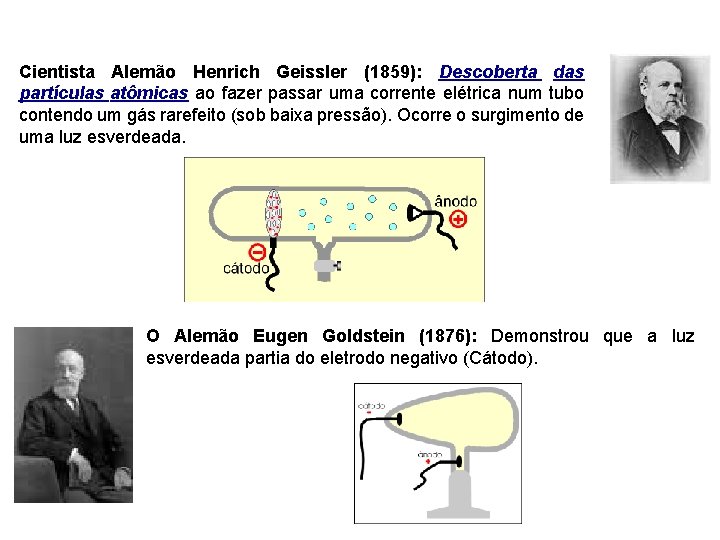
Cientista Alemão Henrich Geissler (1859): Descoberta das partículas atômicas ao fazer passar uma corrente elétrica num tubo contendo um gás rarefeito (sob baixa pressão). Ocorre o surgimento de uma luz esverdeada. O Alemão Eugen Goldstein (1876): Demonstrou que a luz esverdeada partia do eletrodo negativo (Cátodo).

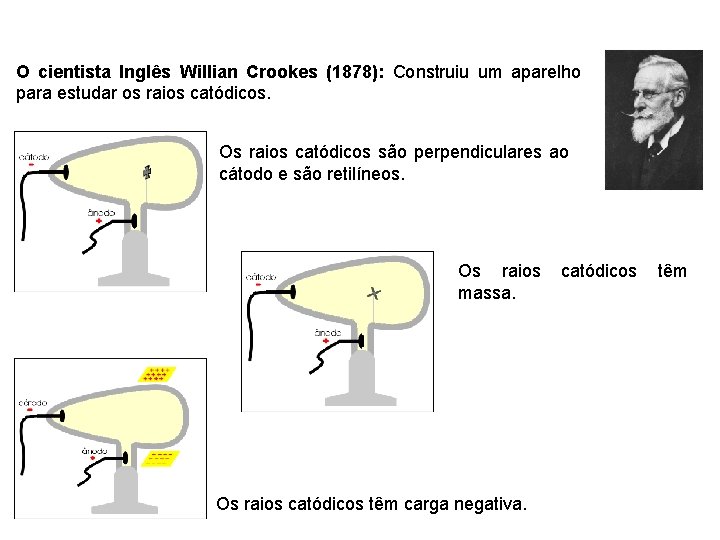
O cientista Inglês Willian Crookes (1878): Construiu um aparelho para estudar os raios catódicos. Os raios catódicos são perpendiculares ao cátodo e são retilíneos. Os raios massa. Os raios catódicos têm carga negativa. catódicos têm

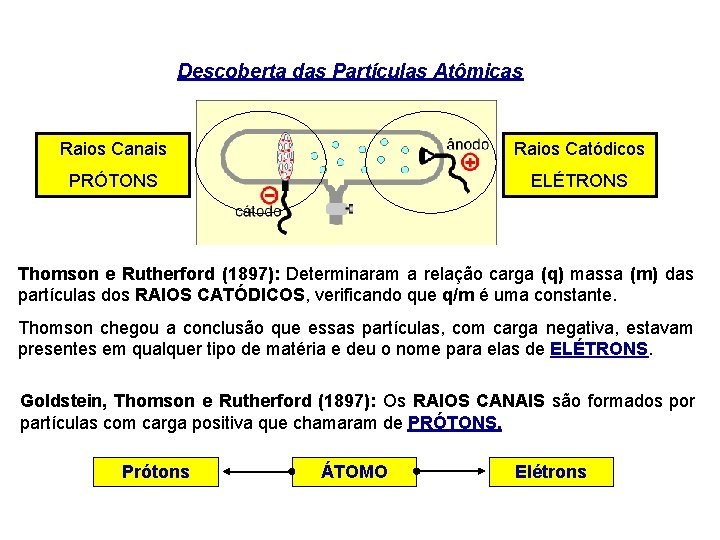
Descoberta das Partículas Atômicas Raios Canais Raios Catódicos PRÓTONS ELÉTRONS Thomson e Rutherford (1897): Determinaram a relação carga (q) massa (m) das partículas dos RAIOS CATÓDICOS, verificando que q/m é uma constante. Thomson chegou a conclusão que essas partículas, com carga negativa, estavam presentes em qualquer tipo de matéria e deu o nome para elas de ELÉTRONS. Goldstein, Thomson e Rutherford (1897): Os RAIOS CANAIS são formados por partículas com carga positiva que chamaram de PRÓTONS. Prótons ÁTOMO Elétrons

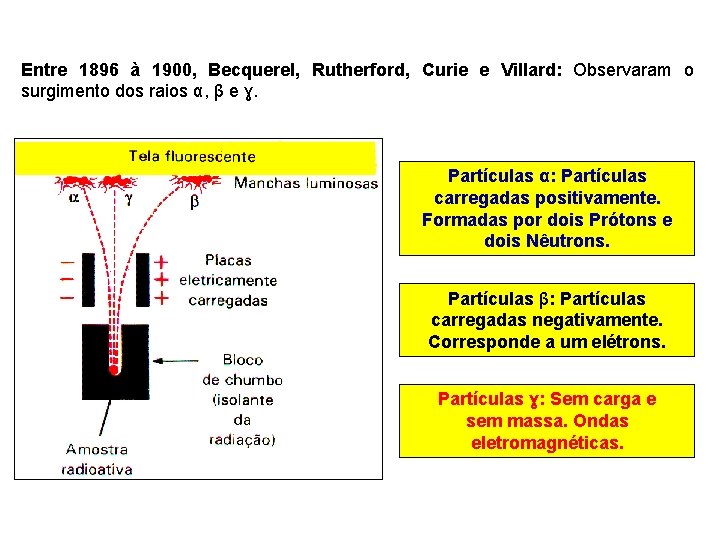
Entre 1896 à 1900, Becquerel, Rutherford, Curie e Villard: Observaram o surgimento dos raios α, β e ɣ. Partículas α: Partículas carregadas positivamente. Formadas por dois Prótons e dois Nêutrons. Partículas β: Partículas carregadas negativamente. Corresponde a um elétrons. Partículas ɣ: Sem carga e sem massa. Ondas eletromagnéticas.

Química Geral MODELO ATÔMICO DE THOMSON Thomson (1904): Teoria sobre a estrutura Atômica. Segundo Thomson o átomo era uma esfera positiva que, para tornar-se neutra, apresentava elétrons (partículas negativas) incrustadas na superfície. Esse modelo atômico ficou conhecido como Pudim de Ameixa.

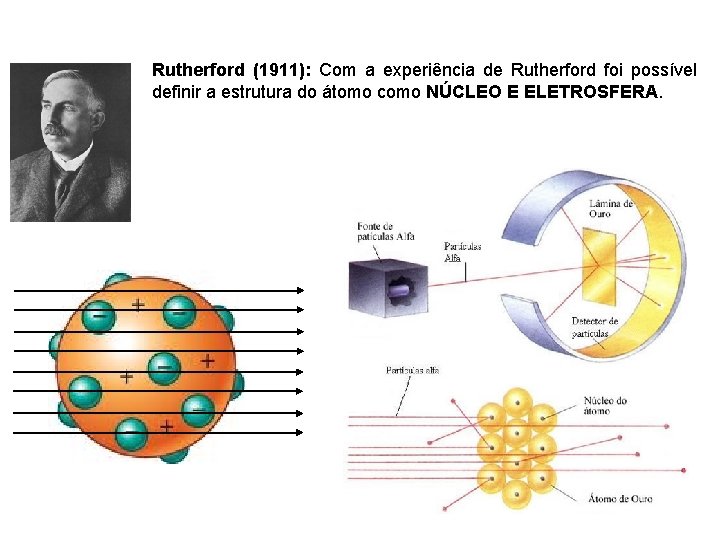
Rutherford (1911): Com a experiência de Rutherford foi possível definir a estrutura do átomo como NÚCLEO E ELETROSFERA.

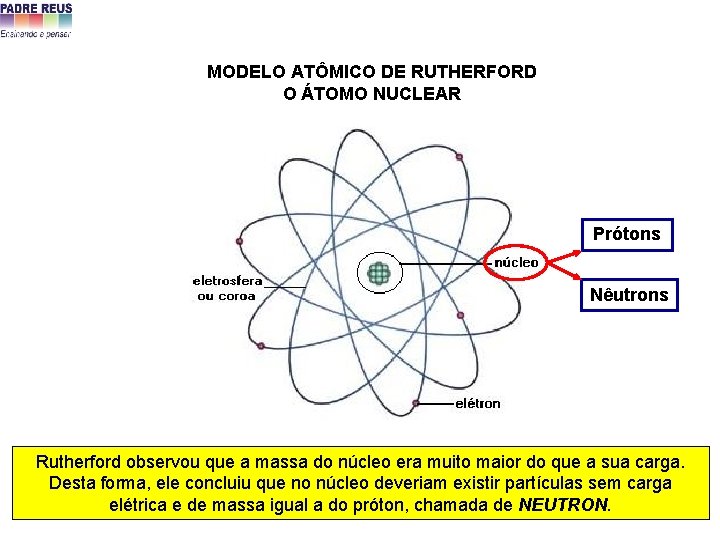
MODELO ATÔMICO DE RUTHERFORD O ÁTOMO NUCLEAR Prótons Nêutrons Rutherford observou que a massa do núcleo era muito maior do que a sua carga. Desta forma, ele concluiu que no núcleo deveriam existir partículas sem carga elétrica e de massa igual a do próton, chamada de NEUTRON.

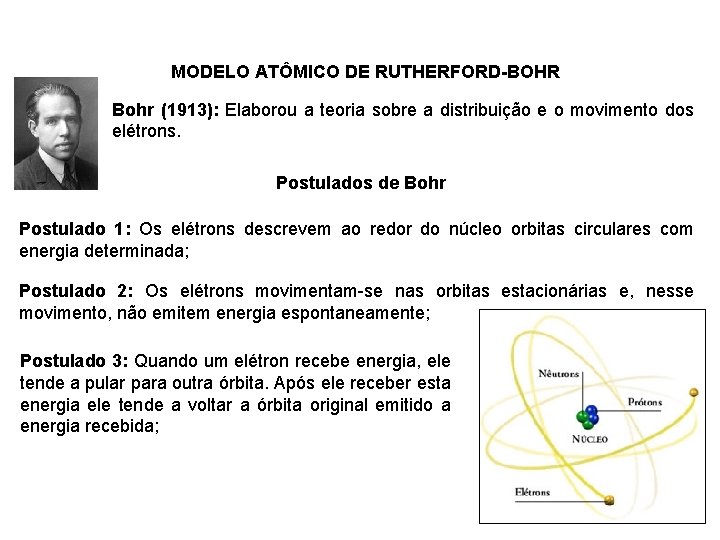
MODELO ATÔMICO DE RUTHERFORD-BOHR Bohr (1913): Elaborou a teoria sobre a distribuição e o movimento dos elétrons. Postulados de Bohr Postulado 1: Os elétrons descrevem ao redor do núcleo orbitas circulares com energia determinada; Postulado 2: Os elétrons movimentam-se nas orbitas estacionárias e, nesse movimento, não emitem energia espontaneamente; Postulado 3: Quando um elétron recebe energia, ele tende a pular para outra órbita. Após ele receber esta energia ele tende a voltar a órbita original emitido a energia recebida;

Arnold Johannes Wilhelm Sommerfeld (1914): Admitiu que além da das orbitas circulares, o elétron descreve uma orbita elíptica ao redor do núcleo do átomos. Essas orbitas, circulares e elípticas, com diferentes excentricidade apresentam diferentes conteúdos de energia, CHAMADAS DE CAMADAS. De Broglie (1923): Desenvolveu uma equação na qual demonstrava que qualquer corpo em movimento está associado à fenômenos ondulatórios. Os ELÉTRONS apresentam a natureza de uma PARTÍCULA-ONDA. Werner Heisenberg (1927): Anunciou o Princípio da Incerteza. “ É impossível determinar simultaneamente a posição exata e a velocidade de uma partícula onda num dado instante”

Erwin Schrödinger (1926): Propôs a teoria chamada de Mecânica Ondulatória. ESTABELECEU O CONCEITO DE ORBITAL. Ψv = [2/L]1/2. sen [n πk/L] n = NÚMERO QU NTICO n = 1, 2, 3. . . ORBITAL É O ESPAÇO AO REDOR DO NÚCLEO EM QUE É MUITO GRANDE A PROPABILIDADE DE SE LOCALIZAR O ELÉTRON. MODELO ATÔMICO ONDULATÓRIO
 Importa viver senhor
Importa viver senhor Unidade de ensino superior dom bosco
Unidade de ensino superior dom bosco Competição
Competição Tkm 50
Tkm 50 Canto no presépio pequenino
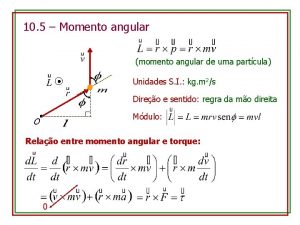
Canto no presépio pequenino Momento angular
Momento angular Unidade caloria
Unidade caloria Unidade central de processamento
Unidade central de processamento Constante de boltzmann unidade
Constante de boltzmann unidade Unidade pastoral nova oeiras
Unidade pastoral nova oeiras Mol
Mol Unidade de ensino superior dom bosco
Unidade de ensino superior dom bosco Newton unidade
Newton unidade Unidade de medida
Unidade de medida Unidade estilística
Unidade estilística Unidades de pressão
Unidades de pressão