QUMICA GERAL UNIDADE 10 FUNES INORG NICAS Prof




























![Química Geral p. H = - log [H+] p. OH = - log [OH-] Química Geral p. H = - log [H+] p. OH = - log [OH-]](https://slidetodoc.com/presentation_image_h/8ce85588ab9ec726e6971e92de123ef4/image-44.jpg)

![Química Geral p. H = - log [H+] Ka = [CH 3 COO-]1. [H Química Geral p. H = - log [H+] Ka = [CH 3 COO-]1. [H](https://slidetodoc.com/presentation_image_h/8ce85588ab9ec726e6971e92de123ef4/image-46.jpg)

![Química Geral p. OH = - log [OH-] = ? Kb = [NH 4+]1. Química Geral p. OH = - log [OH-] = ? Kb = [NH 4+]1.](https://slidetodoc.com/presentation_image_h/8ce85588ab9ec726e6971e92de123ef4/image-48.jpg)
- Slides: 50

QUÍMICA GERAL UNIDADE 10 – FUNÇÕES INORG NICAS Prof. Cristian Berto da Silveira

Química Geral UNIDADE 10 - FUNÇÕES INORG NICAS As função química corresponde a um conjunto de substâncias que apresentam propriedades químicas semelhantes. As substâncias inorgânicas podem ser classificadas em quatro funções: * Os Ácidos; * As Bases; * Os Sais; * Os Óxidos; ÁCIDOS e BASES Definições de Ácidos e Bases: Ácido: Substâncias que apresentam sabor azedo; 1. Boyle (1640): Base: Substâncias que apresentam sabor amargo;

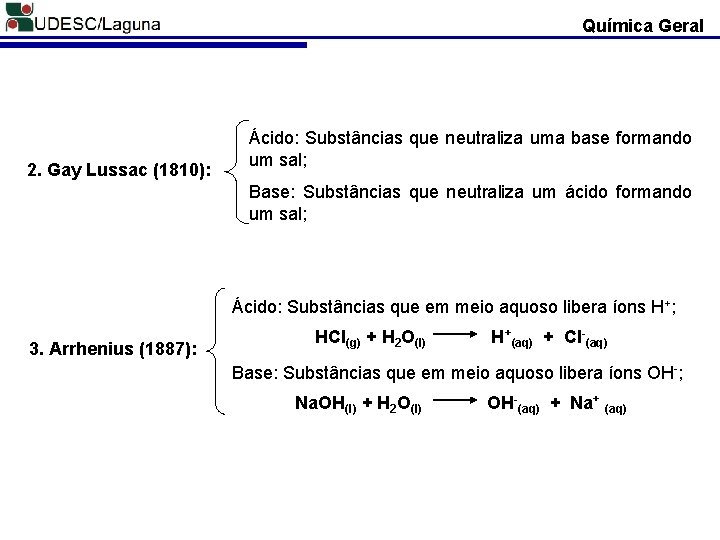
Química Geral 2. Gay Lussac (1810): Ácido: Substâncias que neutraliza uma base formando um sal; Base: Substâncias que neutraliza um ácido formando um sal; Ácido: Substâncias que em meio aquoso libera íons H+; 3. Arrhenius (1887): HCl(g) + H 2 O(l) H+(aq) + Cl-(aq) Base: Substâncias que em meio aquoso libera íons OH-; Na. OH(l) + H 2 O(l) OH-(aq) + Na+ (aq)

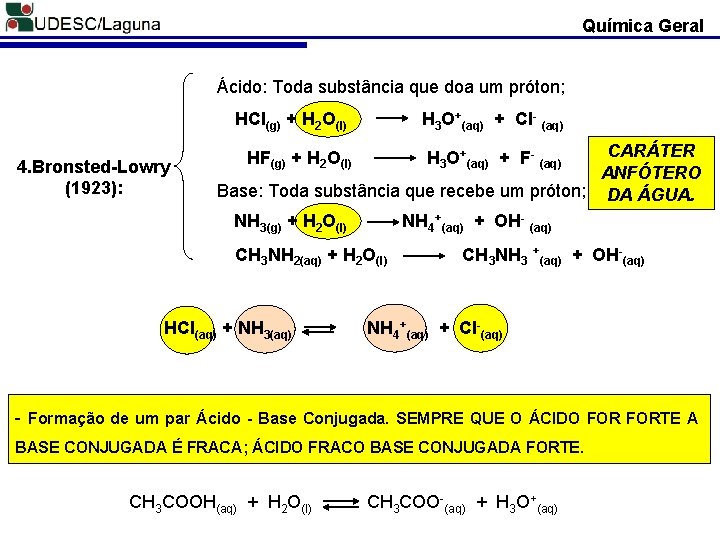
Química Geral Ácido: Toda substância que doa um próton; HCl(g) + H 2 O(l) 4. Bronsted-Lowry (1923): H 3 O+(aq) + Cl- (aq) CARÁTER ANFÓTERO Base: Toda substância que recebe um próton; DA ÁGUA. NH 3(g) + H 2 O(l) NH 4+(aq) + OH- (aq) HF(g) + H 2 O(l) H 3 O+(aq) + F- (aq) CH 3 NH 2(aq) + H 2 O(l) HCl(aq) + NH 3(aq) CH 3 NH 3 +(aq) + OH-(aq) NH 4+(aq) + Cl-(aq) - Formação de um par Ácido - Base Conjugada. SEMPRE QUE O ÁCIDO FORTE A BASE CONJUGADA É FRACA; ÁCIDO FRACO BASE CONJUGADA FORTE. CH 3 COOH(aq) + H 2 O(l) CH 3 COO-(aq) + H 3 O+(aq)

Química Geral - Formação de um par Base – Ácido Conjugada. SEMPRE QUE A BASE FORTE O ÁCIDO CONJUGADO É FRACO; BASE FRACA ÁCIDO CONJUGADO FORTE. NH 3(g) + H 2 O(l) NH 4+ (aq) + OH-(aq) - Exercício. Identifique o ácido de Brosted e sua base conjugada nas reações abaixo: a) HSO 4 - (aq) + OH-(aq) b) PO 43 -(aq) + H 2 O(l) + SO 42 -(aq); HPO 42 -(aq) + OH-(aq);

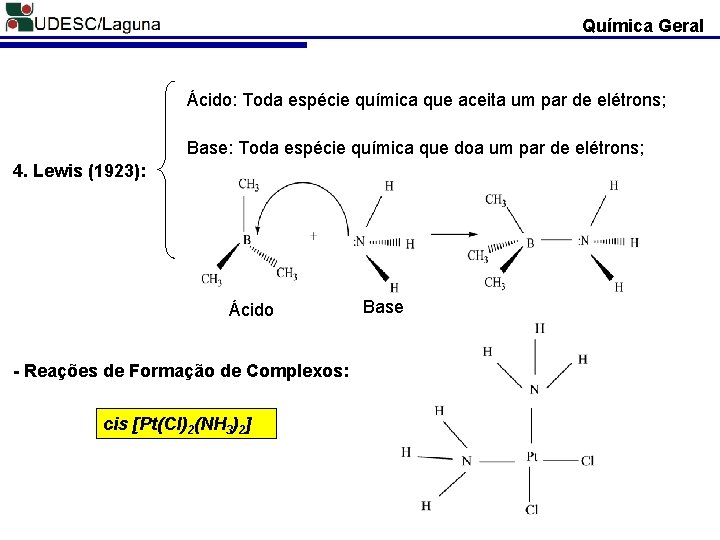
Química Geral Ácido: Toda espécie química que aceita um par de elétrons; Base: Toda espécie química que doa um par de elétrons; 4. Lewis (1923): Ácido - Reações de Formação de Complexos: cis [Pt(Cl)2(NH 3)2] Base

Química Geral Hidrogênios Ionizáveis: são os que são liberados e que se ligam ao elemento mais eletronegativo na molécula do ácido. H 3 PO 2(aq) + H 2 O(l) H 3 O+(aq) + H 2 PO 21 -(aq) H 3 PO 2(aq) + 2 H 2 O(l) 2 H 3 O+(aq) + HPO 22 -(aq) Apresenta apenas 1 H+ Apresenta apenas 2 H+ Classificação dos Ácidos 1. Quanto a presença ou ausência de carboxila (-COOH): Orgânicos: CH 3 -COOH, HOOC-COOH Inorgânicos: H 2 CO 3, H 2 CO 2, HCN

Química Geral 2. Quanto a presença ou ausência de oxigênio: Hidrácidos: HCl, H 2 S, HBr Oxiácidos: H 2 SO 4, H 3 PO 4, HCl. O 4 3. Quanto ao número de elementos químicos: Binário: HCl, HBr, HF Ternário: H 2 SO 4, H 3 PO 4, HCN Quaternário: H 4[Fe(CN)6] 4. Quanto ao número de hidrogênios ionizáveis: Monoácidos: HCl, HI, H 3 PO 2 Diácidos: H 2 SO 4, H 2 S, H 3 PO 3 Triácidos: H 3 PO 4, H 3 BO 3, H 3 BO 2 Tetrácidos: H 4 P 2 O 7

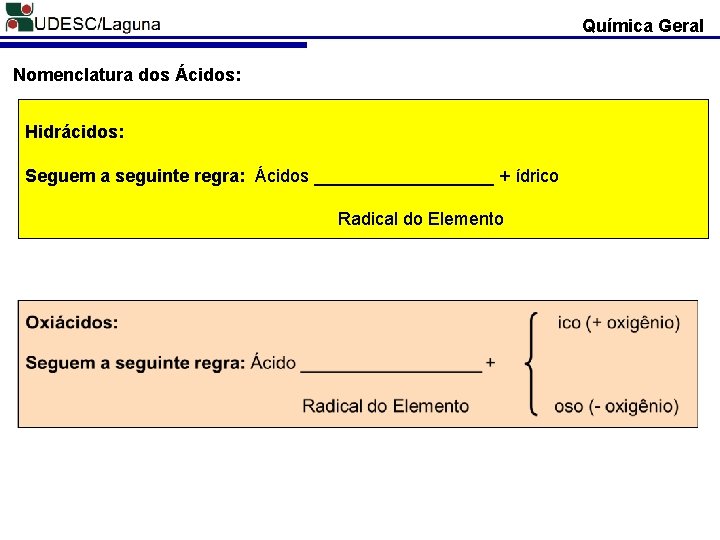
Química Geral Nomenclatura dos Ácidos: Hidrácidos: Seguem a seguinte regra: Ácidos _________ + ídrico Radical do Elemento

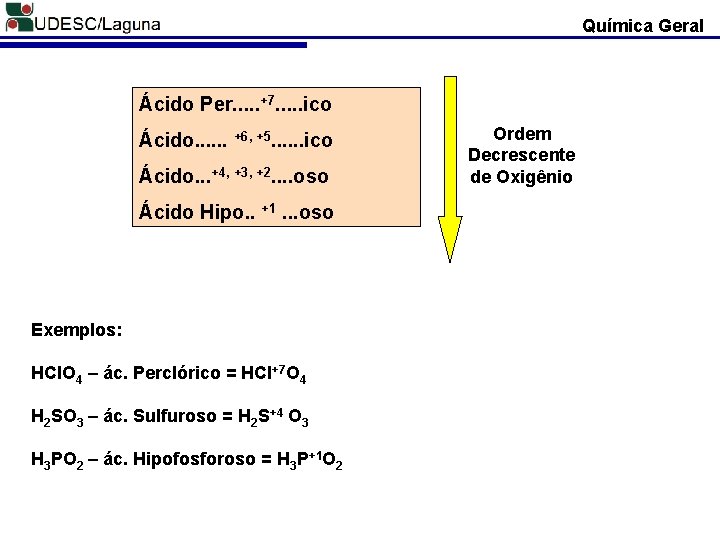
Química Geral Ácido Per. . . +7. . . ico Ácido. . . +6, +5. . . ico Ácido. . . +4, +3, +2. . oso Ácido Hipo. . +1. . . oso Exemplos: HCl. O 4 – ác. Perclórico = HCl+7 O 4 H 2 SO 3 – ác. Sulfuroso = H 2 S+4 O 3 H 3 PO 2 – ác. Hipofosforoso = H 3 P+1 O 2 Ordem Decrescente de Oxigênio

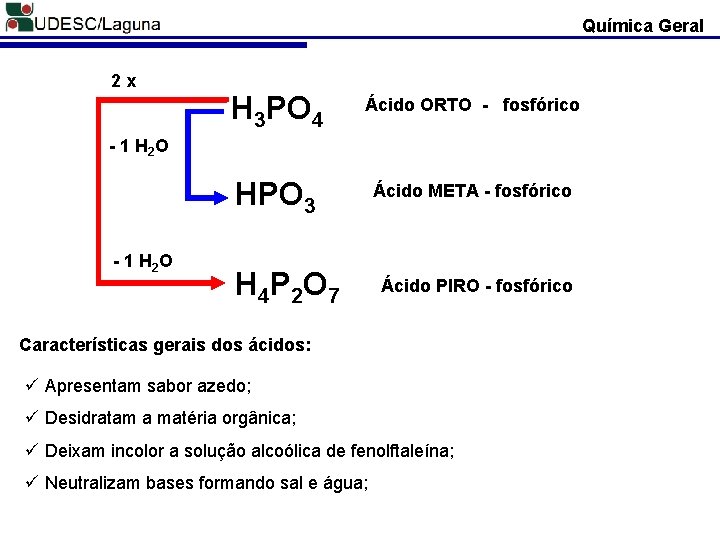
Química Geral Exemplos: H 2 S-2 - Ácido Sulfídrico H 2 S+4 O 3 - Ácido Sulfuroso Para ácidos do enxofre usamos o radical em latim “sulfur”. H 2 S+6 O 4 - Ácido sulfúrico Classificaçâo dos Ácidos quanto aos prefixos: * O prefixo ORTO é usado para o Ácido Fundamental; * O prefixo META é usado quando do Ácido ORTO retira-se 1 H 2 O; * O prefixo PIRO é usado para indicar a retirada de 1 H 2 O de duas moléculas do ORTO.

Química Geral 2 x H 3 PO 4 Ácido ORTO - fosfórico HPO 3 Ácido META - fosfórico - 1 H 2 O H 4 P 2 O 7 Ácido PIRO - fosfórico Características gerais dos ácidos: ü Apresentam sabor azedo; ü Desidratam a matéria orgânica; ü Deixam incolor a solução alcoólica de fenolftaleína; ü Neutralizam bases formando sal e água;

Química Geral Ácidos importantes: 1. Ácido Sulfúrico - H 2 SO 4 É um líquido incolor e oleoso de densidade 1, 85 g/cm 3, é um ácido forte que reage com metais originando sulfatos além de ser muito higroscópico. É aplicado em baterias de veículos. Pode ser obtido a partir das seguintes reações: S + O 2 SO 2 + ½O 2 SO 3 + H 2 O H 2 SO 4 É usado para medir o desenvolvimento industrial de um país.

Química Geral 2. Ácido Clorídrico - HCl Solução de hidreto de cloro em água. Apresenta forte odor, além de ser sufocante. É utilizado na limpeza de peças metálicas e de superfícies de mármore. É encontrado no suco gástrico humano. É conhecido como ácido muriático. A limpeza de superfícies com ácido clorídrico é chamada de decapagem. 3. Ácido Nítrico - HNO 3 Líquido incolor fumegante ao ar que ataca violentamente os tecidos animais e vegetais, produzindo manchas amareladas na pele. É muito usado em química orgânica para a produção de nitro-compostos. CH 3 + 3 HNO 3 -NO 2 + 3 H 2 O

Química Geral 4. Ácido Fosfórico - H 3 PO 4 É um líquido xaporoso obtido pela oxidação do fósforo vermelho com ácido nítrico concentrado. É um ácido moderado usado na indústria de vidros, preparo de águas minerais e nos refrigerantes de “cola”. Seus fosfatos são usados como adubo. Seus fosfatos fazem parte da formulação do fertilizante “NPK”.

Química Geral Classificação das Bases Geralmente as bases apresentam: - OH- do lado direito da fórmula; - Metais na composição; - Ligações iônicas; - São sólidas a temperatura ambiente; Na. OH Na+ + OH- Ca(OH)2 Al(OH)3 Ca 2+ + 2 OHAl 3+ + 3 OH- Exceção: NH 3 + H 2 O - Ametais; - Lig. covalentes; - Solução aquosa; - Volátil. NH 4 OH

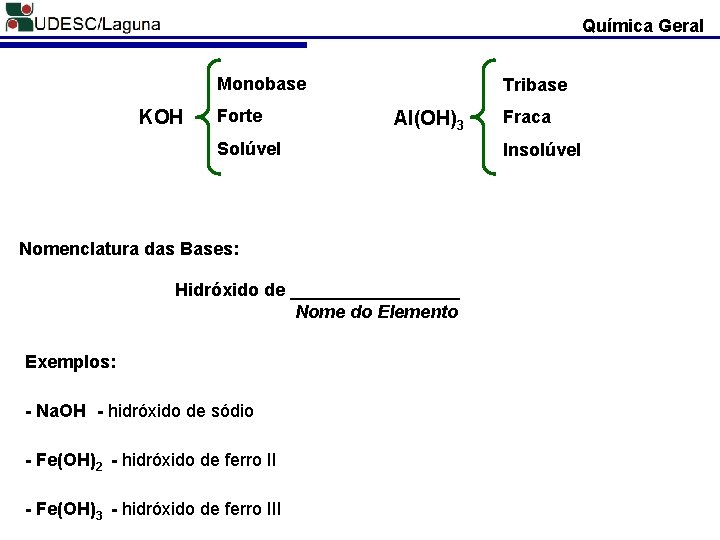
Química Geral 1. Quanto ao Número de Hidroxilas: - Monobases: Na. OH; NH 4 OH - Dibases: Ca(OH)2; Mg(OH)2 - Tribases: Al(OH)3; Fe(OH)3 - Tetrabases: Pb(OH)4; Sn(OH)4 2. Quanto ao Grau de Dissociação Iônica: - Fortes: Os hidróxidos de metais alcalinos (G 1) e metais alcalinos terrosos (G 2); - Fracas: Nesse grupo incluem-se o hidróxido de amônio (NH 4 OH) e as demais bases; 3. Quanto à Solubilidade em Água - Totalmente solúveis: os hidróxidos metais alcalinos (G 1) e o hidróxido de amônio (NH 4 OH). - Parcialmente solúveis: hidróxidos metais alcalino-terrosos (G 2). - Insolúveis: todos os demais hidróxidos.

Química Geral Monobase KOH Forte Tribase Al(OH)3 Solúvel Nomenclatura das Bases: Hidróxido de _________ Nome do Elemento Exemplos: - Na. OH - hidróxido de sódio - Fe(OH)2 - hidróxido de ferro II - Fe(OH)3 - hidróxido de ferro III Fraca Insolúvel

Química Geral Características gerais das bases: ü Apresentam sabor caústico; ü Neutralizam ácidos formando sal e água; Bases importantes: 1. Hidróxido de Sódio - Na. OH É um sólido branco floculado muito solúvel em água além de extremamente caústico. É usado na desidratação de gorduras, no branqueamento de fibras (celulose) e na fabricação de sabões e detergentes e como desentupidor de ralos e esgotos. Sabões e detergentes são chamados de agentes tensoativos e possuem caráter básico.

Química Geral 2. Hidróxido de Cálcio - Hidróxido de cálcio É uma suspensão aquosa de aparência leitosa, obtida a partir do Ca. O (cal virgem). É usada na caiação de paredes e muros, na neutralização de solos ácidos e na fabricação de doces. Ca. O + H 2 O Cal Virgem Ca(OH)2 Cal Apagada 3. Hidróxido de Magnésio - Mg(OH)2 É uma suspensão leitosa, obtida a partir do Mg. O. É usada como antiácido estomacal e também como laxante. Conhecido como leito de magnésio. Mg(OH)2 + 2 HCl Mg. Cl 2 + 2 H 2 O

Química Geral 4. Hidróxido de Alumínio - Al(OH)3 É uma suspensão gelatinosa que pode adsorver moléculas orgânicas que por ventura estejam em solução aquosa (no tratamento da água). É usada como antiácido estomacal, para tingimentos e na preparação de placas (resina ou verniz) para pintura artística.

Química Geral - FORÇA DOS ÁCIDOS E BASES: - HCl, HF, HNO 3, CH 3 COOH, HCl. O 4 Grau de Ionização (α) – Capacidade que o ácido, ou a base, apresenta de se dissociar em água. Quanto maior esta capacidade mais forte é considerado o ácido ou a base. α = número de moléculas ionizadas número de moléculas adicionadas Ácidos fracos: 0< a < 5% Ácidos moderados: 5% £ a £ 50% Ácidos fortes : 50% < a < 100%

Química Geral Constante de Equilíbrio (Kc) – É a maneira mais adequada para definir a força de um ácido ou de uma base. a. A + b. B c. C + d. D Kc = [C]c. [D]d [A]a. [B]b Quanto maior o valor de Kc mais deslocado para direita o equilíbrio; Quanto menor o valor de Kc mais deslocado para esquerda o equilíbrio; Hidrácidos: Fortes: HCl, HBr, HI Moderado: HF Os demais são fracos

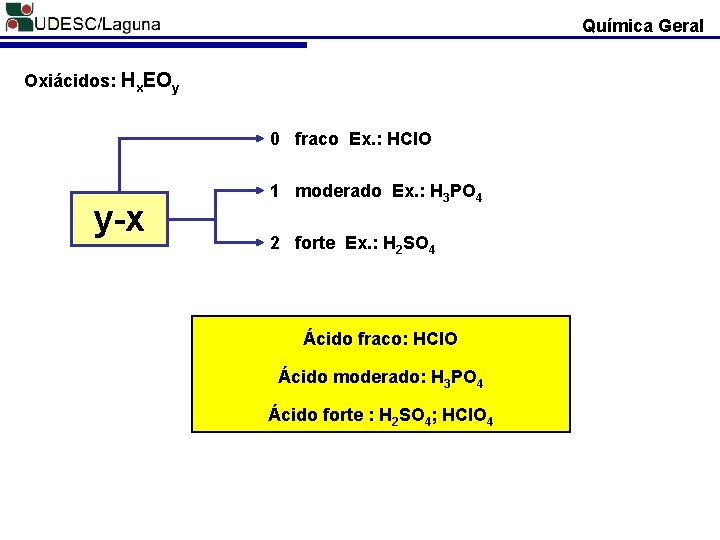
Química Geral Oxiácidos: Hx. EOy 0 fraco Ex. : HCl. O y-x 1 moderado Ex. : H 3 PO 4 2 forte Ex. : H 2 SO 4 Ácido fraco: HCl. O Ácido moderado: H 3 PO 4 Ácido forte : H 2 SO 4; HCl. O 4

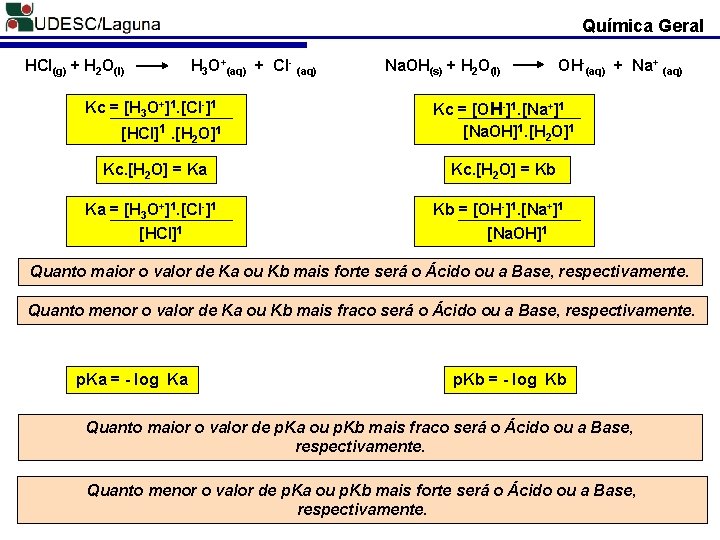
Química Geral HCl(g) + H 2 O(l) H 3 O+(aq) + Cl- (aq) Kc = [H 3 O+]1. [Cl-]1 [HCl]1. [H 2 O]1 Kc. [H 2 O] = Ka Ka = [H 3 O+]1. [Cl-]1 [HCl]1 Na. OH(s) + H 2 O(l) OH-(aq) + Na+ (aq) Kc = [OH-]1. [Na+]1 [Na. OH]1. [H 2 O]1 Kc. [H 2 O] = Kb Kb = [OH-]1. [Na+]1 [Na. OH]1 Quanto maior o valor de Ka ou Kb mais forte será o Ácido ou a Base, respectivamente. Quanto menor o valor de Ka ou Kb mais fraco será o Ácido ou a Base, respectivamente. p. Ka = - log Ka p. Kb = - log Kb Quanto maior o valor de p. Ka ou p. Kb mais fraco será o Ácido ou a Base, respectivamente. Quanto menor o valor de p. Ka ou p. Kb mais forte será o Ácido ou a Base, respectivamente.

Química Geral Auto ionização da água: a água pura é uma substância neutra, porém sofre ionização formando íons H+ e íons OH-. H 2 O H+ + OH- Kc = [H+]1. [OH-]1 [H 2 O]1 A 25 o. C a constante de equilíbrio da água (Kc) é 1, 8. 10 -16. Kc. [H 2 O] = Kw Kw = [H+]. [OH-] 1 L de água a 25 o. C apresenta M = 55, 6 mol. L-1. Kw = 1, 8. 10 -16. 55, 6 [H+] = 10 -7 Kw = 1, 01. 10 -14 [OH-] = 10 -7 [H+]. [OH-] = 10 -14 mol. L-1 SUBST NCIA NEUTRA [H+] = [OH-]; SUBST NCIA ÁCIDA [H+] > [OH-]; SUBSTANCIA BÁSICA [H+] < [OH-];

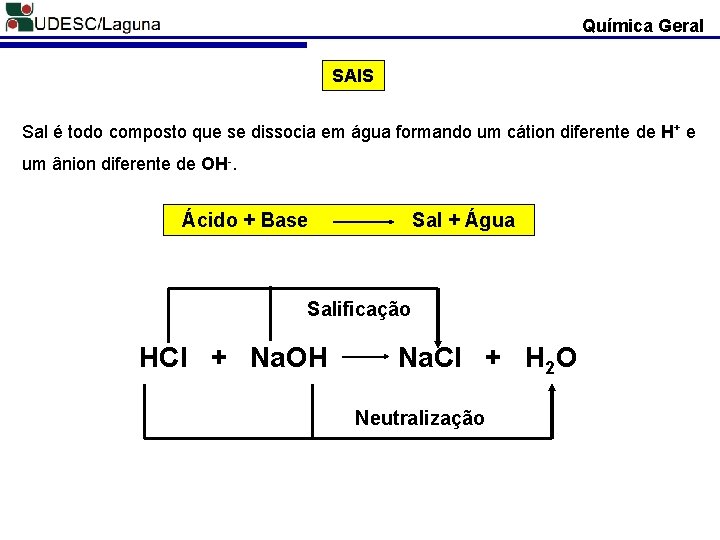
Química Geral SAIS Sal é todo composto que se dissocia em água formando um cátion diferente de H+ e um ânion diferente de OH-. Ácido + Base Sal + Água Salificação HCl + Na. OH Na. Cl + H 2 O Neutralização

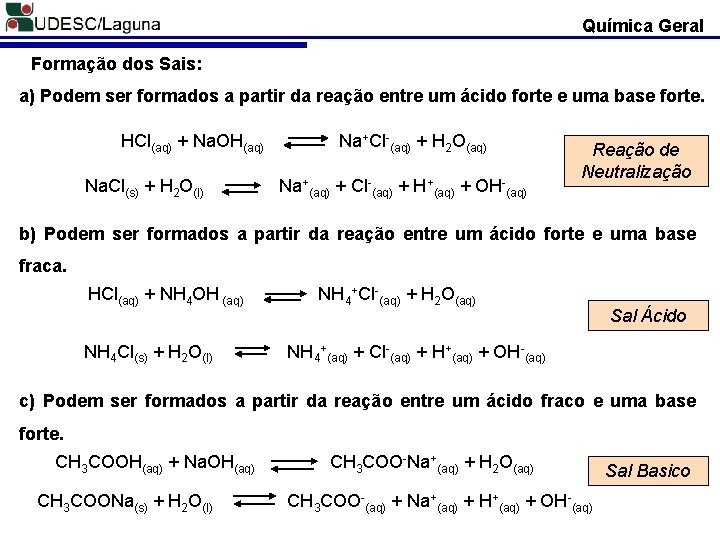
Química Geral Formação dos Sais: a) Podem ser formados a partir da reação entre um ácido forte e uma base forte. HCl(aq) + Na. OH(aq) Na. Cl(s) + H 2 O(l) Na+Cl-(aq) + H 2 O(aq) Na+(aq) + Cl-(aq) + H+(aq) + OH-(aq) Reação de Neutralização b) Podem ser formados a partir da reação entre um ácido forte e uma base fraca. HCl(aq) + NH 4 OH (aq) NH 4 Cl(s) + H 2 O(l) NH 4+Cl-(aq) + H 2 O(aq) Sal Ácido NH 4+(aq) + Cl-(aq) + H+(aq) + OH-(aq) c) Podem ser formados a partir da reação entre um ácido fraco e uma base forte. CH 3 COOH(aq) + Na. OH(aq) CH 3 COONa(s) + H 2 O(l) CH 3 COO-Na+(aq) + H 2 O(aq) CH 3 COO-(aq) + Na+(aq) + H+(aq) + OH-(aq) Sal Basico

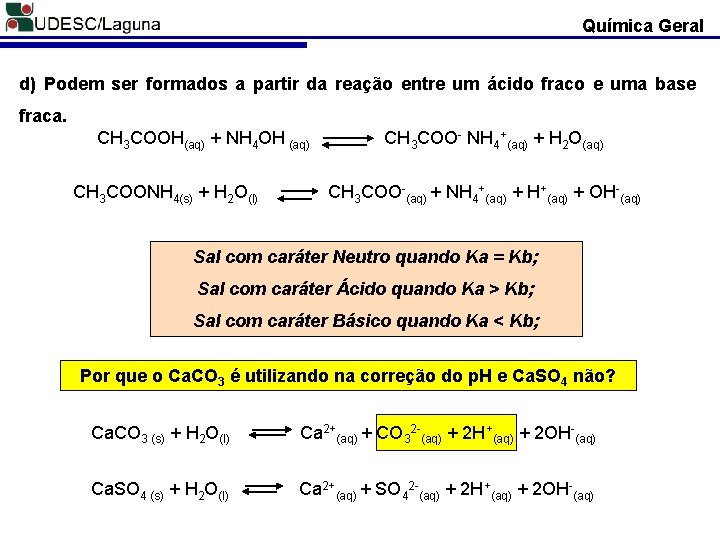
Química Geral d) Podem ser formados a partir da reação entre um ácido fraco e uma base fraca. CH 3 COOH(aq) + NH 4 OH (aq) CH 3 COONH 4(s) + H 2 O(l) CH 3 COO- NH 4+(aq) + H 2 O(aq) CH 3 COO-(aq) + NH 4+(aq) + H+(aq) + OH-(aq) Sal com caráter Neutro quando Ka = Kb; Sal com caráter Ácido quando Ka > Kb; Sal com caráter Básico quando Ka < Kb; Por que o Ca. CO 3 é utilizando na correção do p. H e Ca. SO 4 não? Ca. CO 3 (s) + H 2 O(l) Ca 2+(aq) + CO 32 -(aq) + 2 H+(aq) + 2 OH-(aq) Ca. SO 4 (s) + H 2 O(l) Ca 2+(aq) + SO 42 -(aq) + 2 H+(aq) + 2 OH-(aq)

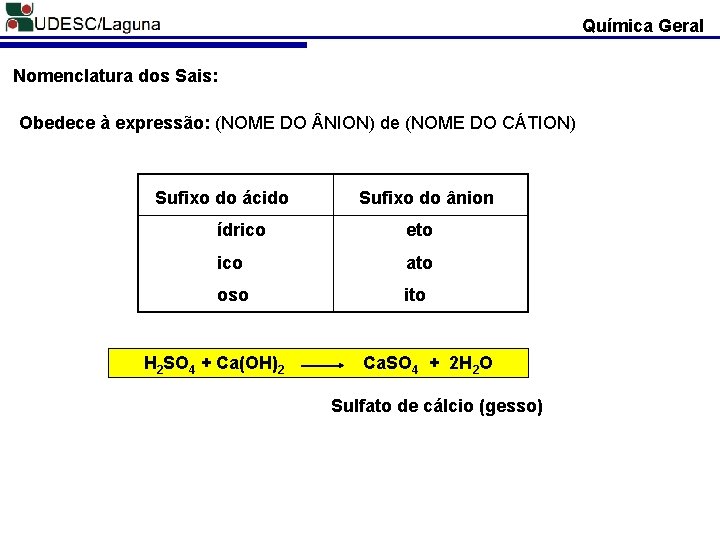
Química Geral Nomenclatura dos Sais: Obedece à expressão: (NOME DO NION) de (NOME DO CÁTION) Sufixo do ácido Sufixo do ânion ídrico eto ico ato oso ito H 2 SO 4 + Ca(OH)2 Ca. SO 4 + 2 H 2 O Sulfato de cálcio (gesso)

Química Geral Classificação dos Sais: 1. Quanto à Presença de Oxigênio: - Oxissais: Ca. SO 4 , Ca. CO 3 , KNO 3 - Halóides: Na. Cl , Ca. Cl 2 , KCl 2. Quanto ao Número de Elementos: - Binários: Na. Cl , KBr , Ca. Cl 2 - Ternários: Ca. SO 4 , Al 2(SO 4)3 - Quaternários: Na. CNO , Na 4 Fe(CN)6 3. Quanto à Presença de Água: - Hidratados: Cu. SO 4. 5 H 2 O; Ca. SO 4. 2 H 2 O - Anidro: KCl; Na. Cl; Ca. SO 4

Química Geral 4. Quanto à Natureza: - Neutros ou normais: Na. Br; Ca. CO 3 - Ácidos ou Hidrogenossais: Na. HCO 3; Ca. HPO 4 - Básicos ou Hidroxissais: Ca(OH)Br - Duplos ou mistos: Na. KSO 4: Ca. Cl. Br Sais importantes: 1. Bicarbonato de Sódio - Na. HCO 3 É um pó branco que perde CO 2 com facilidade (efervescência). É usado como antiácido estomacal, fermento químico e nos extintores de incêndio.

Química Geral 2. Carbonato de Cálcio - Ca. CO 3 É um sólido branco que por aquecimento perde CO 2 e produz Ca. O (calcinação). É usado na fabricação de cimentos, como corretivo do solo e como fundente em metalurgia. 3. Nitrato de Sódio - Na. NO 3 É um sólido cristalizado no sistema cúbico, além de ser um ótimo oxidante para reações químicas. É usado na fabricação de fertilizantes e explosivos. Nos Andes era utilizado na conservação da carne por ser higroscópico. 4. Cloreto de Amônio - NH 4 Cl É um sólido granulado obtido do líquido amoniacal das fábricas de gás. É usado na fabricas de soldagem, na galvanização do ferro e na fabricação de tecidos. Por ser higroscópico é utilizado na fabricação de bolachas.

Química Geral ÓXIDOS Óxido é todo composto binário oxigenado, no qual o oxigênio é o elemento mais eletronegativo. Fórmula geral dos óxidos: Ex+2 O 2 -X Exemplos: CO 2, H 2 O, Mn 2 O 7, Fe 2 O 3 Nomenclatura dos Óxidos: Regra geral: (Prefixo) + óxido de (prefixo) + elemento CO - monóxido de monocarbono N 2 O 5 - pentóxido de dinitrogênio P 2 O 3 - trióxido de difosforo H 2 O - monóxido de dihidrogênio

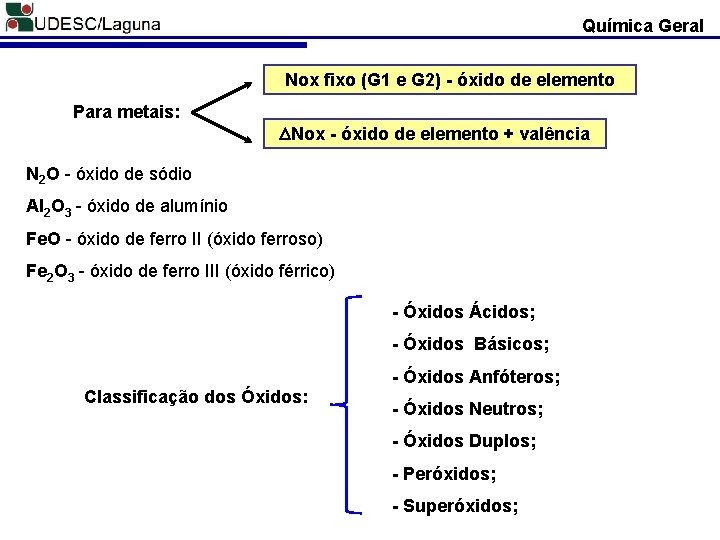
Química Geral Nox fixo (G 1 e G 2) - óxido de elemento Para metais: Nox - óxido de elemento + valência N 2 O - óxido de sódio Al 2 O 3 - óxido de alumínio Fe. O - óxido de ferro II (óxido ferroso) Fe 2 O 3 - óxido de ferro III (óxido férrico) - Óxidos Ácidos; - Óxidos Básicos; - Óxidos Anfóteros; Classificação dos Óxidos: - Óxidos Neutros; - Óxidos Duplos; - Peróxidos; - Superóxidos;

Química Geral Óxidos Básicos – Metálicos São formados por metais alcalinos e alcalinos terrosos e reagem com água formando bases e com ácidos formando sal e água. Óxido básico + H 2 O base 2 Na. O + H 2 O 2 Na. OH Ca. O + H 2 O Ca(OH)2 Óxido básico + ácido sal + H 2 O Mg. O + 2 HCl Mg. Cl 2 + H 2 O

Química Geral Óxidos Ácidos – Anidridos São formados por ametais e reagem com água formando ácidos e com bases formando sal e água. Óxido ácido + H 2 O ácido CO 2 + H 2 O H 2 CO 3 N 2 O 5 + H 2 O 2 HNO 3 SO 3 + H 2 O H 2 SO 4 Óxido ácido + base sal + H 2 O CO 2 + Ca(OH)2 Ca. CO 3 + H 2 O

Química Geral Óxidos Anfóteros – Anfipróticos São óxidos de caráter intermediário entre ácido e básico. Reagem com ácidos e bases formando sal e água. Óxido anfótero + ácido/base sal + água Zn. O + 2 HCl Zn. Cl 2 + H 2 O Zn. O + 2 Na. OH Na 2 Zn. O 2 + H 2 O Óxidos Neutros – Indiferentes São todos covalentes e não reagem com base, ácido ou água; mas podem reagir com oxigênio. CO + H 2 O Não ocorre reação NO + HCl Não ocorre reação CO + ½O 2 CO 2

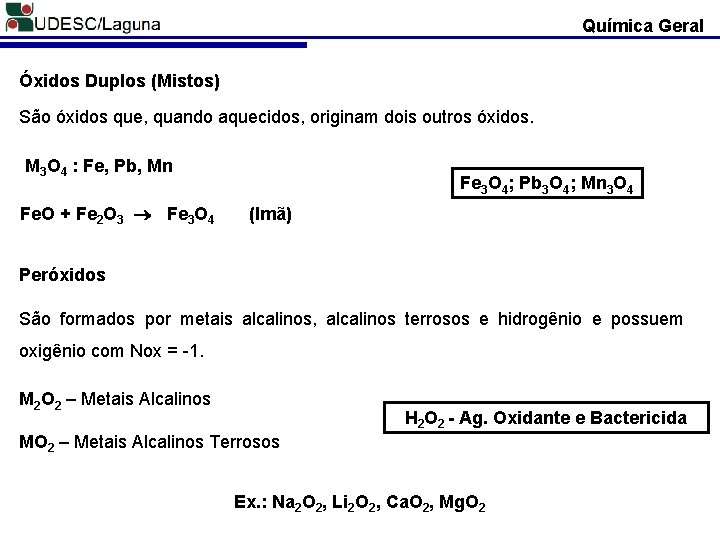
Química Geral Óxidos Duplos (Mistos) São óxidos que, quando aquecidos, originam dois outros óxidos. M 3 O 4 : Fe, Pb, Mn Fe. O + Fe 2 O 3 Fe 3 O 4; Pb 3 O 4; Mn 3 O 4 (Imã) Peróxidos São formados por metais alcalinos, alcalinos terrosos e hidrogênio e possuem oxigênio com Nox = -1. M 2 O 2 – Metais Alcalinos H 2 O 2 - Ag. Oxidante e Bactericida MO 2 – Metais Alcalinos Terrosos Ex. : Na 2 O 2, Li 2 O 2, Ca. O 2, Mg. O 2

Química Geral Superóxidos (polióxidos) São formados por metais alcalinos, alcalinos terrosos e hidrogênio e possuem oxigênio com Nox = - ½. M 2 O 4 – Metais Alcalinos MO 4 – Metais Alcalinos Terrosos Ex. : Na 2 O 4, Li 2 O 4, Ca. O 4, Mg. O 4

Química Geral Óxidos importantes 1. Óxido de Zinco – Zn. O É um sólido branco de caráter anfótero (anfiprótico). É usado na fabricação de cremes dermatológicos, na indústria de tintas e na galvanização do ferro. 2. Óxido de Alumínio – Al 2 O 3 É um sólido muito duro (dureza 9) de onde é extraído, por eletrólise, o alumínio metálico. Na forma cristalizada é encontrado nas safiras e nos rubis.

Química Geral 3. Peróxido de Hidrogênio – H 2 O 2 É uma solução aquosa que se decompõe facilmente em presença de luz (fotólise). É utilizada como agente oxidante e bactericida. H 2 O 2 H 2 O + ½O 2 4. Tetróxido de Triferro – Fe 3 O 4 É um sólido escuro que apresenta características ferromagnéticas. É utilizado na fabricação de caixas de som e aparelhos eletrônicos em geral. Fe. O + Fe 2 O 3 Fe 3 O 4

Química Geral Medidas de p. H para Ácidos e Bases p. H = potencial hidrogeniônico. p. H = - log [H+] Ácidos Fortes = os ácidos fortes em água encontram-se praticamente ionizados. O equilíbrio da reação está deslocado para o sentido de formação do produto. Para um solução de HCl 0, 1 mol. L-1, qual o valor do p. H? HCl(g) + H 2 O(l) H 3 O+(aq) + Cl- (aq) p. H = - log 0, 1 p. H = 1 Bases Fortes = as bases fortes em água encontram-se praticamente dissociadas. O equilíbrio da reação está deslocado para o sentido de formação do produto. Para um solução de Na. OH 0, 0001 mol. L-1, qual o valor do p. H? Na. OH(s) + H 2 O(l) OH-(aq) + Na+ (aq)
![Química Geral p H log H p OH log OH Química Geral p. H = - log [H+] p. OH = - log [OH-]](https://slidetodoc.com/presentation_image_h/8ce85588ab9ec726e6971e92de123ef4/image-44.jpg)
Química Geral p. H = - log [H+] p. OH = - log [OH-] p. OH = - log [0, 0001] p. OH = 4 p. H + p. OH = 14 p. H = 10

Química Geral Ácidos Fracos = os ácidos fraco em água encontram-se pouco ionizados. O equilíbrio da reação está deslocado para o sentido de formação do reagente. Exercício. O ácido acético (CH 3 COOH ) é um ácido forte ou fraco. Para um solução de CH 3 COOH 0, 1 mol. L-1 qual o valor do p. H? Dados: Ka = 1. 8 x 10 -5 CH 3 COOH(aq) + H 2 O(l) Ka = [H 3 O+] = CH 3 COO-(aq) + H 3 O+(aq) [CH 3 COO-]1. [H 3 O+]1 [CH 3 COOH]1 Ka. [CH 3 COOH] [H 3 O+] = [CH 3 COO-] = [H 3 O+] 1. 8 x 10 -5 x 0, 1 α = número de moléculas ionizadas x 100 número de moléculas adicionadas α = 1. 3 % [H 3 O+] = 1. 3 x 10 -3 α = 1. 3 x 10 -3 x 100 0, 1
![Química Geral p H log H Ka CH 3 COO1 H Química Geral p. H = - log [H+] Ka = [CH 3 COO-]1. [H](https://slidetodoc.com/presentation_image_h/8ce85588ab9ec726e6971e92de123ef4/image-46.jpg)
Química Geral p. H = - log [H+] Ka = [CH 3 COO-]1. [H 3 O+]1 [CH 3 COOH]1 [CH 3 COO-] = [H 3 O+] = [H+] = ? [H 3 O+] = 1. 8 x 10 -5 x 0, 1 Ka. [CH 3 COOH] [H 3 O+] = 1. 3 x 10 -3 p. H = - log 1. 34 x 10 -3 p. H = 2, 87 p. H = - log Ka. [ácido]

Química Geral Bases Fracas = as bases fraca em água encontram-se pouco dissociadas. O equilíbrio da reação está deslocado para o sentido de formação do reagente. Exercício. Para um solução de NH 4 OH 0, 0001 mol. L-1 qual o valor do p. H? Dados: Kb = 1. 8 x 10 -5 NH 3(g) + H 2 O(l) NH 4+ (aq) + OH-(aq) Kb = [NH 4+]1. [OH-]1 [NH 3]1 [OH-] = Kb. [NH 3] [NH 4+] = [OH-] = 1. 8 x 10 -5 x 0, 0001 α = número de moléculas ionizadas x 100 número de moléculas adicionadas α = 42. 4 % [OH-] = 4, 24 x 10 -5 mol. L-1 α = 4. 24 x 10 -5 x 100 0, 0001
![Química Geral p OH log OH Kb NH 41 Química Geral p. OH = - log [OH-] = ? Kb = [NH 4+]1.](https://slidetodoc.com/presentation_image_h/8ce85588ab9ec726e6971e92de123ef4/image-48.jpg)
Química Geral p. OH = - log [OH-] = ? Kb = [NH 4+]1. [OH-]1 [NH 3]1 [NH 4+] = [OH-] = Kb. [NH 3] [OH-] = 1. 8 x 10 -5 x 0, 0001 [OH-] = 4, 24 x 10 -5 mol. L-1 p. OH = - log 4, 24 x 10 -5 p. OH = 4, 37 p. H = 14 + log p. H = 9, 63 Kb. [base] UM ÁCIDO FRACO PODE SER MAIS ÁCIDO DO QUE UM ÁCIDO FORTE?

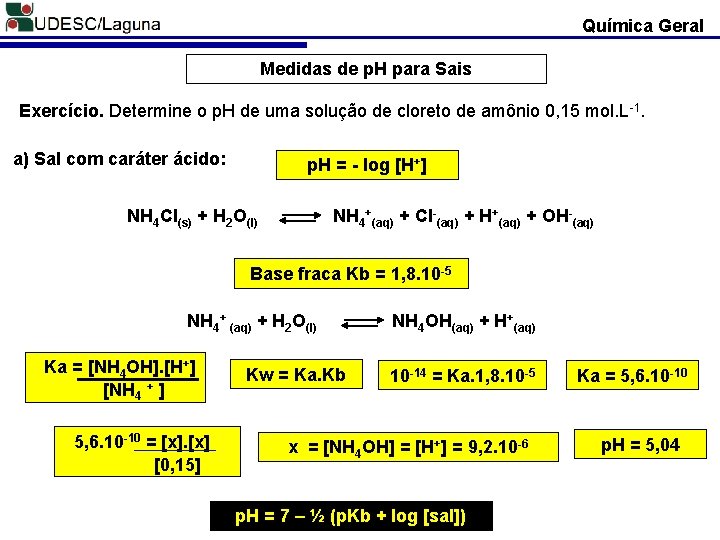
Química Geral Medidas de p. H para Sais Exercício. Determine o p. H de uma solução de cloreto de amônio 0, 15 mol. L-1. a) Sal com caráter ácido: p. H = - log [H+] NH 4 Cl(s) + H 2 O(l) NH 4+(aq) + Cl-(aq) + H+(aq) + OH-(aq) Base fraca Kb = 1, 8. 10 -5 NH 4+ (aq) + H 2 O(l) Ka = [NH 4 OH]. [H+] [NH 4 + ] 5, 6. 10 -10 = [x] [0, 15] Kw = Ka. Kb NH 4 OH(aq) + H+(aq) 10 -14 = Ka. 1, 8. 10 -5 x = [NH 4 OH] = [H+] = 9, 2. 10 -6 p. H = 7 – ½ (p. Kb + log [sal]) Ka = 5, 6. 10 -10 p. H = 5, 04

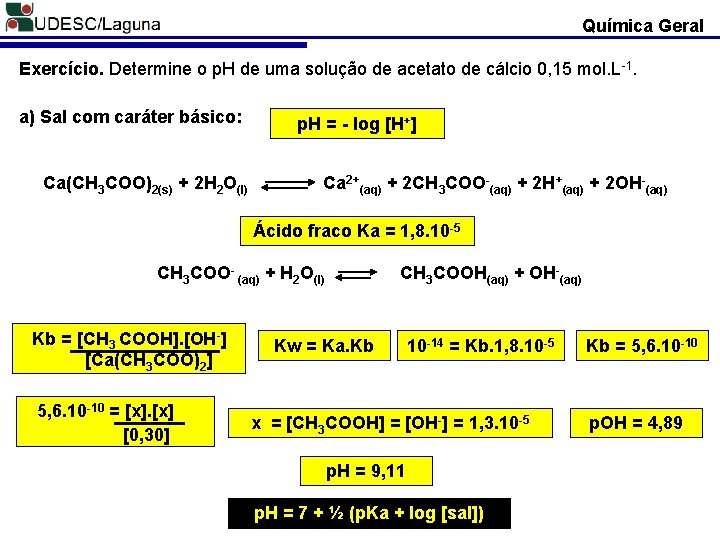
Química Geral Exercício. Determine o p. H de uma solução de acetato de cálcio 0, 15 mol. L-1. a) Sal com caráter básico: Ca(CH 3 COO)2(s) + 2 H 2 O(l) p. H = - log [H+] Ca 2+(aq) + 2 CH 3 COO-(aq) + 2 H+(aq) + 2 OH-(aq) Ácido fraco Ka = 1, 8. 10 -5 CH 3 COO- (aq) + H 2 O(l) Kb = [CH 3 COOH]. [OH-] [Ca(CH 3 COO)2] 5, 6. 10 -10 = [x] [0, 30] CH 3 COOH(aq) + OH-(aq) Kw = Ka. Kb 10 -14 = Kb. 1, 8. 10 -5 x = [CH 3 COOH] = [OH-] = 1, 3. 10 -5 p. H = 9, 11 p. H = 7 + ½ (p. Ka + log [sal]) Kb = 5, 6. 10 -10 p. OH = 4, 89
 Linguagem c
Linguagem c Main funes
Main funes Carta informal
Carta informal Ponteiro
Ponteiro Main funes
Main funes Nicas level 3 assessment criteria
Nicas level 3 assessment criteria Buen alumno
Buen alumno Unidade caloria
Unidade caloria Primeira unidade de conservação do brasil
Primeira unidade de conservação do brasil Igreja nova oeiras
Igreja nova oeiras Momento angular unidade
Momento angular unidade é prova de amor junto a mesa partilhar
é prova de amor junto a mesa partilhar Constante de boltzmann unidade
Constante de boltzmann unidade Newton unidade
Newton unidade No presépio pequenino
No presépio pequenino Semntica
Semntica Unidade de ensino superior dom bosco
Unidade de ensino superior dom bosco Unidade central de processamento
Unidade central de processamento Unidade de medida
Unidade de medida Referencial inercial
Referencial inercial Massa atomica e massa molecular
Massa atomica e massa molecular Unidades funcionais dos seres vivos
Unidades funcionais dos seres vivos Simbolo unidade de medida
Simbolo unidade de medida Unidade de ensino superior dom bosco
Unidade de ensino superior dom bosco Fluido
Fluido Tkm 50
Tkm 50 Converso de medida
Converso de medida Competição
Competição Marcelo speziali
Marcelo speziali Modelo gerbner
Modelo gerbner Formula pg
Formula pg Objetivo geral e especifico
Objetivo geral e especifico Objetivo geral
Objetivo geral 6
6 Taxa de mortalidade geral formula
Taxa de mortalidade geral formula Termo geral do binomio
Termo geral do binomio Arquentro
Arquentro Ginástica geral características
Ginástica geral características Objetivo geral folclore
Objetivo geral folclore Historia geral e do brasil jose alves de freitas neto
Historia geral e do brasil jose alves de freitas neto Resistência orgânica geral
Resistência orgânica geral Relatividade geral
Relatividade geral Ligações quimicas
Ligações quimicas Ginastica 4 ano
Ginastica 4 ano Termo geral do binomio
Termo geral do binomio Exemplo de metodologia pronta
Exemplo de metodologia pronta Geografia geral
Geografia geral Governo geral objetivo
Governo geral objetivo Expressão geral dos zeros
Expressão geral dos zeros Plano cartesiano
Plano cartesiano Objetivo geral
Objetivo geral