QUMICA GERAL UNIDADE 2 NMEROS QU NTICOS Prof














- Slides: 34

QUÍMICA GERAL UNIDADE 2 - NÚMEROS QU NTICOS Prof. Cristian Berto da Silveira

Química Geral REVISÃO PARTÍCULAS ATÔMICAS ELETROSFERA NÚCLEO: Contém Prótons e Nêutrons. ELÉTROSFERA: Contém Elétrons. Partículas Carga Relativa Massa Relativa Prótons +1 1 Nêutrons 0 1 Elétrons -1 1/1840

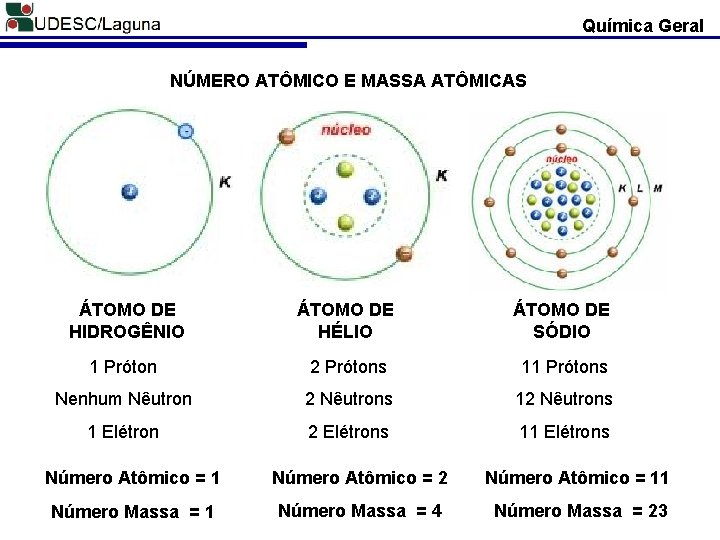
Química Geral NÚMERO ATÔMICO E MASSA ATÔMICAS ÁTOMO DE HIDROGÊNIO ÁTOMO DE HÉLIO ÁTOMO DE SÓDIO 1 Próton 2 Prótons 11 Prótons Nenhum Nêutron 2 Nêutrons 1 Elétron 2 Elétrons 11 Elétrons Número Atômico = 1 Número Atômico = 2 Número Atômico = 11 Número Massa = 4 Número Massa = 23

Química Geral Número Atômico (Z) = É o número correspondente à carga nuclear, ou seja, o número de prótons existente no núcleo. Z=p Z = Número Atômico. p = Número de Prótons. Número Massa (A) = É o número correspondente à soma das quantidades de prótons e de nêutrons existentes no núcleo. A=p+n A = Número de Massa. p = Número de Prótons. n = Número de Nêutrons.

Química Geral Exercícios 1. O átomo de magnésio apresenta doze prótons e doze nêutrons. Qual o número atômico e o número de massa deste elemento? 2. Descobrir o número de prótons, de nêutrons e de elétrons do átomo de carbono que apresenta Z = 6 e A = 13.

Química Geral UNIDADE 2 - NÚMEROS QU NTICOS 2 - Números Quânticos As teorias da MEC NICA QU NTICA, definidas por Planck, De Broglie, Schrödinger e Heisemberg, dentre outras, auxiliaram na identificação dos elétrons. Os NÚMEROS QUANTICOS são os modelos que nos auxiliam na localização e identificação da posição do elétron na orbita de um átomo. 1. Números Quânticos Principal (n); 2. Números Quânticos Secundário (l); 3. Números Quânticos Magnético (ml); 4. Números Quânticos Spin (ms);

Química Geral 1. Números Quânticos Principal (n): É um número inteiro que representa os níveis de energia, desde n = 1, para o primeiro nível; n = 2 para o segundo nível e assim até o infinito. O NÚMERO QU NTICO PRINCIPAL foi deduzido independentemente por Bohr e Schrödinger, pela fórmula: E = - 2. π2. m. e 4. Z 2 n 2. h 2 E = energia de uma camada; m = massa de um elétron; 1 2 3 4 5 6 7 e = carga de um elétron; Z = número atômico; h = constante de Planck; n número quântico principal; Como nos átomos conhecidos número máximo de camada é igual a 7, o NÚMERO QU NTICO PRINCIPAL VARIA DE 1 A 7.

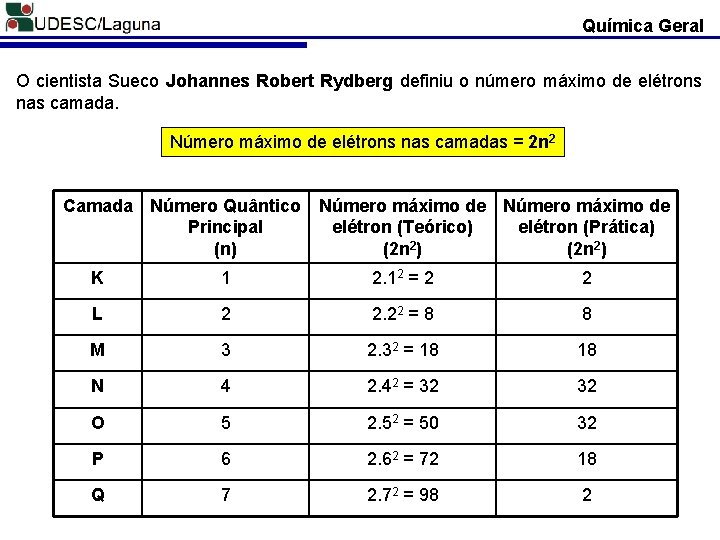
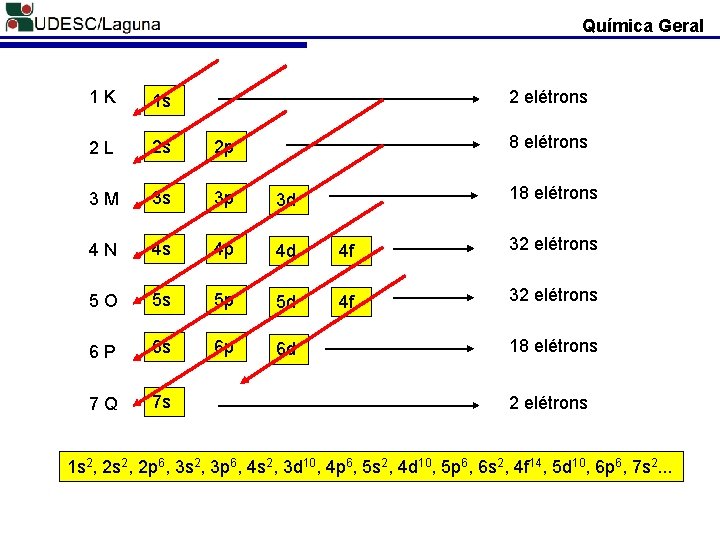
Química Geral O cientista Sueco Johannes Robert Rydberg definiu o número máximo de elétrons nas camada. Número máximo de elétrons nas camadas = 2 n 2 Camada Número Quântico Principal (n) Número máximo de elétron (Teórico) elétron (Prática) (2 n 2) K 1 2. 12 = 2 2 L 2 2. 22 = 8 8 M 3 2. 32 = 18 18 N 4 2. 42 = 32 32 O 5 2. 52 = 50 32 P 6 2. 62 = 72 18 Q 7 2. 72 = 98 2

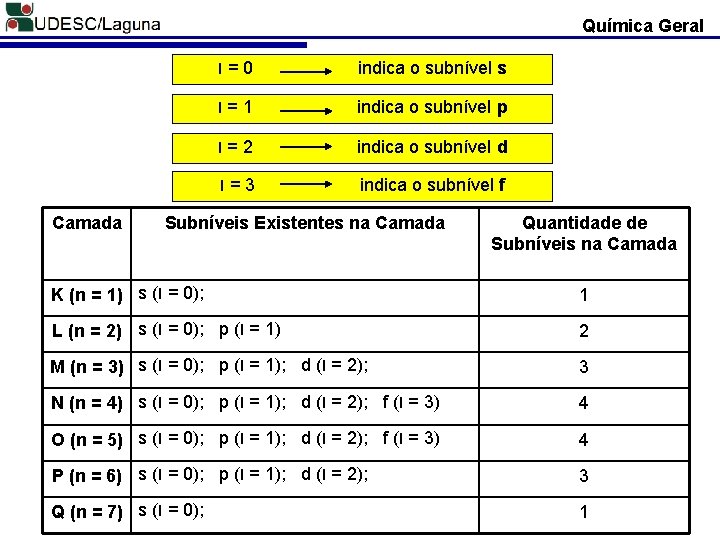
Química Geral Exercícios 3. Qual o número máximo de elétrons nas camadas atômicas K, M, O e Q? 4. Se o número quântico principal de um elétron for igual a 6 ele estará localizado em que camada? 2. Números Quânticos Secundário (l): Também conhecido como número quântico de momento angular do orbital. Caracteriza a uma subdivisão de energia dentro de cada camada, revelando, desta maneira a existência do Subnível de Energia. l = 0; 1; 2; . . . ; n - 1 l = 0; l = 1; l = 2; l = 3;

Química Geral Camada l=0 indica o subnível s l=1 indica o subnível p l=2 indica o subnível d l=3 indica o subnível f Subníveis Existentes na Camada Quantidade de Subníveis na Camada K (n = 1) s (l = 0); 1 L (n = 2) s (l = 0); p (l = 1) 2 M (n = 3) s (l = 0); p (l = 1); d (l = 2); 3 N (n = 4) s (l = 0); p (l = 1); d (l = 2); f (l = 3) 4 O (n = 5) s (l = 0); p (l = 1); d (l = 2); f (l = 3) 4 P (n = 6) s (l = 0); p (l = 1); d (l = 2); 3 Q (n = 7) s (l = 0); 1

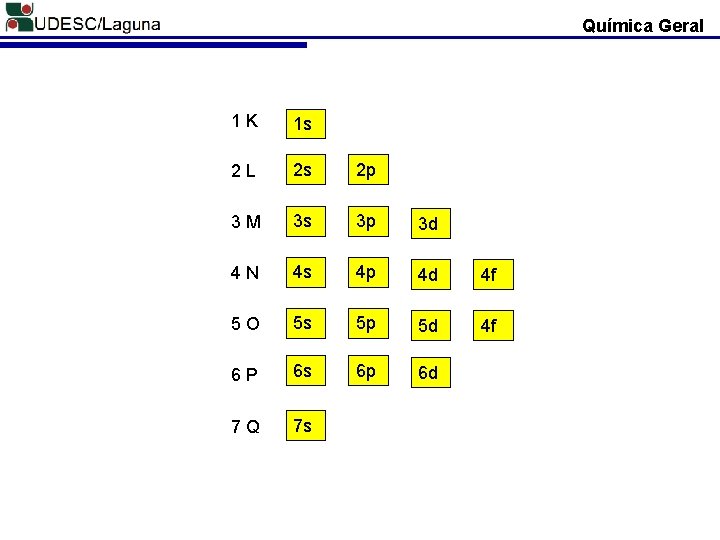
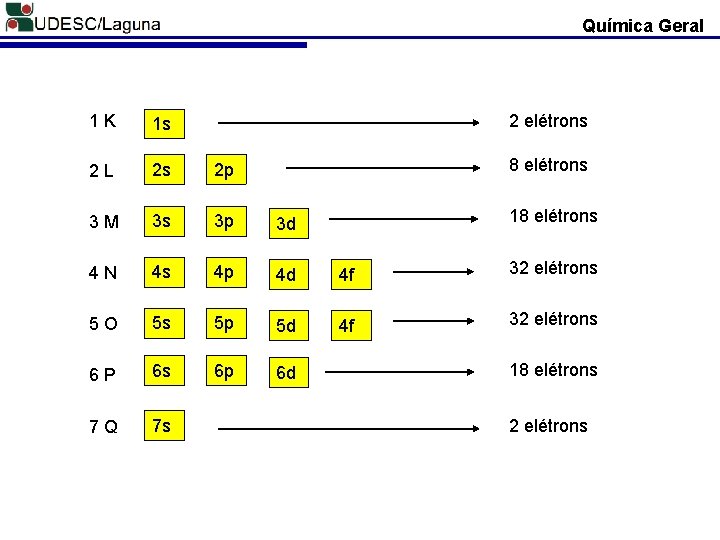
Química Geral 1 K 1 s 2 L 2 s 2 p 3 M 3 s 3 p 3 d 4 N 4 s 4 p 4 d 4 f 5 O 5 s 5 p 5 d 4 f 6 P 6 s 6 p 6 d 7 Q 7 s

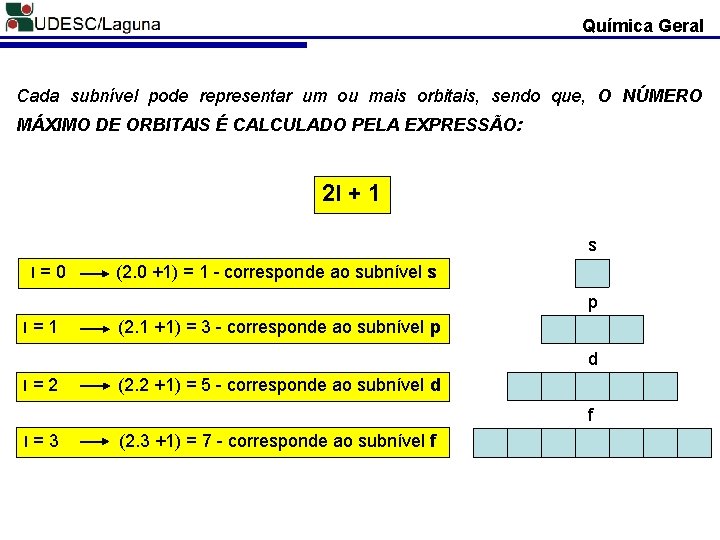
Química Geral Cada subnível pode representar um ou mais orbitais, sendo que, O NÚMERO MÁXIMO DE ORBITAIS É CALCULADO PELA EXPRESSÃO: 2 l + 1 s l=0 (2. 0 +1) = 1 - corresponde ao subnível s p l=1 (2. 1 +1) = 3 - corresponde ao subnível p d l=2 (2. 2 +1) = 5 - corresponde ao subnível d f l=3 (2. 3 +1) = 7 - corresponde ao subnível f

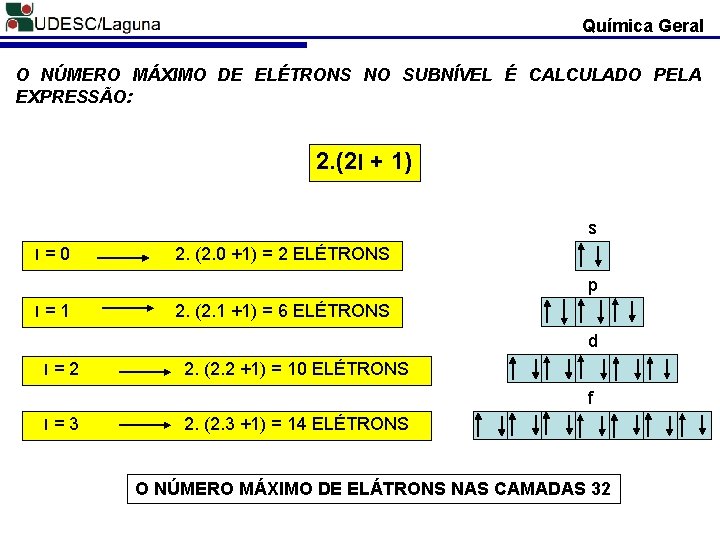
Química Geral O NÚMERO MÁXIMO DE ELÉTRONS NO SUBNÍVEL É CALCULADO PELA EXPRESSÃO: 2. (2 l + 1) s l=0 2. (2. 0 +1) = 2 ELÉTRONS p l=1 2. (2. 1 +1) = 6 ELÉTRONS d l=2 2. (2. 2 +1) = 10 ELÉTRONS f l=3 2. (2. 3 +1) = 14 ELÉTRONS O NÚMERO MÁXIMO DE ELÁTRONS NAS CAMADAS 32

Química Geral 1 K 1 s 2 L 2 s 2 p 3 M 3 s 3 p 3 d 4 N 4 s 4 p 4 d 4 f 32 elétrons 5 O 5 s 5 p 5 d 4 f 32 elétrons 6 P 6 s 6 p 6 d 7 Q 7 s 2 elétrons 8 elétrons 18 elétrons 2 elétrons

Química Geral Exercícios 5. Determine em que camada se localiza o elétron que apresenta: a) n = 2; b) n = 4; c) n = 6; d) n = 7; 6. Indique a camada e o subnível em que se localiza o elétron que apresenta os seguintes números quânticos: a) n = 2; l = 1; b) n = 4; l = 0; c) n = 6; l = 3; d) n = 3; l = 2;

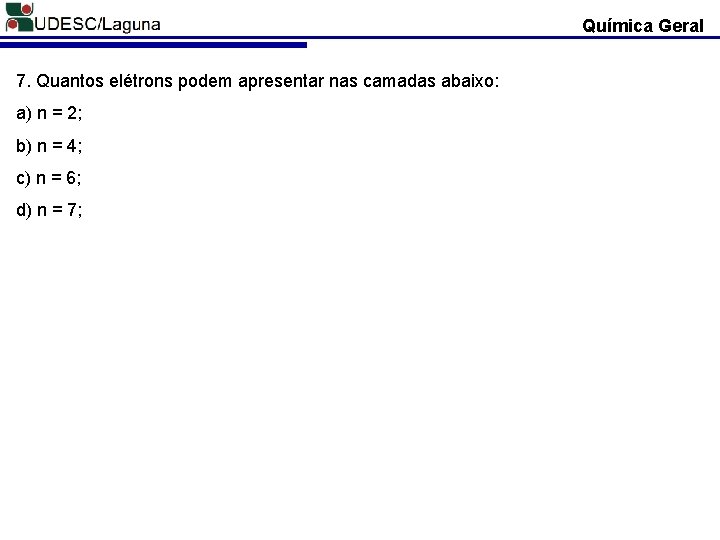
Química Geral 7. Quantos elétrons podem apresentar nas camadas abaixo: a) n = 2; b) n = 4; c) n = 6; d) n = 7;

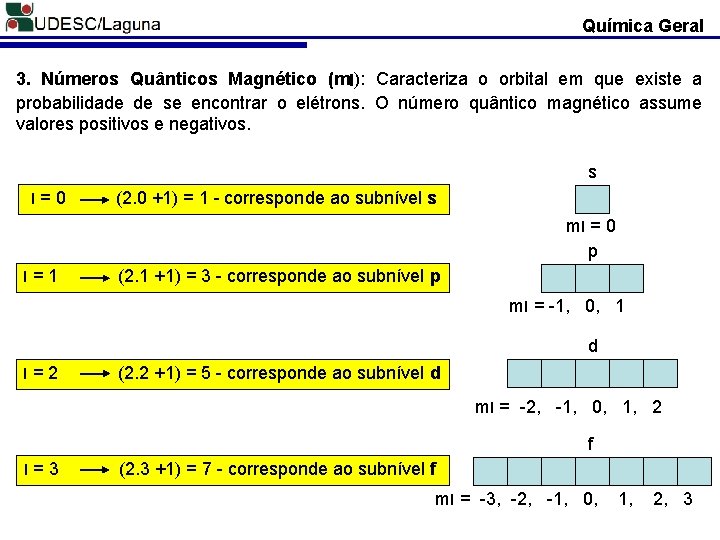
Química Geral 3. Números Quânticos Magnético (ml): Caracteriza o orbital em que existe a probabilidade de se encontrar o elétrons. O número quântico magnético assume valores positivos e negativos. s l=0 (2. 0 +1) = 1 - corresponde ao subnível s ml = 0 p l=1 (2. 1 +1) = 3 - corresponde ao subnível p ml = -1, 0, 1 d l=2 (2. 2 +1) = 5 - corresponde ao subnível d ml = -2, -1, 0, 1, 2 f l=3 (2. 3 +1) = 7 - corresponde ao subnível f ml = -3, -2, -1, 0, 1, 2, 3

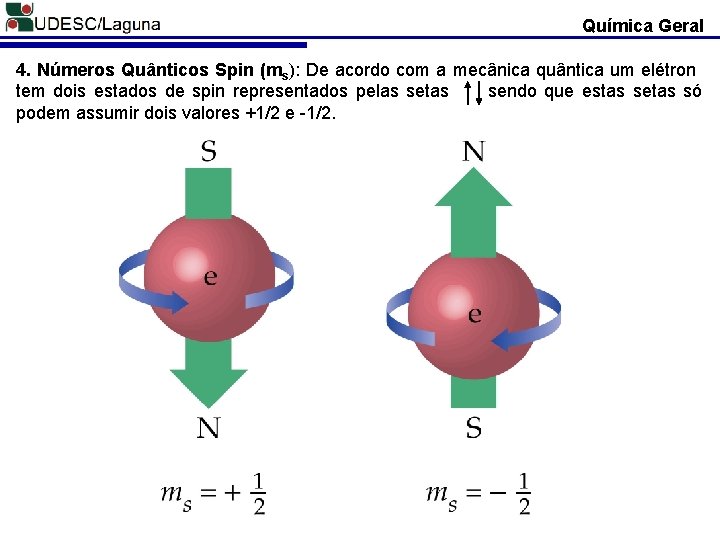
Química Geral 4. Números Quânticos Spin (ms): De acordo com a mecânica quântica um elétron tem dois estados de spin representados pelas setas sendo que estas setas só podem assumir dois valores +1/2 e -1/2.

Química Geral Exercícios 8. Os três números quânticos de um elétron em um determinado estado são: n = 4; l = 2; ml = -1. Em que tipo de orbital este elétrons está localizado? 9. Localizar o elétron representado pelos números quânticos n = 5; l = 2; ml = 1 e ms = 1/2.

Química Geral 10. Indicar os números quânticos do elétron situado na camada L, subnível p e orbital central.

Química Geral Sequência de Energia dos Subnívies. Linus Pauling (1901 a 1994): Químico norte americano desenvolveu a metodologia prática que fornece a ordem crescente de energia dos subníveis. Tem maior energia o elétron que apresenta a maior soma dos números quânticos principal e secundário ( n + l). Exemplo 1: Entre os subníveis 5 d e 6 s qual o de maior energia? 5 d - n = 5; l = 2. n + l = 7. 5 d é o de maior energia. 6 s - n = 6; l = 0. n + l = 6. Exemplo 2: Entre os subníveis 4 p e 5 s qual o de maior energia? 4 p - n = 4; l = 1. n + l = 5. 5 s - n = 5; l = 0. n + l = 5. 5 s é o de maior energia, pois apresenta maior número quântico principal.

Química Geral 1 K 1 s 2 L 2 s 2 p 3 M 3 s 3 p 3 d 4 N 4 s 4 p 4 d 4 f 32 elétrons 5 O 5 s 5 p 5 d 4 f 32 elétrons 6 P 6 s 6 p 6 d 7 Q 7 s 2 elétrons 8 elétrons 18 elétrons 2 elétrons 1 s 2, 2 p 6, 3 s 2, 3 p 6, 4 s 2, 3 d 10, 4 p 6, 5 s 2, 4 d 10, 5 p 6, 6 s 2, 4 f 14, 5 d 10, 6 p 6, 7 s 2. . .

Química Geral Regra de Hund: Princípio da Máxima Multiplicidade. A distribuição dos elétrons é feita em duas etapas: 1. Coloca-se inicialmente um elétron em cada orbital, este deve apresentar spins paralelos; 2. Após cada orbital, do mesmo subnível, apresentar um elétron inicia-se o emparelhamento dos demais. 1 Elétron 2 Elétrons 3 Elétrons 5 Elétrons

Química Geral 11. Fazer a distribuição eletrônica para os átomos abaixo. Identificar o última camada, e o subnível mais energético. a) Na (Z=11); b) Mn (Z=25); c) Co (Z=27).

Química Geral 11. Fazer a distribuição eletrônica para os átomos dos gases nobres, dos metais alcalinos, alcalinos terrosos e halogênios. IMPORTANTE: OS ELÉTRONS MAIS EXTERNOS SÃO USADOS NA FORMAÇÃO DAS LIGAÇÕES QUÍMICAS. A TEORIA QUE DEFINE ESTAS LIGAÇÕES É CONHECIDA COMO TEORIA DA LIGAÇÃO PELA VALÊNCIA.

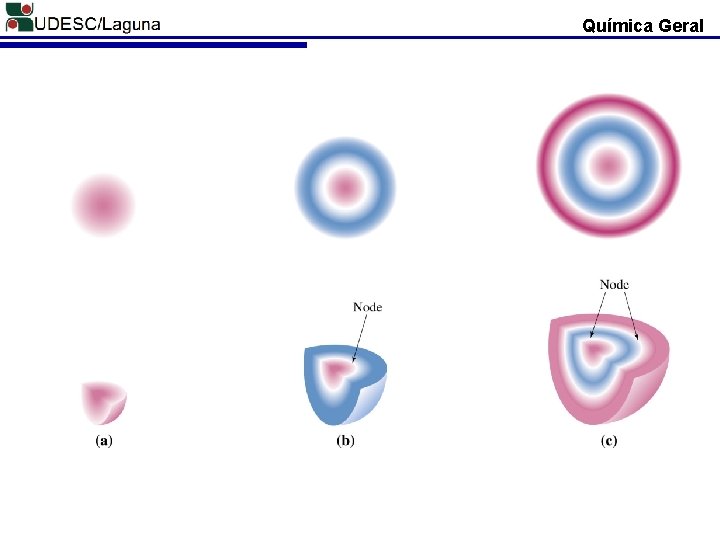
Química Geral GEOMETRIA DOS ORBITAIS É a região do espaço onde existe a máxima probabilidade de se encontrar um elétron. Ψv = Função de Onda; L = Comprimento; n = número quântico; [2/L]1/2 . sen [n πk/L] Schrödinger 1927

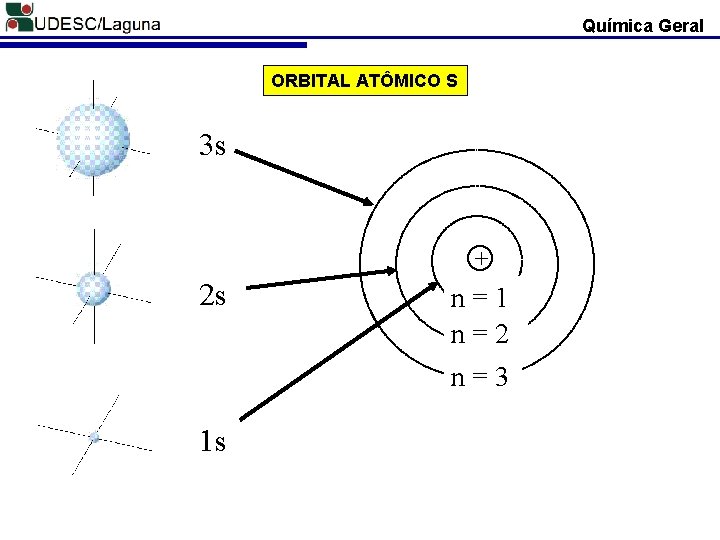
Química Geral ORBITAL ATÔMICO S 3 s + 2 s n=1 n=2 n=3 1 s

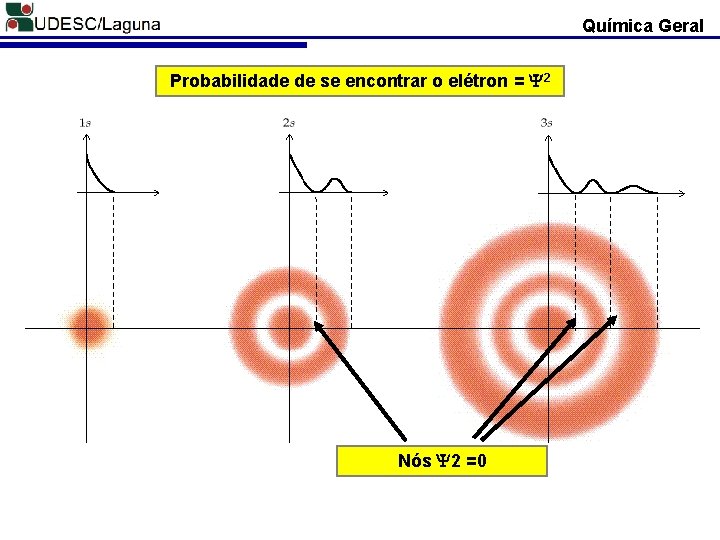
Química Geral Probabilidade de se encontrar o elétron = 2 Nós 2 =0

Química Geral

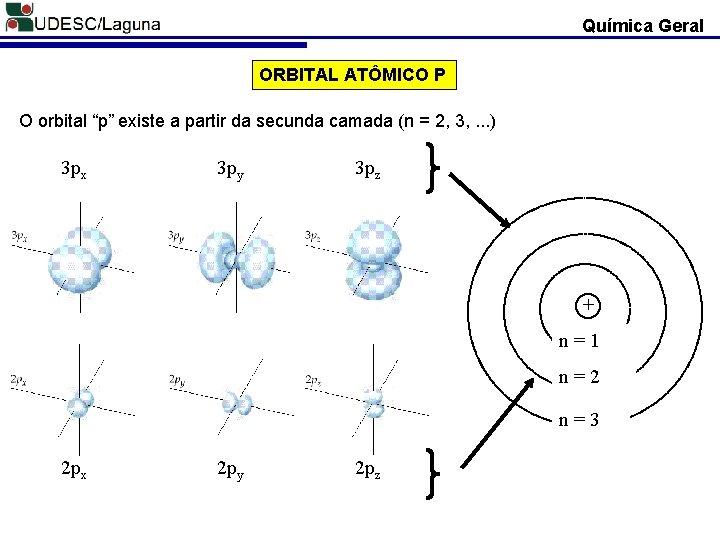
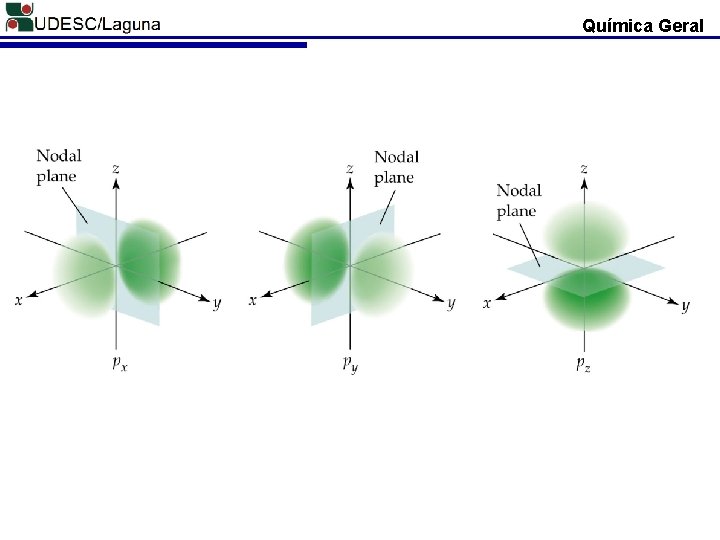
Química Geral ORBITAL ATÔMICO P O orbital “p” existe a partir da secunda camada (n = 2, 3, . . . ) 3 px 3 py 3 pz + n=1 n=2 n=3 2 px 2 py 2 pz

Química Geral

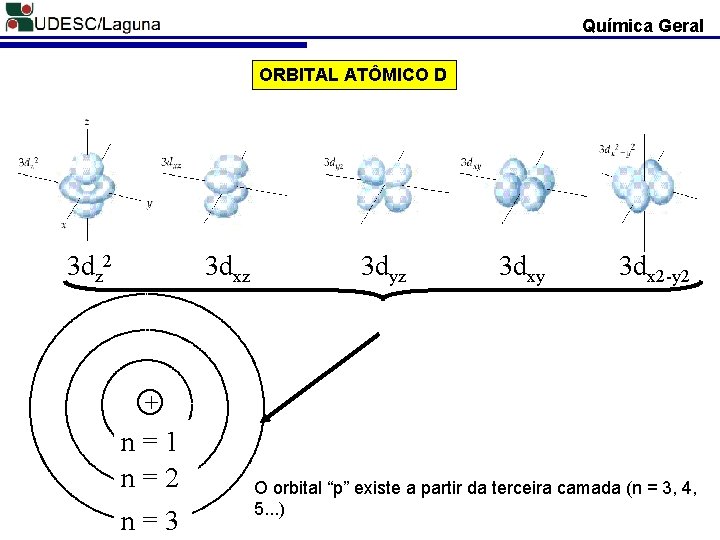
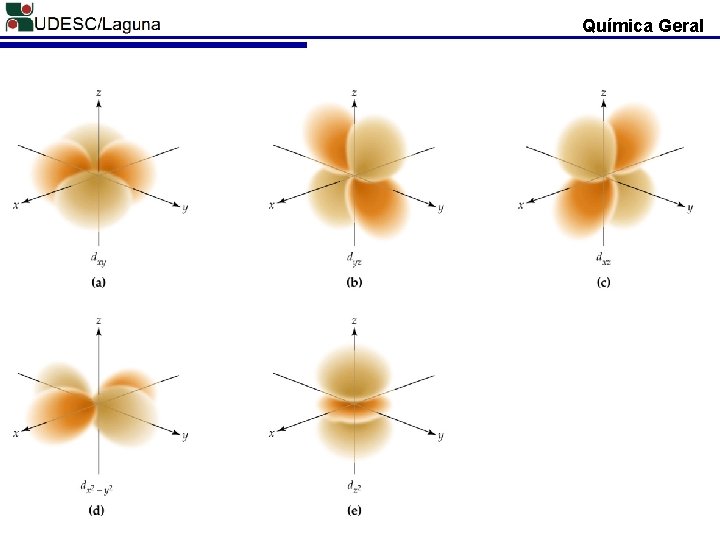
Química Geral ORBITAL ATÔMICO D 3 dz 2 3 dxz 3 dyz 3 dxy 3 dx 2 -y 2 + n=1 n=2 n=3 O orbital “p” existe a partir da terceira camada (n = 3, 4, 5. . . )

Química Geral

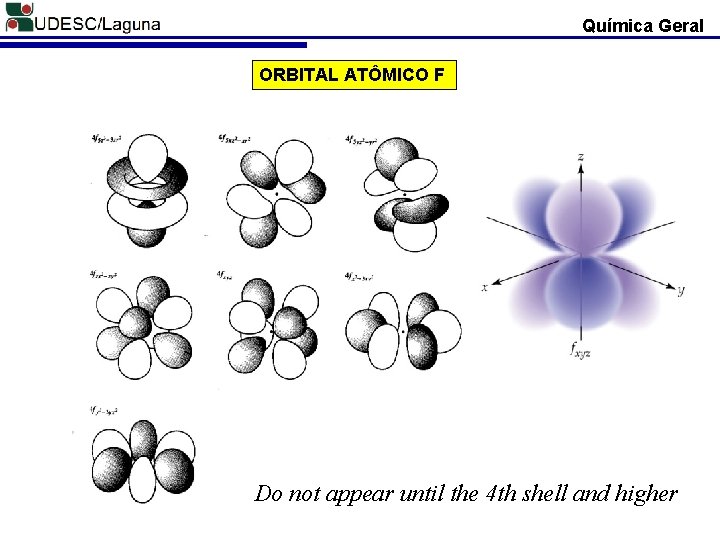
Química Geral ORBITAL ATÔMICO F Do not appear until the 4 th shell and higher
 Numeros pentagonales
Numeros pentagonales Nmeros romanos
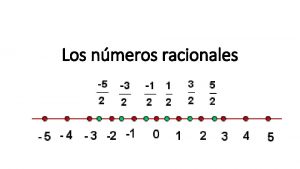
Nmeros romanos Nmeros reales
Nmeros reales Nmeros naturales
Nmeros naturales Nmeros reales
Nmeros reales Numeros romanos del 400 al 600
Numeros romanos del 400 al 600 Recta numerica de numeros enteros
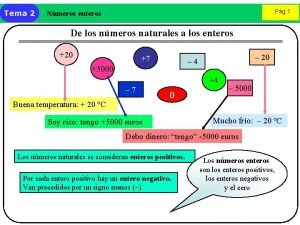
Recta numerica de numeros enteros Nmeros enteros
Nmeros enteros Nmeros enteros
Nmeros enteros Nyuexternal
Nyuexternal Nmeros ordinales
Nmeros ordinales Nmeros enteros
Nmeros enteros Nmeros romanos
Nmeros romanos Numerais cardinais
Numerais cardinais Número divisivel por 7
Número divisivel por 7 Nmeros ordinales
Nmeros ordinales Nmeros naturales
Nmeros naturales Nmeros ordinales
Nmeros ordinales Nmeros romanos
Nmeros romanos Los nmeros
Los nmeros Yu chi ho
Yu chi ho 1ero 2do. 3ero 4to 5to 6to 7mo
1ero 2do. 3ero 4to 5to 6to 7mo Refrão meditativo para quaresma
Refrão meditativo para quaresma Constante de boltzmann unidade
Constante de boltzmann unidade Newton unidade
Newton unidade No presépio pequenino deus é hoje nosso irmão
No presépio pequenino deus é hoje nosso irmão Unidade de ensino superior dom bosco
Unidade de ensino superior dom bosco Unidade estilística
Unidade estilística Unidade central de processamento
Unidade central de processamento Unidade de medida
Unidade de medida Din newton
Din newton Unidade de medida u
Unidade de medida u Citoplasma
Citoplasma Simbolo unidade de medida
Simbolo unidade de medida Unidade de ensino superior dom bosco
Unidade de ensino superior dom bosco