QUMICA GERAL UNIDADE 5 LIGAES QUMICAS Prof Cristian



















- Slides: 50

QUÍMICA GERAL UNIDADE 5 - LIGAÇÕES QUÍMICAS Prof. Cristian Berto da Silveira

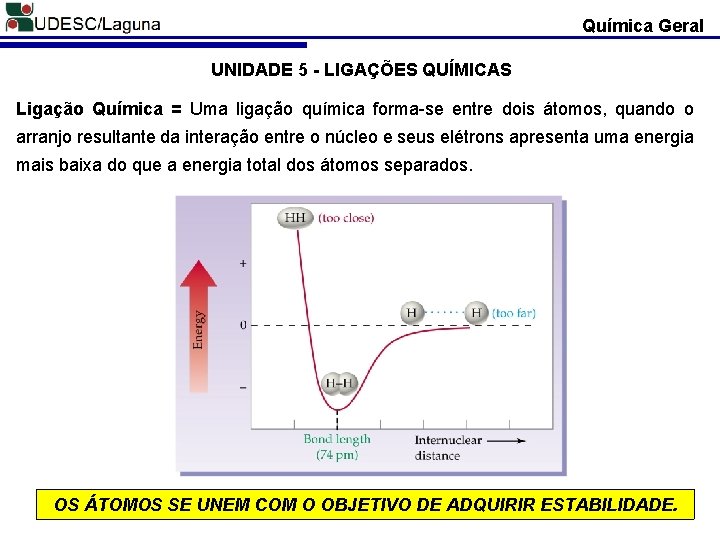
Química Geral UNIDADE 5 - LIGAÇÕES QUÍMICAS Ligação Química = Uma ligação química forma-se entre dois átomos, quando o arranjo resultante da interação entre o núcleo e seus elétrons apresenta uma energia mais baixa do que a energia total dos átomos separados. OS ÁTOMOS SE UNEM COM O OBJETIVO DE ADQUIRIR ESTABILIDADE.

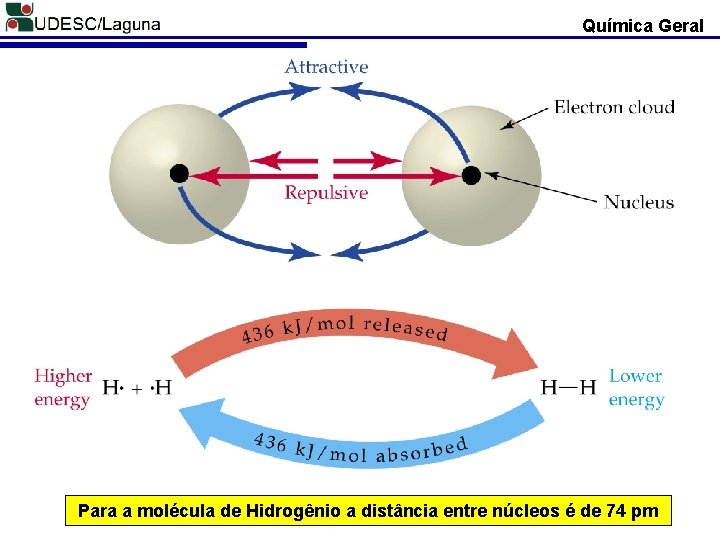
Química Geral Para a molécula de Hidrogênio a distância entre núcleos é de 74 pm

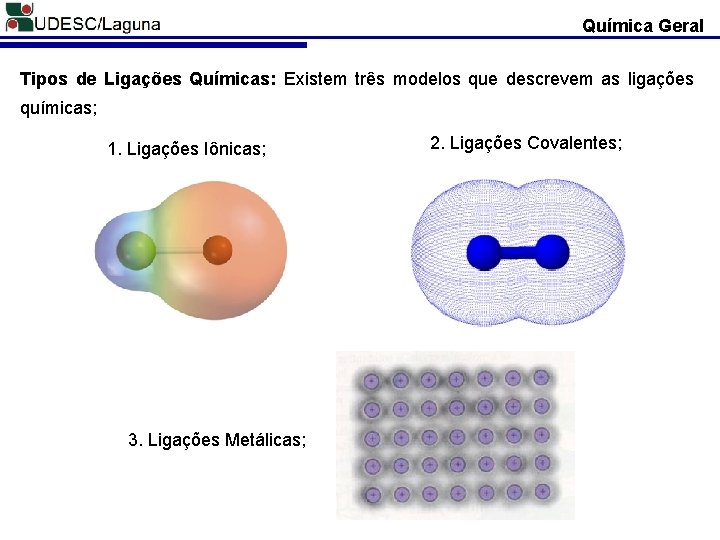
Química Geral Tipos de Ligações Químicas: Existem três modelos que descrevem as ligações químicas; 1. Ligações Iônicas; 3. Ligações Metálicas; 2. Ligações Covalentes;

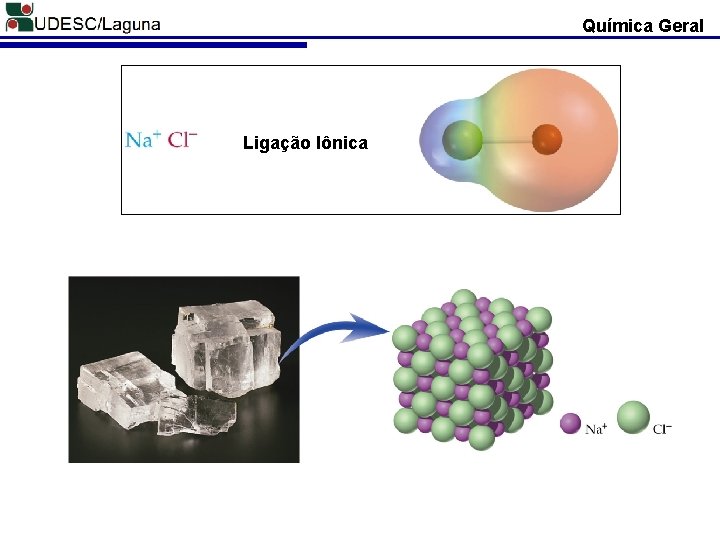
Química Geral LIGAÇÕES IÔNICAS No modelo de ligação química denominada ligações iônicas, as forças eletrostáticas atraem as partículas com cargas elétricas opostas. Formação do Cátion: Ocorre quando um átomo perde elétron. Na (g) Na+(g) + 1 e- Formação do nion: Ocorre quando um átomo recebe elétron. Cl (g) + 1 e- Cl-(g) Formação de um sólido a partir de seus íons. Na + (g) + Cl - (g) Na. Cl(s)

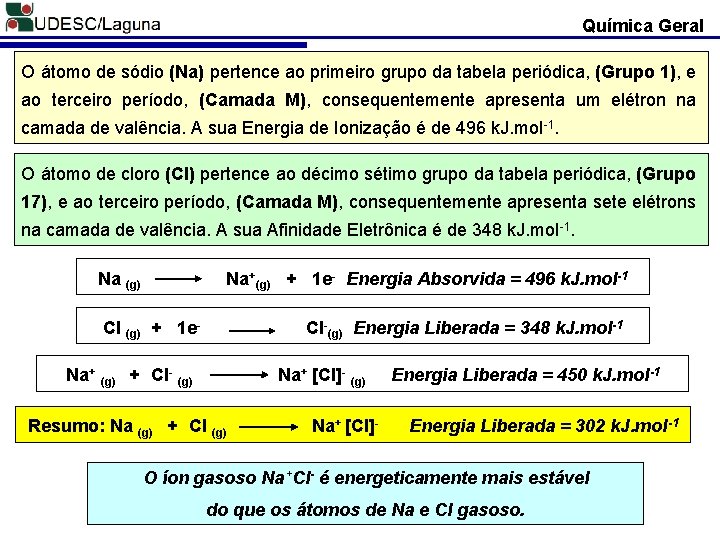
Química Geral O átomo de sódio (Na) pertence ao primeiro grupo da tabela periódica, (Grupo 1), e ao terceiro período, (Camada M), consequentemente apresenta um elétron na camada de valência. A sua Energia de Ionização é de 496 k. J. mol-1. O átomo de cloro (Cl) pertence ao décimo sétimo grupo da tabela periódica, (Grupo 17), e ao terceiro período, (Camada M), consequentemente apresenta sete elétrons na camada de valência. A sua Afinidade Eletrônica é de 348 k. J. mol-1. Na (g) Na+(g) + 1 e- Energia Absorvida = 496 k. J. mol-1 Cl (g) + 1 e- Cl-(g) Energia Liberada = 348 k. J. mol-1 Na+ (g) + Cl- (g) Na+ [Cl]- (g) Resumo: Na (g) + Cl (g) Na+ [Cl]- Energia Liberada = 450 k. J. mol-1 Energia Liberada = 302 k. J. mol-1 O íon gasoso Na+Cl- é energeticamente mais estável do que os átomos de Na e Cl gasoso.

Química Geral Levando em consideração a formação do cloreto de sódio no estado sólido temos que: Etapa A: Na (s) Etapa B: Na (g) Etapa C: ½ Cl 2 (g) Etapa D: Cl (g) + 1 e- Na(g) Energia Absorvida = 108 k. J. mol-1 Na+(g) + e- Energia Absorvida = 496 k. J. mol-1 Cl(g) Energia Absorvida = 121 k. J. mol-1 Cl-(g) Energia Liberada = 348 k. J. mol-1 Etapa E: Na+ (g) + Cl- (g) Na. Cl (s) Resumo: Na (s) + ½ Cl 2 (g) Na. Cl (s) Energia Liberada = 787 k. J. mol-1 Energia Liberada = 410 k. J. mol-1

Química Geral Ligação Iônica

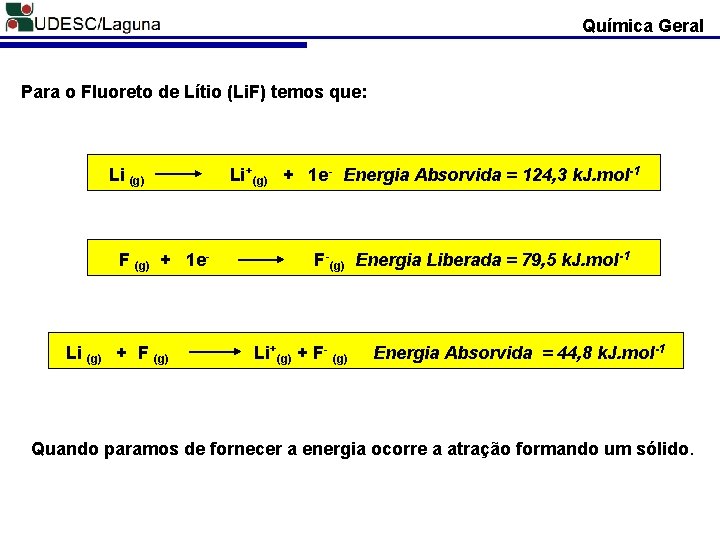
Química Geral Para o Fluoreto de Lítio (Li. F) temos que: Li (g) F (g) + 1 e- Li (g) + F (g) Li+(g) + 1 e- Energia Absorvida = 124, 3 k. J. mol-1 F-(g) Energia Liberada = 79, 5 k. J. mol-1 Li+(g) + F- (g) Energia Absorvida = 44, 8 k. J. mol-1 Quando paramos de fornecer a energia ocorre a atração formando um sólido.

Química Geral G. N. Lewis (1916): Desenvolveu o método de empregado na distribuição de elétrons ao redor dos átomos e moléculas. Distribuição dos elétrons de valência ao redor dos átomos. Valência: É a capacidade de combinação dos átomos. Geralmente os elétrons da camada mais externa são os responsáveis pela formação da ligação ou pela combinação com outros átomos.

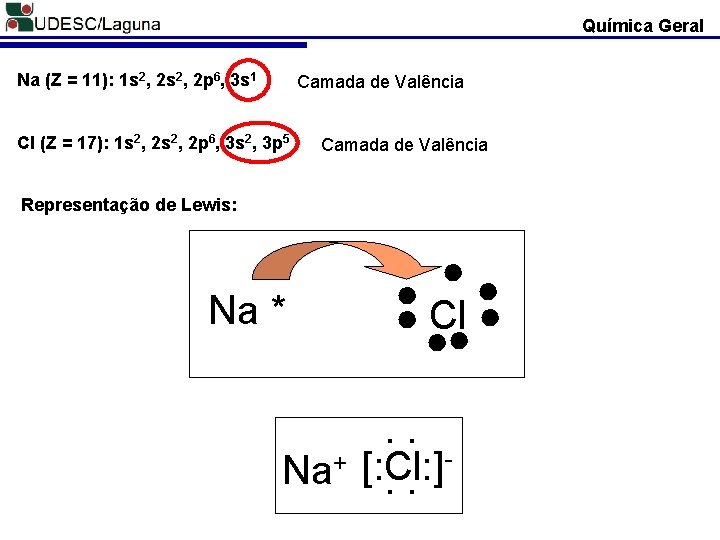
Química Geral Na (Z = 11): 1 s 2, 2 p 6, 3 s 1 Camada de Valência Cl (Z = 17): 1 s 2, 2 p 6, 3 s 2, 3 p 5 Camada de Valência Representação de Lewis: Na * ●● ● ● Cl ● ●● . . + [: Cl: ] Na. .

Química Geral Langmuir: Provou experimentalmente que os gases nobres são elementos que possuem pequena reatividade química. São elementos que apresentam uma baixa afinidade eletrônica e uma elevada energia de ionização. São átomos considerados estáveis e que apresentam a sua camada de valência completa com oito elétrons. Regra do Octeto: Os átomos buscam a estabilidade com oito elétrons na camada de valência. Na (Z = 11): 1 s 2, 2 p 6, 3 s 1 Cl (Z = 17): 1 s 2, 2 p 6, 3 s 2, 3 p 5 . . + [: Cl: ] Na. .

Química Geral A regra do octeto é um guia para previsões sobre as ligações químicas e estequiometria. Geralmente as ligações iônicas ocorrem pela ligação de um METAL (formam o octeto pela perda de um elétron) e os NÃO-METAIS (formam o octeto pela ganho de um elétron). Metais: Geralmente os que estão localizados a esquerda da tabela periódica apresentam baixa energia de ionização e baixa afinidade eletrônica, desta forma espera-se que estes elementos tenham uma maior tendência perder os elétrons, formando CÁTIONS. Não-Metais: Geralmente os que estão localizados a direita da tabela periódica apresentam alta energia de ionização e alta afinidade eletrônica, desta forma espera -se que estes elementos tenham uma maior tendência a ganhar os elétrons, formando ÁNIONS.

Química Geral Os metais formam cátions: - Monovalentes: Na+ perdem 1 e-; - Bivalentes: Ca 2+ perdem 2 e-; - Trivalentes: Al 3+ perdem 3 e-; - Tetravalentes: Pb 4+ perdem 4 e-; - Pentavalentes: Bi 5+ perdem 5 e-; Os nâo-metais formam ânions: - Com cinco elétrons: N recebem 3 e-; - Com seis elétrons: O recebem 2 e-; - Com sete elétrons: F recebe 1 e-;

Química Geral Exercícios: 1. Escrever a configuração eletrônica dos Íons: a) In (Z = 49); b) Cu (Z = 29) c) Cr (Z = 24) d) P (Z = 15) - In 3+: - Cu+: - Cr 2+: - P-3: - Cu 2+: - Cr 3+: Exceção: Nos átomos de Cr e Cu a subcamada (4 s) contem apenas 1 elétron. Isto ocorre porque as energias 3 d e 4 s são muito próximas, de maneira que um dos elétron 4 s passa para a subcamada 3 d, devido a maior energia de emparelhamento.

Química Geral Exercícios: 1. Escrever a configuração eletrônica dos Íons: a) Fe (Z = 26); b) O (Z = 8) - Fe 2+: - O 2 -: - Fe 3+:

Química Geral 2. Escrever a estrutura de Lewis para a molécula de Cloreto de Cálcio (Ca. Cl 2): Ca (Z = 20); Cl (Z = 17):

Química Geral 3. Escrever a estrutura de Lewis para a molécula de Óxido de Alumínio (Al 2 O 3): Al (Z = 13); O (Z = 8):

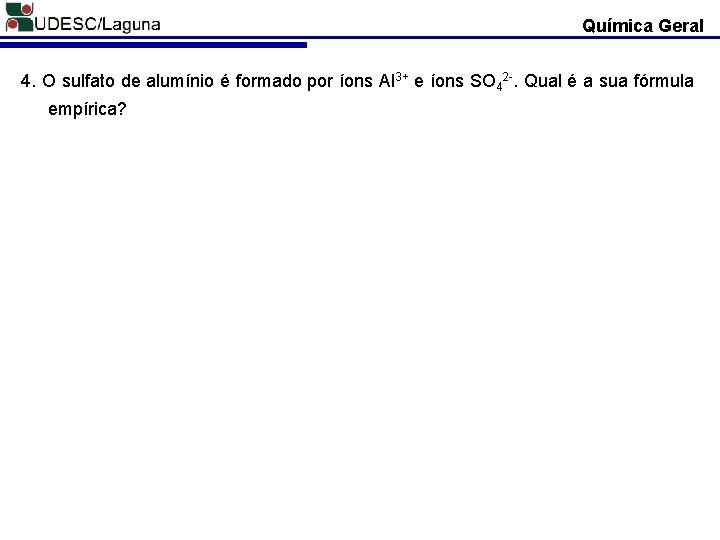
Química Geral 4. O sulfato de alumínio é formado por íons Al 3+ e íons SO 42 -. Qual é a sua fórmula empírica?

Química Geral LIGAÇÕES COVALENTES No modelo de ligação química denominada ligações covalentes dois átomos têm a mesma tendência de ganhar ou perder elétrons. Os elétrons ficam compartilhados entre os dois átomos. O compartilhamento dos elétrons ocorre principalmente entre não metais, ou entre um não metal e um semi-metal, ou seja átomos que necessitam receber elétrons.

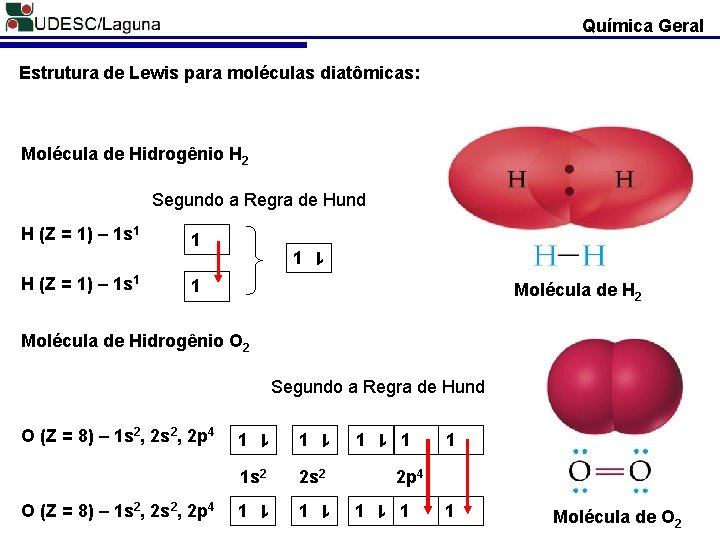
Química Geral Estrutura de Lewis para moléculas diatômicas: Molécula de Hidrogênio H 2 Segundo a Regra de Hund H (Z = 1) – 1 s 1 1 Molécula de H 2 Molécula de Hidrogênio O 2 Segundo a Regra de Hund 1 1 s 2 2 s 2 1 1 1 2 p 4 1 1 1 O (Z = 8) – 1 s 2, 2 s 2, 2 p 4 1 1 Molécula de O 2

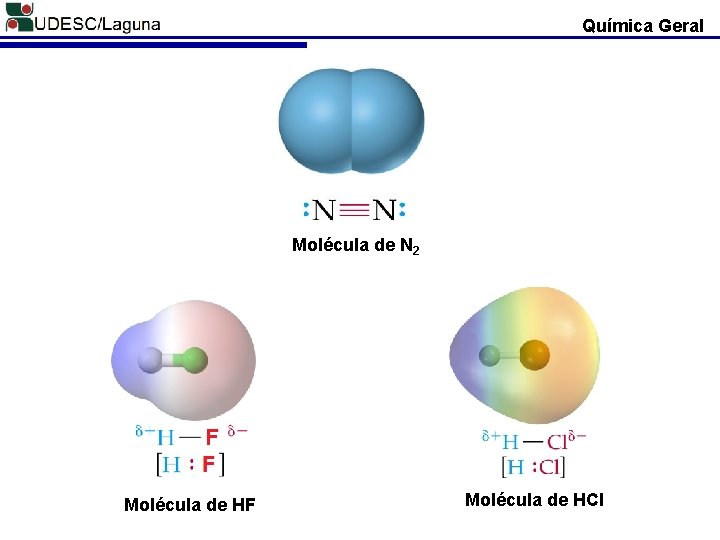
Química Geral Molécula de N 2 Molécula de HF Molécula de HCl

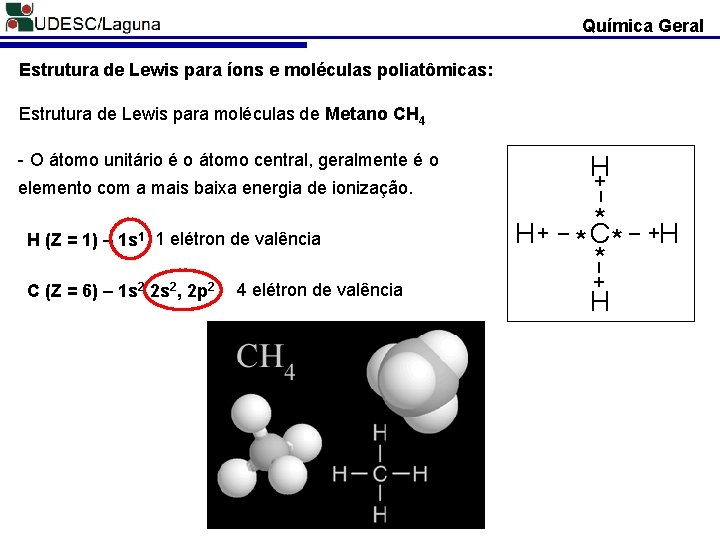
Química Geral Estrutura de Lewis para íons e moléculas poliatômicas: Estrutura de Lewis para moléculas de Metano CH 4 elemento com a mais baixa energia de ionização. 1 elétron de valência * H + _ * C * _ +H * _ H (Z = 1) – 1 s 1 H + _ - O átomo unitário é o átomo central, geralmente é o C (Z = 6) – 1 s 2 2 s 2, 2 p 2 4 elétron de valência + H

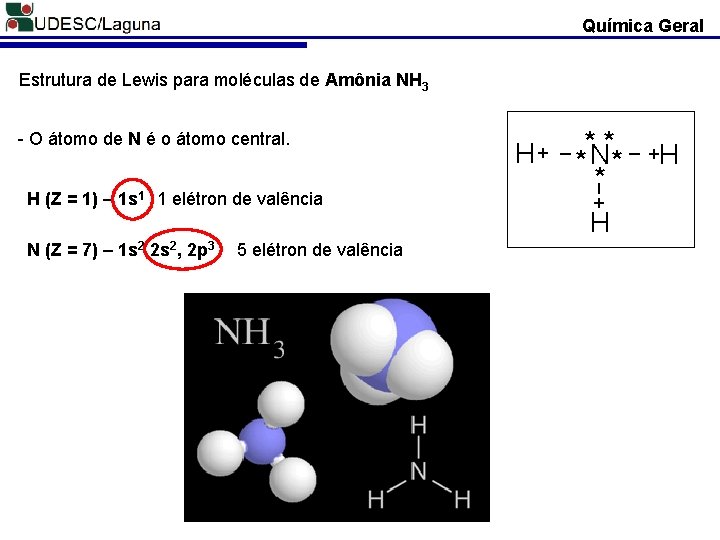
Química Geral Estrutura de Lewis para moléculas de Amônia NH 3 H (Z = 1) – 1 s 1 1 elétron de valência N (Z = 7) – 1 s 2 2 s 2, 2 p 3 5 elétron de valência H + _ **N** _ +H * _ - O átomo de N é o átomo central. + H

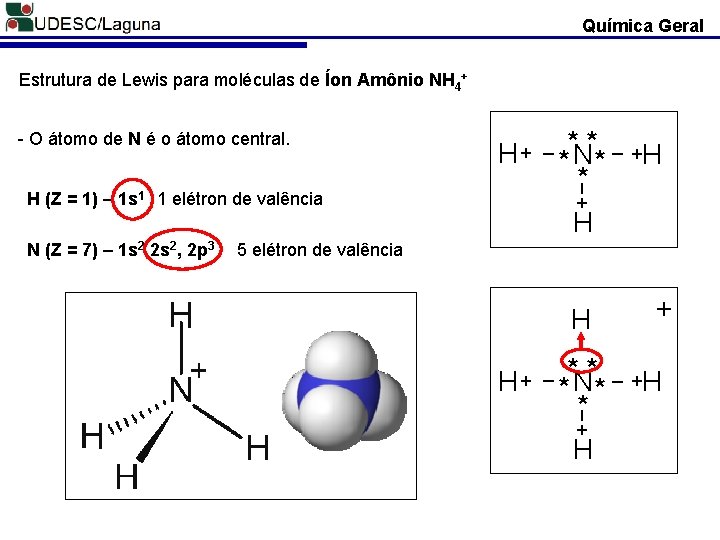
Química Geral Estrutura de Lewis para moléculas de Íon Amônio NH 4+ H (Z = 1) – 1 s 1 1 elétron de valência + H 5 elétron de valência H + _ **N** _ +H * _ N (Z = 7) – 1 s 2 2 s 2, 2 p 3 H + _ **N** _ +H * _ - O átomo de N é o átomo central. + H

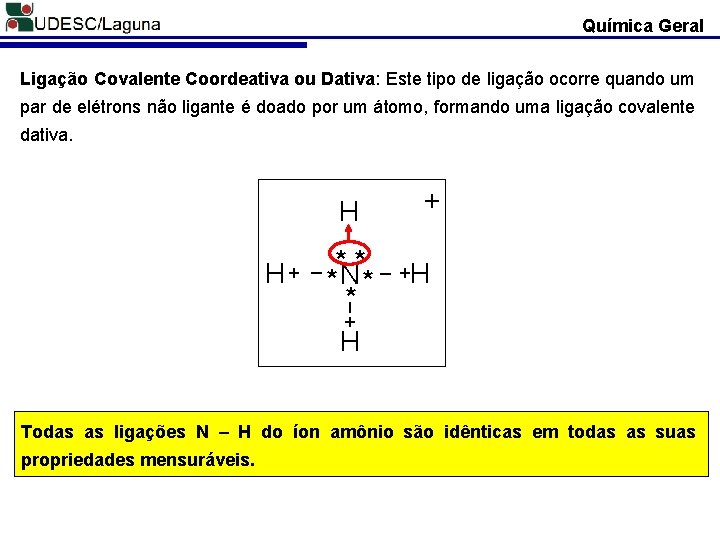
Química Geral Ligação Covalente Coordeativa ou Dativa: Este tipo de ligação ocorre quando um par de elétrons não ligante é doado por um átomo, formando uma ligação covalente dativa. H + _ **N** _ +H * + H Todas as ligações N – H do íon amônio são idênticas em todas as suas propriedades mensuráveis.

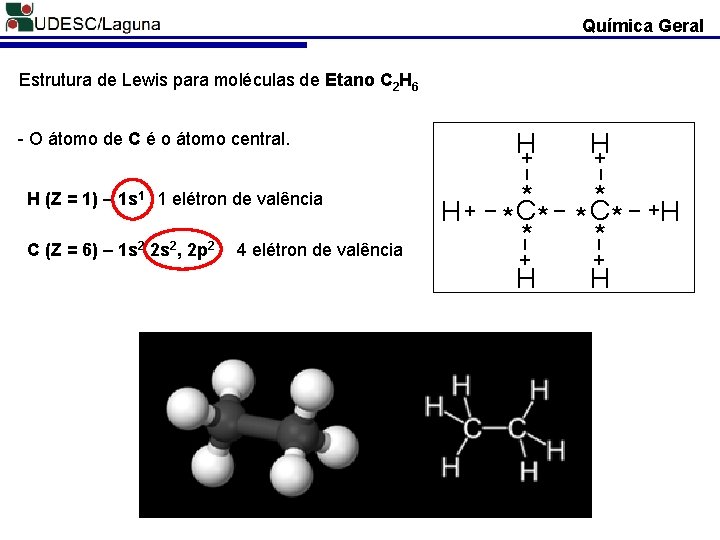
Química Geral Estrutura de Lewis para moléculas de Etano C 2 H 6 C (Z = 6) – 1 s 2 2 s 2, 2 p 2 4 elétron de valência _ * _ + H * C* * _ H (Z = 1) – 1 s 1 1 elétron de valência + H _ H + * _+ * C* H * _ H + _ - O átomo de C é o átomo central. + H

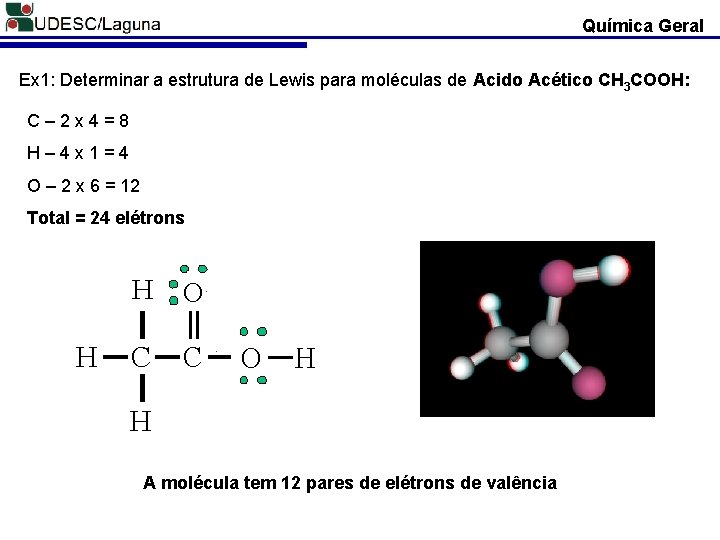
Química Geral Ex 1: Determinar a estrutura de Lewis para moléculas de Acido Acético CH 3 COOH: C– 2 x 4=8 H– 4 x 1=4 O – 2 x 6 = 12 Total = 24 elétrons A molécula tem 12 pares de elétrons de valência

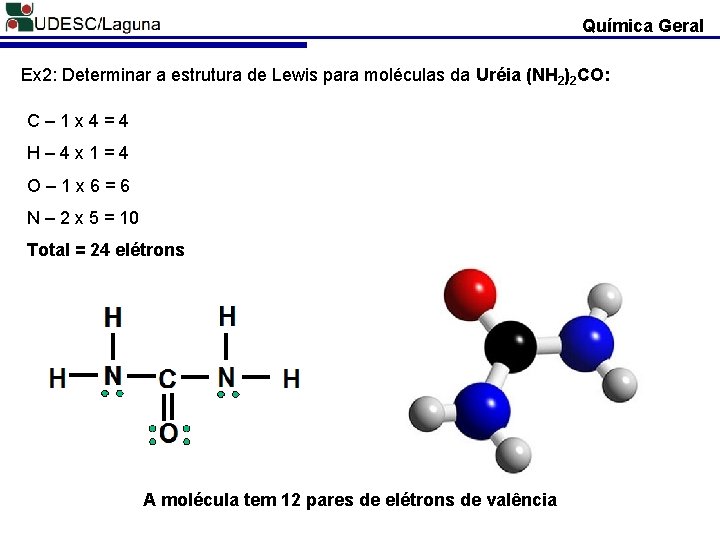
Química Geral Ex 2: Determinar a estrutura de Lewis para moléculas da Uréia (NH 2)2 CO: C– 1 x 4=4 H– 4 x 1=4 O– 1 x 6=6 N – 2 x 5 = 10 Total = 24 elétrons A molécula tem 12 pares de elétrons de valência

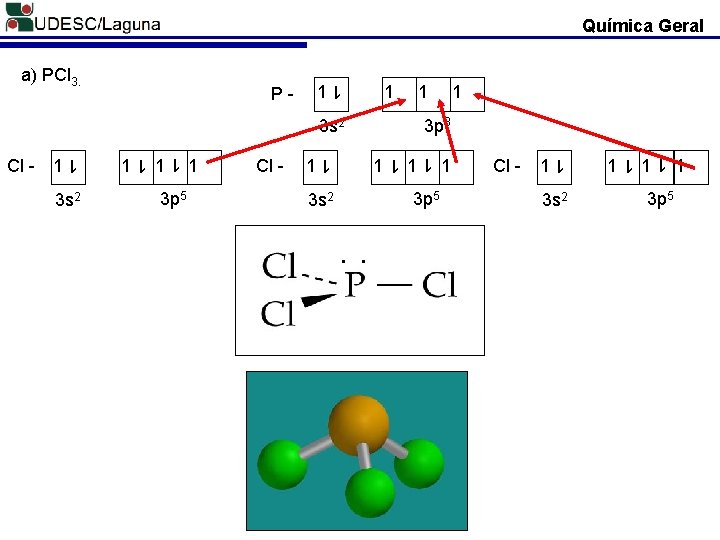
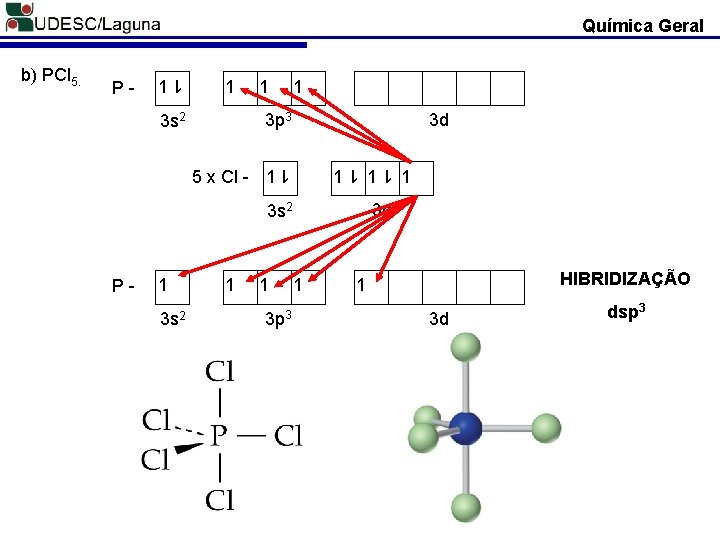
Química Geral Limitações da Regra do Octeto: A regra do octeto nos diz que oito elétrons preenche uma camada para que o átomo possa atingir a configuração eletrônica de um gás nobre ns 2 np 6. Entretanto existem as seguintes situações: 1. Moléculas com número impares de elétrons: Cl. O 2, NO 2; 2. Moléculas nas quais os átomos apresentam menos de um octeto, ou seja moléculas deficientes de elétrons: BF 3; 3. E quando o átomo central de uma molécula tem os orbitais (d) semi-preenchido, ele pode acomodar mais elétrons, 10, 12 ou até mais elétrons, nesta situação ocorre a expansão da camada de valência. Determinar a estrutura de Lewis para as moléculas: a) PCl 3 b) PCl 5 a) PCl 3. P (Z = 15) - 1 s 2, 2 p 6, 3 s 2, 3 p 3. 5 elétrons na camada de valência. Cl (Z = 17) - 1 s 2, 2 p 6, 3 s 2, 3 p 5. 7 elétrons na camada de valência.

Química Geral 1 1 3 p 3 Cl - 1 1 3 p 5 1 1 1 1 3 s 2 1 3 p 5 3 s 2 . . 1 Cl - 1 1 1 3 s 2 Cl - 1 1 P- 1 a) PCl 3. 3 p 5 1

Química Geral 1 1 1 3 p 3 5 x Cl - 1 3 d 1 1 3 s 2 1 1 3 p 3 1 3 p 5 3 s 2 P- 1 1 P- 1 b) PCl 5. 1 HIBRIDIZAÇÃO 1 3 d dsp 3

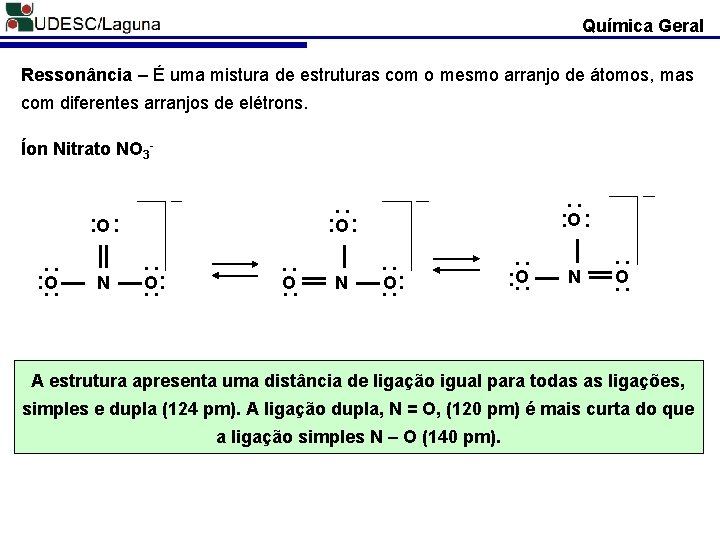
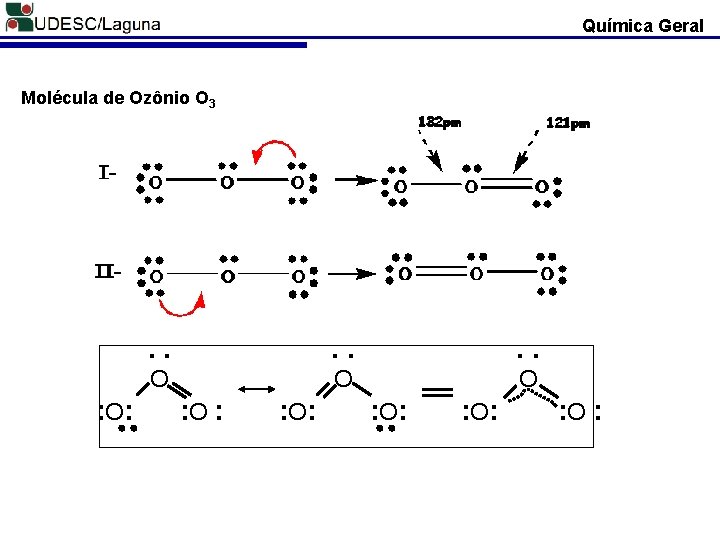
Química Geral Ressonância – É uma mistura de estruturas com o mesmo arranjo de átomos, mas com diferentes arranjos de elétrons. Íon Nitrato NO 3 - . . N . . . O. . . N . . . . O . . O N . . . O. A estrutura apresenta uma distância de ligação igual para todas as ligações, simples e dupla (124 pm). A ligação dupla, N = O, (120 pm) é mais curta do que a ligação simples N – O (140 pm).

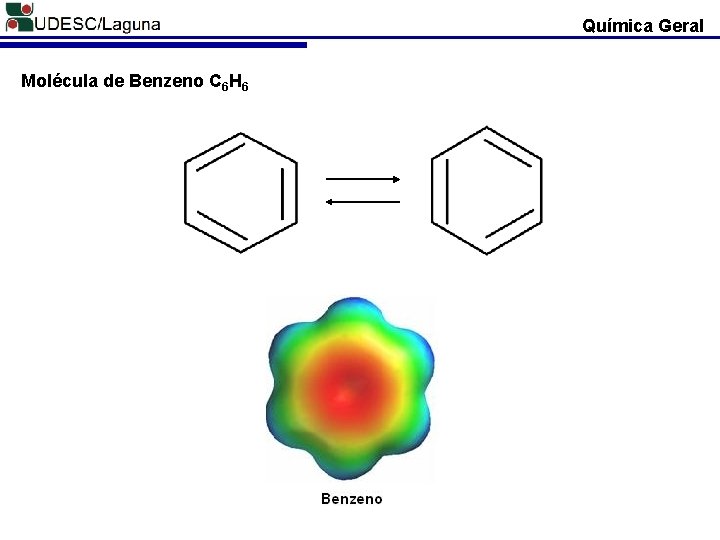
Química Geral Molécula de Benzeno C 6 H 6

Química Geral Molécula de Ozônio O 3 : O : . . . O O O : : O :

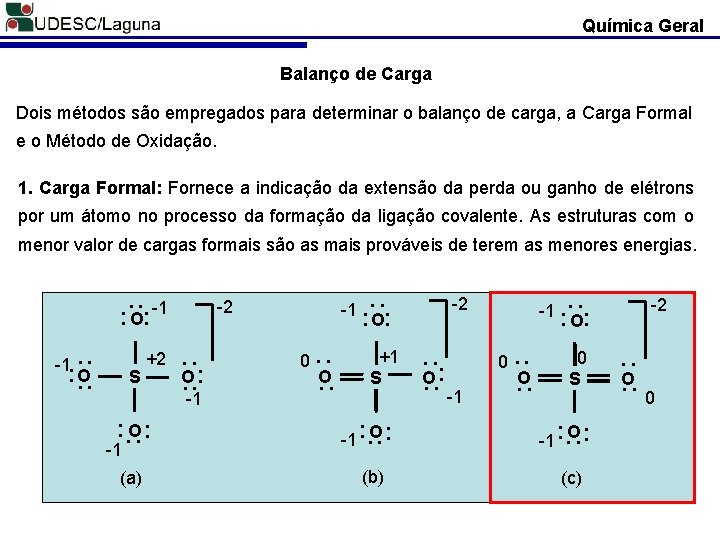
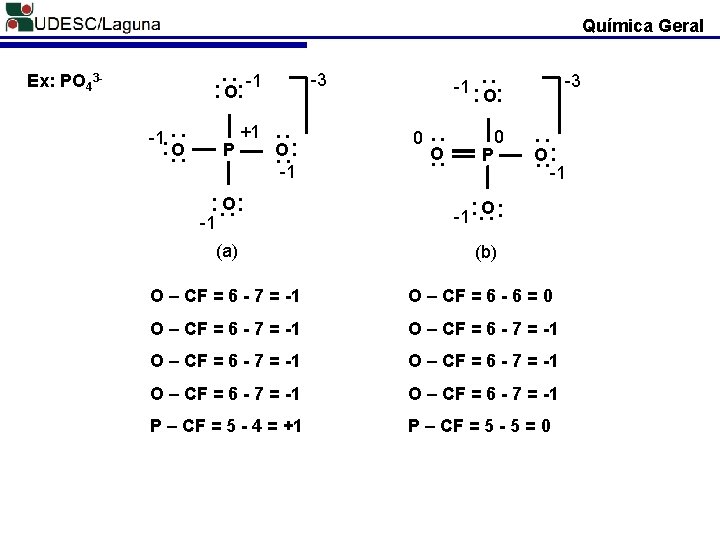
Química Geral Balanço de Carga Dois métodos são empregados para determinar o balanço de carga, a Carga Formal e o Método de Oxidação. 1. Carga Formal: Fornece a indicação da extensão da perda ou ganho de elétrons por um átomo no processo da formação da ligação covalente. As estruturas com o menor valor de cargas formais são as mais prováveis de terem as menores energias. -1. . O. . . +2. . S O. . -1 . . O -2 0. . O. . +1 S . . O. . -1 -1 . . O 0. . O. . 0 S (a) (b) (c) . . . . -1. O. . . . O. -1 -2 . . -1 . . . . -2 . . -1 O . . O. . 0

Química Geral A soma aritmética de todas as cargas formais dos átomos que compõe uma molécula ou um íon é igual ao total cargas do molécula ou íon. - Para atribuir a Carga Formal de um átomo é necessário decidir quantos elétrons um átomo possui; * Primeiro Passo: Um átomo possui um elétron de cada par de ligação preso a ele. * Segundo Passo: Um átomo possui seus pares de elétrons isolados completamente; * Terceiro Passo: Conte o número de elétrons atribuídos em um átomo e subtraia o resultado do número de elétrons de valência do átomo livre. Carga Formal: (Elétrons de valência do átomo isolado) – (Elétrons de valência do átomo ligado)

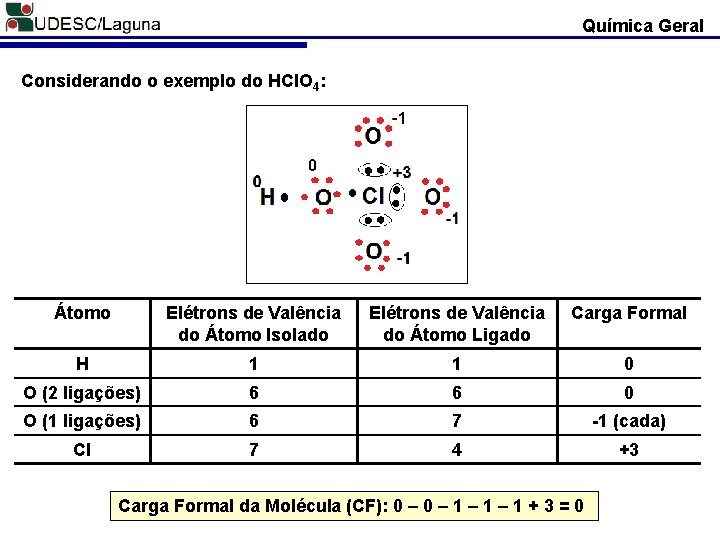
Química Geral Considerando o exemplo do HCl. O 4: Átomo Elétrons de Valência do Átomo Isolado Elétrons de Valência do Átomo Ligado Carga Formal H 1 1 0 O (2 ligações) 6 6 0 O (1 ligações) 6 7 -1 (cada) Cl 7 4 +3 Carga Formal da Molécula (CF): 0 – 1 – 1 + 3 = 0


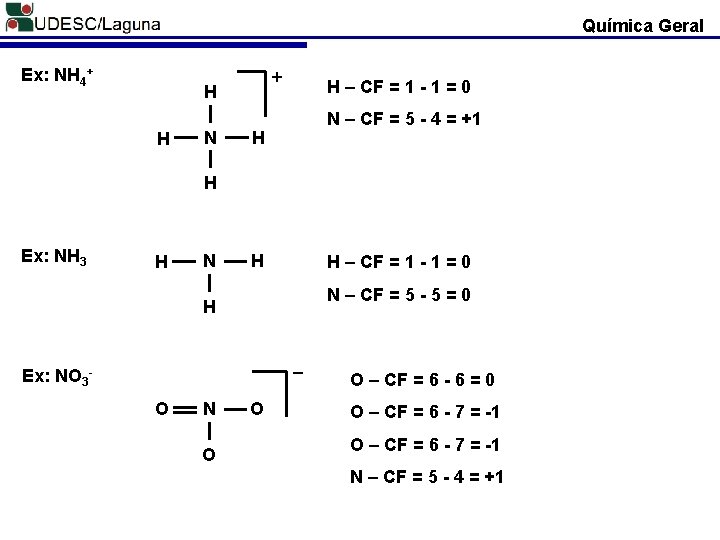
Química Geral Ex: NH 4+ + H H N H – CF = 1 - 1 = 0 N – CF = 5 - 4 = +1 H H Ex: NH 3 H N H H – CF = 1 - 1 = 0 N – CF = 5 - 5 = 0 H _ Ex: NO 3 O N O O O – CF = 6 - 6 = 0 O – CF = 6 - 7 = -1 N – CF = 5 - 4 = +1

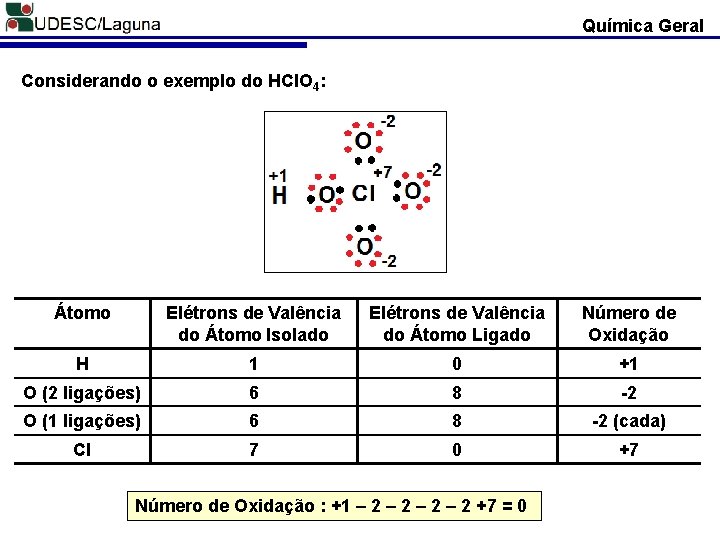
Química Geral 2. Número de Oxidação: Existem dois métodos para se determinar o número de oxidação. - Método 1 - Os elétrons de valência são contados da mesma forma que quando se atribui a carga formal, exceto que ambos os elétrons de ligação são atribuídos ao átomos MAIS ELETRONEGATIVO. Se os dois átomos ligados são o idênticos, o par compartilhado é dividido entre dois, como nas cargas formais.

Química Geral Considerando o exemplo do HCl. O 4: Átomo Elétrons de Valência do Átomo Isolado Elétrons de Valência do Átomo Ligado Número de Oxidação H 1 0 +1 O (2 ligações) 6 8 -2 O (1 ligações) 6 8 -2 (cada) Cl 7 0 +7 Número de Oxidação : +1 – 2 – 2 +7 = 0

Química Geral - Método 2 - Um conjunto de regras foram estabelecidas para determinar o número de oxidação para o segundo método. REGRAS PARA A DETERMINAÇÃO DO NÚMERO DE OXIDAÇÃO: 1 - Flúor nos seus compostos apresenta sempre número de oxidação -1; 2 - Oxigênio nos seus compostos possui número de oxidação -2; Exceções: a. Peróxido e Superóxidos: Estes compostos contém ligações O – O. O número de oxidação peróxido é -1 e nos superóxido é ½; b. Fluoreto de Oxigênio: A regra 1 sempre tem preferência. Em OF 2 e O 2 F 2 os números de oxidação de cada oxigênio são +2 e +1, respectivamente; 3 - Hidrogênio: na maioria dos compostos o número de oxidação é +1; Exceções: Nos hidretos metálicos o valor é -1;

Química Geral 4 - Compostos de elemento do grupo periódico I (metais alcalinos) e II (metais alcalinos terrosos): Este elementos tem seus números de oxidação +1 e +2, respectivamente; Elementos do Grupo III A, quando combinados, geralmente possuem número de oxidação +3; 5 - Na fórmula da substância ou espécie (íon, átomo, molécula), a soma dos números de oxidação de todos os elementos é igual à carga elétrica que aparece com a formula; a. Um átomo de qualquer elemento no estado livre (não combinado) tem número de oxidação igual a zero (0); b. Qualquer íon simples (monoatômico) tem número de oxidação igual a sua carga. c. A soma dos números de oxidação de todos os átomos da fórmula (empírica ou moleculares) para um composto inteiro é igual a zero (0);

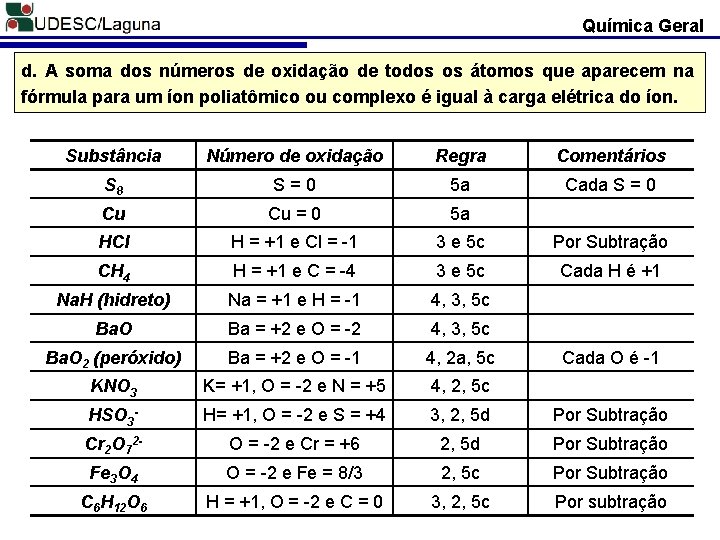
Química Geral d. A soma dos números de oxidação de todos os átomos que aparecem na fórmula para um íon poliatômico ou complexo é igual à carga elétrica do íon. Substância Número de oxidação Regra Comentários S 8 S=0 5 a Cada S = 0 Cu Cu = 0 5 a HCl H = +1 e Cl = -1 3 e 5 c Por Subtração CH 4 H = +1 e C = -4 3 e 5 c Cada H é +1 Na. H (hidreto) Na = +1 e H = -1 4, 3, 5 c Ba. O Ba = +2 e O = -2 4, 3, 5 c Ba. O 2 (peróxido) Ba = +2 e O = -1 4, 2 a, 5 c KNO 3 K= +1, O = -2 e N = +5 4, 2, 5 c HSO 3 - H= +1, O = -2 e S = +4 3, 2, 5 d Por Subtração Cr 2 O 72 - O = -2 e Cr = +6 2, 5 d Por Subtração Fe 3 O 4 O = -2 e Fe = 8/3 2, 5 c Por Subtração C 6 H 12 O 6 H = +1, O = -2 e C = 0 3, 2, 5 c Por subtração Cada O é -1

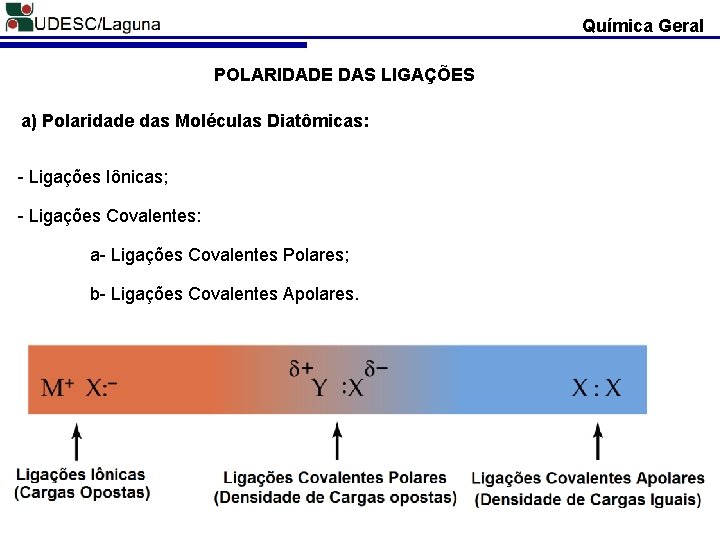
Química Geral POLARIDADE DAS LIGAÇÕES a) Polaridade das Moléculas Diatômicas: - Ligações Iônicas; - Ligações Covalentes: a- Ligações Covalentes Polares; b- Ligações Covalentes Apolares.

Química Geral Em 1939 Linus Pauling estabeleceu o conceito de eletronegatividade. * Com base na definição de eletronegatividade foi possível desenvolver uma regra para determinar se uma ligação química apresenta um caráter iônico ou covalente. * Quando o valor da diferença de eletronegatividade, entre os átomos em uma ligação química, for superior a 1, 7, a Ligação Química apresenta um Caráter Iônico; * Quando o valor da diferença de eletronegatividade, entre os átomos em uma ligação química, for inferior a 1, 7, a Ligação Química apresenta um Caráter Covalente Polar; * Quando o valor da diferença de eletronegatividade, , entre os átomos em uma ligação química, for igual a 0 (zero), a Ligação Química apresenta um Caráter Covalente Apolar;

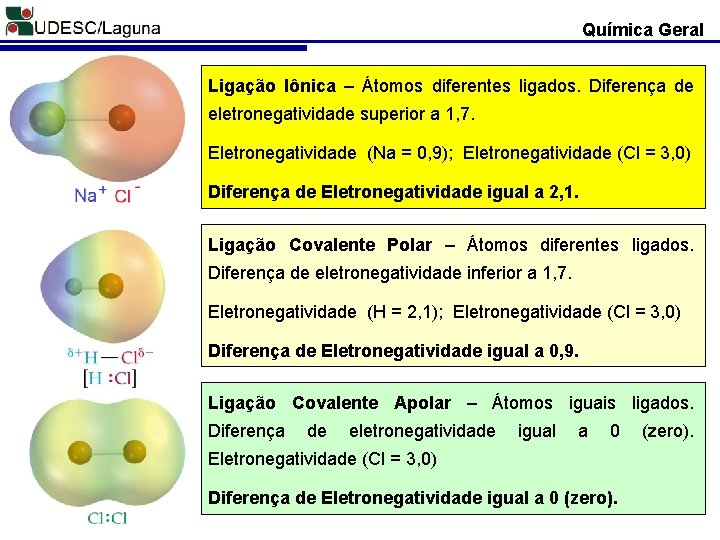
Química Geral Ligação Iônica – Átomos diferentes ligados. Diferença de eletronegatividade superior a 1, 7. Eletronegatividade (Na = 0, 9); Eletronegatividade (Cl = 3, 0) Diferença de Eletronegatividade igual a 2, 1. Ligação Covalente Polar – Átomos diferentes ligados. Diferença de eletronegatividade inferior a 1, 7. Eletronegatividade (H = 2, 1); Eletronegatividade (Cl = 3, 0) Diferença de Eletronegatividade igual a 0, 9. Ligação Covalente Apolar – Átomos iguais ligados. Diferença de eletronegatividade igual a 0 Eletronegatividade (Cl = 3, 0) Diferença de Eletronegatividade igual a 0 (zero).

Química Geral Todas as moléculas diatômicas são polares se suas ligações forem polares; Todas as moléculas diatômicas que são compostas por átomos diferentes são ligeiramente polares; Todas as moléculas diatômicas, homonucleares, tais como: O 2, N 2, Cl 2 F 2. . . , são apolares. Sua ligação química é uma Ligação Covalente Apolar. AS LIGAÇÕES IÔNICAS E COVALENTES SÃO DOIS MODELOS EXTREMOS DE LIGAÇÕES QUÍMICAS. A MAIORIA DAS LIGAÇÕES QUÍMICAS REAIS FICA EM UM LUGAR ENTRE PURAMENTE IÔNICO E PURAMENTE COVALENTE.

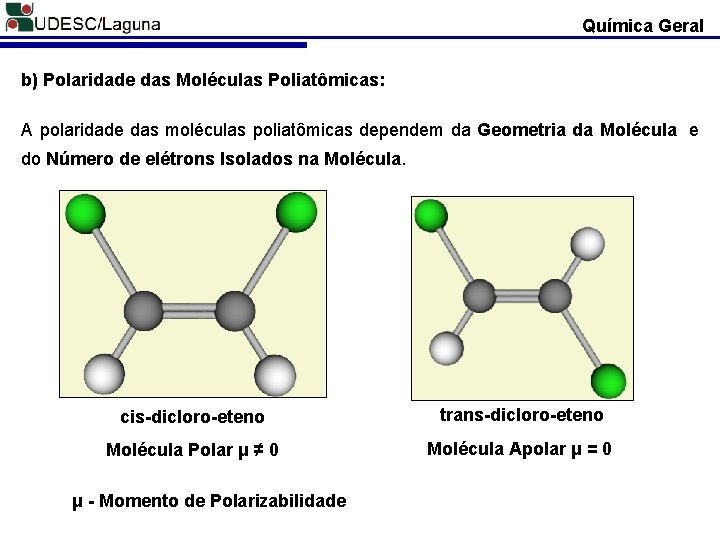
Química Geral b) Polaridade das Moléculas Poliatômicas: A polaridade das moléculas poliatômicas dependem da Geometria da Molécula e do Número de elétrons Isolados na Molécula. cis-dicloro-eteno trans-dicloro-eteno Molécula Polar μ ≠ 0 Molécula Apolar μ = 0 μ - Momento de Polarizabilidade