Introduo ao conceito de reao Qumica Disciplina Qumica
























- Slides: 31

Introdução ao conceito de reação Química Disciplina: Química Professor: Rubens Barreto Unidade: I

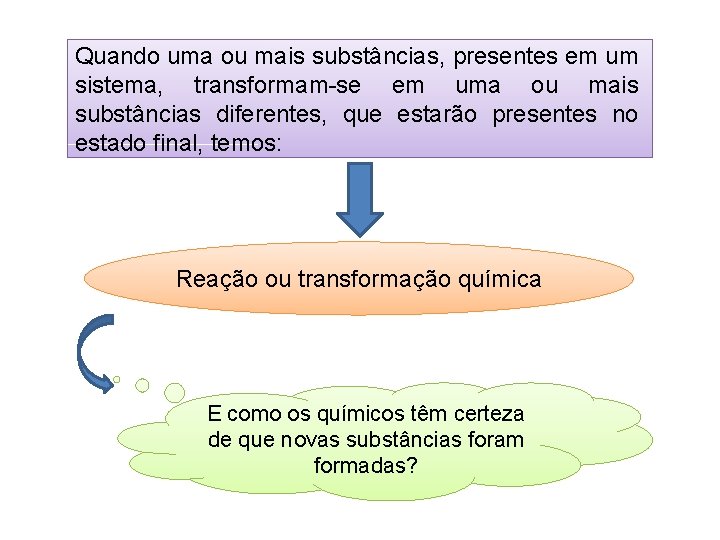
Quando uma ou mais substâncias, presentes em um sistema, transformam-se em uma ou mais substâncias diferentes, que estarão presentes no estado final, temos: Reação ou transformação química E como os químicos têm certeza de que novas substâncias foram formadas?

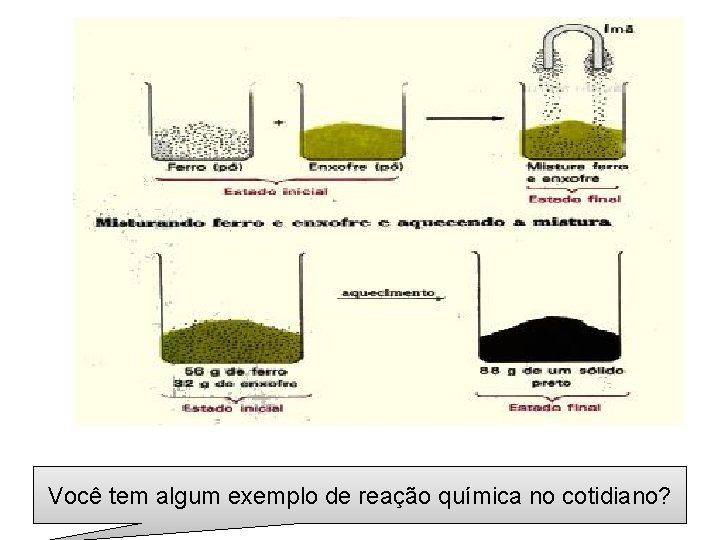
Exemplos de reação química Combustão do etanol + oxigênio → gás carbônico + água reagentes produtos Reação entre o ferro e o enxofre + ferro → sulfeto ferroso reagentes produto

Você tem algum exemplo de reação química no cotidiano?

Como saber se uma reação ocorreu? • Mudança de cor • Formação de gases • Formação de preciptado • Alteração de temperatura • Mudança de odor

A vida na terra é resultado de uma série de reações químicas

Reações de decomposição – Uma única substância reagente origina como produto duas ou mais substâncias. Exemplos: Decomposição do peróxido de hidrogênio → água + gás oxigênio *A água oxigenda sofre fotólise. luz Decomposição do carbonato de cálcio → óxido de cálcio + gás carbônico calor *O carbonato de cálcio sofre pirólise

A decomposição da água A água sofre eletrólise

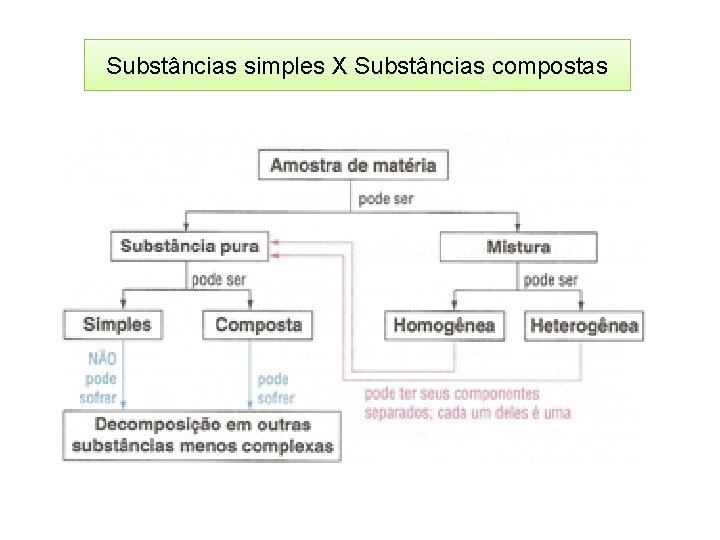
Substâncias simples X Substâncias compostas

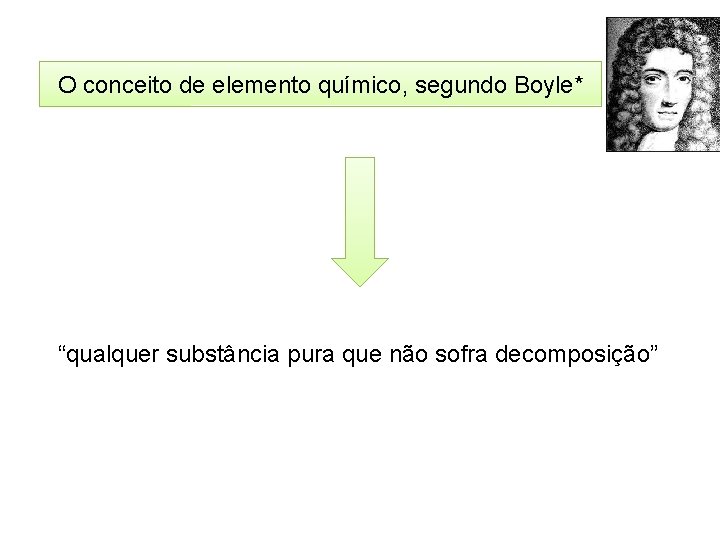
O conceito de elemento químico, segundo Boyle* “qualquer substância pura que não sofra decomposição”

A lei da conservação da massa A lei de Lavoisier – No interior de um recipiente fechado, a massa total não varia, quais quer que sejam as transformações que venham a ocorrer. Ou seja, a soma das massas antes da reação é igual à soma das massas após a reação. 66

Na natureza, nada se perde, nada se cria; a matéria apenas se transforma. Exemplo: Verifica-se que 3 gramas de carbono reage com 8 gramas de oxigênio, produzindo 11 gramas de gás carbônico.

A figura ilustra uma possibilidade de se testar a Lei de Lavoisier num procedimento simples : 67

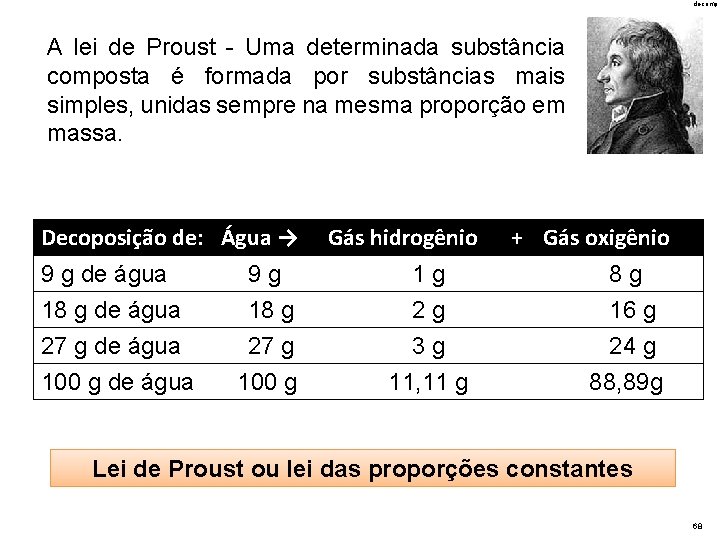
PROUST


decomp A lei de Proust - Uma determinada substância composta é formada por substâncias mais simples, unidas sempre na mesma proporção em massa. Decoposição de: Água → Gás hidrogênio + Gás oxigênio 9 g de água 18 g de água 27 g de água 9 g 18 g 27 g 1 g 2 g 3 g 8 g 16 g 24 g 100 g de água 100 g 11, 11 g 88, 89 g Lei de Proust ou lei das proporções constantes 68

Proust concluiu que a composição química das substâncias compostas é sempre constante, não importando qual a sua origem. As leis de Lavoisier e a de Proust, são denominadas leis ponderais, por que falam em massa das substâncias envolvidas. Elas marcam o nascimento da Química como ciência.


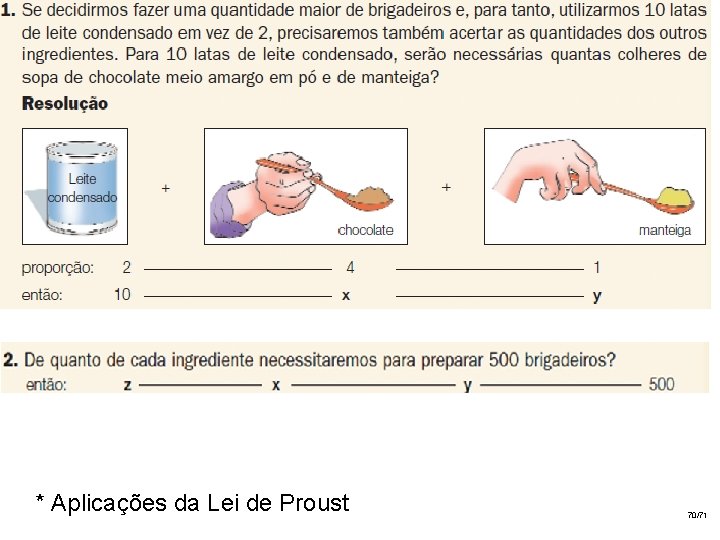
* Aplicações da Lei de Proust 70/71

Exercícios do livro Página: 71 Atividades: 5, 6, 7 e 8 Página: 76 Atividades 18, 19 e 20

Propriedades da Matéria A matéria apresenta várias propriedades que são classificadas em gerais, funcionais e específicas. I. Propriedades Gerais da Matéria São comuns a toda e qualquer espécie de matéria, independentemente da substância de que ela é feita. As principais são: massa, extensão, impenetrabilidade, divisibilidade, compressibilidade e elasticidade.

• Massa - Todos os corpos possuem massa. • Extensão - Todos os corpos ocupam lugar no espaço. • Impenetrabilidade - Dois corpos não ocupam, ao mesmo tempo, um mesmo lugar no espaço. • Divisibilidade - Os corpos podem ser divididos em partes cada vez menores.

• Compressibilidade - Os corpos possuem a propriedade de poder diminuir de tamanho, sob a ação de forças externas. • Elasticidade - Os corpos possuem a propriedade de voltar à forma e volume originais, cessada a causa que os deformou.

II. Propriedades Funcionais da Matéria São propriedades observadas somente em determinados grupos de matéria. Esses grupos são chamados funções químicas, e as principais são: ácidos, bases, sais e óxidos que serão estudados oportunamente.

III. Propriedades Específicas da Matéria São propriedades que permitem identificar uma determinada espécie de matéria. Dentre as propriedades específicas, podemos citar: – Propriedades físicas: ponto de fusão, ponto de ebulição, densidade. – Propriedades organolépticas: odor, sabor. – Propriedades químicas: reações químicas.

Explicando as variações de energia que acompanham as transformações materiais Durante os fenômenos físicos e químicos, podemos notar a liberação ou absorção de energia. Energia térmica (calor) • liberada na queima do carvão. • Absorvida para evaporar a água. Energia luminosa (luz) • liberada na combustão de uma vela • Absorvida na fotossíntese dos vegetais Energia elétrica (eletricidade) • liberada numa pilha elétrica. • Absorvida na carga de uma bateria de celular

Os fenômenos que liberam energia são chamados de exotérmicos e os que absorvem energia são denominados endotérmicos.

Contabilidade durante uma reação química: • existe uma certa quantidade de energia armazenada (energia potencial) no interior das moléculas inicias (reagentes); • quando as moléculas iniciais são quebradas (durante as reações químicas), essa energia é liberada; • no entanto, gasta-se energia para formar as moléculas finais (produtos); • O saldo de energia é a energia que a reação química irá liberar ou deverá receber. . .

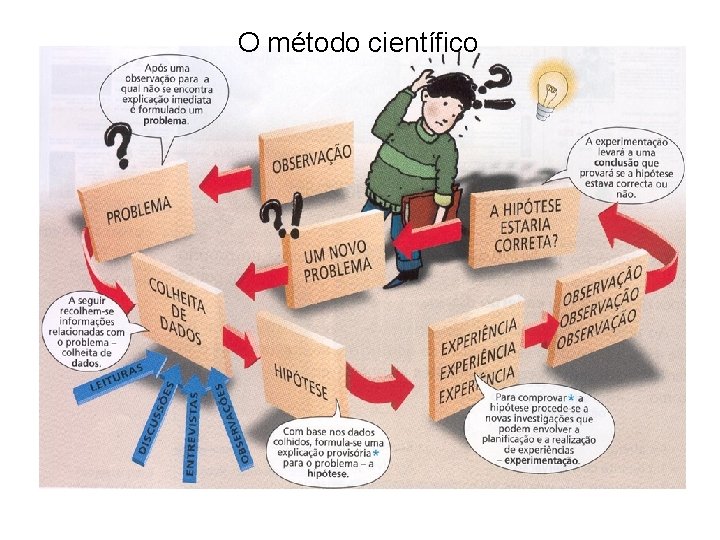
O método científico

Exercícios: 1. Dentre os fenômenos abaixo, quais são os que liberam e quais os que consomem energia? (a) queima de gasolina (b) evaporação do álcool (c) derretimento do gelo (d) Explosão da pólvora (e) Subida de um foguete

2. Nos sistemas mencionados abaixo, ocorrem transformações de um tipo de energia em outro. Mencione quais são as transformações principais no funcionamento de: (a) Uma bateria de automóvel; (b) Uma lâmpada elétrica; (c) Motor a explosão; (d) Uma turbina elétrica.
 Conceito de processo e o conceito de thread
Conceito de processo e o conceito de thread Disciplina operativa pemex
Disciplina operativa pemex Upravljanje razredom
Upravljanje razredom Definición de disciplina
Definición de disciplina Disciplina operacional
Disciplina operacional La quinta disciplina
La quinta disciplina Peter senge 1990 the fifth discipline
Peter senge 1990 the fifth discipline Parenhimska tkiva
Parenhimska tkiva Sportska disciplina
Sportska disciplina Disciplina teletransmitida
Disciplina teletransmitida Contabilidad es la disciplina que enseña las normas
Contabilidad es la disciplina que enseña las normas El orden y la disciplina
El orden y la disciplina Literatura disciplina
Literatura disciplina Quinta disciplina pensamiento sistemico
Quinta disciplina pensamiento sistemico Disciplina edm
Disciplina edm Disciplina externa
Disciplina externa Lcp disciplina
Lcp disciplina Disciplina virtude
Disciplina virtude Literatura disciplina
Literatura disciplina Conditii interne ale invatarii in gradinita
Conditii interne ale invatarii in gradinita Disciplina pozitiva
Disciplina pozitiva Como se disciplina a un pastor
Como se disciplina a un pastor Cuál es la importancia de estudios sociales
Cuál es la importancia de estudios sociales Strofa je
Strofa je Etika kao filozofska disciplina
Etika kao filozofska disciplina Acorde disciplina
Acorde disciplina Leyes de la quinta disciplina
Leyes de la quinta disciplina Elementos de la disciplina
Elementos de la disciplina Etapa adisciplinar
Etapa adisciplinar O que é a vara da disciplina
O que é a vara da disciplina Disciplina mercado financeiro
Disciplina mercado financeiro Caracteristica de la disciplina
Caracteristica de la disciplina






















































