Reaes Qumicas Introduo Componentes Tipos de reaes Reao









- Slides: 17

Reações Químicas §Introdução; §Componentes; §Tipos de reações;

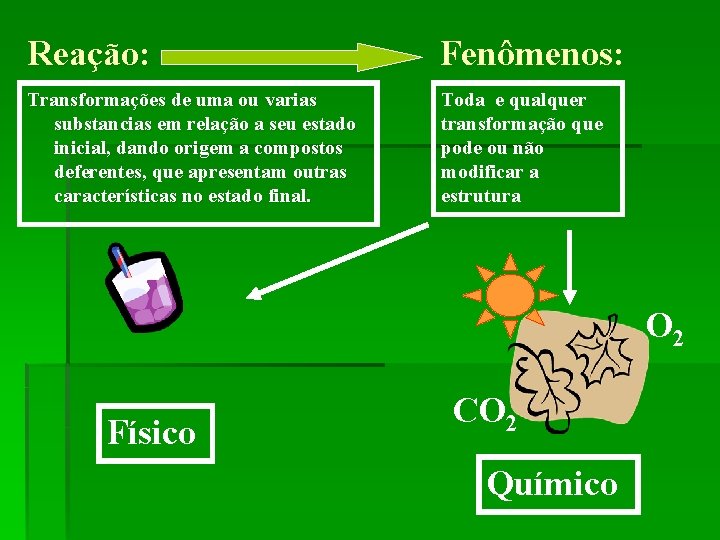
Reação: Fenômenos: Transformações de uma ou varias substancias em relação a seu estado inicial, dando origem a compostos deferentes, que apresentam outras características no estado final. Toda e qualquer transformação que pode ou não modificar a estrutura O 2 Físico CO 2 Químico

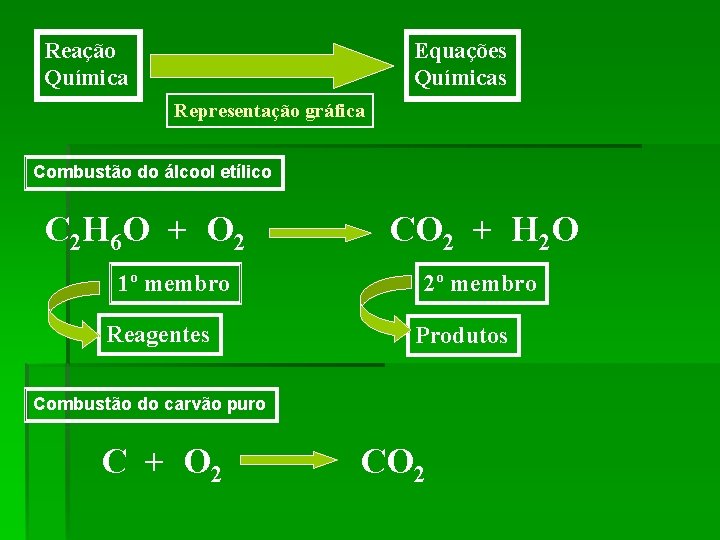
Reação Química Equações Químicas Representação gráfica Combustão do álcool etílico C 2 H 6 O + O 2 1º membro Reagentes CO 2 + H 2 O 2º membro Produtos Combustão do carvão puro C + O 2 CO 2

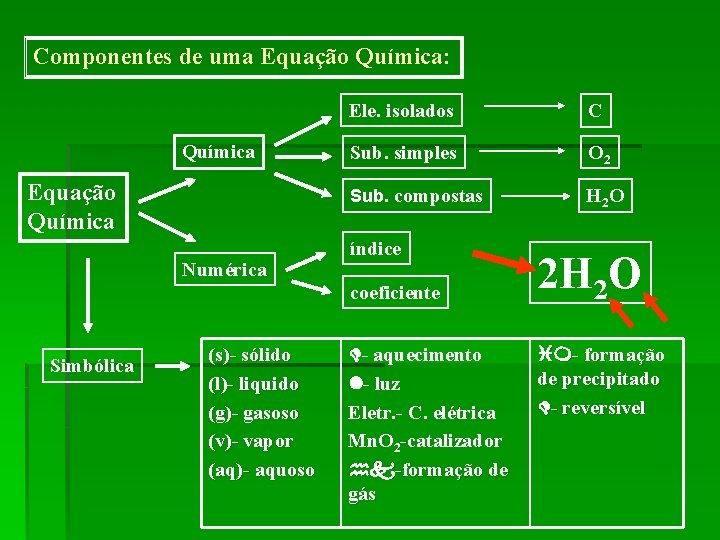
Componentes de uma Equação Química: Química Equação Química Numérica Ele. isolados C Sub. simples O 2 Sub. compostas H 2 O índice coeficiente Simbólica (s)- sólido (l)- liquido (g)- gasoso (v)- vapor (aq)- aquoso - aquecimento - luz Eletr. - C. elétrica Mn. O 2 -catalizador -formação de gás 2 H 2 O - formação de precipitado - reversível

Balanceamento de equações (parte inicial) – cálculo de massa Repetem cada elementos químicos de uma molécula Índices CO 2 Ca. CO 3 Al(OH)3 Al 2(SO 4)3 Obs: elementos em C =1 O=2 Ca=1 C=1 O=3 Coeficiente: Al=1 O=3 (1 x 3) H=3 (1 x 3) Al=2 S=3 (3 x 1) O=12 (4 x 3) Repetem a molécula completa perenteses devem ser multiplicados pelo índice que fica no lado de fora 3 H 2 O 2 Bi 2 O 3 3 Cu(OH)2 4 Ca 3(PO 4)2 H =2 x 3 =6 O =1 x 3=3 Bi =2 x 2=4 O =3 x 2=6 Cu =1 x 3=3 O =2 x 3=6 H =2 x 3=6 Ca =3 x 4=12 P =2 x 4=8 O =4 x 2=8 x 4=32

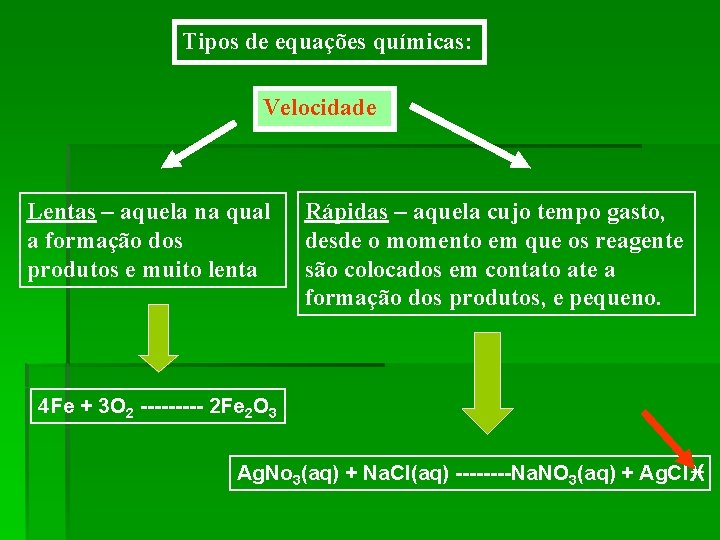
Tipos de equações químicas: Velocidade Lentas – aquela na qual a formação dos produtos e muito lenta Rápidas – aquela cujo tempo gasto, desde o momento em que os reagente são colocados em contato ate a formação dos produtos, e pequeno. 4 Fe + 3 O 2 ----- 2 Fe 2 O 3 Ag. No 3(aq) + Na. Cl(aq) ----Na. NO 3(aq) + Ag. Cl

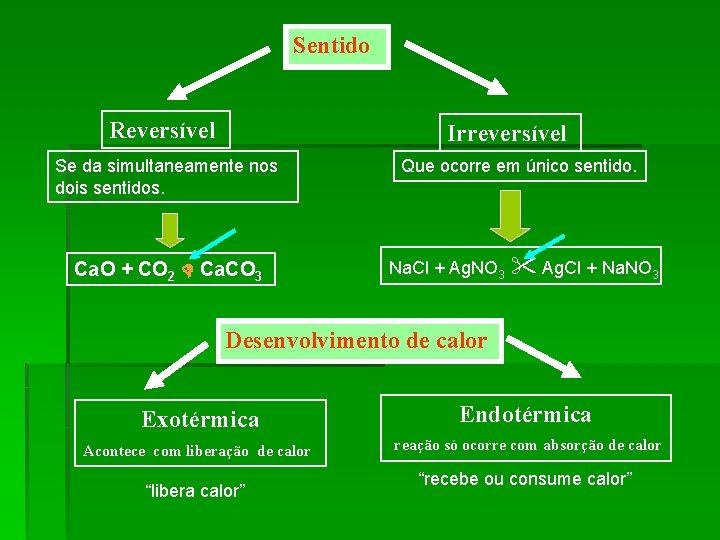
Sentido Reversível Irreversível Se da simultaneamente nos dois sentidos. Que ocorre em único sentido. Ca. O + CO 2 Ca. CO 3 Na. Cl + Ag. NO 3 Ag. Cl + Na. NO 3 Desenvolvimento de calor Exotérmica Endotérmica Acontece com liberação de calor reação só ocorre com absorção de calor “libera calor” “recebe ou consume calor”

Toda reação ocorre com absorção ou liberação de calor. Essa energia e dada pela unidade caloria por mol(cal/mol) Exotérmica C + O 2 CO 2 ; H = -94. 100 cal Endotérmica N 2 + O 2 2 NO; H = +21. 600 cal Natureza das substancias Combinação (síntese ou associação) A + B AB Decomposição (analise ou dissociação) AB A + B Deslocamento (simples troca) A B + C AC + B Substituição (dupla-troca) AB + CD AC + BD

Pratique: Exercícios para fazer em sala Cl 2 + Mg. Br 2 Mg. Cl 2 + Br 2 Simples troca 2 HI H 2 + I 2 analise C + O 2 CO 2 Síntese 2 Al + 6 HCl 2 Al. Cl 3 + 3 H 2 Simples troca Na. OH + HCl Na. Cl + H 2 O Dupla troca 6 C + 6 H 2 + 3 O 2 C 6 H 12 O 6 Síntese Ca. O + H 2 O Ca(OH)2 Síntese Ag. NO 3 + Na. Cl Ag. Cl + Na. NO 3 Dupla troca 6 C + 6 H 2 + 3 O 2 C 6 H 12 O 6 Síntese

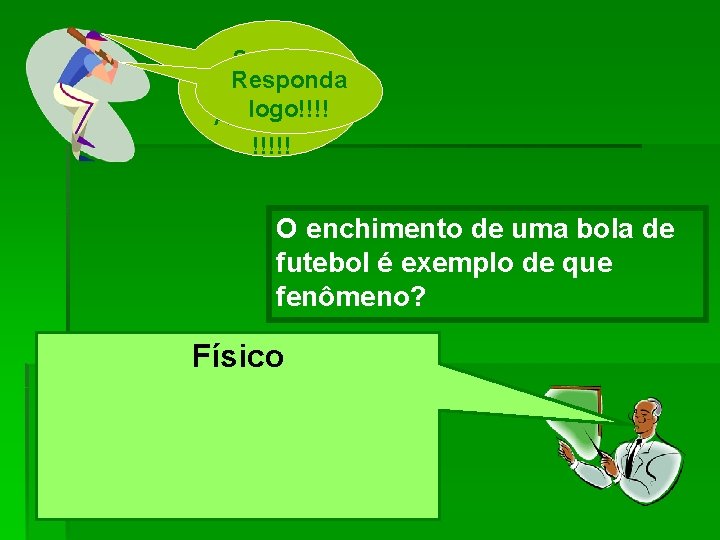
Segura Responda essa logo!!!! Atividade! !!!!! O enchimento de uma bola de futebol é exemplo de que fenômeno? Físico

Segura Responda essa logo!!!! Atividade! !!!!! Qual o nome das duas partes de uma equação química? Reagentes e produtos

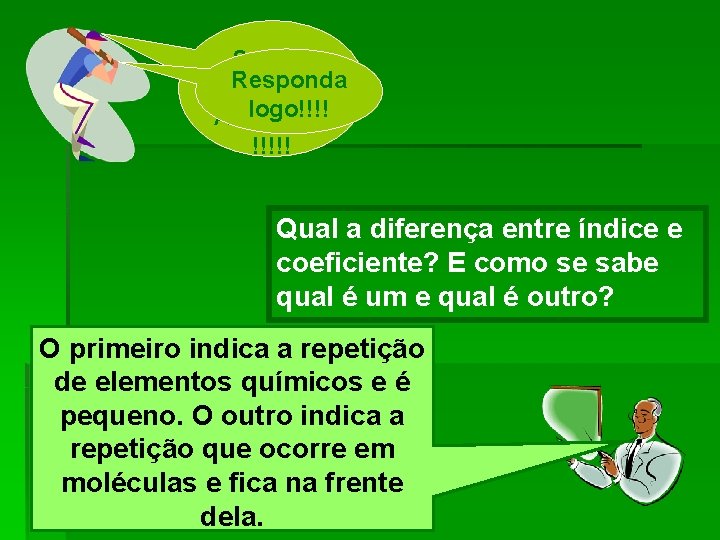
Segura Responda essa logo!!!! Atividade! !!!!! Qual a diferença entre índice e coeficiente? E como se sabe qual é um e qual é outro? O primeiro indica a repetição de elementos químicos e é pequeno. O outro indica a repetição que ocorre em moléculas e fica na frente dela.

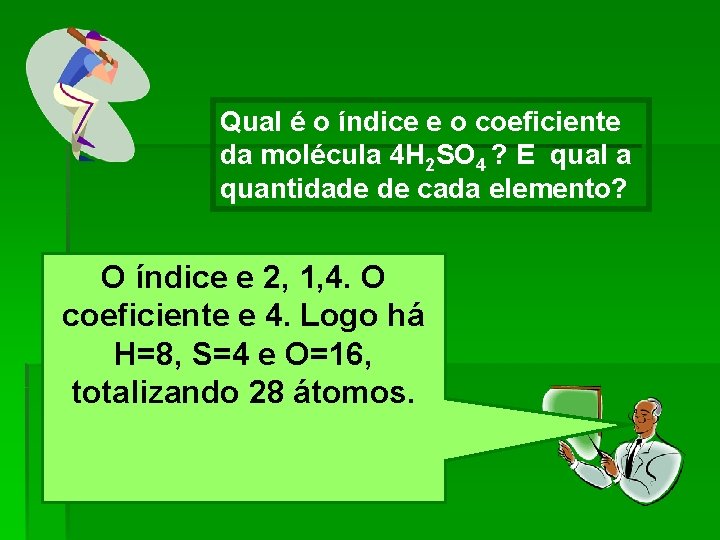
Qual é o índice e o coeficiente da molécula 4 H 2 SO 4 ? E qual a quantidade de cada elemento? O índice e 2, 1, 4. O coeficiente e 4. Logo há H=8, S=4 e O=16, totalizando 28 átomos.

Qual a característica mais comum em reações rápidas? Presença de um símbolo que indica a formação de precipitado ou a seta para baixo.

Que tipo de reação consume energia em sua realização? Endotérmica

A união de duas substancias e tem como produto uma única substancia, e o tipo de reação chamada de que? Combinação ou síntese

Obrigado pela atenção!!!! Qualquer duvida procure o professor
 Qumicas
Qumicas Componentes componentes
Componentes componentes Que es el bolo alimenticio
Que es el bolo alimenticio Componentes de los nucleótidos
Componentes de los nucleótidos Componentes componentes
Componentes componentes Texto explicativo
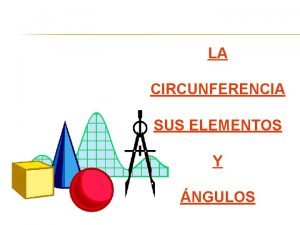
Texto explicativo Elementos de una circunferencia
Elementos de una circunferencia Celulas estrelladas
Celulas estrelladas Deflactor del pib ejemplo
Deflactor del pib ejemplo Tipos de ecosistemas terrestres
Tipos de ecosistemas terrestres Componentes de un si
Componentes de un si Turbina kaplan componentes
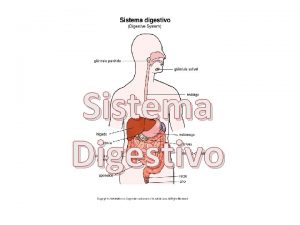
Turbina kaplan componentes Componentes del cuerpo
Componentes del cuerpo Componentes del periodonto de proteccion
Componentes del periodonto de proteccion Miocardiopatias clasificacion
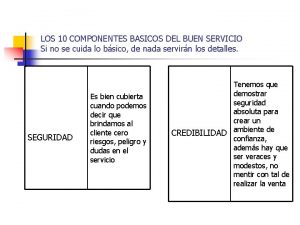
Miocardiopatias clasificacion Componentes básicos del buen servicio ejemplos
Componentes básicos del buen servicio ejemplos Motherboard componentes
Motherboard componentes Componentes basicos de una computadora
Componentes basicos de una computadora