TIPOS DE REACCIONES QUMICAS Q U M I






- Slides: 7

TIPOS DE REACCIONES QUÍMICAS Q U Í M I C A 1 º M E D I O C O L E G I O A L T A S C U M B R E S P U E R T O V A R A S P R O F E S O R : A L E J A N D R O R U B I O O R T I Z

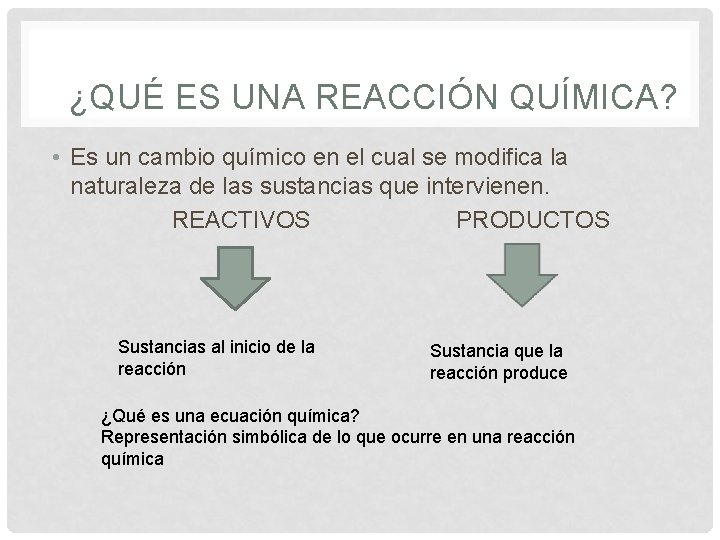
¿QUÉ ES UNA REACCIÓN QUÍMICA? • Es un cambio químico en el cual se modifica la naturaleza de las sustancias que intervienen. REACTIVOS PRODUCTOS Sustancias al inicio de la reacción Sustancia que la reacción produce ¿Qué es una ecuación química? Representación simbólica de lo que ocurre en una reacción química

CLASIFICACIÓN DE REACCIONES QUÍMICAS Reacciones de combustión: La combustión es un proceso químico por el cual una sustancia llamada combustible, reacciona con el oxígeno. Esta reacción es exotérmica, es decir, libera calor, luz o sonido. Durante la combustión los compuestos que contienen carbono, hidrógeno y a veces oxígeno, arden en el aire (consumiendo oxígeno produciendo CO 2 y H 2 O Para que se inicie es necesaria un poco de energía. Ejemplo: combustión del carbono (carbón vegetal o mineral) C + O 2 → CO 2 dióxido de carbono Si la combustión se realiza con poco oxígeno ocurre lo siguiente: C + O 2 → CO monóxido de carbono Un gas venenoso y peligroso

Reacciones de combinación (Síntesis): sucede cuando un elemento reacciona o se combina con otro elemento para formar un compuesto, es decir, se ha sintetizado un nuevo compuesto. Forma general A + B → AB Ejemplo: reacción de nitrógeno gaseoso con hidrógeno gaseoso para producir amoniaco gaseoso. N 2 + 3 H 2 → 2 NH 3 Recuerde que el número delante del símbolo o compuesto representa un número de moléculas o moles, y es porque la ecuación química debe estar igualada en cantidades de sustancia en reactantes y productos.

Reacciones de descomposición: Reacciones donde un compuesto se convierte en dos o más sustancias sencillas. Forma general AB → A `+ B En la electrólisis del agua, esta se descompone en sus elementos 2 H 2 O → 2 H 2 +O 2

Reacciones de sustitución simple: Una sustancia desplaza a otra de sus compuestos. Forma general Ejemplo : A + BC → AC A + BC → AB metal activo + agua → Na + H 2 O + + B cuando A es metal C cuando A es no metal Hidróxido metálico + Hidrógeno → Na. OH + H 2

Reacción de doble sustitución: Intercambio de los iones de un compuesto, con los iones de otro compuesto para formar dos sustancias diferentes. Forma general AB + Intercambian compañeros Ejemplo: H 2 SO 4 + Na 2 S CD → → Na 2 SO 4 AD + + BC H 2 S












