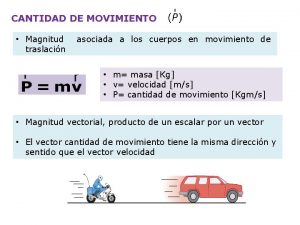
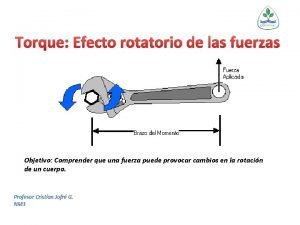
Fuerzas Qumicas Fuerzas Qumicas Las fuerzas qumicas se











































- Slides: 68

Fuerzas Químicas

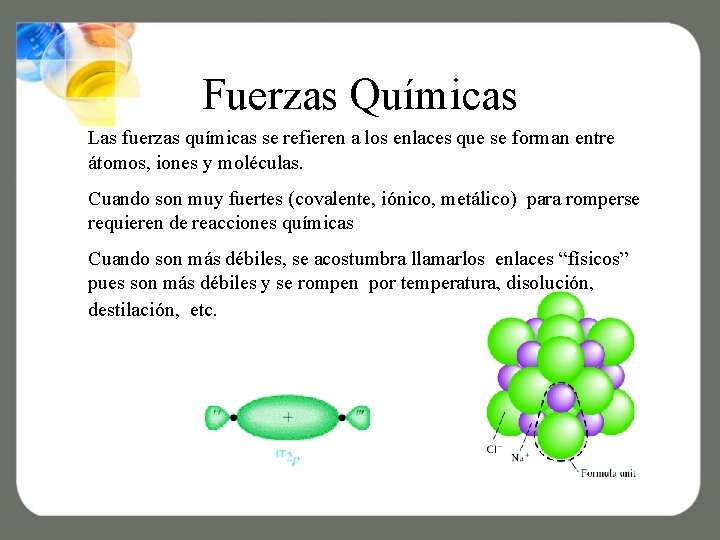
Fuerzas Químicas Las fuerzas químicas se refieren a los enlaces que se forman entre átomos, iones y moléculas. Cuando son muy fuertes (covalente, iónico, metálico) para romperse requieren de reacciones químicas Cuando son más débiles, se acostumbra llamarlos enlaces “físicos” pues son más débiles y se rompen por temperatura, disolución, destilación, etc.

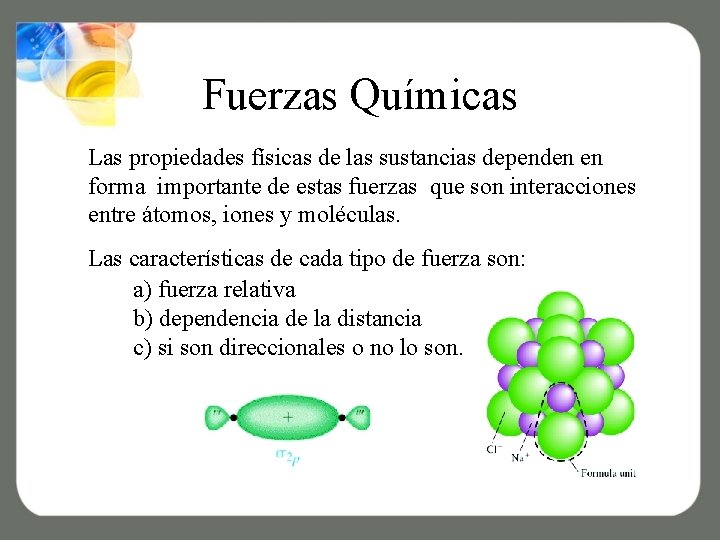
Fuerzas Químicas Las propiedades físicas de las sustancias dependen en forma importante de estas fuerzas que son interacciones entre átomos, iones y moléculas. Las características de cada tipo de fuerza son: a) fuerza relativa b) dependencia de la distancia c) si son direccionales o no lo son.

• Los enlaces químicos son metálicos, iónicos y covalentes, y las interacciones se denominan puentes de hidrógeno, de van der Waals y London • Los radios más utilizados son los metálicos, iónicos, covalentes, y van der Waals (Lenard Jones y cristalino)

• La distancia es uno de los parámetros más importantes para determinar el tipo y fuerza del enlace. • La distancia y el radio de un elemento se calcula, generalmente, cuando está formando un compuesto. Por lo tanto, este parámetro depende del tipo de enlace y el ambiente en que se encuentra el elemento. Los enlaces pueden ser metálicos, iónicos o covalentes, o interacciones polares, como son las fuerzas de van der Waals o puentes de hidrógeno. El radio, por lo tanto, se ve influenciado por el tipo de enlace

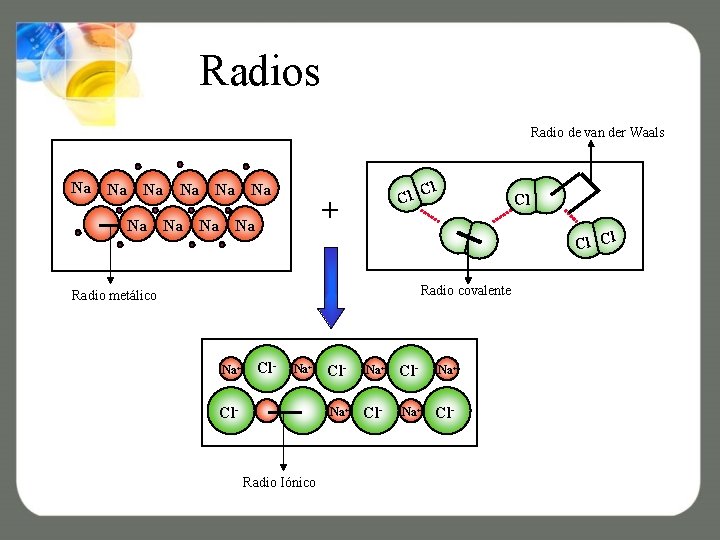
Radios Los radios más comunes son: covalente, iónico, metálico y de van der Waals,

Radios Radio de van der Waals Na Na Na Cl l C + Na Cl l Cl C Radio covalente Radio metálico Na+ Cl- Radio Iónico Cl- Na+ Na+ Cl-

Radio Covalente El radio covalente de un atómo X se calcula en su molécula homonuclear (X 2). Cuando se utilizan para calcular los radios del mismo elemento en una molécula heteronuclear, las distancias obtenidas son menores a las experimentales. Esto se debe a la diferencia de electronegatividad que aporta un factor de enlace iónico que disminuye la distancia r. AB = r. A + r. B – 9 = diferencia de electronegatividad

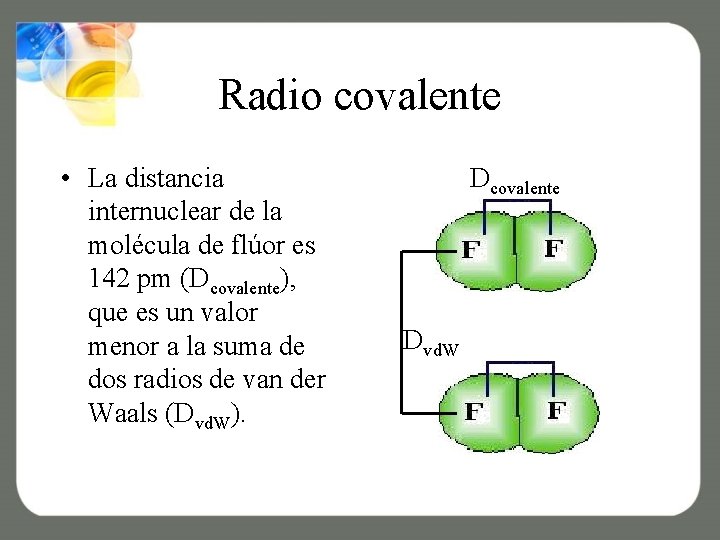
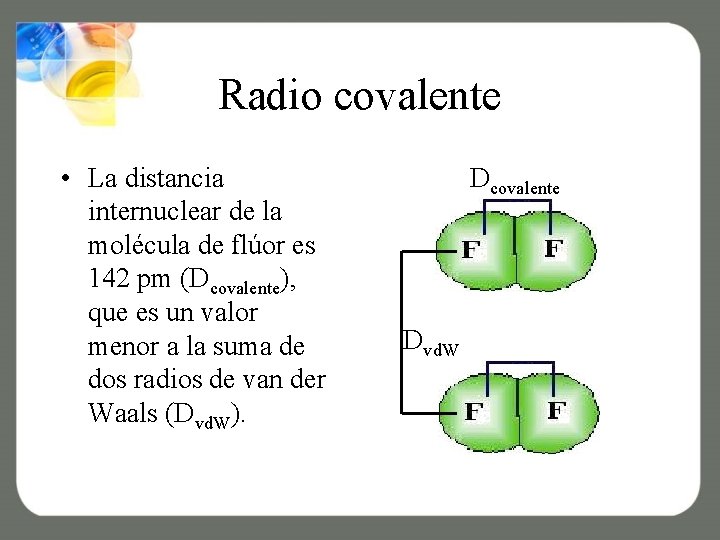
Radio covalente • La distancia internuclear de la molécula de flúor es 142 pm (Dcovalente), que es un valor menor a la suma de dos radios de van der Waals (Dvd. W). Dcovalente Dvd. W

Radio covalente • La distancia internuclear de la molécula de flúor es 142 pm (Dcovalente), que es un valor menor a la suma de dos radios de van der Waals (Dvd. W). Dcovalente Dvd. W

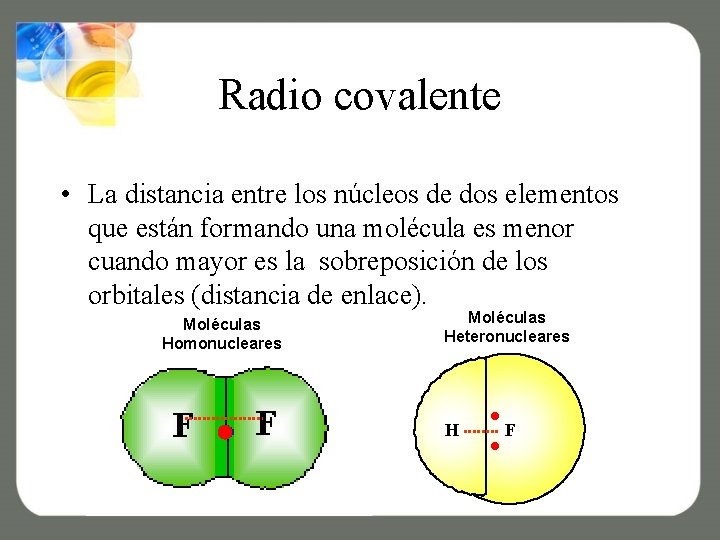
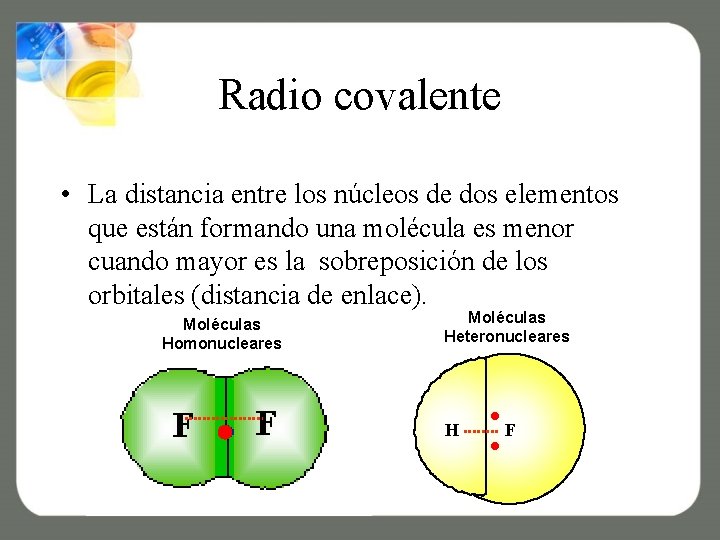
Radio covalente • La distancia entre los núcleos de dos elementos que están formando una molécula es menor cuando mayor es la sobreposición de los orbitales (distancia de enlace). Moléculas Homonucleares Moléculas Heteronucleares H F

Radio covalente • La distancia entre los núcleos de dos elementos que están formando una molécula es menor cuando mayor es la sobreposición de los orbitales (distancia de enlace). Moléculas Homonucleares Moléculas Heteronucleares H F

Radio Covalente El radio covalente de un atómo X se calcula en su molécula homonuclear (X 2). Cuando se utilizan para calcular los radios del mismo elemento en una molécula heteronuclear, las distancias obtenidas son menores a las experimentales. Esto se debe a la diferencia de electronegatividad que aporta un factor de enlace iónico que disminuye la distancia r. AB = r. A + r. B – 9 = diferencia de electronegatividad

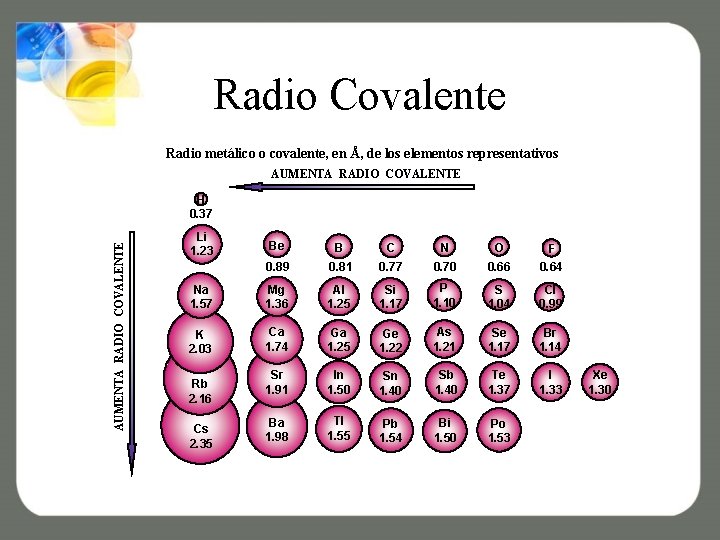
Radio Covalente Radio metálico o covalente, en Å, de los elementos representativos AUMENTA RADIO COVALENTE H 0. 37 Li 1. 23 Be B C N O 0. 89 0. 81 0. 77 0. 70 0. 66 F 0. 64 Na 1. 57 Mg 1. 36 Al 1. 25 Si 1. 17 P 1. 10 S 1. 04 Cl 0. 99 K 2. 03 Ca 1. 74 Ga 1. 25 Ge 1. 22 As 1. 21 Se 1. 17 Br 1. 14 Sr 1. 91 In 1. 50 Sn 1. 40 Sb 1. 40 Te 1. 37 I 1. 33 Ba 1. 98 Tl 1. 55 Pb 1. 54 Bi 1. 50 Po 1. 53 Rb 2. 16 Cs 2. 35 Xe 1. 30

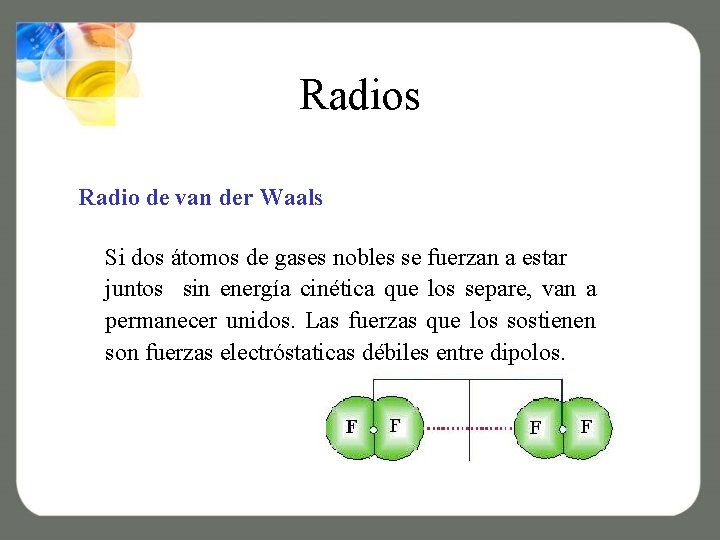
Radios Radio de van der Waals Si dos átomos de gases nobles se fuerzan a estar juntos sin energía cinética que los separe, van a permanecer unidos. Las fuerzas que los sostienen son fuerzas electróstaticas débiles entre dipolos.

Diferencias de Radios Radio de van der Waals Si dos átomos de gases nobles se fuerzan a estar juntos sin energía cinética que los separe, van a permanecer unidos. Siendo las fuerzas electróstaticas débiles entre dipolos las que los matienen unidos.

Diferencias de Radios Radio de van der Waals La distancia internuclear promueve el equilibrio de las fuerzas de atracción con las fuerzas de repulsión de Pauli entre las capas electrónicas. Cuando las dos moléculas son idénticas, la mitad de la distancia entre ellas se denomina radio de van der Waals o radio de no enlace.

Diferencias de Radios La distancia internuclear promueve el equilibrio de las fuerzas de atracción con las fuerzas de repulsión de Pauli entre las capas electrónicas. Cuando las dos moléculas son idénticas, la mitad de la distancia entre ellas se denomina radio de van der Waals o radio de no enlace.

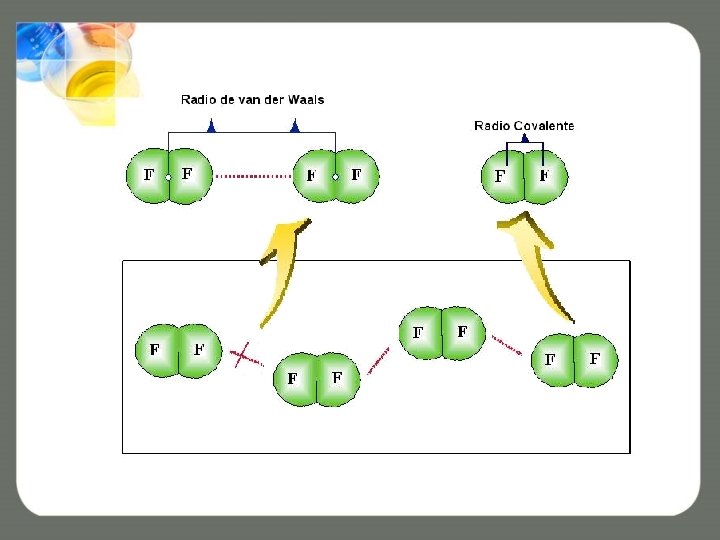
Radio de van der Waals • Las interacciones entre las moléculas son más débiles y las distancias mayores (de no enlace). Y a ese radio se le conoce como de van der Waals. • A continuación se muestran varias moléculas de F 2 (covalentes), las cuales presentan una distancia entre los núcleos de sus átomos conocida como radio covalente y, fuerzas de unión entre las moléculas, llamadas de van der Waals.


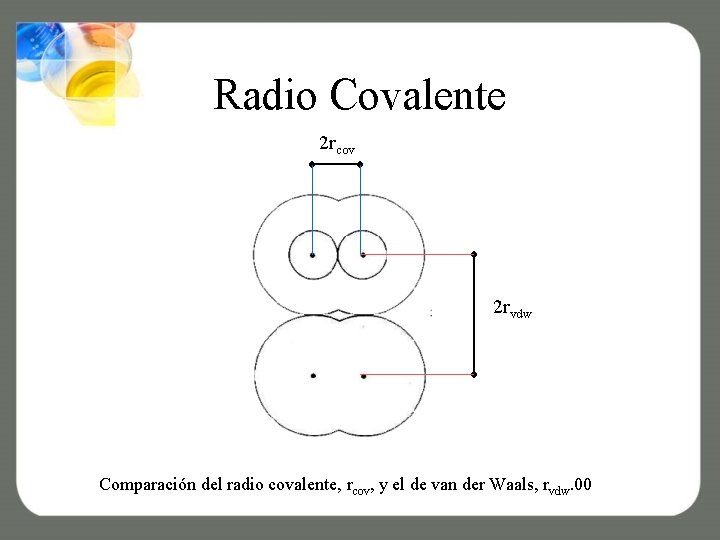
Radio Covalente 2 rcov 2 rvdw Comparación del radio covalente, rcov, y el de van der Waals, rvdw. 00

Diferencias de Radios Cuando se trabaja con gases, especialmente los nobles, a menudo conviene utilizar en lugar del radio de van der Waals el llamado radio de Lennar Jones, que es la mitad de la distancia del máximo acercamiento de dos moléculas cuya energía cinética depende sólo de las fuerzas de atracción entre ellas. De esta manera se pueden manejar unidades más pequeñas, ya que las distancias entre moléculas de gases nobles son grandes debido a que las fuerzas externas de compresión son débiles.

Diferencia entre el radio de van der Waals y de Lennar Jones. r. LJ r. VDW distancia EEq energía

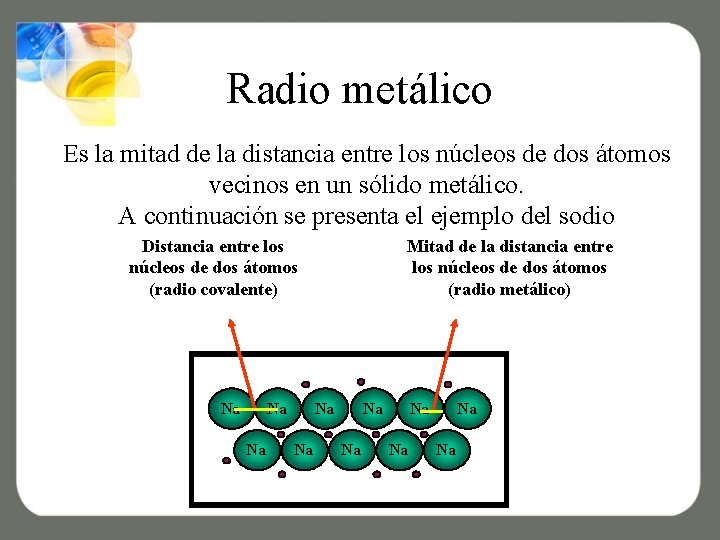
Radio metálico Es la mitad de la distancia entre los núcleos de dos átomos vecinos en un sólido metálico. A continuación se presenta el ejemplo del sodio Distancia entre los núcleos de dos átomos (radio covalente) Na Na Na Mitad de la distancia entre los núcleos de dos átomos (radio metálico) Na Na

Radio iónico • Es la distancia entre el centro del núcleo del ión y el electrón estable más alejado del mismo. • Ya que no se puede conocer, el lugar exacto donde se localiza dicho electrón, se utiliza la densidad electrónica mínima para definir el sitio en que se ubica la frontera entre un ión y el contra ion.

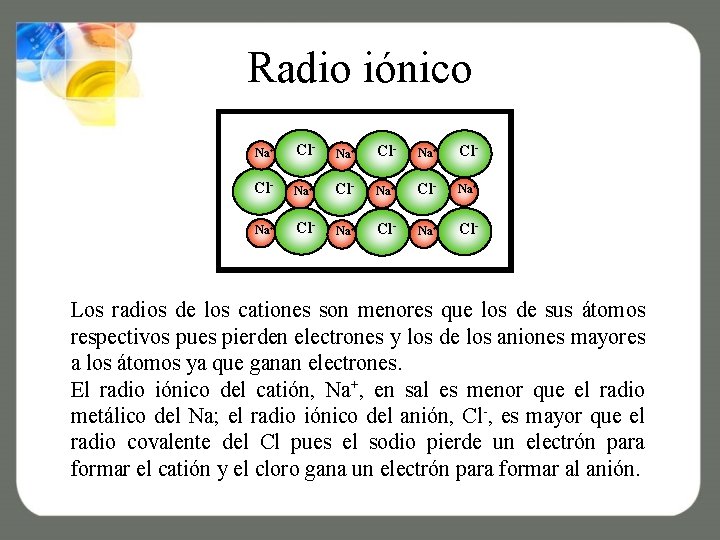
Radio iónico Na+ Cl- Na+ Cl- Na+ Cl- Los radios de los cationes son menores que los de sus átomos respectivos pues pierden electrones y los de los aniones mayores a los átomos ya que ganan electrones. El radio iónico del catión, Na+, en sal es menor que el radio metálico del Na; el radio iónico del anión, Cl-, es mayor que el radio covalente del Cl pues el sodio pierde un electrón para formar el catión y el cloro gana un electrón para formar al anión.

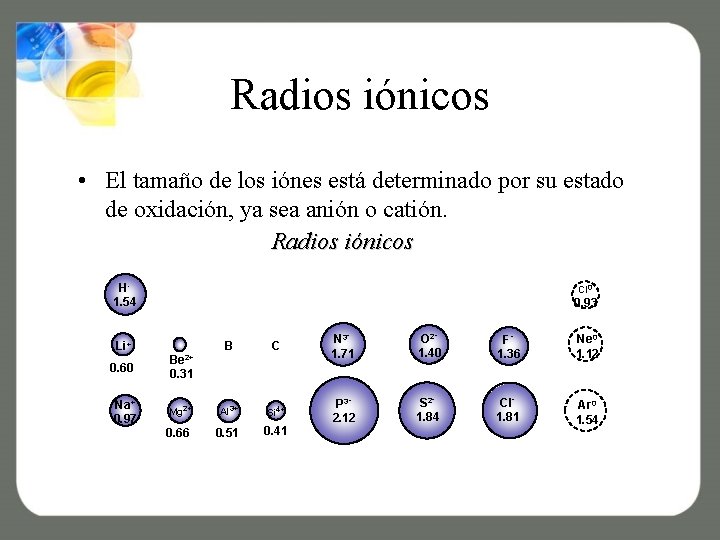
Radios iónicos • El tamaño de los iónes está determinado por su estado de oxidación, ya sea anión o catión. Radios iónicos H 1. 54 Cl 0 0. 93 B C N 31. 71 O 21. 40 F 1. 36 Ne 0 1. 12 Mg 2+ Al 3+ Si 4+ S 21. 84 Cl 1. 81 0. 51 Ar 0 1. 54 0. 66 0. 41 P 32. 12 Li+ 0. 60 Na+ 0. 97 Be 2+ 0. 31

Radio Atómico Representa la distancia que existe entre el núcleo y la capa de valencia (la más externa). Figura: Radio atómico en la tabla periódica, Enciclopedia Encarta

Radio Atómico (teórico) Bragg y Slater, señalaron que es posible determinar con precisión las distancias internucleares utilizando, la adición de radios atómicos, sin importar el tipo de enlace presente. Estos radios son similares a los covalentes, 85 pm más grandes que los de los cationes y 85 pm más pequeños que los aniones, por ello la suma de ambos equivale a la suma de las especies sin carga.

Radio Atómico

Interacciones entre patículas (átomos, iones y moléculas

Enlace Covalente Es un enlace direccional, que se basa en la superposición de los orbitales atómicos. La relación de la energía con la distancia no permite escribir una función simple como en otros casos. De aquí se puede plantear que la fuerza del enlace decrece rápidamente cuando la distancia aumenta (short -range force).

Enlace Iónico Carece de carácter direccional ya que resulta de interacciones electrostáticas. Esta basado en que uno de los átomos ceda electrones y el otro los reciba. Para explicar estas interacciones se emplea la ecuación de Born (Z+Z-) E= (4 0 r)

Enlace Iónico La energía del enlace depende del tamaño y número de iónes y , disminuye al aumentar la distancia, sin embargo, la dependencia hacia la carga es más importante que con respecto al radio

Interacciones ión-dipolo Un dipolo se describe com dos caragas iguales y de signo contrario separadas una distancia r. m = qr´ Se consideran interacciones direccionales ya que el ión con carga contraria al cmapo electrico se alinea pesentando La energía del enlace es proporcional a la carga del ión por el dipolo e inversamente proporcional al cuadrado de la distancia

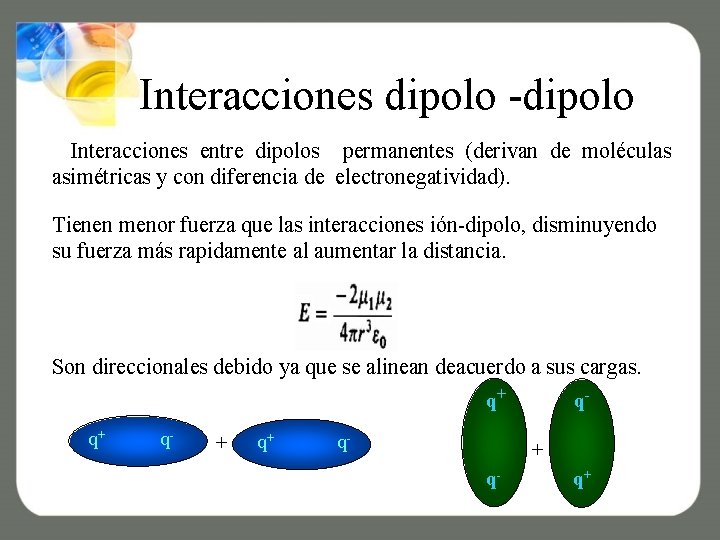
Interacciones dipolo -dipolo Interacciones entre dipolos permanentes (derivan de moléculas asimétricas y con diferencia de electronegatividad). Tienen menor fuerza que las interacciones ión-dipolo, disminuyendo su fuerza más rapidamente al aumentar la distancia. Son direccionales debido ya que se alinean deacuerdo a sus cargas. q+ q+ q- q+

Interacciones ión-dipolo inducido Un ión al aproximarse a una molécula no polar (sin carga), distorsiona la nube electrónica, provocando la formación de un dipolo. Tal deformación dependerá de la. Ióncapacidad de polarización a de la especie neutra, también llamada blandura. Ión Molécula no polar Ión Dipolo inducido

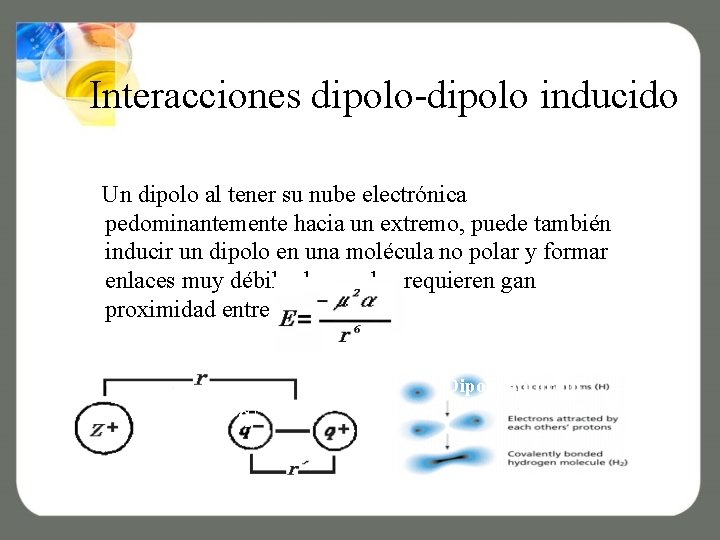
Interacciones dipolo-dipolo inducido Un dipolo al tener su nube electrónica pedominantemente hacia un extremo, puede también inducir un dipolo en una molécula no polar y formar enlaces muy débiles los cuales requieren gan proximidad entre las especies. Dipolo inducido q+

Interacciones dipolos instantáneos También llamadas feurzas de London, son el resultado del desequilibrio momentáneo en la distribución electrónica. Esta polarización (desequilibrio) puede ser inducida tanto por una molécula polar o por la repulsión de nubes electrónicas con cargas negativas en moléculas no polares. La energía se puede calcular como: = dipolo instantáneo promedio + a = capacidad de polarización q I = energía de ionización q- q+ q-

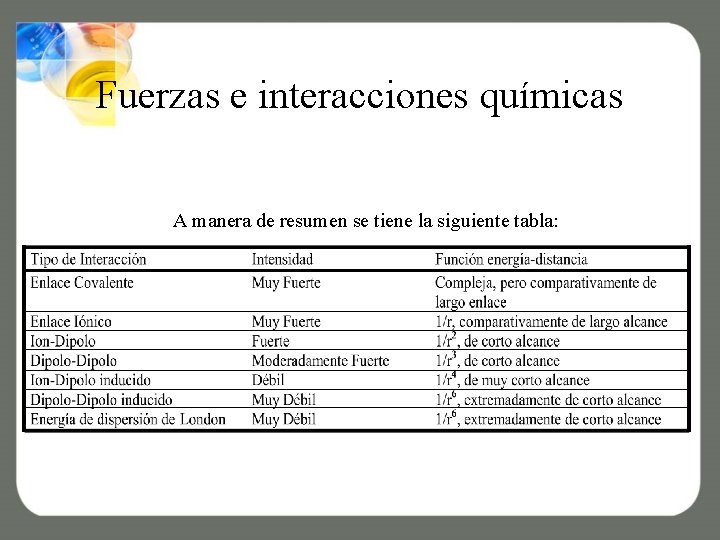
Fuerzas e interacciones químicas A manera de resumen se tiene la siguiente tabla:

Fusión y Ebullición

Consecuencias físicas de las Fuerzas Químicas De acuerdo al tipo de enlace y la fuerza del mismo, las especies químicas presentan diferentes propiedades como son: Punto de fusión y ebullición. Resultan de suministrar la suficiente energía térmica a un sólido para vencer la energía que los mantiene unidos. Aunque no necesariamente se rompen todas las fuerzas químicas. Solubilidad. Dependen de la energía para separar los iones del compuesto, así como la energía requerida para solvatarlos.

Puntos de fusión y ebullición Existen diferencias sustanciales entre cada uno de los enlaces y las interacciones; y tienen consecuencias en sus propiedades físicas, como la temperatura de fusión y ebullición. Mientras más fuertes sean las fuerzas intermoleculares, mayor será la energía requerida para romper enlaces y, por tanto, las temperaturas de fusión y ebullición son más altas.

Consecuencias físicas de las Fuerzas Químicas Ejemplos: En redes covalentes tiene muy altos puntos de fusión y ebullición (1000 -4000°C). Diamante sublima a 3700°C Silice funde 1710 y ebulle a 2200°C Cuando son polímeros y los enlaces que se rompen son los más débiles los puntos de fusión bajan drásticamente a pocos cientos de grados.

• La energía de fusión en todos los casos dependerá de la energía requerida para romper el enlace y de la estabilidad del producto • Por ejemplo, la silice Si. O 2 como red es muy estable y sus enlaces son muy fuertes mientras que cuando se funde el sólido se forma una molécula muy inestable O=Si=O, por lo que el punto de fusión es muy alto

• Los polímeros tienen enlaces covalentes muy fuertes como parte de los monómeros y luego en enlace entre monómeros puede ser muy fuerte o muy débil. • Los plásticos que funden a bajas temperaturas se conocen como termolábiles y los que son muy resistentes a la temperatura termofijos

Consecuencias de las fuerzas Químicas • En compuestos covalentes moleculares, se rompen únicamente fuerzas de London o van der Waals ya que las moléculas no se afectan, por lo que los puntos de fusión y ebullición varían de muy bajos a bajos (-300 hasta 50°C). Enlaces covalentes

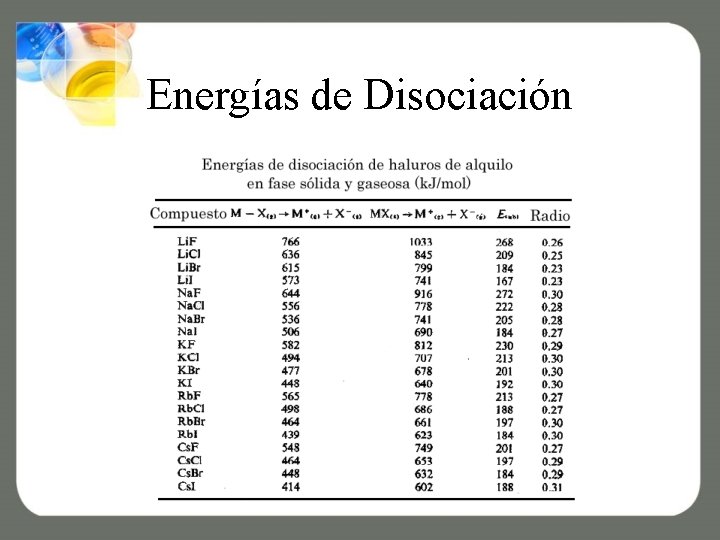
Fuerzas Químicas • Fuerzas iónicas depende de la Uo, entre mayor sea esta mas grande será la energía requerida. • Entre mayor es el carácter covalente de un enlace menor será la energía necesaria • En general todos los puntos de fusión son mayores a 100 o. C y pueden ser mayores de 1000 o. C KF = 880 °C KCl = 776 °C KBr = 730 °C Ag. F = 435 °C Ag. Cl = 455 °C Ag. Br = 434 °C

Solubilidad

¿Cómo saber si un compuesto es soluble? • Para solubilizar un soluto, se debe llegar a un estado de menor energía en la solución que en estado sólido, y la energía de Gibbs de la reacción debe ser negativa: G = H –T S Una reacción es espontánea si el G es negativo, así que la solubilidad esta determinada por los H y S del proceso, mientras mayor sea S más se favorecerá la solubilidad.

• Todas las sustancias tienden a disolverse en disolventes con enlaces similares ya que la entropia dirige la reacción • Este fenómeno ayuda a identificar sustancias a partir del uso de una serie de disolventes

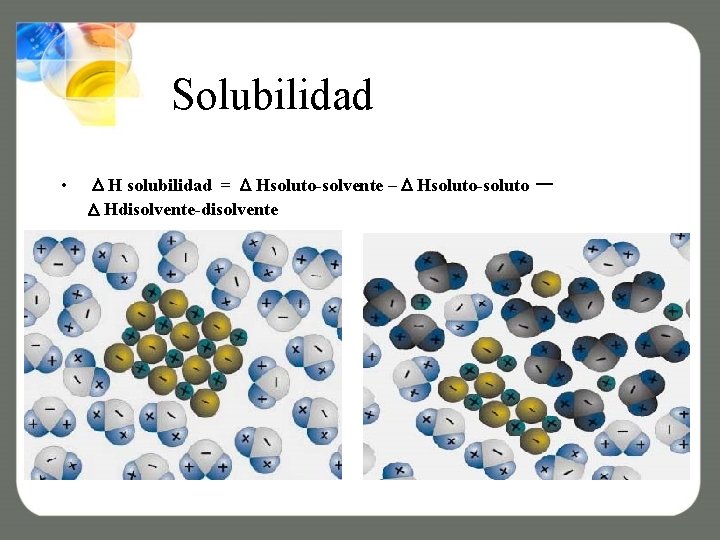
• Hsolubilidad = Hsoluto-disolvente – ( Hsoluto-soluto + H disolvente- disolvente) • O sea la energía interna en un proceso de disolución será igual a la energía de los enlaces soluto-disolventelo que cuesta romper los enlaces soluto-soluto y disolvente-disolvente)

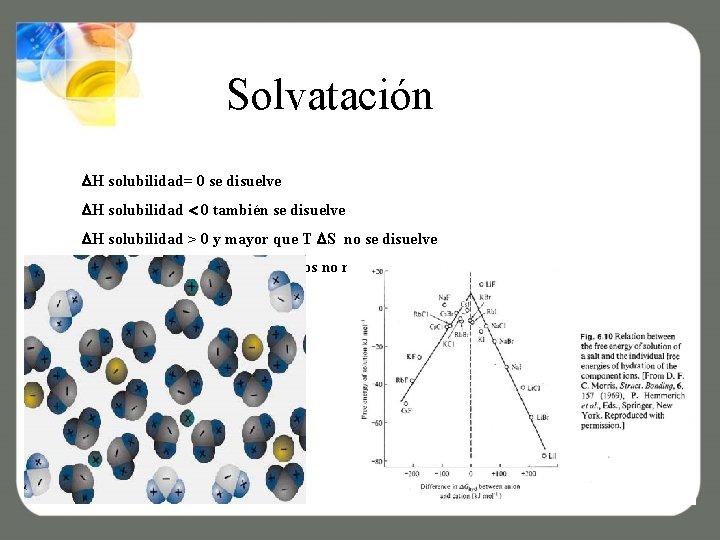
Disolución La entropía en una disolución siempre es positiva al contrario de la formación de un sólido, por lo que basta con que H solubilidad sea negativa, igual a 0, o positiva pero menor que T S. H solubilidad 0 se disuelve exotérmicamente H solubilidad= 0 se disuelve H solubilidad > 0 y menor que T S se disuelve endotérmicamente H solubilidad > 0 y mayor que T S no se disuelve Para aumetnar la solubilidad se puede calentar + + S

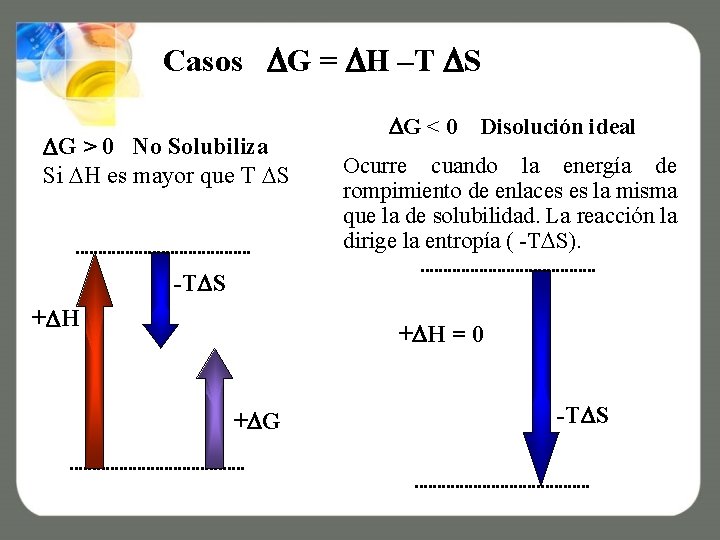
Casos G = H –T S G > 0 No Solubiliza Si H es mayor que T S G < 0 Disolución ideal Ocurre cuando la energía de rompimiento de enlaces es la misma que la de solubilidad. La reacción la dirige la entropía ( -T S). -T S + H = 0 + G -T S

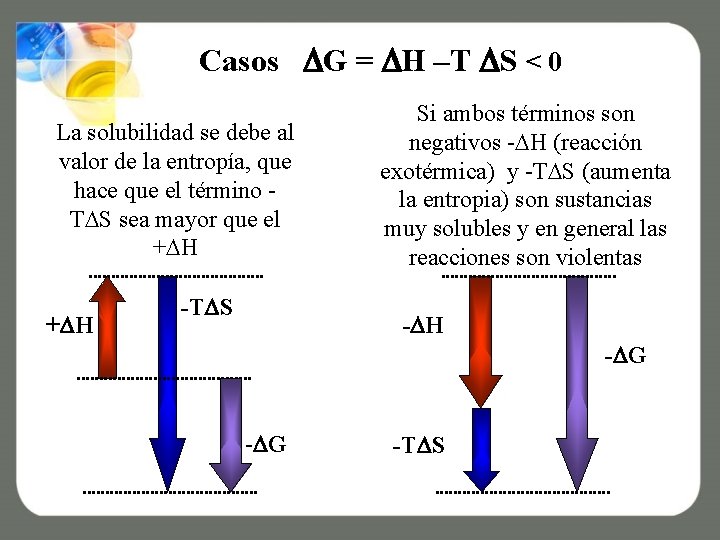
Casos G = H –T S < 0 La solubilidad se debe al valor de la entropía, que hace que el término T S sea mayor que el + H -T S Si ambos términos son negativos - H (reacción exotérmica) y -T S (aumenta la entropia) son sustancias muy solubles y en general las reacciones son violentas - H - G -T S

• Las sustancias unidas en redes por enlaces covalentes no se disuelven ya que sus enlaces son muy fuertes • Las sustancias covalentes que forman moléculas si se pueden disolver: • A) moléculas polares en disolventes polares • B) moléculas no polares en disolventes no polares

• Las moléculas polares se disuelven en otros disolventes polares básicamente en reacciones dirigidas por la entropía • Las moléculas no polares en disolventes no polares también son disoluciones ideales

Solubilidad de sustancias nopolares • Las sustancias unidas por fuerzas de London se disuelven entre si, pues se rompen enlaces débiles (-i 1), (i 2 -i 2) y se forman enlaces relativamente iguales, de la misma energía (i 2 -i 2) pero aumenta la entropia. La H = 0 pero S= + G = H – T S H = 0 G = – T S S = R (n. A donde A ln A + n. B ln B) , B son las fracciones molares del soluto y del solvente.

Sin embargo, los disolventes no polares unidos por fuerzas de London no se disuelven en agua ni disuelven sales iónicas ya que: romper enlaces dipolo instantáneo- dipolo instantáneo (ii) es energéticamente “barato”, los enlaces que forma con el agua son i-dipolo (muy débiles) y en número similar al que existía, por lo que no se lleva a cabo En el caso de sales se rompen enlaces ion-ion y se forman iondipolo instantáneo (i-ión) son tan débiles que no compensan la cantidad de energía que requiere romper la la red cristalina (ión-ión) i-i + dipolo-dipolo = i-dipolo i-i + ión-ión = i-ión ,

Disolución de sustancias iónicas Para disolver un compuesto iónico, se debe vencer la energía de la atracción electrostática entre los iones en la red cristalina. El proceso de disolución de un compuesto iónico en agua se puede explicar mediante el ciclo de Born-Haber. Las energías asociadas con este proceso son: – La requerida para la disociación de los iones en la red cristalina. – La energía de solvatación.

• Cuando la Uo es mucho mayor que la suma de las energías de hidratación la H es muy positiva y , a pesar de que S es positivo fuerza a que G = H – T S = +

Energías de Disociación

Solubilidad de sustancias ionicas • Por lo tanto, cuando una sal no se disuelve es que la energía de latice Uo que mantiene unidos a los iones en la fase sólida es mucho mayor que T S, pero si es positiva pero menor que - T S se disuelve endotérmicamente. • A continuación se presenta una disolución de una sustancia iónica donde queda claro que el “desorden molecular” o sea el número de estados posibles aumenta

Solubilidad de sales

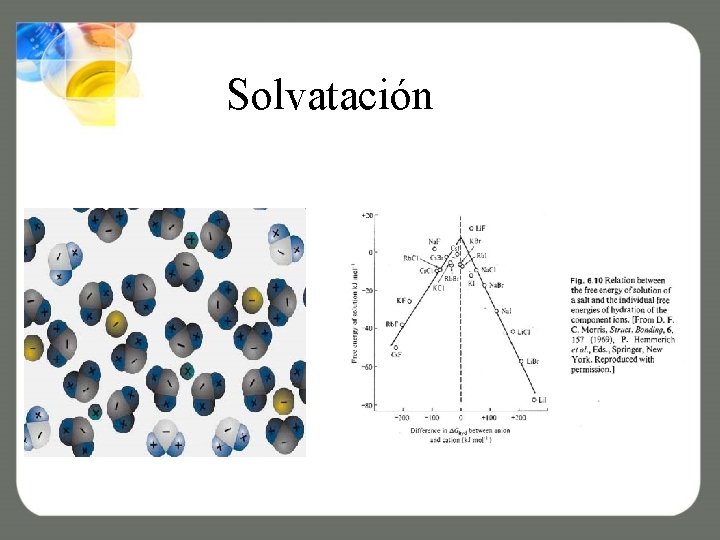
Solvatación

Solubilidad • H solubilidad = Hsoluto-solvente – Hsoluto-soluto Hdisolvente-disolvente –

Solvatación H solubilidad= 0 se disuelve H solubilidad 0 también se disuelve H solubilidad > 0 y mayor que T S no se disuelve Se puede calentar hasta 100 grados no más a presión ambiental

Energía Libre y disoluciones
 Qumicas
Qumicas Fuerza entre distancia
Fuerza entre distancia Fuerzas internas del mercado
Fuerzas internas del mercado Las fuerzas 3 eso fisica y quimica
Las fuerzas 3 eso fisica y quimica Dipolo permanente
Dipolo permanente Ley 139-13 de las fuerzas armadas
Ley 139-13 de las fuerzas armadas Representando fuerzas
Representando fuerzas Torque sentido horario y antihorario
Torque sentido horario y antihorario Preguntas sobre las 5 fuerzas de porter
Preguntas sobre las 5 fuerzas de porter Modelo de las 5 fuerzas de porter
Modelo de las 5 fuerzas de porter Teorema de las fuerzas vivas
Teorema de las fuerzas vivas Primera ley de newton
Primera ley de newton Modelo de las 5 fuerzas de porter
Modelo de las 5 fuerzas de porter Que son fuerzas intramoleculares
Que son fuerzas intramoleculares Friccion estatica
Friccion estatica Universidad de las fuerzas armadas espe
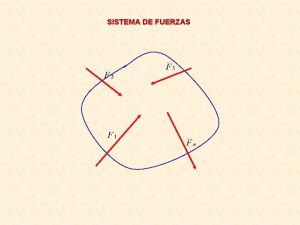
Universidad de las fuerzas armadas espe Sistema de fuerza
Sistema de fuerza Fuerzas internas
Fuerzas internas Sistema de fuerzas concurrentes
Sistema de fuerzas concurrentes Como saber si un elemento es polar o apolar
Como saber si un elemento es polar o apolar Misma dirección y sentido contrario
Misma dirección y sentido contrario Fresultante
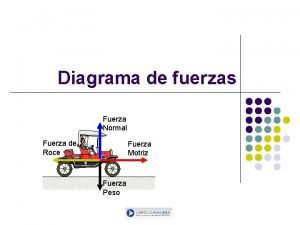
Fresultante Fuerza de roce
Fuerza de roce Como se representa la fuerza
Como se representa la fuerza Argon punto de fusion y ebullicion
Argon punto de fusion y ebullicion Fuerzas positivas y negativas
Fuerzas positivas y negativas Direccion de la fuerza neta
Direccion de la fuerza neta Fuerzas simultaneas
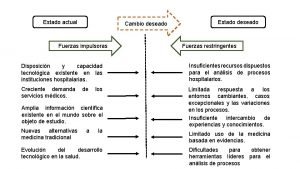
Fuerzas simultaneas Fuerzas impulsoras
Fuerzas impulsoras Fuerzas débiles
Fuerzas débiles Diagrama de fuerza normal
Diagrama de fuerza normal Ten ten siempre fuerzas y esperanza
Ten ten siempre fuerzas y esperanza Ion dipolo
Ion dipolo Caracter vectorial de la fuerza
Caracter vectorial de la fuerza Dos niños ejercen fuerzas paralelas de 30 y 10 n
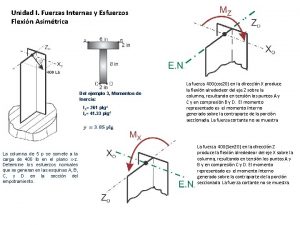
Dos niños ejercen fuerzas paralelas de 30 y 10 n Diagrama de fuerza cortante y momento flector
Diagrama de fuerza cortante y momento flector Fuerzas sobre superficies planas sumergidas
Fuerzas sobre superficies planas sumergidas Clases de fuerzas intermoleculares
Clases de fuerzas intermoleculares Clases de fuerzas intermoleculares
Clases de fuerzas intermoleculares Fuerzas locacionales
Fuerzas locacionales Teorema de los trabajos virtuales
Teorema de los trabajos virtuales Fuerzas impulsoras y restrictivas ejemplos
Fuerzas impulsoras y restrictivas ejemplos Modelo de fuerzas motrices
Modelo de fuerzas motrices Fuerzas fisica
Fuerzas fisica Fuerzas locacionales
Fuerzas locacionales Macrolocalizacion
Macrolocalizacion Silvana y juan aplican dos fuerzas sobre un objeto de 2 kg
Silvana y juan aplican dos fuerzas sobre un objeto de 2 kg Levantó mis manos al cielo
Levantó mis manos al cielo Fuerza resultante
Fuerza resultante Dipolo-dipolo inducido
Dipolo-dipolo inducido Matriz efe
Matriz efe Fuerza neta
Fuerza neta Momento dipolo dipolo
Momento dipolo dipolo Fuerza elastica
Fuerza elastica Dinamica
Dinamica Un arquero de 60 kg esta de pie en reposo
Un arquero de 60 kg esta de pie en reposo Tomame y dame fuerzas para seguir tu camino
Tomame y dame fuerzas para seguir tu camino Metodo de lineas de influencia
Metodo de lineas de influencia Fuerzas
Fuerzas Teorema de castigliano
Teorema de castigliano Ch2fcooh nombre
Ch2fcooh nombre Localizacin
Localizacin Fuerzas intermoleculares ejemplos
Fuerzas intermoleculares ejemplos Fuerzas por contacto
Fuerzas por contacto Constante electrica k
Constante electrica k Vertical solucion
Vertical solucion Gracias mo dios
Gracias mo dios Aceleración 2 eso
Aceleración 2 eso Fuerzas erosivas
Fuerzas erosivas