Reaes inorgnicas INTRODUO Uma reao qumica ocorre quando















- Slides: 24

Reações inorgânicas

INTRODUÇÃO Uma reação química ocorre quando uma ou mais substâncias interagem de modo a formar novas substâncias. A ocorrência de uma reação pode ser detectada através de evidências macroscópicas, tais como a formação de um precipitado, o desprendimento de um gás ou uma mudança de cor. Podem ocorrer também modificações só perceptíveis a sensores colocados no meio reacional, tais como alterações de condutividade elétrica ou no modo pelo qual uma substância absorve a luz.

Reações espontâneas são aquelas que progridem na direção do equilíbrio por conta própria, sem interferência externa. A condição mais usual para a espontaneidade termodinâmica de reações inorgânicas é a de que elas sejam exotérmicas. Esse critério se aplica, talvez, a 95% dessas reações. Pode-se dizer, portanto, que uma variação negativa de entalpia é a força diretora da maioria das reações inorgânicas. Se uma reação é espontânea eu uma dada direção, ela obviamente não o é na direção contrária.

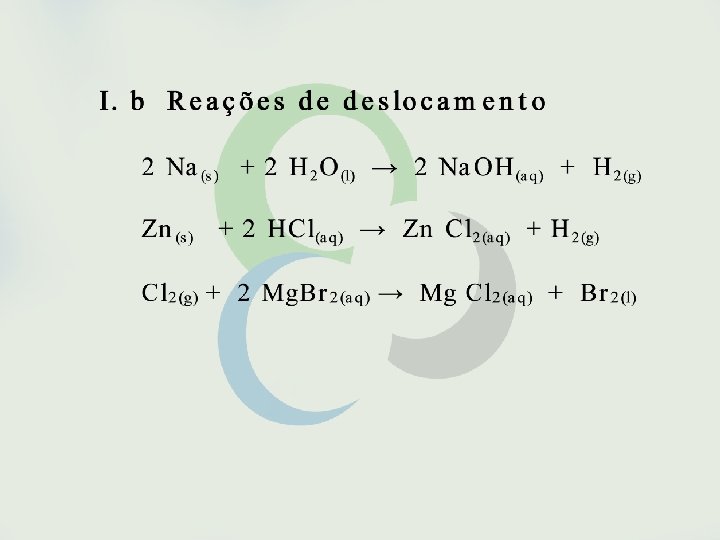
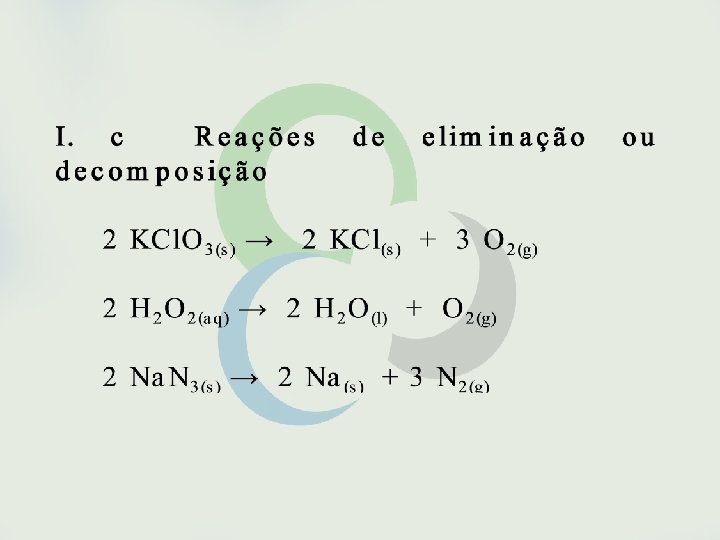
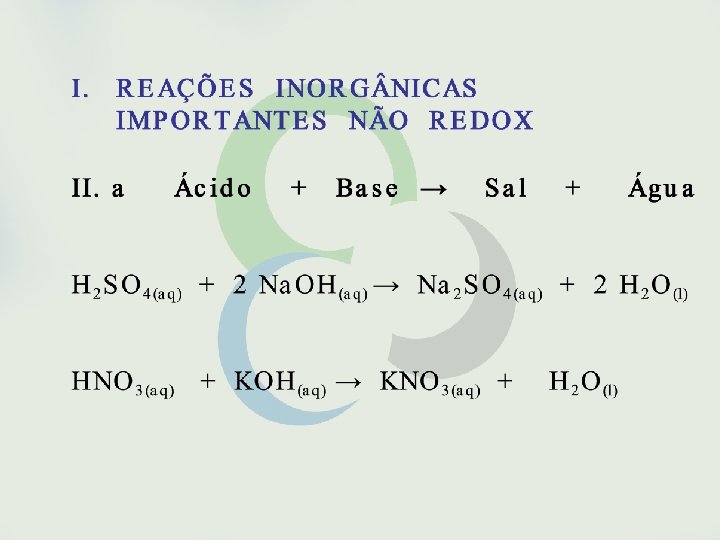
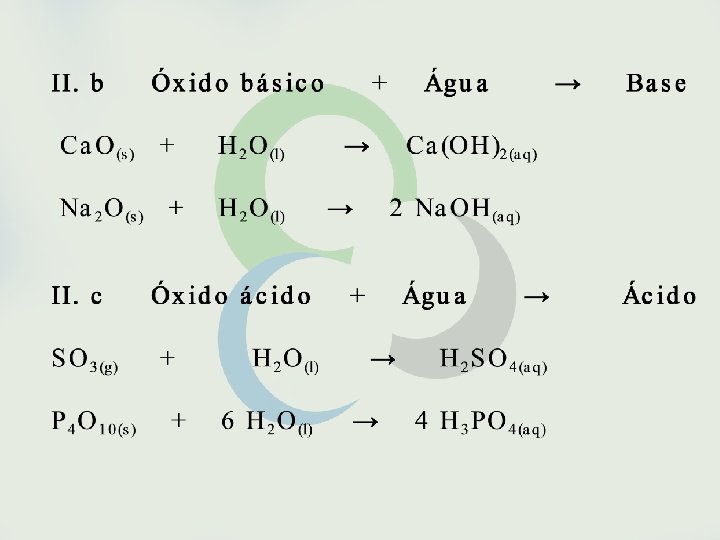
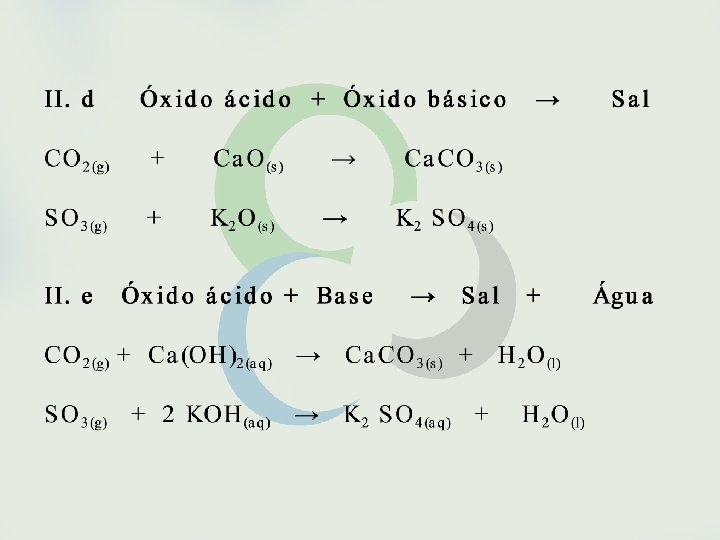
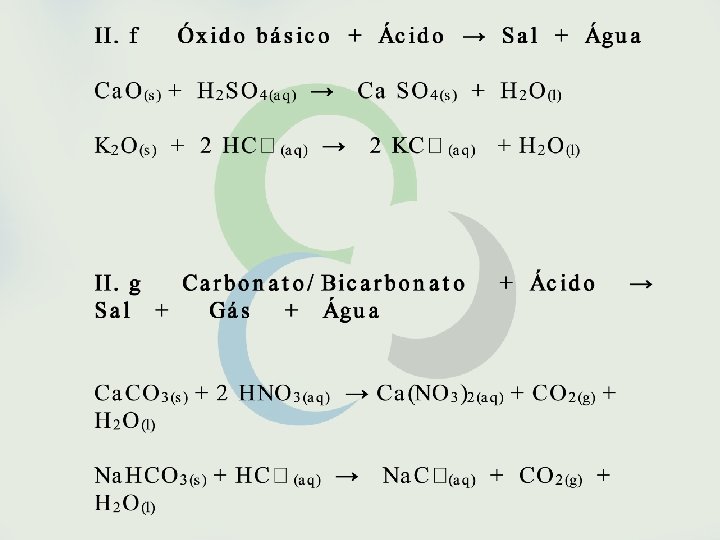
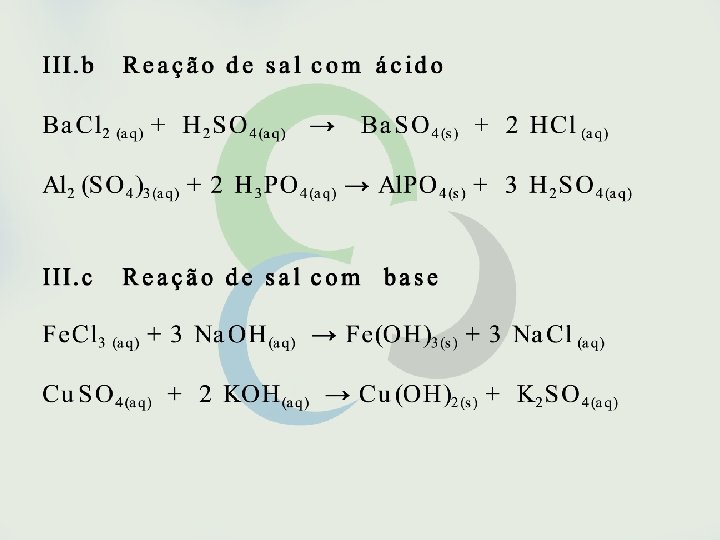
Seria possível, entretanto, fazer previsões sobre a espontaneidade de uma reação sem o conhecimento de sua variação de entalpia? Sim, isso é possível em muitos casos como, por exemplo, em reações envolvendo eletrólitos em solução aquosa. São espontâneas as reações que formam gases, precipitados ou eletrólitos fracos. São também espontâneas as reações entre oxidantes e redutores fortes.

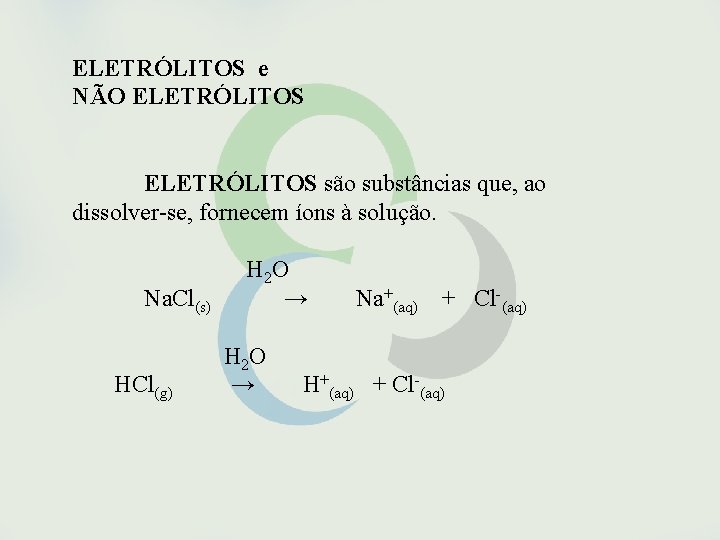
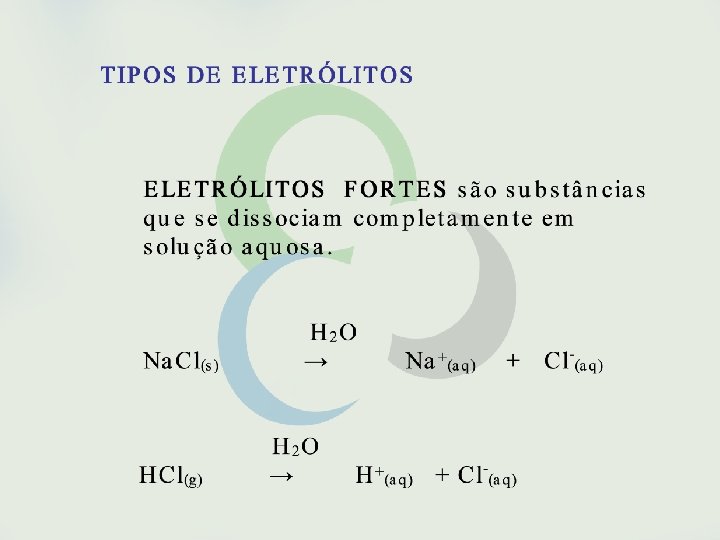
ELETRÓLITOS e NÃO ELETRÓLITOS são substâncias que, ao dissolver-se, fornecem íons à solução. H 2 O Na. Cl(s) → Na+(aq) + Cl-(aq) H 2 O HCl(g) → H+(aq) + Cl-(aq)

NÃO ELETRÓLITOS são substâncias que se dissolvem sem fornecer íons à solução. Sacarose (C 12 H 22 O 11), etanol (C 2 H 5 OH), acetona [(CH 3)2 CO], o nitrogênio molecular (N 2) e o oxigênio molecular (O 2).


















 Cmsp eb
Cmsp eb A diversidade das plantas
A diversidade das plantas Bipartição
Bipartição Bacia hidrográfica do rio grande
Bacia hidrográfica do rio grande Ciclo de krebs
Ciclo de krebs Durante a respiração sistêmica no homem ocorre
Durante a respiração sistêmica no homem ocorre Brisa maritima como ocorre
Brisa maritima como ocorre Onde ocorre a fecundação
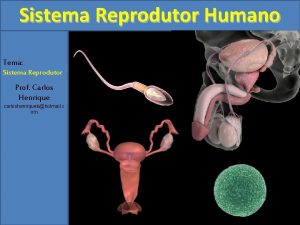
Onde ocorre a fecundação Sulco retro olivar
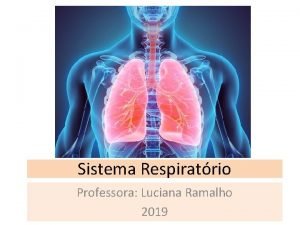
Sulco retro olivar Pulmao bronquios
Pulmao bronquios Função intestino delgado e grosso
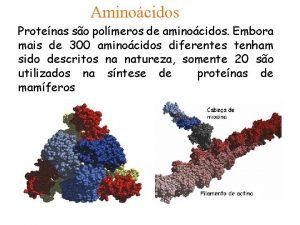
Função intestino delgado e grosso Ligação peptidica como ocorre
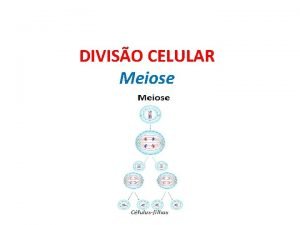
Ligação peptidica como ocorre Meiose
Meiose Meninges netter
Meninges netter Sempre é preciso saber quando uma etapa chega ao final
Sempre é preciso saber quando uma etapa chega ao final Canal contexto
Canal contexto Linhas de campo
Linhas de campo Sempre é preciso saber quando uma etapa chega ao final
Sempre é preciso saber quando uma etapa chega ao final Reflexo patelar
Reflexo patelar Celdas
Celdas Qumica
Qumica Qumica
Qumica Funcion quimica y grupo funcional
Funcion quimica y grupo funcional Qumica
Qumica Qumica
Qumica