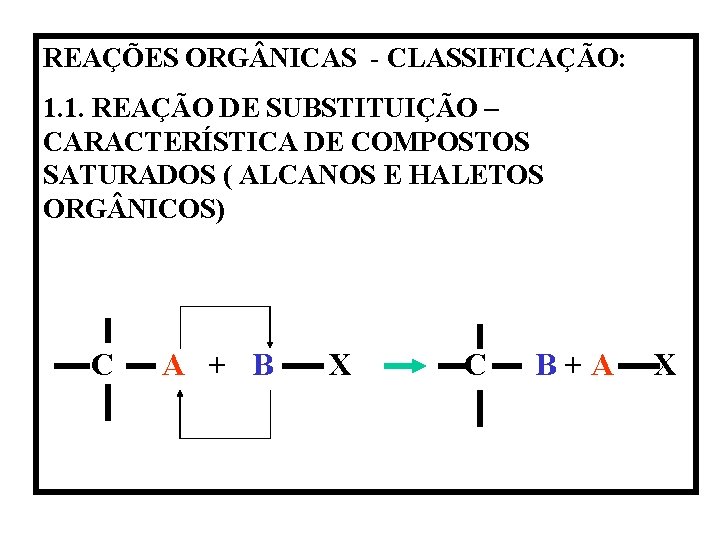
REAES ORG NICAS CLASSIFICAO 1 1 REAO DE






![5. 6. OXIDAÇÃO E REDUÇÃO. OXIDAÇÃO - AÇÃO DO [O]. REDUÇÃO - AÇÃO DO 5. 6. OXIDAÇÃO E REDUÇÃO. OXIDAÇÃO - AÇÃO DO [O]. REDUÇÃO - AÇÃO DO](https://slidetodoc.com/presentation_image/33cc6063e320f1e84f954dea2472e328/image-36.jpg)
![7. 2. ETINO PRODUZ ETANODIAL KMn. O 4/BÁSICO H-C = C-H + 4[O] O 7. 2. ETINO PRODUZ ETANODIAL KMn. O 4/BÁSICO H-C = C-H + 4[O] O](https://slidetodoc.com/presentation_image/33cc6063e320f1e84f954dea2472e328/image-40.jpg)
![9. 4. O ÁLCOOL TERCIÁRIO NÃO OXIDA OH H 3 C–C–CH 3 + [O] 9. 4. O ÁLCOOL TERCIÁRIO NÃO OXIDA OH H 3 C–C–CH 3 + [O]](https://slidetodoc.com/presentation_image/33cc6063e320f1e84f954dea2472e328/image-49.jpg)

- Slides: 54

REAÇÕES ORG NICAS - CLASSIFICAÇÃO: 1. 1. REAÇÃO DE SUBSTITUIÇÃO – CARACTERÍSTICA DE COMPOSTOS SATURADOS ( ALCANOS E HALETOS ORG NICOS) C A + B X C B + A X

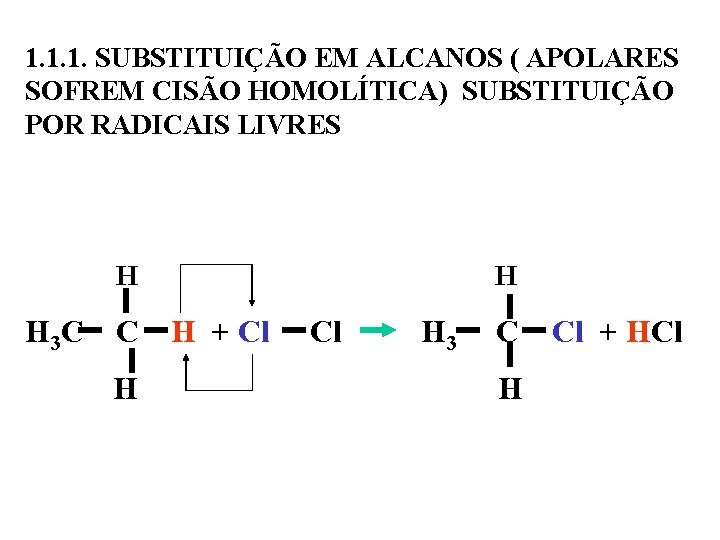
1. 1. 1. SUBSTITUIÇÃO EM ALCANOS ( APOLARES SOFREM CISÃO HOMOLÍTICA) SUBSTITUIÇÃO POR RADICAIS LIVRES H H 3 C C H + Cl Cl H 3 C Cl + HCl H

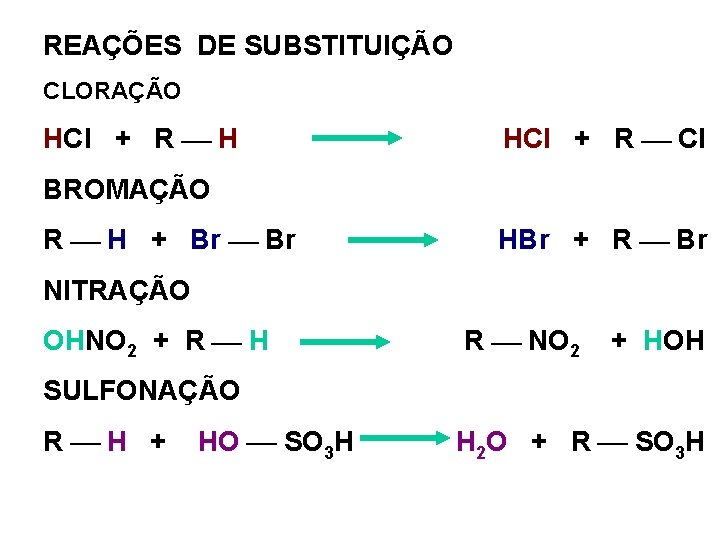
REAÇÕES DE SUBSTITUIÇÃO CLORAÇÃO HCl + R ¾ H HCl + R ¾ Cl BROMAÇÃO R ¾ H + Br ¾ Br HBr + R ¾ Br NITRAÇÃO OHNO 2 + R ¾ H R ¾ NO 2 + HOH SULFONAÇÃO R¾H + HO ¾ SO 3 H H 2 O + R ¾ SO 3 H

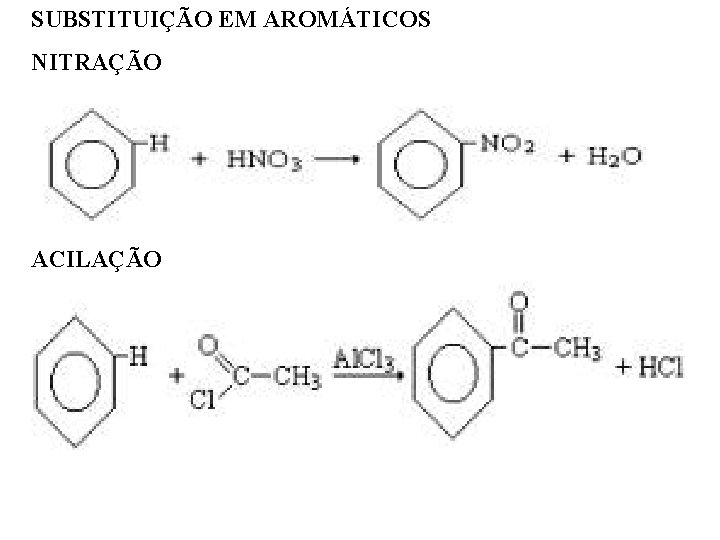
SUBSTITUIÇÃO EM AROMÁTICOS NITRAÇÃO ACILAÇÃO

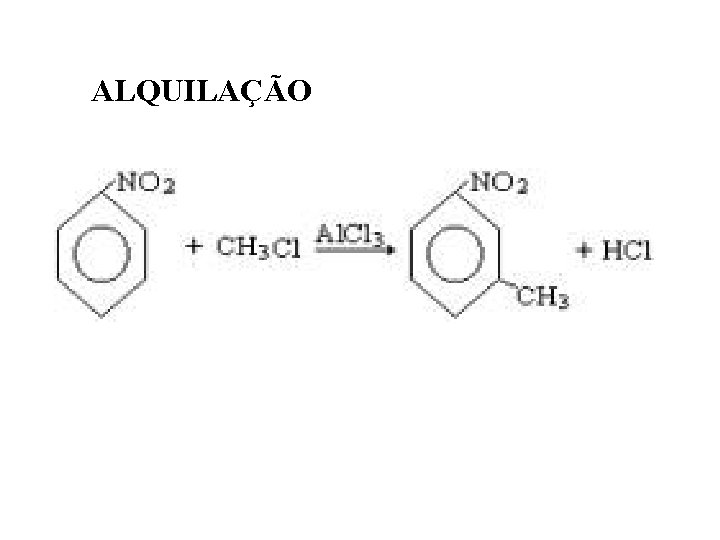
ALQUILAÇÃO

REAÇÕES ORG NICAS 1. REAÇÕES DE SUBSTITUIÇÃO. 1. 1. ALCANOS: Por serem apolares sofrem cisão homolítica e a reação ocorre por meio de radicais livres. EXEMPLO: Halogenação - Cloração do metano: CH 4 + 4 Cℓ 2 CCℓ 4 + 4 HCℓ

1. 2. HALETOS ORG NICOS - Por serem compostos polares, sofrem cisão heterolítica. Como a molécula orgânica perde o elétron da ligação com o halogênio, é atacada por um reagente nucleófilo. EXEMPLO: Reação com água - Monocloroetano + água. H 3 C-Cl + HOH H 3 C-OH + HCl

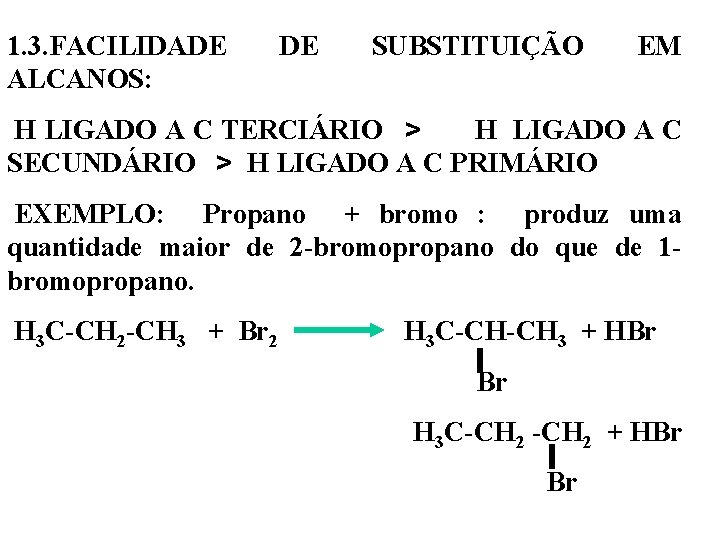
1. 3. FACILIDADE ALCANOS: DE SUBSTITUIÇÃO EM H LIGADO A C TERCIÁRIO > H LIGADO A C SECUNDÁRIO > H LIGADO A C PRIMÁRIO EXEMPLO: Propano + bromo : produz uma quantidade maior de 2 -bromopropano do que de 1 - bromopropano. H 3 C-CH 2 -CH 3 + Br 2 H 3 C-CH-CH 3 + HBr H 3 C-CH 2 + HBr

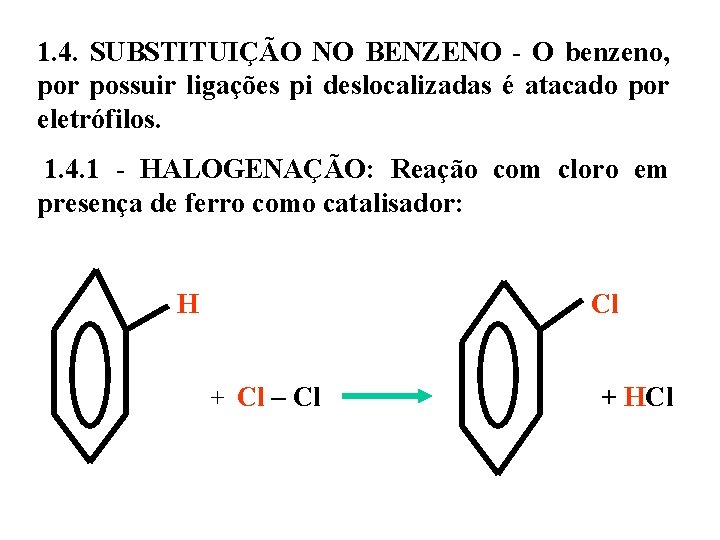
1. 4. SUBSTITUIÇÃO NO BENZENO - O benzeno, por possuir ligações pi deslocalizadas é atacado por eletrófilos. 1. 4. 1 - HALOGENAÇÃO: Reação com cloro em presença de ferro como catalisador: H Cl + Cl – Cl + HCl

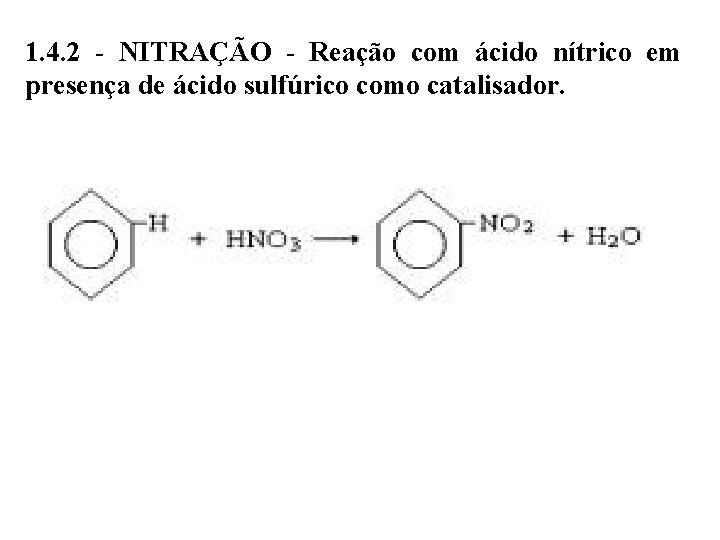
1. 4. 2 - NITRAÇÃO - Reação com ácido nítrico em presença de ácido sulfúrico como catalisador.

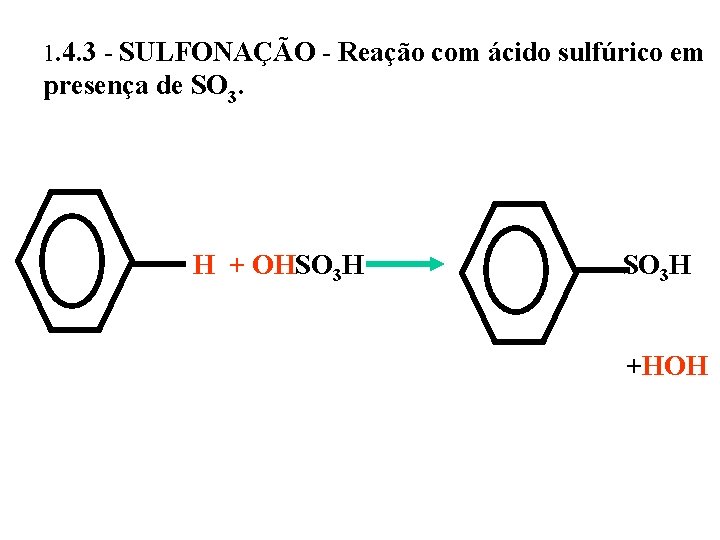
1. 4. 3 - SULFONAÇÃO - Reação com ácido sulfúrico em presença de SO 3. H + OHSO 3 H +HOH

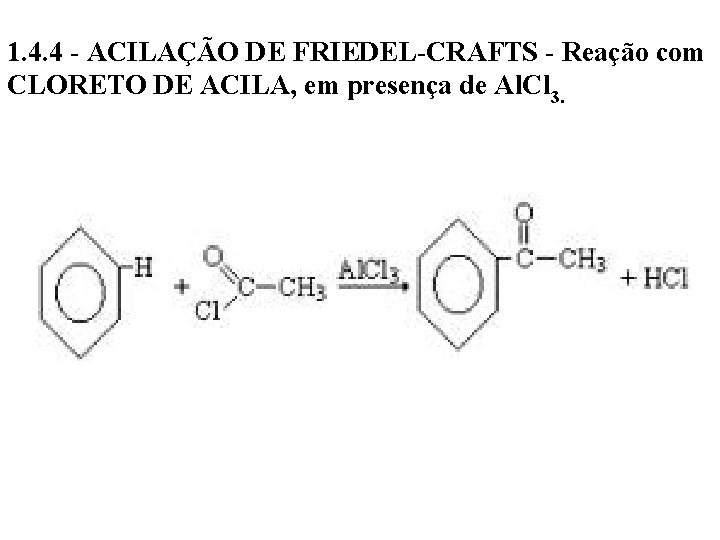
1. 4. 4 - ACILAÇÃO DE FRIEDEL-CRAFTS - Reação com CLORETO DE ACILA, em presença de Al. Cl 3.

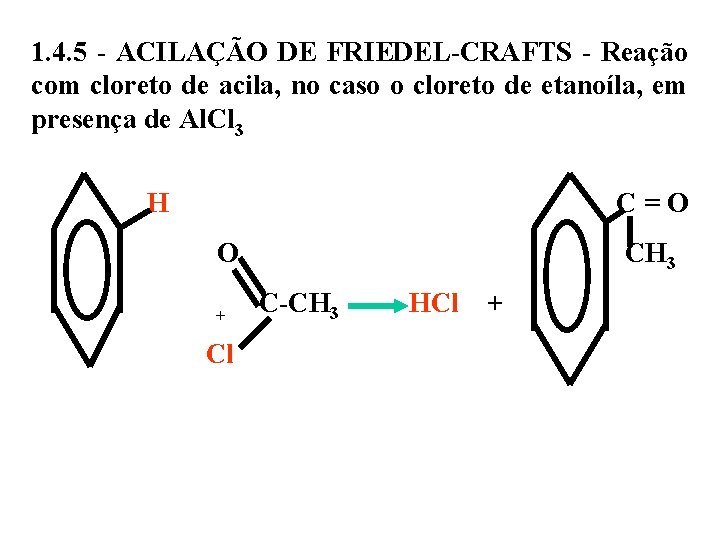
1. 4. 5 - ACILAÇÃO DE FRIEDEL-CRAFTS - Reação com cloreto de acila, no caso o cloreto de etanoíla, em presença de Al. Cl 3 H C = O CH 3 + C-CH 3 HCl + Cl

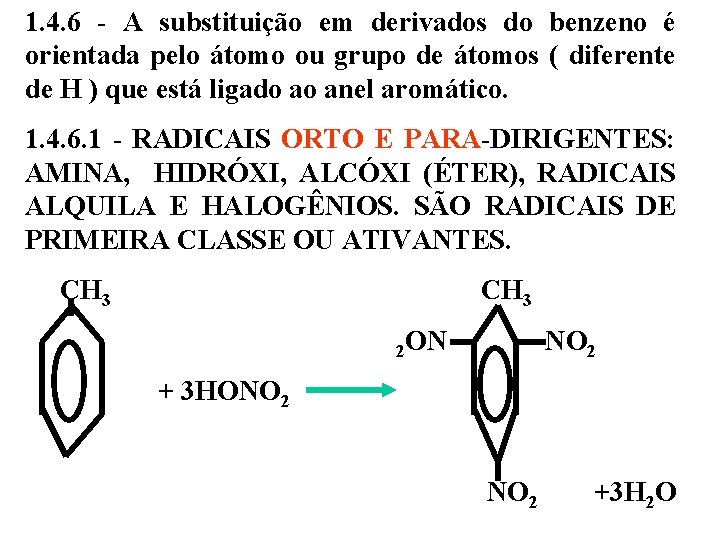
1. 4. 6 - A substituição em derivados do benzeno é orientada pelo átomo ou grupo de átomos ( diferente de H ) que está ligado ao anel aromático. 1. 4. 6. 1 - RADICAIS ORTO E PARA-DIRIGENTES: AMINA, HIDRÓXI, ALCÓXI (ÉTER), RADICAIS ALQUILA E HALOGÊNIOS. SÃO RADICAIS DE PRIMEIRA CLASSE OU ATIVANTES. CH 3 2 ON NO 2 + 3 HONO 2 NO 2 +3 H 2 O

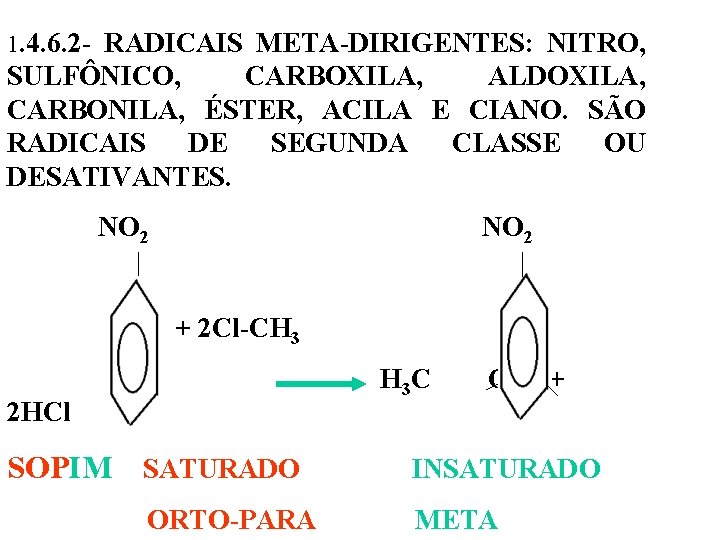
1. 4. 6. 2 - RADICAIS META-DIRIGENTES: NITRO, SULFÔNICO, CARBOXILA, ALDOXILA, CARBONILA, ÉSTER, ACILA E CIANO. SÃO RADICAIS DE SEGUNDA CLASSE OU DESATIVANTES. NO 2 + 2 Cl-CH 3 H 3 C CH 3 + 2 HCl SOPIM SATURADO INSATURADO ORTO-PARA META

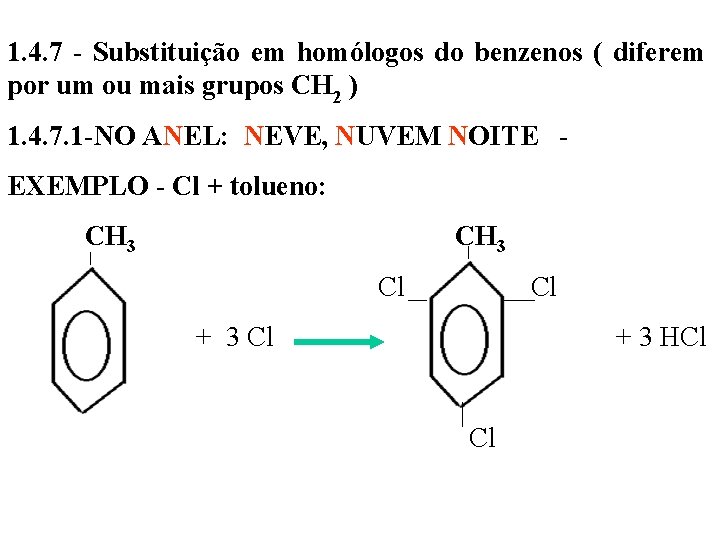
1. 4. 7 - Substituição em homólogos do benzenos ( diferem por um ou mais grupos CH 2 ) 1. 4. 7. 1 -NO ANEL: NEVE, NUVEM NOITE - EXEMPLO - Cl + tolueno: CH 3 Cl + 3 Cl + 3 HCl Cl

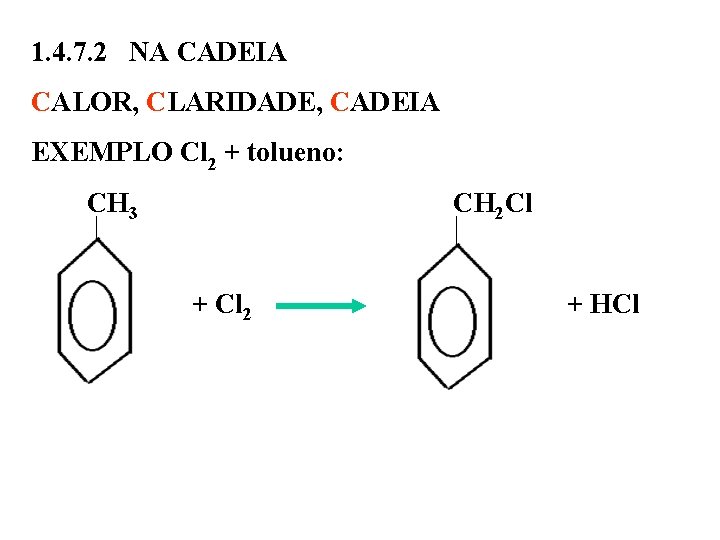
1. 4. 7. 2 NA CADEIA CALOR, CLARIDADE, CADEIA EXEMPLO Cl 2 + tolueno: CH 3 CH 2 Cl + Cl 2 + HCl

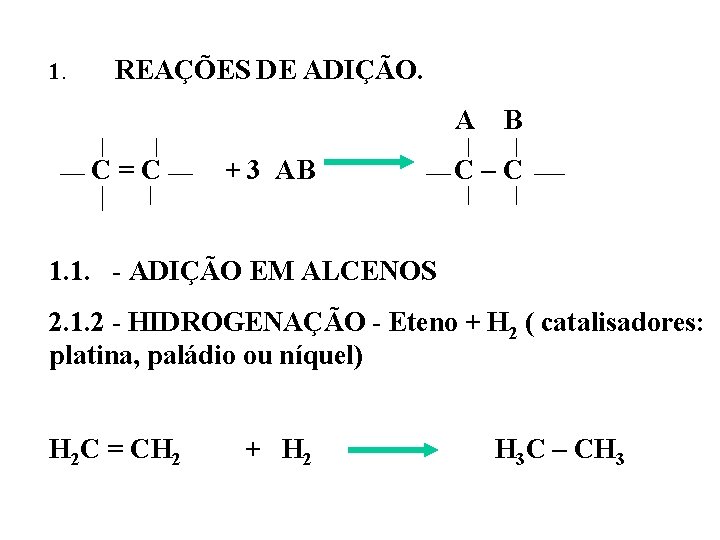
1. REAÇÕES DE ADIÇÃO. A B C = C + 3 AB C – C 1. 1. - ADIÇÃO EM ALCENOS 2. 1. 2 - HIDROGENAÇÃO - Eteno + H 2 ( catalisadores: platina, paládio ou níquel) H 2 C = CH 2 + H 2 H 3 C – CH 3

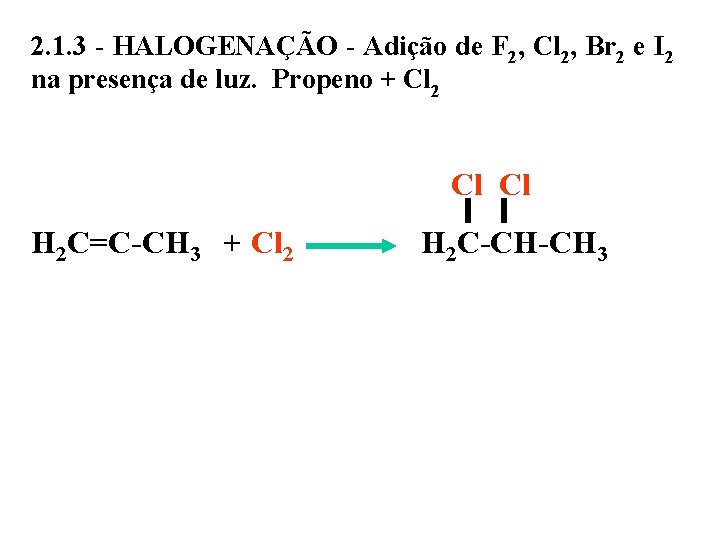
2. 1. 3 - HALOGENAÇÃO - Adição de F 2, Cl 2, Br 2 e I 2 na presença de luz. Propeno + Cl 2 Cl Cl H 2 C=C-CH 3 + Cl 2 H 2 C-CH-CH 3

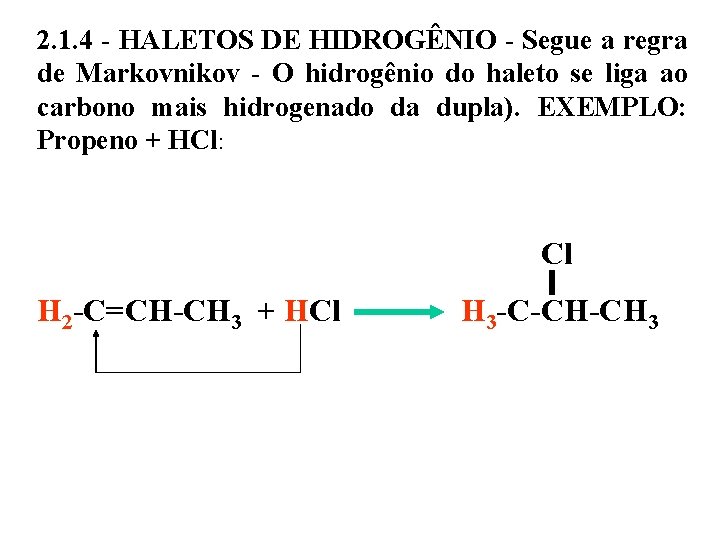
2. 1. 4 - HALETOS DE HIDROGÊNIO - Segue a regra de Markovnikov - O hidrogênio do haleto se liga ao carbono mais hidrogenado da dupla). EXEMPLO: Propeno + HCl: Cl H 2 -C=CH-CH 3 + HCl H 3 -C-CH-CH 3

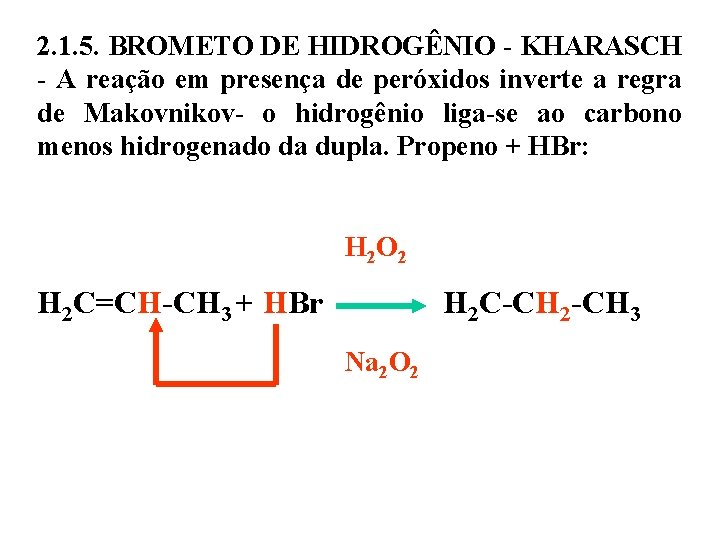
2. 1. 5. BROMETO DE HIDROGÊNIO - KHARASCH - A reação em presença de peróxidos inverte a regra de Makovnikov- o hidrogênio liga-se ao carbono menos hidrogenado da dupla. Propeno + HBr: H 2 O 2 H 2 C=CH-CH 3 + HBr H 2 C-CH 2 -CH 3 Na 2 O 2

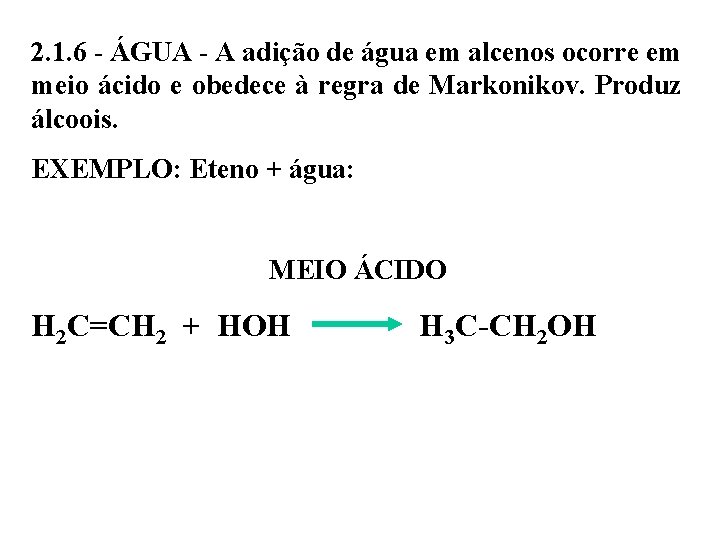
2. 1. 6 - ÁGUA - A adição de água em alcenos ocorre em meio ácido e obedece à regra de Markonikov. Produz álcoois. EXEMPLO: Eteno + água: MEIO ÁCIDO H 2 C=CH 2 + HOH H 3 C-CH 2 OH

1. REAÇÕES DE ADIÇÃO EM CICLANOS. OS CICLANOS COM ATÉ 5 CARBONOS NA MOLÉCULA PODEM SOFRER REAÇÕES DE ADIÇÃO. 1. 1. TEORIA DAS TENSÕES DE BAYER - Quanto mais o ângulo entre as ligações no ciclo se afasta de 109 28' mais instável ( e mais fácil de ser rompido) se torna o ciclano. Isto ocorre na ordem: ciclopropano (60 ), ciclobutano (90 ) e ciclopentano (108 ).

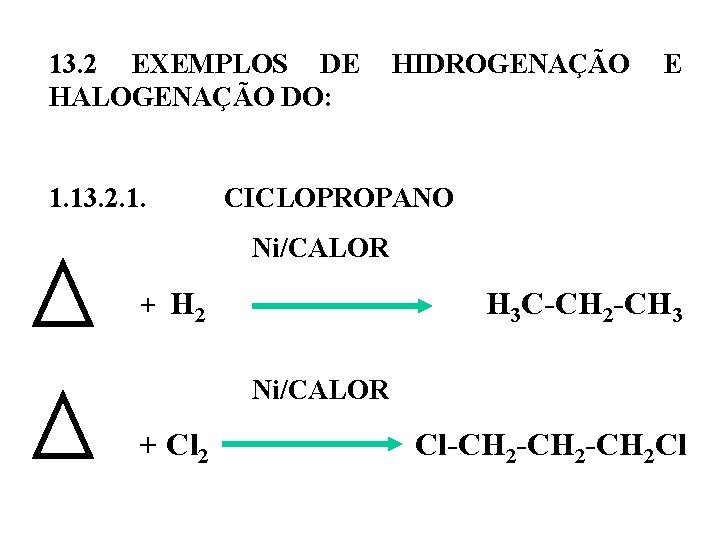
13. 2 EXEMPLOS DE HIDROGENAÇÃO E HALOGENAÇÃO DO: 1. 13. 2. 1. CICLOPROPANO Ni/CALOR + H 2 H 3 C-CH 2 -CH 3 Ni/CALOR + Cl 2 Cl-CH 2 -CH 2 Cl

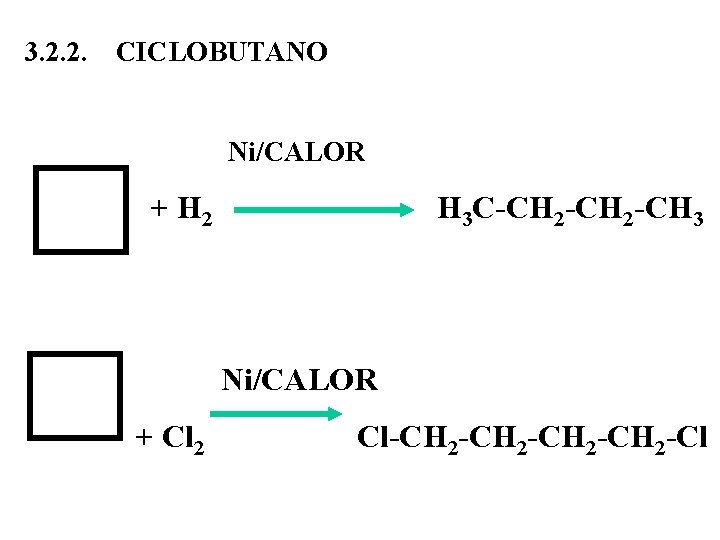
3. 2. 2. CICLOBUTANO Ni/CALOR + H 2 H 3 C-CH 2 -CH 3 Ni/CALOR + Cl 2 Cl-CH 2 -CH 2 -Cl

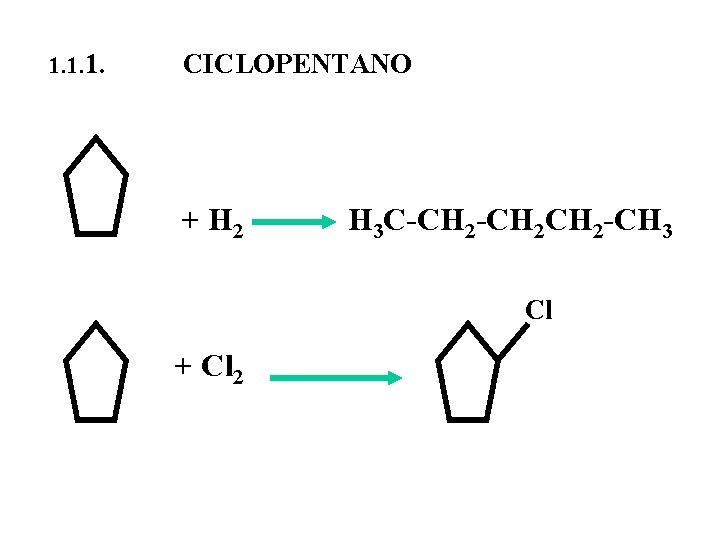
1. 1. 1. CICLOPENTANO + H 2 H 3 C-CH 2 CH 2 -CH 3 Cl + Cl 2

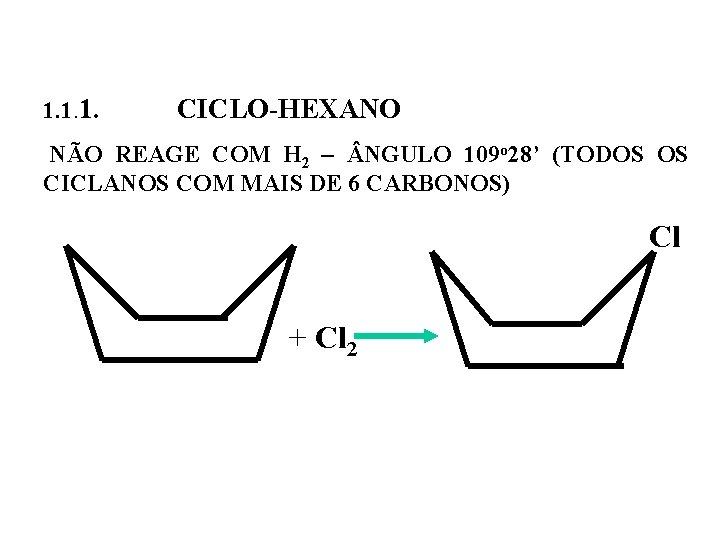
1. 1. 1. CICLO-HEXANO NÃO REAGE COM H 2 – NGULO 109 o 28’ (TODOS OS CICLANOS COM MAIS DE 6 CARBONOS) Cl + Cl 2

4. REAÇÕES DE ELIMINAÇÃO: 4. 1. ELIMINAÇÃO INTRAMOLECULAR DE HALETOS ORG NICOS. PRODUZ ALCENOS É FEITA COM KOH EM MEIO ALCOÓLICO. O HIDROGÊNIO MAIS FACILMENTE ELIMINADO: C TERC MAIOR C SEC MAIOR C PRIMÁRIO, O QUE IRÁ DETERMINAR O COMPOSTO OBTIDO EM MAIOR QUANTIDADE.

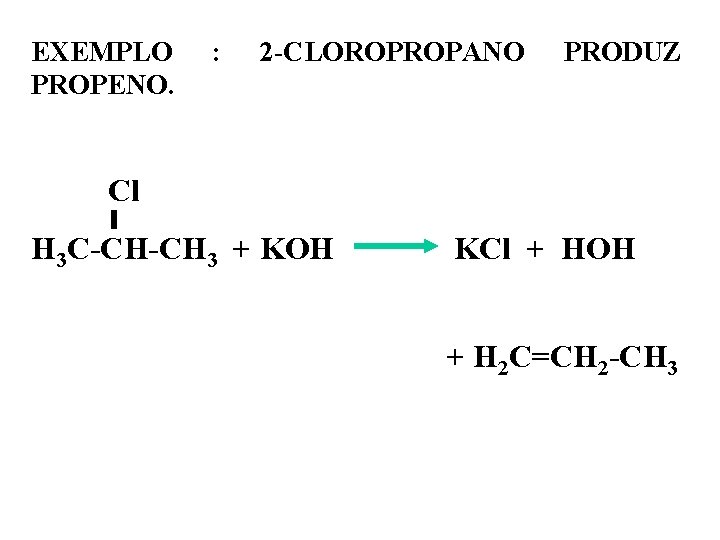
EXEMPLO PROPENO. : 2 -CLOROPROPANO PRODUZ Cl H 3 C-CH-CH 3 + KOH KCl + HOH + H 2 C=CH 2 -CH 3

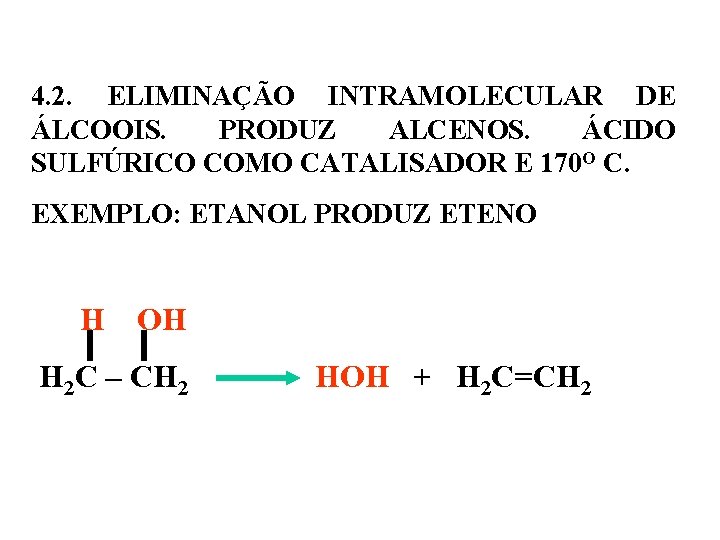
4. 2. ELIMINAÇÃO INTRAMOLECULAR DE ÁLCOOIS. PRODUZ ALCENOS. ÁCIDO SULFÚRICO COMO CATALISADOR E 170 O C. EXEMPLO: ETANOL PRODUZ ETENO H OH H 2 C – CH 2 HOH + H 2 C=CH 2

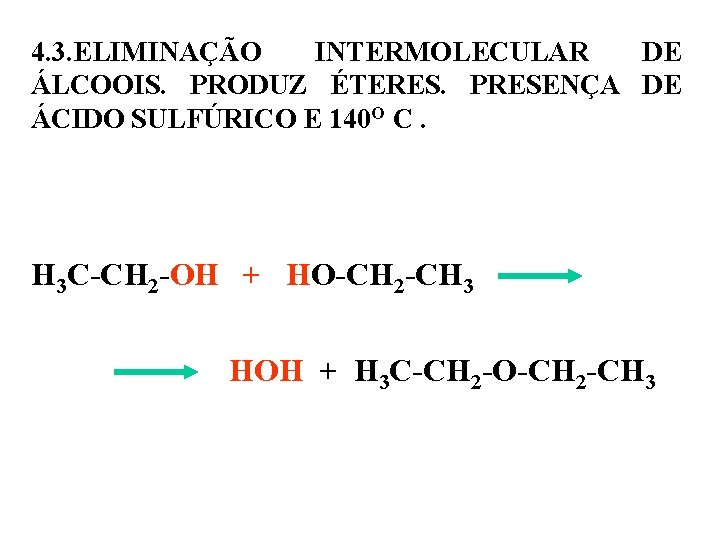
4. 3. ELIMINAÇÃO INTERMOLECULAR DE ÁLCOOIS. PRODUZ ÉTERES. PRESENÇA DE ÁCIDO SULFÚRICO E 140 O C. H 3 C-CH 2 -OH + HO-CH 2 -CH 3 HOH + H 3 C-CH 2 -O-CH 2 -CH 3

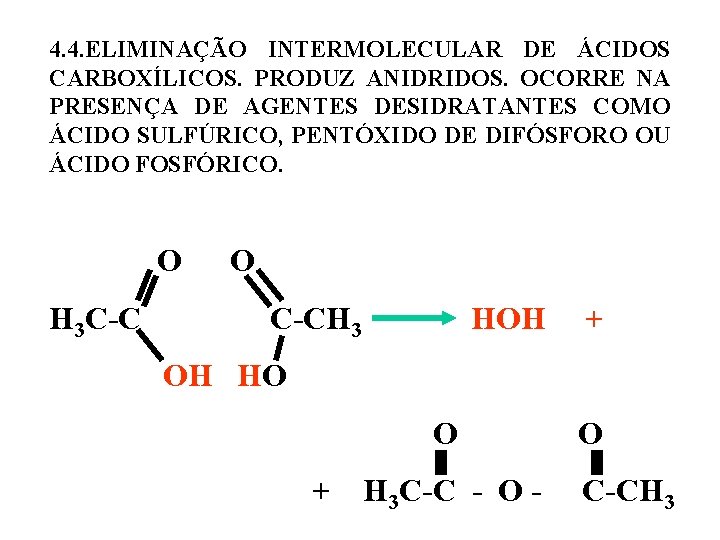
4. 4. ELIMINAÇÃO INTERMOLECULAR DE ÁCIDOS CARBOXÍLICOS. PRODUZ ANIDRIDOS. OCORRE NA PRESENÇA DE AGENTES DESIDRATANTES COMO ÁCIDO SULFÚRICO, PENTÓXIDO DE DIFÓSFORO OU ÁCIDO FOSFÓRICO. O O H 3 C-C C-CH 3 HOH + OH HO + H 3 C-C - O - C-CH 3

5. PRINCIPAIS ESPECÍFICAS. REAÇÕES ORG NICAS 5. 1. COMBUSTÃO: EXEMPLO COMBUSTÃO DO PROPANO: COMBUSTÃO TOTAL CH 3 -CH 2 -CH 3 + 5 O 2 3 CO 2 +4 H 2 O COMBUSTÃO PARCIAL CH 3 -CH 2 -CH 3 + 7/2 O 2 3 CO +4 H 2 O COM FORMAÇÃO DE FULIGEM CH 3 -CH 2 -CH 3 + 2 O 2 3 C +4 H 2 O

5. 2. SALIFICAÇÃO. É A REAÇÃO ENTRE UM ÁCIDO CARBOXÍLICO E UMA BASE DE ARRHENIUS. EXEMPLO: ÁCIDO PALMÍTICO E HIDRÓXIDO DE SÓDIO PRODUZ PALMITATO DE SÓDIO (SABÃO) E ÁGUA. C 15 H 31 COOH + Na. OH C 15 H 31 COONa +H 2 O

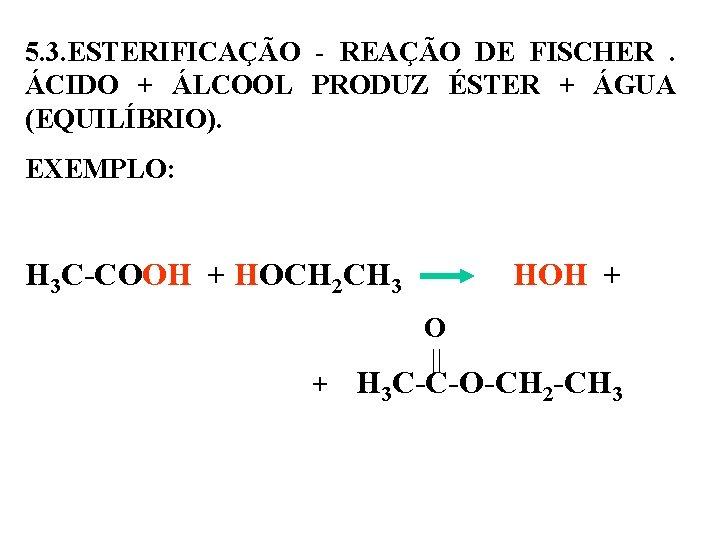
5. 3. ESTERIFICAÇÃO - REAÇÃO DE FISCHER . ÁCIDO + ÁLCOOL PRODUZ ÉSTER + ÁGUA (EQUILÍBRIO). EXEMPLO: H 3 C-COOH + HOCH 2 CH 3 HOH + O + H 3 C-C-O-CH 2 -CH 3
![5 6 OXIDAÇÃO E REDUÇÃO OXIDAÇÃO AÇÃO DO O REDUÇÃO AÇÃO DO 5. 6. OXIDAÇÃO E REDUÇÃO. OXIDAÇÃO - AÇÃO DO [O]. REDUÇÃO - AÇÃO DO](https://slidetodoc.com/presentation_image/33cc6063e320f1e84f954dea2472e328/image-36.jpg)
5. 6. OXIDAÇÃO E REDUÇÃO. OXIDAÇÃO - AÇÃO DO [O]. REDUÇÃO - AÇÃO DO [H]. 5. 6. 1. OZONÓLISE DE ALCENOS - SE AMBOS OS CARBONOS DA DUPLA SÃO PRIMÁRIOS OU SECUNDÁRIOS PRODUZ ALDEÍDOS. H 2 C=CH-CH 3 + O 3 + H 2 O H-C=O + O=C-CH 3 + H 2 O 2 H

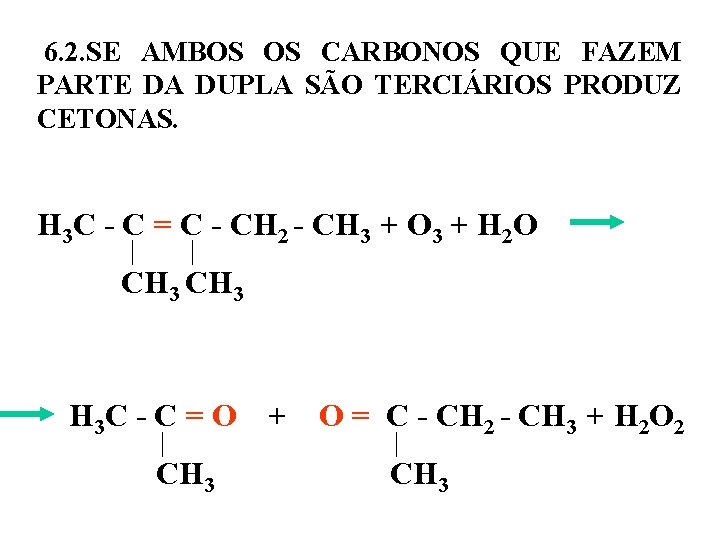
6. 2. SE AMBOS OS CARBONOS QUE FAZEM PARTE DA DUPLA SÃO TERCIÁRIOS PRODUZ CETONAS. H 3 C - C = C - CH 2 - CH 3 + O 3 + H 2 O CH 3 H 3 C - C = O + O = C - CH 2 - CH 3 + H 2 O 2 CH 3

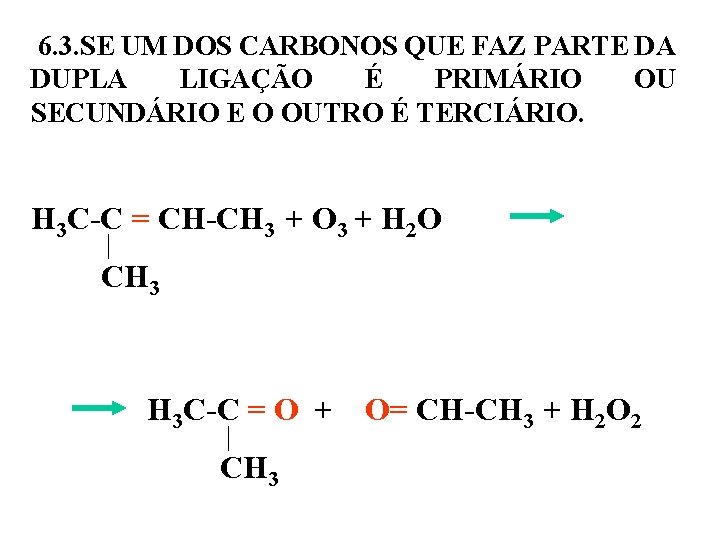
6. 3. SE UM DOS CARBONOS QUE FAZ PARTE DA DUPLA LIGAÇÃO É PRIMÁRIO OU SECUNDÁRIO E O OUTRO É TERCIÁRIO. H 3 C-C = CH-CH 3 + O 3 + H 2 O CH 3 H 3 C-C = O + O= CH-CH 3 + H 2 O 2 CH 3

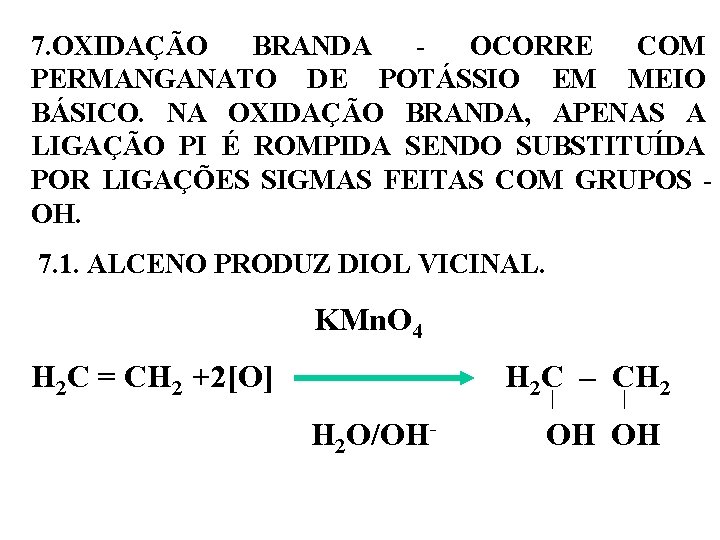
7. OXIDAÇÃO BRANDA - OCORRE COM PERMANGANATO DE POTÁSSIO EM MEIO BÁSICO. NA OXIDAÇÃO BRANDA, APENAS A LIGAÇÃO PI É ROMPIDA SENDO SUBSTITUÍDA POR LIGAÇÕES SIGMAS FEITAS COM GRUPOS OH. 7. 1. ALCENO PRODUZ DIOL VICINAL. KMn. O 4 H 2 C = CH 2 +2[O] H 2 C – CH 2 - H O/OH 2 OH OH
![7 2 ETINO PRODUZ ETANODIAL KMn O 4BÁSICO HC CH 4O O 7. 2. ETINO PRODUZ ETANODIAL KMn. O 4/BÁSICO H-C = C-H + 4[O] O](https://slidetodoc.com/presentation_image/33cc6063e320f1e84f954dea2472e328/image-40.jpg)
7. 2. ETINO PRODUZ ETANODIAL KMn. O 4/BÁSICO H-C = C-H + 4[O] O = C – C = O + H H + H 2 O 2

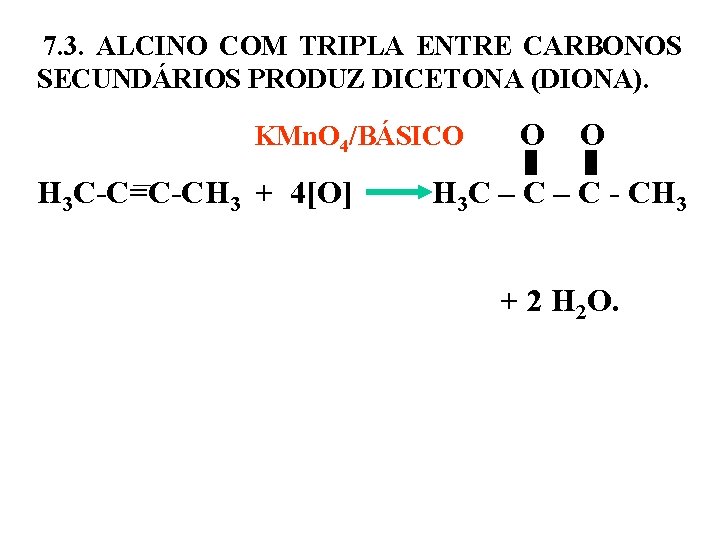
7. 3. ALCINO COM TRIPLA ENTRE CARBONOS SECUNDÁRIOS PRODUZ DICETONA (DIONA). KMn. O 4/BÁSICO O O H 3 C-C=C-CH 3 + 4[O] H 3 C – C - CH 3 + 2 H 2 O.

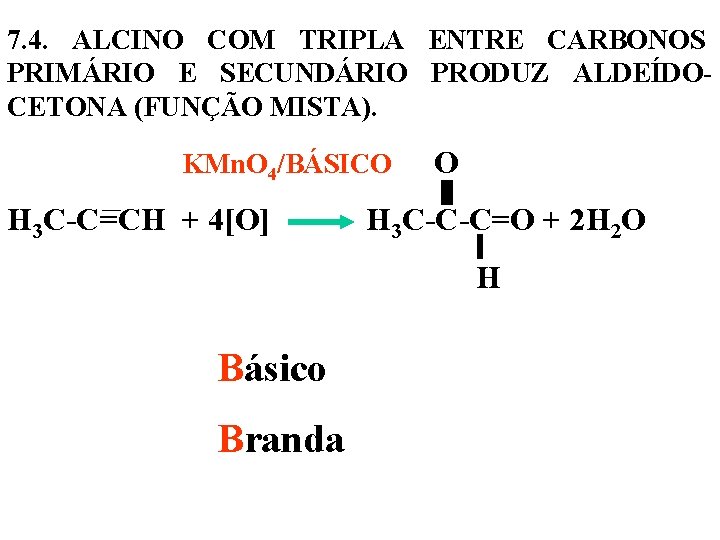
7. 4. ALCINO COM TRIPLA ENTRE CARBONOS PRIMÁRIO E SECUNDÁRIO PRODUZ ALDEÍDOCETONA (FUNÇÃO MISTA). KMn. O 4/BÁSICO O H 3 C-C=CH + 4[O] H 3 C-C-C=O + 2 H 2 O H Básico Branda

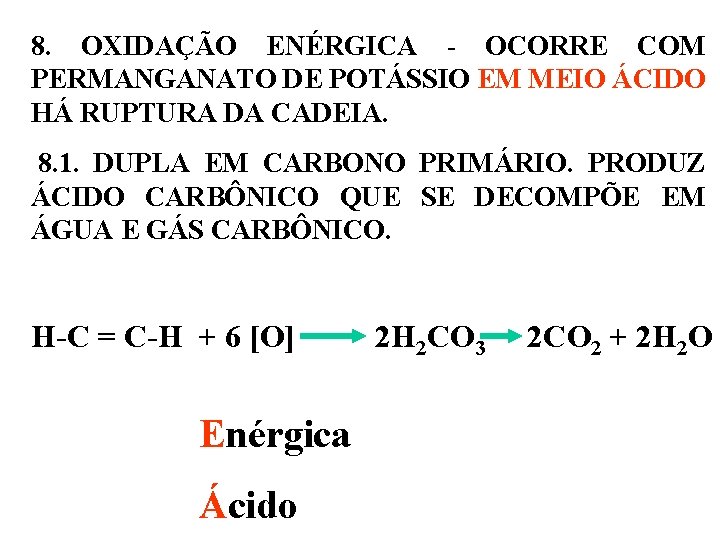
8. OXIDAÇÃO ENÉRGICA - OCORRE COM PERMANGANATO DE POTÁSSIO EM MEIO ÁCIDO HÁ RUPTURA DA CADEIA. 8. 1. DUPLA EM CARBONO PRIMÁRIO. PRODUZ ÁCIDO CARBÔNICO QUE SE DECOMPÕE EM ÁGUA E GÁS CARBÔNICO. H-C = C-H + 6 [O] 2 H 2 CO 3 2 CO 2 + 2 H 2 O Enérgica Ácido

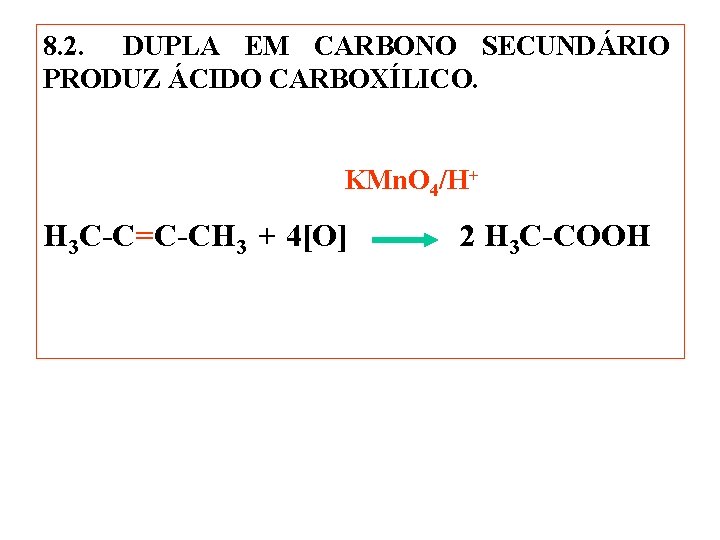
8. 2. DUPLA EM CARBONO SECUNDÁRIO PRODUZ ÁCIDO CARBOXÍLICO. KMn. O 4/H+ H 3 C-C=C-CH 3 + 4[O] 2 H 3 C-COOH

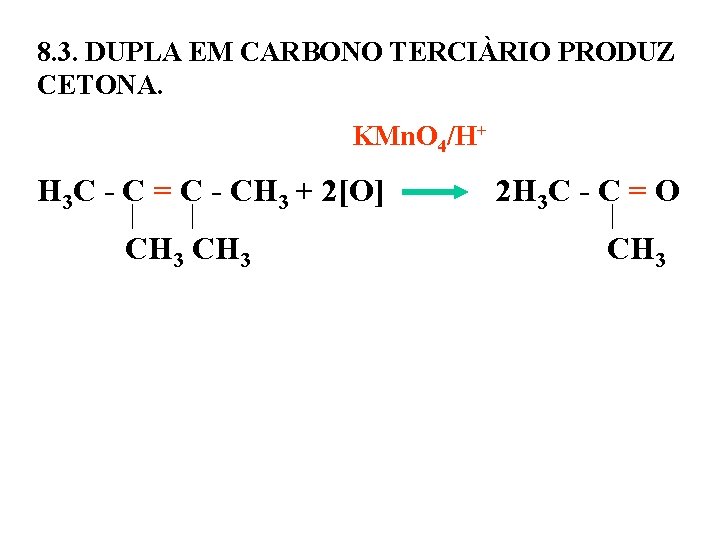
8. 3. DUPLA EM CARBONO TERCIÀRIO PRODUZ CETONA. KMn. O 4/H+ H 3 C - C = C - CH 3 + 2[O] 2 H 3 C - C = O CH 3

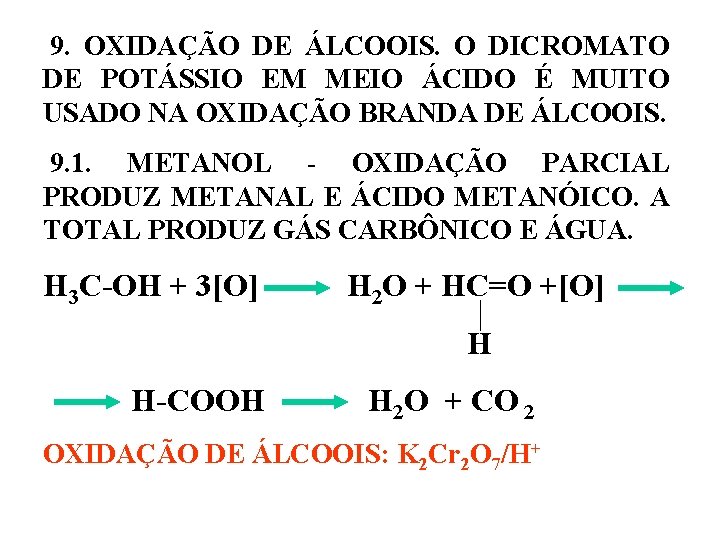
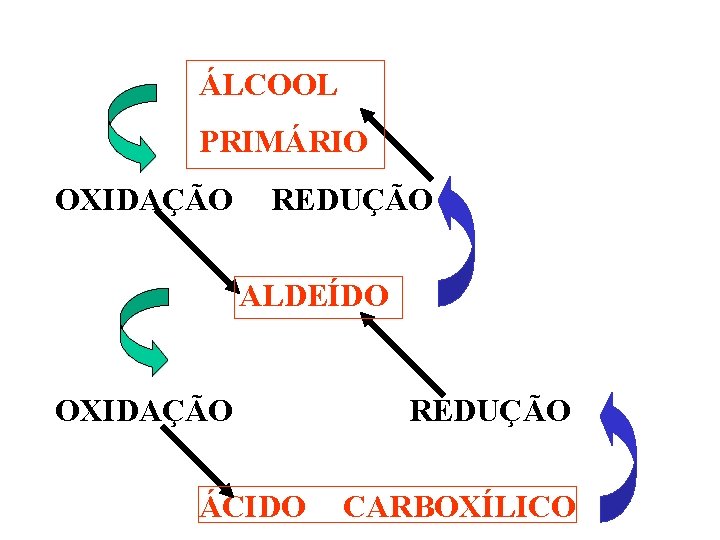
9. OXIDAÇÃO DE ÁLCOOIS. O DICROMATO DE POTÁSSIO EM MEIO ÁCIDO É MUITO USADO NA OXIDAÇÃO BRANDA DE ÁLCOOIS. 9. 1. METANOL - OXIDAÇÃO PARCIAL PRODUZ METANAL E ÁCIDO METANÓICO. A TOTAL PRODUZ GÁS CARBÔNICO E ÁGUA. H 3 C-OH + 3[O] H 2 O + HC=O +[O] H H-COOH H 2 O + CO 2 OXIDAÇÃO DE ÁLCOOIS: K 2 Cr 2 O 7/H+

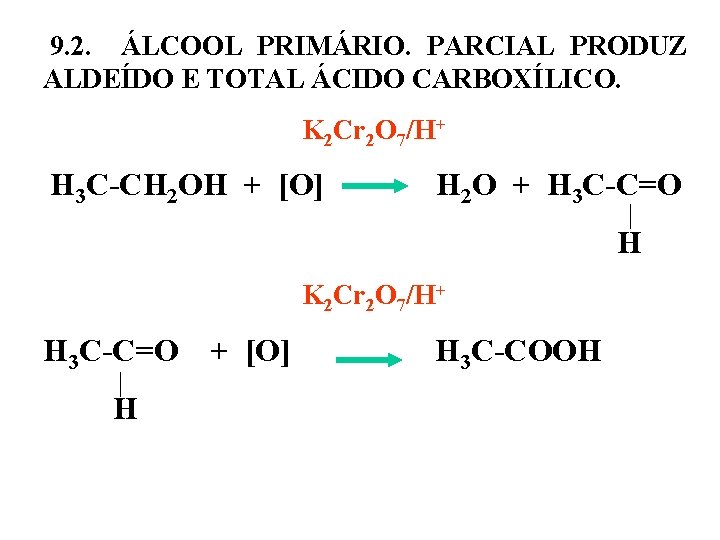
9. 2. ÁLCOOL PRIMÁRIO. PARCIAL PRODUZ ALDEÍDO E TOTAL ÁCIDO CARBOXÍLICO. K 2 Cr 2 O 7/H+ H 3 C-CH 2 OH + [O] H 2 O + H 3 C-C=O H K 2 Cr 2 O 7/H+ H 3 C-C=O + [O] H H 3 C-COOH

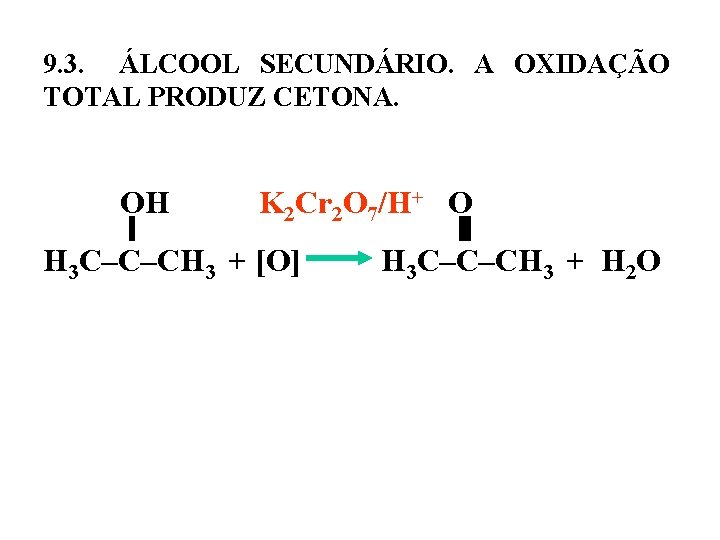
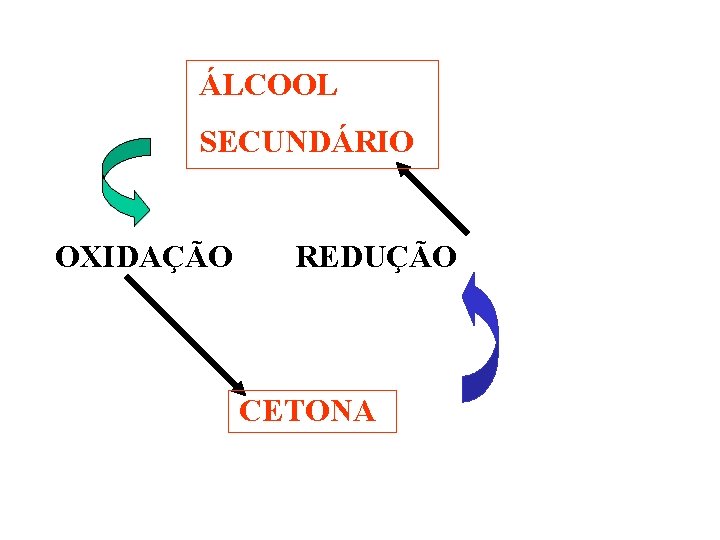
9. 3. ÁLCOOL SECUNDÁRIO. A OXIDAÇÃO TOTAL PRODUZ CETONA. OH K 2 Cr 2 O 7/H+ O H 3 C–C–CH 3 + [O] H 3 C–C–CH 3 + H 2 O
![9 4 O ÁLCOOL TERCIÁRIO NÃO OXIDA OH H 3 CCCH 3 O 9. 4. O ÁLCOOL TERCIÁRIO NÃO OXIDA OH H 3 C–C–CH 3 + [O]](https://slidetodoc.com/presentation_image/33cc6063e320f1e84f954dea2472e328/image-49.jpg)
9. 4. O ÁLCOOL TERCIÁRIO NÃO OXIDA OH H 3 C–C–CH 3 + [O] NÃO REAGE CH 3

10. REDUÇÃO DE ÁCIDOS, ALDEÍDOS E CETONAS. OCORRE COM ZINCO EM PRESENÇA DE ÁCIDO CLORÍDRICO. 10. 1. ALDEÍDO. REDUÇÃO TOTAL PRODUZ ÁLCOOL PRIMÁRIO H 3 C-C=O + 2[H] H 3 C-CH 2 -OH H

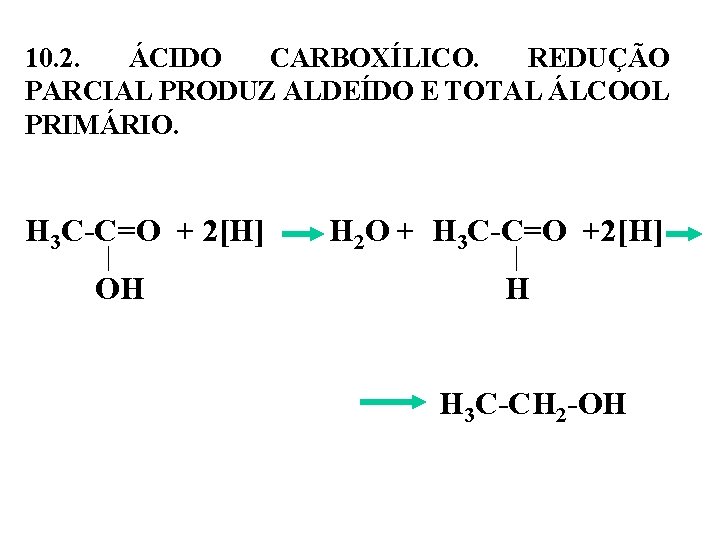
10. 2. ÁCIDO CARBOXÍLICO. REDUÇÃO PARCIAL PRODUZ ALDEÍDO E TOTAL ÁLCOOL PRIMÁRIO. H 3 C-C=O + 2[H] H 2 O + H 3 C-C=O +2[H] OH H 3 C-CH 2 -OH

ÁLCOOL PRIMÁRIO OXIDAÇÃO REDUÇÃO ALDEÍDO OXIDAÇÃO REDUÇÃO ÁCIDO CARBOXÍLICO

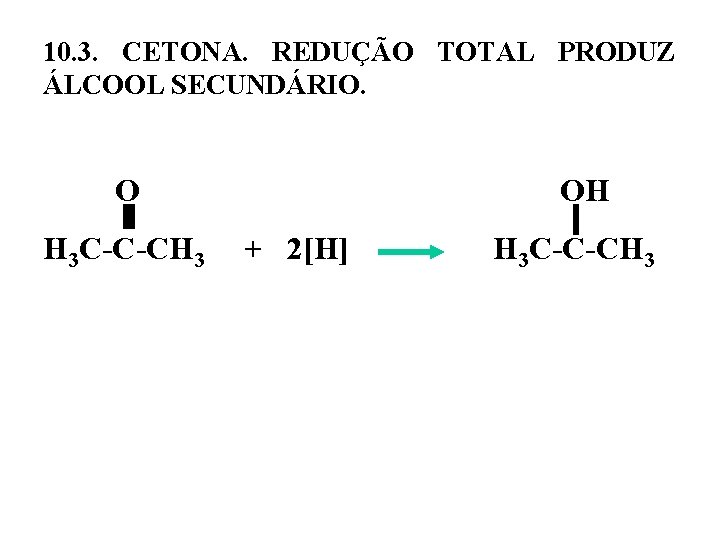
10. 3. CETONA. REDUÇÃO TOTAL PRODUZ ÁLCOOL SECUNDÁRIO. O OH H 3 C-C-CH 3 + 2[H] H 3 C-C-CH 3

ÁLCOOL SECUNDÁRIO OXIDAÇÃO REDUÇÃO CETONA
 Nicas level 1 assessment criteria
Nicas level 1 assessment criteria Nicas de estudio
Nicas de estudio Nv-email.org
Nv-email.org Partners peoplesoft ibridge
Partners peoplesoft ibridge Houze.org/bibb
Houze.org/bibb Commolit.org
Commolit.org Lbnl org chart
Lbnl org chart Www.cipfa.org
Www.cipfa.org Microprocessor
Microprocessor Ielts customer service
Ielts customer service El yunque rainforest food web
El yunque rainforest food web Read works.org answers
Read works.org answers Cciw.org
Cciw.org Molview.org extension
Molview.org extension Www.digitalliteracyassessment.org
Www.digitalliteracyassessment.org Esti 26 horarios de clases
Esti 26 horarios de clases Interventioncentral.org reading
Interventioncentral.org reading Http://nineplanets.org/
Http://nineplanets.org/ Strategic and competitive intelligence professionals
Strategic and competitive intelligence professionals Pierpass tmf
Pierpass tmf Yeastgenome.org
Yeastgenome.org Gl library
Gl library Www.iso.org in sinhala
Www.iso.org in sinhala Irn.org anatomy and physiology
Irn.org anatomy and physiology Sqa scots language
Sqa scots language Www.ocsd.org warrants
Www.ocsd.org warrants Imcpl.org login
Imcpl.org login Mikrobit british council org
Mikrobit british council org Florida blue org chart
Florida blue org chart Diesse.org
Diesse.org Www.fcclainc
Www.fcclainc Www.teachingenglish.org.uk
Www.teachingenglish.org.uk Accessexcellence.org
Accessexcellence.org Www.isotools.org
Www.isotools.org Clsafetycheck.org
Clsafetycheck.org Read write think
Read write think Canvas hallco
Canvas hallco What is the name of georgia fccla publication
What is the name of georgia fccla publication Ncdeca.org
Ncdeca.org Http://www.stopdisastersgame.org/
Http://www.stopdisastersgame.org/ Http://library.thinkquest.org
Http://library.thinkquest.org Https://bigfuture.collegeboard.org/college-search
Https://bigfuture.collegeboard.org/college-search Chicken leg dissection lab
Chicken leg dissection lab Ascelibrary
Ascelibrary Iec http://www.iec.ch
Iec http://www.iec.ch Www.sciencebuddies.org
Www.sciencebuddies.org Greenschool edupage.org
Greenschool edupage.org Long island marthoma church
Long island marthoma church Https learningapps org display
Https learningapps org display Icas score levels
Icas score levels Hics level 1
Hics level 1 Doral academy - jam
Doral academy - jam Www.ritap.org
Www.ritap.org La.ldschurch.org/online
La.ldschurch.org/online Esol britishcouncil org
Esol britishcouncil org