Reaes de Oxidao So denominadas reaes de oxidao



![[O] Álcool primário [O] Aldeído parcial OH H 3 C ¾ C¾H Ácido carboxílico [O] Álcool primário [O] Aldeído parcial OH H 3 C ¾ C¾H Ácido carboxílico](https://slidetodoc.com/presentation_image_h/88a566e3ae3e689d317cbb781374f881/image-9.jpg)
![[O] Álcool secundário OH H 3 C ¾ Cetona [O] C ¾ CH 3 [O] Álcool secundário OH H 3 C ¾ Cetona [O] C ¾ CH 3](https://slidetodoc.com/presentation_image_h/88a566e3ae3e689d317cbb781374f881/image-10.jpg)
- Slides: 13

Reações de Oxidação São denominadas reações de oxidação toda reação que ocorre entre um composto orgânico e o elemento químico oxigênio (O), devido ao fato de haver um aumento do nox dos átomos de carbono envolvidos.

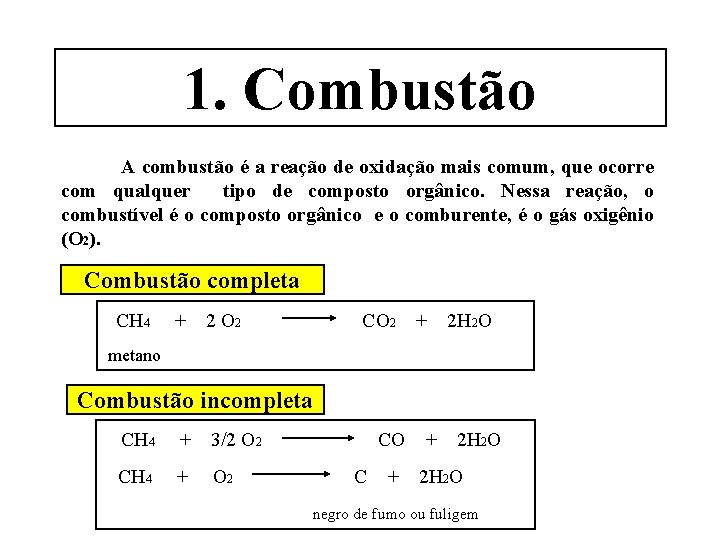
1. Combustão A combustão é a reação de oxidação mais comum, que ocorre com qualquer tipo de composto orgânico. Nessa reação, o combustível é o composto orgânico e o comburente, é o gás oxigênio (O 2). Combustão completa CH 4 + 2 O 2 CO 2 + 2 H 2 O metano Combustão incompleta CH 4 + 3/2 O 2 CH 4 + O 2 CO C + + 2 H 2 O negro de fumo ou fuligem

2. Oxidação branda Ocorre com hidrocarbonetos insaturados e o elemento oxigênio. A principal aplicação dessa reação consiste na diferenciação de alcenos e cicloalcanos, que são isômeros de cadeia, pois apenas os alcenos sofrerão esse tipo de reação. C 3 H 6 OH H 2 C = CH ¾ CH 3 + [O] H 3 C ¾ CH 2 propeno CH 2 H 2 C CH 2 ciclopropano + [O] OH não reage

3. Oxidação enérgica Oxidantes enérgicos tais como KMn. O 4/H 2 SO 4 ; K 2 Cr 2 O 7/H 2 SO 4 ; etc, oxidam os alcenos com ruptura da dupla ligação, dando cetonas e/ou ácidos carboxílicos. ALCENO R ¾ C = C ¾ R 1 R 2 1° Caso: R, R 1, R 2 e R 3 CH 3 ¾ C = C ¾ CH 2 ¾ CH 3 2, 3 -dimetil-2 -penteno R 3 ¹ H [O] CH 3 ¾ C = O CH 3 propanona + O = C ¾ CH 2 ¾ CH 3 butanona

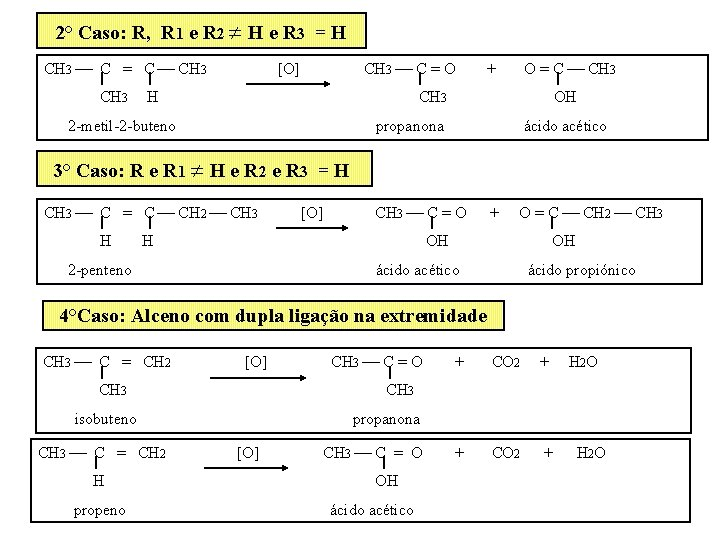
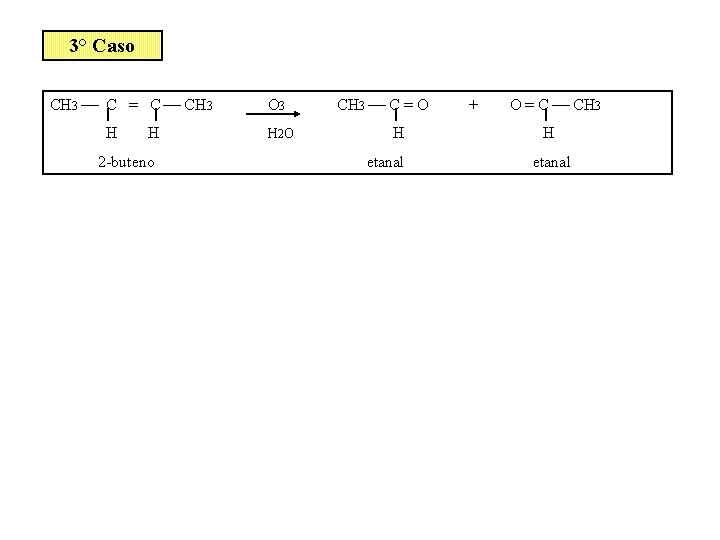
2° Caso: R, R 1 e R 2 ¹ H e R 3 = H CH 3 ¾ C = C ¾ CH 3 ¾ C = O [O] H O = C ¾ CH 3 + CH 3 2 -metil-2 -buteno OH propanona ácido acético 3° Caso: R e R 1 ¹ H e R 2 e R 3 = H CH 3 ¾ C = C ¾ CH 2 ¾ CH 3 H [O] CH 3 ¾ C = O H + O = C ¾ CH 2 ¾ CH 3 OH 2 -penteno OH ácido acético ácido propiónico 4°Caso: Alceno com dupla ligação na extremidade CH 3 ¾ C = CH 2 [O] CH 3 H propeno + CO 2 + H 2 O CH 3 isobuteno CH 3 ¾ C = CH 2 CH 3 ¾ C = O propanona [O] CH 3 ¾ C = O OH ácido acético H 2 O

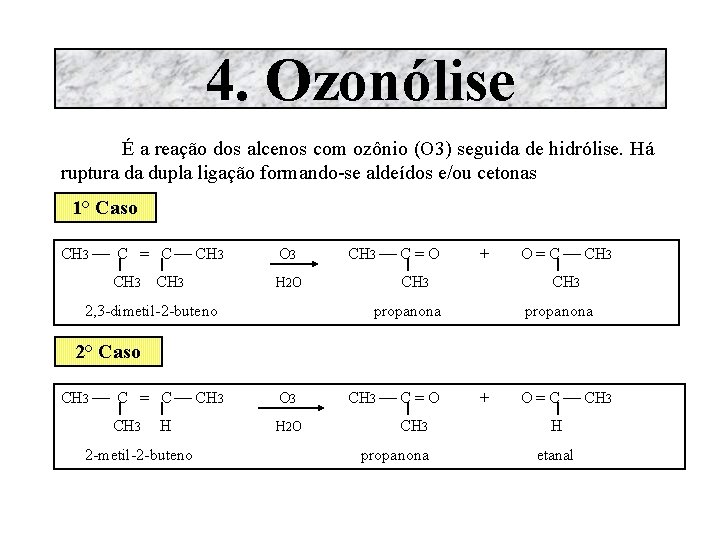
4. Ozonólise É a reação dos alcenos com ozônio (O 3) seguida de hidrólise. Há ruptura da dupla ligação formando-se aldeídos e/ou cetonas 1° Caso CH 3 ¾ C = C ¾ CH 3 O 3 H 2 O 2, 3 -dimetil-2 -buteno CH 3 ¾ C = O + CH 3 O = C ¾ CH 3 propanona 2° Caso CH 3 ¾ C = C ¾ CH 3 H 2 -metil-2 -buteno O 3 H 2 O CH 3 ¾ C = O CH 3 propanona + O = C ¾ CH 3 H etanal

3° Caso CH 3 ¾ C = C ¾ CH 3 H H 2 -buteno O 3 H 2 O CH 3 ¾ C = O H etanal + O = C ¾ CH 3 H etanal

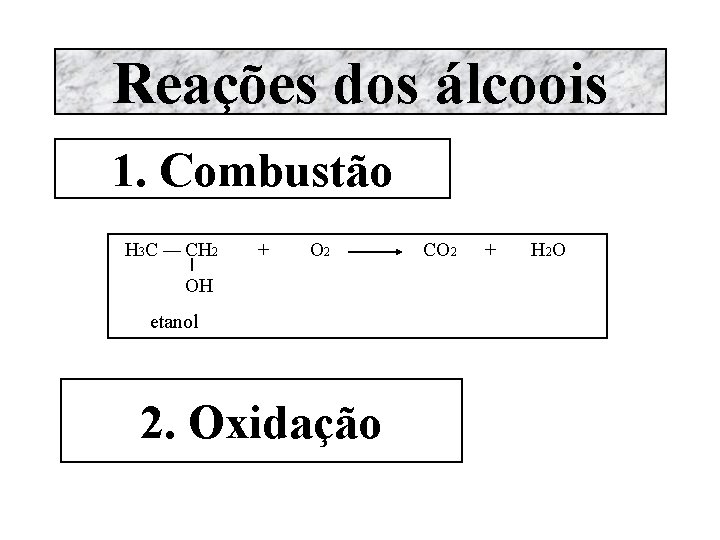
Reações dos álcoois 1. Combustão H 3 C ¾ CH 2 + O 2 OH etanol 2. Oxidação CO 2 + H 2 O
![O Álcool primário O Aldeído parcial OH H 3 C ¾ C¾H Ácido carboxílico [O] Álcool primário [O] Aldeído parcial OH H 3 C ¾ C¾H Ácido carboxílico](https://slidetodoc.com/presentation_image_h/88a566e3ae3e689d317cbb781374f881/image-9.jpg)
[O] Álcool primário [O] Aldeído parcial OH H 3 C ¾ C¾H Ácido carboxílico total [O] H 3 C ¾ C = O H 3 C¾ C = O H H OH etanol ou álcool etílico etanal ou aldeído acético ácido etanóico ou ácido acético
![O Álcool secundário OH H 3 C ¾ Cetona O C ¾ CH 3 [O] Álcool secundário OH H 3 C ¾ Cetona [O] C ¾ CH 3](https://slidetodoc.com/presentation_image_h/88a566e3ae3e689d317cbb781374f881/image-10.jpg)
[O] Álcool secundário OH H 3 C ¾ Cetona [O] C ¾ CH 3 H 3 C ¾ CH 3 H O 2 -propanol propanona ou acetona [O] Álcool terciário não reage

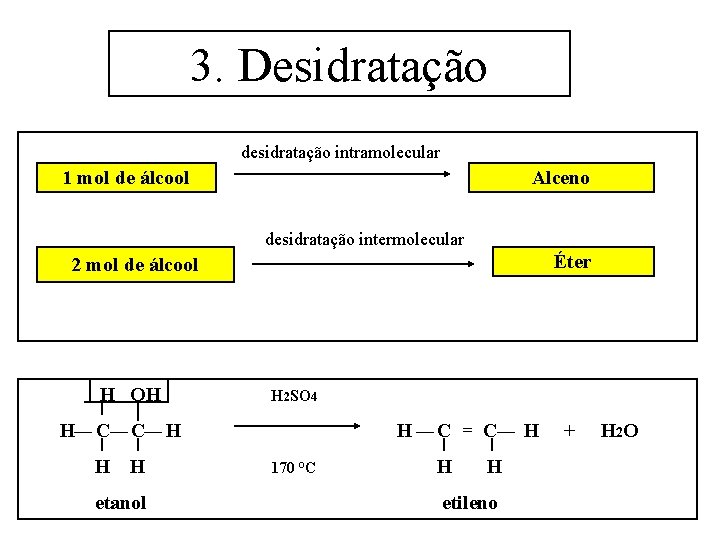
3. Desidratação desidratação intramolecular 1 mol de álcool Alceno desidratação intermolecular Éter 2 mol de álcool H OH H 2 SO 4 H ¾ C¾ C¾ H H H etanol H ¾ C = C¾ H 170 °C H H etileno + H 2 O

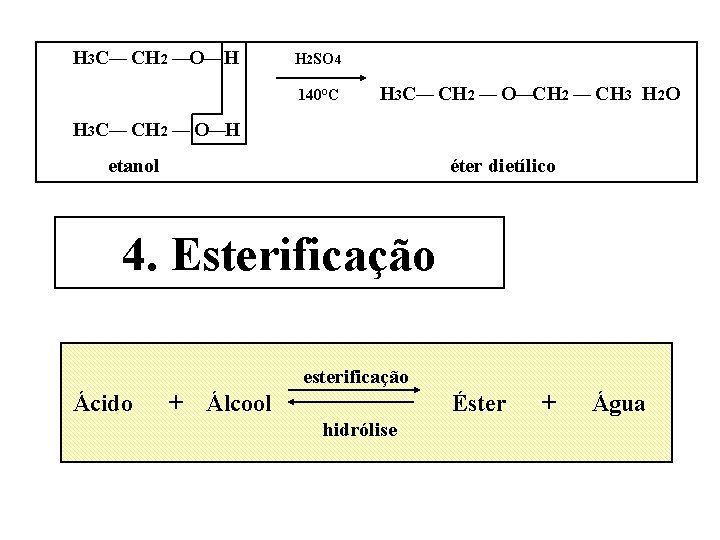
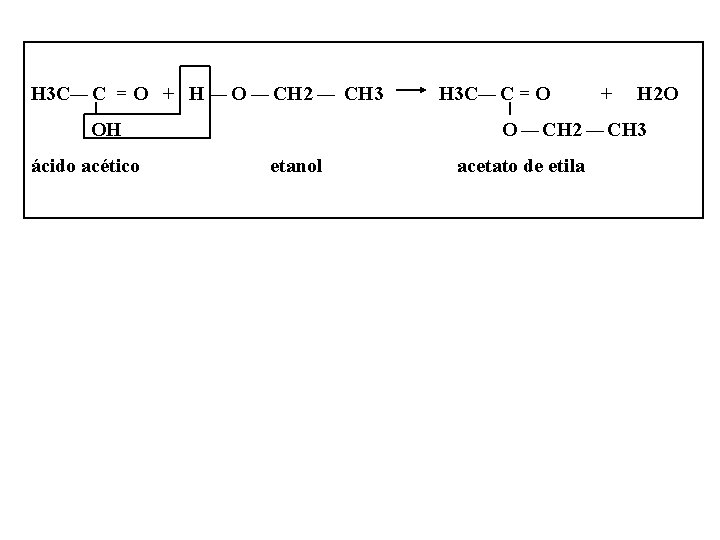
H 3 C¾ CH 2 ¾O¾ H H 2 SO 4 140°C H 3 C¾ CH 2 ¾ O¾CH 2 ¾ CH 3 H 2 O H 3 C¾ CH 2 ¾ O¾H etanol éter dietílico 4. Esterificação esterificação Ácido + Álcool Éster hidrólise + Água

H 3 C¾ C = O + H ¾ O ¾ CH 2 ¾ CH 3 OH ácido acético H 3 C¾ C = O + H 2 O O ¾ CH 2 ¾ CH 3 etanol acetato de etila