Mistura de solues com reao qumica Misturouse x


- Slides: 5

Mistura de soluções com reação química

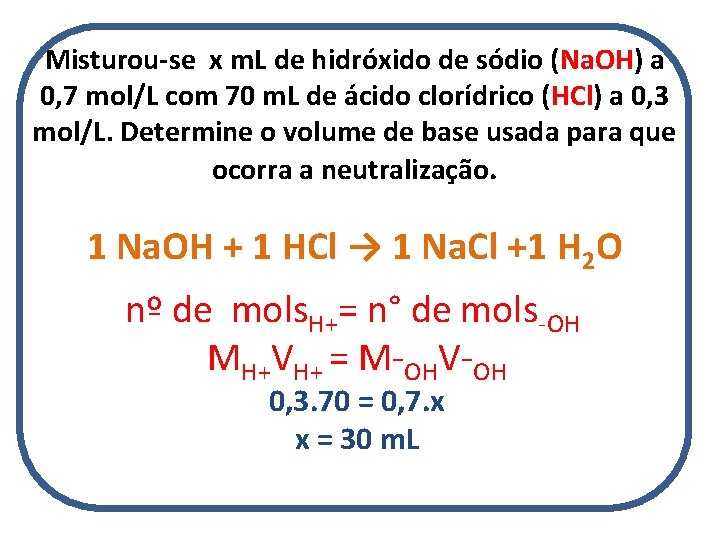
Misturou-se x m. L de hidróxido de sódio (Na. OH) a 0, 7 mol/L com 70 m. L de ácido clorídrico (HCl) a 0, 3 mol/L. Determine o volume de base usada para que ocorra a neutralização. 1 Na. OH + 1 HCl → 1 Na. Cl +1 H 2 O nº de mols. H+= n° de mols-OH MH+VH+ = M-OHV-OH 0, 3. 70 = 0, 7. x x = 30 m. L

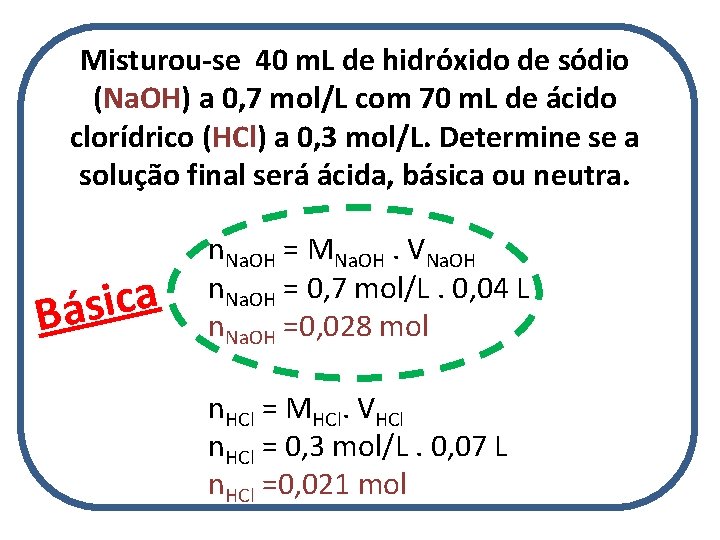
Misturou-se 40 m. L de hidróxido de sódio (Na. OH) a 0, 7 mol/L com 70 m. L de ácido clorídrico (HCl) a 0, 3 mol/L. Determine se a solução final será ácida, básica ou neutra. a c i s Bá n. Na. OH = MNa. OH. VNa. OH n. Na. OH = 0, 7 mol/L. 0, 04 L n. Na. OH =0, 028 mol n. HCl = MHCl. VHCl n. HCl = 0, 3 mol/L. 0, 07 L n. HCl =0, 021 mol

Para neutralizar 200 m. L de solução 3, 20 mol/L de ácido sulfuroso (H 2 SO 3), um laboratorista misturou a ela 800 ml de solução 2, 00 mol/L de hidróxido de potássio (KOH). Considerando o exposto, qual será a característica da solução resultante? a) básica, com concentração do excesso de 0, 23 mol/L. b) ácida, com concentração do excesso de 0, 23 mol/L. c) básica, com concentração do excesso de 0, 32 mol/L. d) ácida, com concentração do excesso de 0, 32 mol/L. e) neutra. (Uncisal) O hidróxido de alumínio, Al(OH)3, é utilizado para combater acidez estomacal. Para neutralizar o ácido clorídrico (HCl) contido em 200 m. L de suco gástrico com concentração de HCl 0, 1 mol/L, é necessária uma massa, em gramas, do referido antiácido igual a: Dado: massa molar Al(OH)3 = 78 g. mol– 1.

(UFRGS) Solução A + Solução B → Solução final Ca(OH)2 HNO 3 4 g 6, 3 g Após a reação, observa-se que a solução final é: a) neutra, pois não há reagente em excesso. b) ácida, devido a um excesso de 0, 6 g de HNO 3. c) ácida, devido a um excesso de 0, 3 g de HNO 3. d) neutra, devido à formação de Ca(NO 3)2. e) básica, devido a um excesso de 0, 3 g de Ca(OH)2. Calcule o volume, em litros, de uma solução aquosa de ácido clorídrico, cuja concentração é de 5, 0 mol/L, necessária para neutralizar 80 m. L de uma solução aquosa de hidróxido de potássio (concentração é de 8 mol/L). a) 0, 0128 b) 12, 8 c) 128 d) 0, 128 e) 1, 28









