SOLUES DILUIES DE SOLUES Quando acrescentamos mais solvente












- Slides: 12

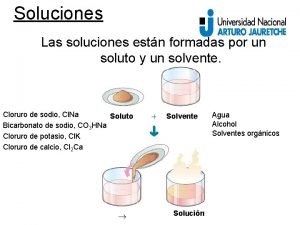
SOLUÇÕES DILUIÇÕES DE SOLUÇÕES Quando acrescentamos mais solvente para diminuir a concentração até o valor necessário, chamamos esse processo de diluição.

SOLUÇÕES Quando adicionamos mais solvente, provocamos um aumento no volume da solução, porém a quantidade de soluto permanece constante. quantidade inicial de soluto = quantidade final de soluto

SOLUÇÕES Assim temos: RELAÇÃO Conc. Comum Ci. Vi = Cf. Vf (g/L) Molaridade Mi. Vi = Mf. Vf (mol/L) Título Ti. Vi = Tf. Vf

SOLUÇÕES Aplicação: Deseja-se preparar 100 m. L de solução de hidróxido de sódio 0, 3 mol /L, tendo-se à disposição uma solução de 2 mol/L. Que volume deverá ser utilizado? Mi. Vi = Mf. Vf , logo: 2. Vi = 0, 3. 0, 1 => Vi = 0, 015 L (15 m. L)

SOLUÇÕES MISTURA DE SOLUÇÕES Mistura de soluções de mesmo soluto: Ao misturarmos soluções em que não ocorrem reação química, o soluto mantém-se inalterado, por exemplo:

SOLUÇÕES Adicionando em um único frasco 50, 0 m. L de uma sol. de Na. Cl 2, 0 g/L (C 1) e 80, 0 m. L de outra solução de Na. Cl 2, 5 g/L (C 2), teremos: m 1 = 2. 0, 05 = 0, 1 g e m 2 = 2, 5. 0, 08 = 0, 2 g Logo Cf = 0, 1 + 0, 2 = 0, 3 = 2, 3 g/L 0, 05 + 0, 08 0, 13

SOLUÇÕES Mistura de soluções de solutos diferentes: O soro glicofisiológico é uma solução usada como reidratante. Ele é formado pela adição em água dos solutos Na. Cl e C H O. Qual é a concentração no soro, sabendo que foram misturados as seguintes soluções: 6 12 6

SOLUÇÕES Solução A (Na. Cl): C = 18 g/L e. V = 50 m. L Solução B (C H O ): C = 100 g/L e. V = 50 m. L 6 12 6 Massa final de Na. Cl = 0, 9 g Massa final de C H O = 5, 0 g Volume final da solução = 100 m. L = 0, 1 L 6 12 6

SOLUÇÕES Para calcular a concentração da solução final, calcula-se a concentração de cada soluto isoladamente: Concentração final da solução de Na. Cl: 18 g/L. 0, 05 L = CNa. Clf. 0, 1 L C = 9 g/L Na. Clf Concentração final da solução de C H O : 100 g/L. 0, 05 L = CC H O f. 0, 1 L CC H O f = 50 g/L 6 6 12 12 6 6

SOLUÇÕES Mistura de soluções com reação química: Quando ocorre uma reação química entre as soluções, utilizamos uma técnica chamada de titulação, na qual consiste em determinar a concentração de uma das soluções misturadas por meio da verificação do ponto de equivalência:

SOLUÇÕES Aplicação: Durante uma titulação, foram utilizados 10 m. L de Na. OH 0, 1 mol/L para neutralizar 25 m. L de HCl. Determine a concentração molar do HCl. Reação de neutralização: 1 Na. OH + 1 HCl 1 Na. Cl + 1 H 2 O

SOLUÇÕES Logo , temos: Na. OH: nºmol = M. V = 0, 1 mol/L. 0, 01 L = 0, 001 mol No ponto de equivalência, temos: HCl: nºmol = nºmol do Na. OH = 0, 001 mol Logo a concentração do HCl, é: M = 0, 001 mol = 0, 04 mol/L 0, 025 L
 Homognea
Homognea Parte por milhao
Parte por milhao Ci . vi = cf . vf
Ci . vi = cf . vf Um mais um é sempre mais que dois projeto de vida
Um mais um é sempre mais que dois projeto de vida Quando tudo não der mais certo
Quando tudo não der mais certo Tudo era apenas uma brincadeira
Tudo era apenas uma brincadeira Quando tudo não der mais certo
Quando tudo não der mais certo Estrazione con solvente zanichelli
Estrazione con solvente zanichelli Esperimento miscugli e soluzioni
Esperimento miscugli e soluzioni Amalgama dental soluto y disolvente
Amalgama dental soluto y disolvente Agua solvente universal
Agua solvente universal Equivalente gramos
Equivalente gramos Tamizado metodo de separacion
Tamizado metodo de separacion