Termoqumica Qumica Ciencia que estudia la materia y























- Slides: 28

Termoquímica

Química: Ciencia que estudia la materia y sus transformaciones Termoquímica: Estudio de las transferencias de calor en las reacciones químicas. Cálculo de la energía de las reacciones químicas

CONTENIDO 1. - Calor de reacción 2. - Entalpía estándar de reacción Entalpía estándar de formación 3. - Leyes Termoquímicas Ley de Hess 4. - Entalpías de cambio de fase. Energías de enlace. Calor de reacción a volumen constante. 4. - Efecto de la temperatura en las entalpías de reacción. Ecuación de Kirchhoff 5. - Variación de entropía y de energía libre de reacción

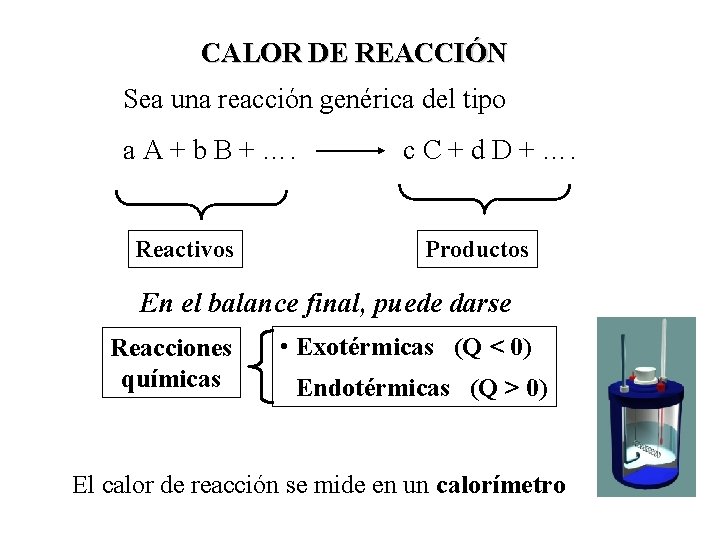
CALOR DE REACCIÓN Sea una reacción genérica del tipo a A + b B + …. Reactivos c C + d D + …. Productos En el balance final, puede darse Reacciones químicas • Exotérmicas (Q < 0) • Endotérmicas (Q > 0) El calor de reacción se mide en un calorímetro

Recipiente Adiabático • Exotérmicas (Q < 0) T > 0 • Endotérmicas (Q > 0) T < 0 • Exotérmicas (Q < 0) Recipiente Diatérmico Qv = Uprod - Ureac Qp = Hprod - Hreac Sí • Endotérmicas (Q > 0) H = U + (PV) = U + P V ¿Intervienen gases? (G. I) H = U + (n. RT) H = U + RT ngas T = 0 No H @ U Si T=cte

ENTALPÍA ESTÁNDAR DE REACCIÓN. Entalpía estándar de reacción ( HTº): H de la reacción a T, cuando los números estequiométricos de moles de los reactivos puros, separados y en sus estados estándar a T, se transforman en los números estequiométricos de moles de los productos puros, separados, en sus estados estándar a la temperatura T. a A + b B + …. c C + d D + …. Para hacer el balance energético se considera que las reacciones tienen lugar hasta el consumo total de los reactivos

Estado estándar de una sustancia a T : • Sólido o Líquido : sustancia pura a T y 1 bar. • Gas : gas ideal a T y 1 bar. • Disoluciones Ideales (Sólidas o líquidas) : • Disoluciones Diluidas Ideales : sólidos o líquidos puros a la T y P de la disolución. • Disolvente: sólido o líquido puro a T y P de la disolución. • Soluto: sustancia a la T y P de la disolución, cuyas propiedades son extrapoladas de las del soluto en disoluciones muy diluidas, pero en el límite de s=1 • Disoluciones Reales : • Convenio de las Disoluciones Ideales. • Convenio de las Disoluciones Diluidas Ideales Estado de referencia de una sustancia a T : La forma más estable de un elemento a T y P=1 bar

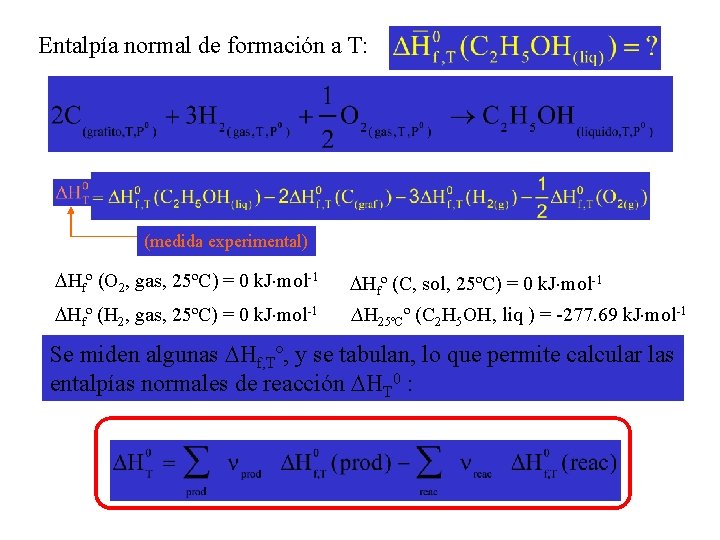
a A + b B + …. ¿Cuánto vale c C + d D + …. ? Arbitrariamente: La entalpía normal de formación de cualquier elemento en su forma de referencia a la temperatura T, es cero Ej: Br 2 (líquido) a P=1 bar y T < 331, 5 K Br 2 (gas) a P=1 bar y T > 331, 5 K Br 2 (gas) Br 2 (liq) Entalpía normal de formación a T: El cambio de H en la reacción de formación de 1 mol de sustancia en su estado normal a T, a partir de los elementos que la constituyen en su forma de referencia a T C (grafito, 307 K, P 0) C (diamante, 307 K, P 0)

ENTALPIAS DE FORMACION ESTANDAR Corresponden al calor absorbido o desprendido en procesos ligadas a la formación de un mol de sustancia en su estado más estable a 1 atmósfera y 298 K a partir de los elementos que la componen en su forma más estable en idénticas condiciones. ½ Br 2 (l) + ½ H 2 (g) HBr (g) Así escrita, porque a 1 atm. y 298 K, el bromo es un líquido, el hidrógeno un gas y el bromuro de hidrógeno, otro gas.

Entalpía normal de formación a T: (medida experimental) Hfº (O 2, gas, 25ºC) = 0 k. J×mol-1 Hfº (C, sol, 25ºC) = 0 k. J×mol-1 Hfº (H 2, gas, 25ºC) = 0 k. J×mol-1 ∆H 25ºCº (C 2 H 5 OH, liq ) = -277. 69 k. J×mol-1 Se miden algunas Hf, Tº, y se tabulan, lo que permite calcular las entalpías normales de reacción HT 0 :


LEYES TERMOQUÍMICAS. Consecuencia del 1º Principio de la Termodinámica El cambio energético que acompaña a una reacción química es de magnitud igual, pero de signo opuesto al que va asociado a la reacción de sentido opuesto. H = -393. 5 k. J H = 393. 5 k. J H: función de estado

LEYES TERMOQUÍMICAS. Ley de Hess Consecuencia del 1º Principio de la Termodinámica La energía intercambiada en forma de calor en una reacción química es la misma tanto si la reacción ocurre en una etapa como si ocurre en varias. H = -110. 5 k. J H = -393. 5 k. J H = +283 k. J H = -110. 5 k. J H: función de estado

Ejemplo: Dadas las reacciones (1) H 2(g) + ½ O 2(g) H 2 O(g) H 10 = – 241’ 8 k. J (2) H 2(g) + ½ O 2(g) H 2 O(l) H 20 = – 285’ 8 k. J calcular la entalpía de vaporización del agua en condiciones estándar. La reacción de vaporización es. . . (3) H 2 O(l) H 2 O(g) H 03 = ? (3) puede expresarse como (1) – (2), luego H 03 = H 01 – H 02 = – 241’ 8 k. J – (– 285’ 8 k. J) = 44 k. J H 0 vaporización = 44 k. J /mol

Esquema de la ley de Hess H H 2(g) + ½ O 2(g) H 10 = – 241’ 8 k. J H 20 = – 285’ 8 k. J H 2 O(g) H 30 = 44 k. J H 2 O(l)

RESUMEN DE REGLAS LEY DE HESS 1. UNA REACCIÓN SE PUEDE OBTENER POR COMBINACIÓN DE OTRAS MEDIANTE SUMAS, RESTAS, MULTIPLICACIONES, ETC. 2. LA ENTALPIA DE ESA REACCION SE OBTIENE MEDIANTE OPERACIONES MATEMATICAS SIMILARES CON LAS ENTALPIAS DE LAS REACCIONES CORRESPONDIENTES. 3. REACCIONES INVERSAS TIENEN ENTALPIAS IGUALES PERO CAMBIADAS DE SIGNO

ENTALPÍA DE REACCIÓN • Entalpía de Combustión H en la reacción de oxidación de una sustancia, para dar CO 2, H 2 O y N 2 si la sustancia está constituida por C, H, y N Ej: Combustión de la glucosa en la actividad celular • Entalpía de Enlace H en la reacción de ruptura (formación) de un enlace químico (depende de la estructura del resto de la molécula)

Energía de enlace. • “Es la energía necesaria para romper un enlace de un mol de sustancia en estado gaseoso” • En el caso de moléculas diatómicas es igual que la energía de disociación: • A—B(g) A(g) + B(g) Hdis = Eenlace= Ee • Ejemplo: H 2(g) 2 H(g) H = 436 k. J • Es positiva (es necesario aportar energía al sistema) • Es difícil de medir. • Se suele calcular aplicando la ley de Hess.

Ejemplo: Calcular la energía del enlace H—Cl • • en el cloruro de hidrógeno conociendo Hf 0(HCl) cuyo valor es – 92, 3 k. J/mol y las entalpías de disociación del H 2 y del Cl 2 que son 436, 0 k. J/mol y 243, 4 k. J/mol, respectivamente. La reacción de disociación del HCl será: (4) HCl(g) H(g) + Cl(g) H 04= ? (1) ½H 2(g) + ½Cl 2(g) HCl(g) H 01 = – 92, 3 k. J (2) H 2(g) 2 H(g) H 02 = 436, 0 k. J (3) Cl 2(g) 2 Cl(g) H 03 = 243, 4 k. J (4) = –(1) + ½(2) + ½(3) H 04 = –(– 92, 3 k. J ) + ½(436, 0 k. J) + ½(243, 4 k. J) = = 432, 0 k. J Ee(HCl) = 432, 0 k. J/mol

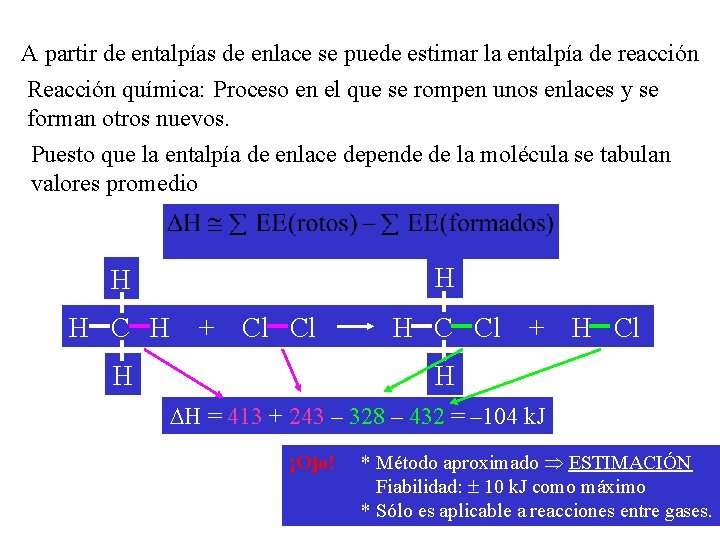
Cálculo de H 0 a partir de las Energía de enlace IMMPUY OR TA (disociación). NT E • Aplicando la ley de Hess en cualquier caso se obtiene la siguiente fórmula: H 0 = ni · Ee(enl. rotos) – nj · Ee(enl. formados) en donde ni representa el número de enlaces rotos y nj, los formados, de cada tipo.

A partir de entalpías de enlace se puede estimar la entalpía de reacción Reacción química: Proceso en el que se rompen unos enlaces y se forman otros nuevos. Puesto que la entalpía de enlace depende de la molécula se tabulan valores promedio H H H C H + Cl Cl H H C Cl + H Cl H H = 413 + 243 – 328 – 432 = – 104 k. J ¡Ojo! * Método aproximado Þ ESTIMACIÓN Fiabilidad: ± 10 k. J como máximo * Sólo es aplicable a reacciones entre gases.

Ejercicio E: Calcular el calor de combustión de propano a partir de los datos de energía de enlace de la tabla. • C 3 H 8 + 5 O 2 3 CO 2 + 4 H 2 O • Enlaces rotos: 8 C–H, 2 C–C y 5 O=O • Enlaces formados: • 6 C=O y 8 O–H • H 0 = Ee(e. rotos) – Ee(e. form. ) • H 0 = 8 Ee(C–H) + 2 Ee(C–C) + 5 Ee(O=O) – [6 Ee(C=O) + 8 Ee(O–H)] • H 0 = 8· 413 k. J + 2· 347 k. J +5· 499 k. J – (6· 745 k. J + 8· 460 k. J) = – 1657 k. J H 0 comb(C 3 H 8) = – 1657 k. J/mol Enlace Ee (k. J/mol) H–H 436 C–C 347 C=C 620 C C 812 O=O 499 Cl–C 243 C–H 413 C–O 315 C=O 745 O–H 460 Cl–H 432

CALORES DE DISOLUCIÓN Muchos procesos en Química ocurren en disolución y, sobre todo, en disolución acuosa. La disolución de una sustancia en agua a presión constante, proporciona entalpías experimentales de disolución que dependen de la cantidad de agua empleada HCl(g) + 10. H 2 O HCl(g) + 40. H 2 O HCl. 10 H 2 O HCl. 40 H 2 O ∆H 0 = - 16. 608 Kcal /mol ∆H 0 = - 17. 453 Kcal /mol Usando Hess, podemos hallar una entalpía de dilución HCl. 10 H 2 O + 30 H 2 O HCl. 40 H 2 O ∆H 0 = - 0. 845 Kcal /mol Si usamos mucha agua, hablamos de entalpía a dilución infinita HCl(g) + ∞H 2 O HCl. ∞H 2 O ∆∞H 0 = - 17. 960 Kcal /mol

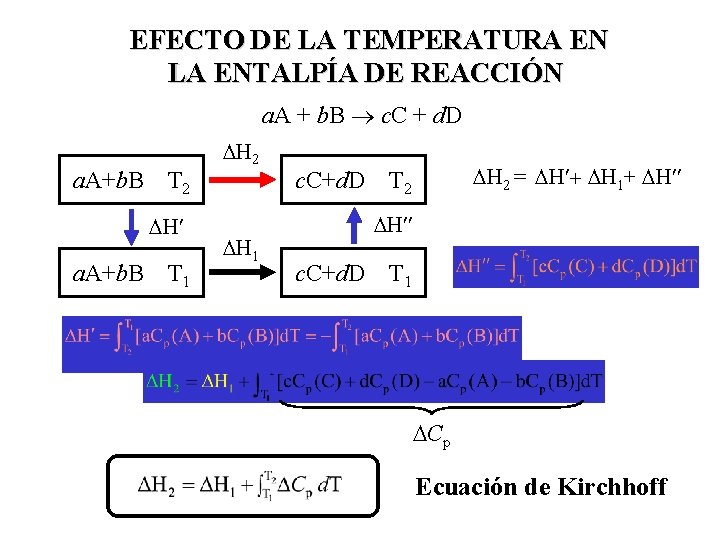
EFECTO DE LA TEMPERATURA EN LA ENTALPÍA DE REACCIÓN a. A + b. B c. C + d. D a. A+b. B T 2 H¢ a. A+b. B T 1 H 2 H 1 c. C+d. D H 2 = H¢+ H 1+ H¢¢ T 2 H¢¢ c. C+d. D T 1 Cp Ecuación de Kirchhoff

VARIACIÓN DE ENTROPÍA Y ENERGÍA LIBRE DE REACCIÓN a. A + b. B c. C + d. D Cálculo de entropía estándar de reacción ( ST 0) El Tercer Principio de la Termodinámica dice que la S 00 K de una sustancia pura en su forma condensada estable es cero (sin cambio de fase)

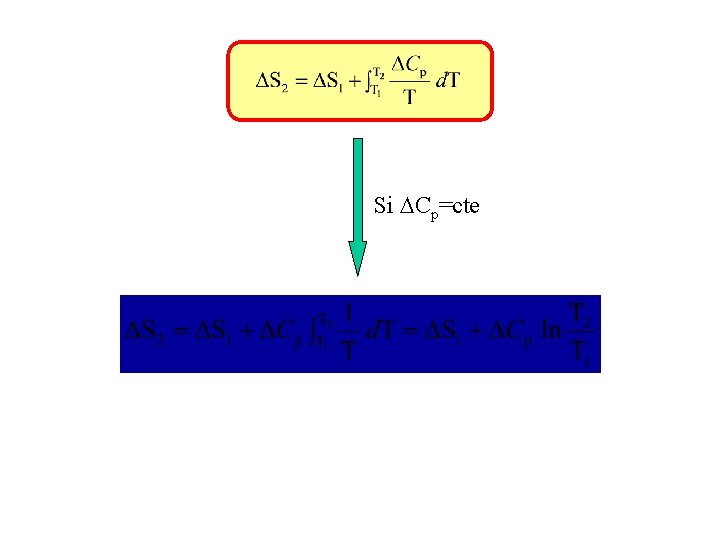
VARIACIÓN DE LA ENTROPÍA DE REACCIÓN CON LA TEMPERATURA. a. A + b. B c. C + d. D a. A+b. B T 2 S¢ a. A+b. B T 1 S 2 S 1 c. C+d. D T 2 S¢¢ c. C+d. D T 1 Cp/T S 2 = S¢+ S 1+ S¢¢

Si Cp=cte

Energía libre normal de formación ( Gfº) de una sustancia: Variación de energía libre en la formación de un mol de sustancia partir de sus elementos en su estado normal. (Unid: J×mol-1) • Si Gº < 0 reactivos productos: espontánea • Si Gº > 0 reactivos productos: no espontánea (reactivos ¬ productos: espontánea) • Si Gº = 0 estado de equilibrio: reactivos « productos Hfº Sº Hº Sº Gº = Hº – T Sº
 Ciencia experimental que estudia la materia
Ciencia experimental que estudia la materia Que es la ciencia formal
Que es la ciencia formal Tejidos animales
Tejidos animales Ciencia que estudia los suelos
Ciencia que estudia los suelos Clases de parrafo
Clases de parrafo Cinco magnitudes escalares
Cinco magnitudes escalares Mapa conceptual de silvicultura
Mapa conceptual de silvicultura La ciencia que estudia las bacterias
La ciencia que estudia las bacterias Que estudia la microeconomía
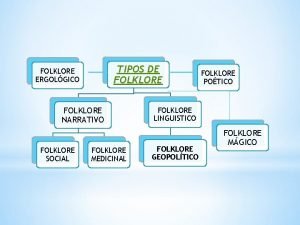
Que estudia la microeconomía Folclore narrativo
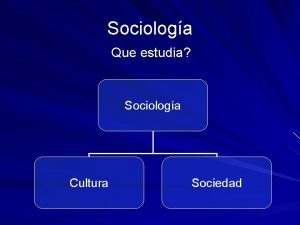
Folclore narrativo Que estudia la sociologia
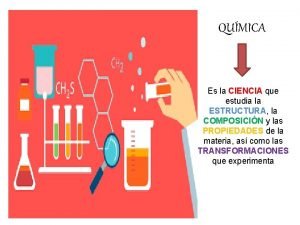
Que estudia la sociologia Que estudia la quimica aplicada
Que estudia la quimica aplicada Demoecologia
Demoecologia Perinisio
Perinisio Identicos
Identicos Sinecologia concepto
Sinecologia concepto Qué estudia la gramática
Qué estudia la gramática Antropologia trabajo social
Antropologia trabajo social Hidrosttica
Hidrosttica Perspectiva heterogénea
Perspectiva heterogénea Como se llama la carrera que estudia la biblia
Como se llama la carrera que estudia la biblia Filogenia que estudia
Filogenia que estudia Que estudia la termologia
Que estudia la termologia Que estudia la qu
Que estudia la qu Características de un hecho social
Características de un hecho social Clasificación de la logica
Clasificación de la logica Que es el sistema fonologico
Que es el sistema fonologico Fonologa
Fonologa Hererocromatina
Hererocromatina