LCE 108 QUMICA INORG NICA E ANALTICA AULAS






















- Slides: 32

LCE 108 - QUÍMICA INORG NICA E ANALÍTICA AULAS PRÁTICAS

OBJETIVO DA DISCIPLINA Introdução aos métodos clássicos e instrumentais de análise química, aplicados a ciências agrárias, abordando aspectos teóricos e práticos.

Por que um Engenheiro Agrônomo ou Engenheiro Florestal deve estudar métodos de análise química e a teoria envolvida?

Cenário 1: Agricultura em geral http: //www. baixaki. com. br/imagens/wpapers/BXK 10965_img_3319 p 800. jpg




ETAPAS DE UMA ANÁLISE QUÍMICA Definição do problema Escolha do método Preparo da amostra Amostragem Análise química Calibração Avaliação

Preparo para uma análise química • • • Boas práticas laboratoriais Segurança individual e coletiva Lista de materiais e reagentes Limpeza Aferição dos materiais e reagentes Preparo das soluções e amostra

Boas práticas laboratoriais • Não consumir alimentos e bebidas no laboratório. • Usar os equipamentos do laboratório apenas para seu propósito designado. • Assegurar-se que o líder de laboratório esteja informado de qualquer condição de falta de segurança. • Conhecer a localização e o uso correto dos equipamentos de segurança disponíveis. • Evitar perturbar ou distrair quem esteja realizando algum trabalho no laboratório.

Boas práticas laboratoriais • Verificar que tanto alunos quanto visitantes estejam equipados com os equipamentos de segurança apropriados. • Assegurar-se que todos os agentes que ofereçam algum risco estejam rotulados e estocados corretamente. • Seguir os procedimentos de descarte adequados para cada reagente ou material de laboratório. • Nunca pipetar ou sugar diretamente com a boca materiais biológicos, perigosos, cáusticos, tóxicos, radioativos ou cancerígenos.

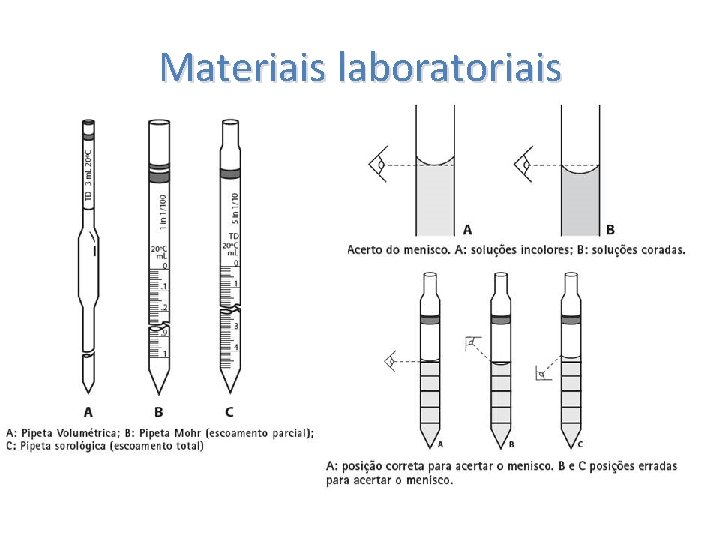
Materiais laboratoriais Óculos de segurança Jaleco para laboratório químico Data limite 16 -03 -2015 – após esta data não será permitido realizar as atividades práticas Calça e sapato fechado

Materiais laboratoriais Cadinho de porcelana Capsula de porcelana Cadinho de platina • Material resistente a temperaturas elevadas • Empregados em técnicas gravimétricas, procedimentos de secagens e fusão

Materiais laboratoriais Forno tipo Mufla Temperatura até 1600°C Dessecador Fechamento hermético Utiliza sílica gel para remover umidade Pinça tenaz para cadinho

Materiais laboratoriais Vidro de relógio Balança analítica Espátula

Materiais laboratoriais Balão volumétrico Proveta

Materiais laboratoriais

Materiais laboratoriais Béquer Funil de vidro Pera de sucção e transferência Bastão de agitação

Limpeza do Material • Todo o material utilizado deve ser lavado • Água (de torneira) e sabão até remoção de todo material visível • triplo enxague com água destilada • Retornar o material para bancada

PRÁTICA 1 - PREPARO DE SOLUÇÕES “Solução é toda mistura homogênea de duas ou mais substâncias. ” • Partículas dispersas são moléculas ou íons comuns, com diâmetro menor que 1 nm (10 -9 m). • Não se sedimentam • Não são retidos por filtros • Não são detectados nem com ultramicroscópio ou microscópio eletrônico.

IMPORT NCIA DAS SOLUÇÕES As reações químicas ocorrem predominantemente em soluções. A grande maioria dos processos biológicos ocorrem em meio aquoso. Solução = soluto + solvente • Solvente: Solvente componente que ocorre em maior proporção no sistema • Solutos: Solutos compostos moleculares e iônicos.

TIPOS DE SOLUÇÕES • Laboratóriais Solução utilizada em análise químicas Soluções nutritivas, hidroponia • Naturais • Processos Rios, lagos, oceanos, etc. Água de chuva Solução de solo Seiva de plantas Fluídos biológicos Águas residuárias Industriais e domésticas Composição conhecida Composição determinada por análise química

PREPARO DE SOLUÇÕES • A partir de soluto sólido • A partir de soluto líquido • A partir de solução em estoque • Por simples diluição • A partir de soluto sólido hidratado

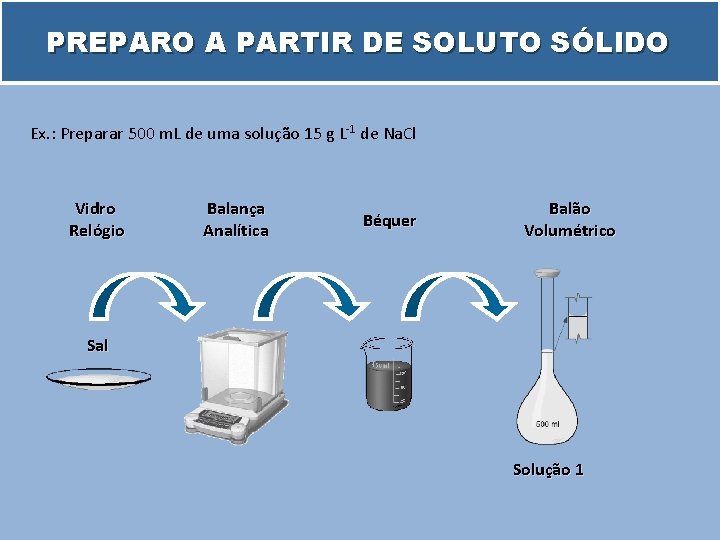
PREPARO A PARTIR DE SOLUTO SÓLIDO Ex. : Preparar 500 m. L de uma solução 15 g L-1 de Na. Cl Vidro Relógio Balança Analítica Béquer Balão Volumétrico Sal Solução 1

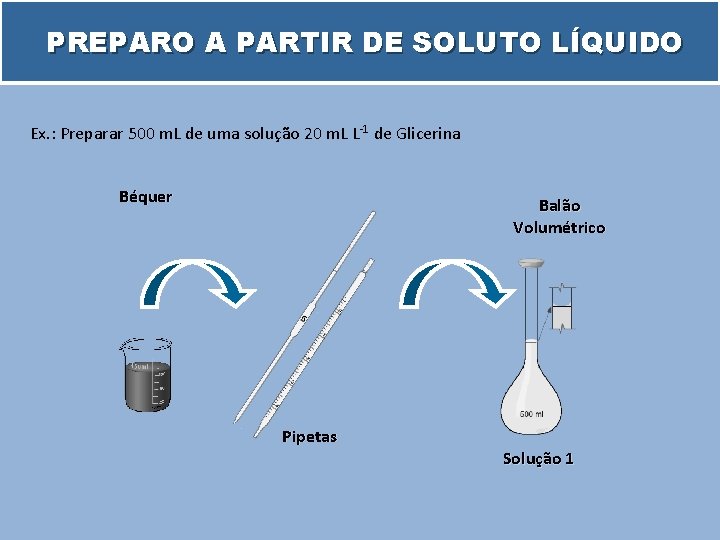
PREPARO A PARTIR DE SOLUTO LÍQUIDO Ex. : Preparar 500 m. L de uma solução 20 m. L L-1 de Glicerina Béquer Balão Volumétrico Pipetas Solução 1

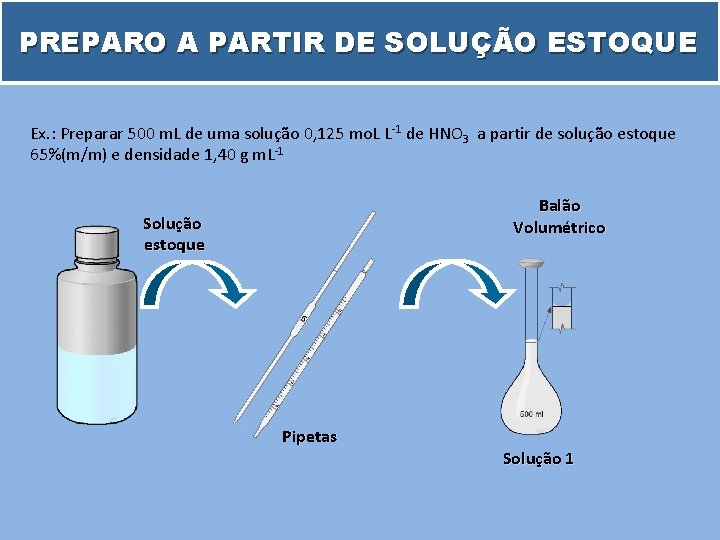
PREPARO A PARTIR DE SOLUÇÃO ESTOQUE Ex. : Preparar 500 m. L de uma solução 0, 125 mo. L L-1 de HNO 3 a partir de solução estoque 65%(m/m) e densidade 1, 40 g m. L-1 Balão Volumétrico Solução estoque Pipetas Solução 1

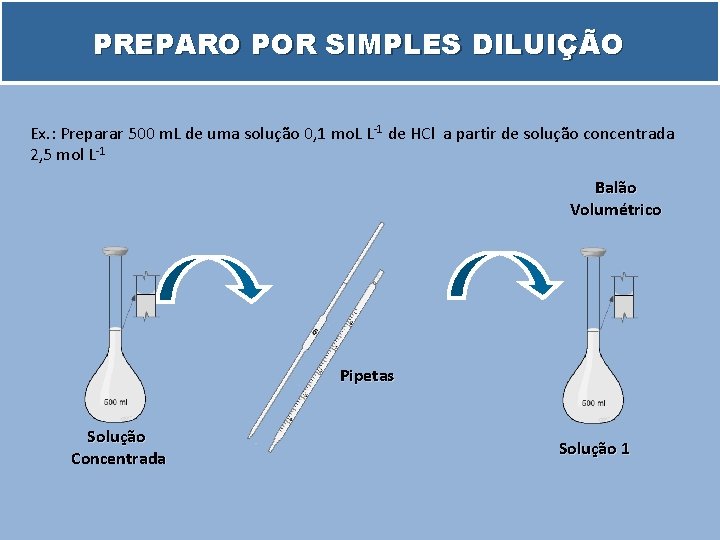
PREPARO POR SIMPLES DILUIÇÃO Ex. : Preparar 500 m. L de uma solução 0, 1 mo. L L-1 de HCl a partir de solução concentrada 2, 5 mol L-1 Balão Volumétrico Pipetas Solução Concentrada Solução 1

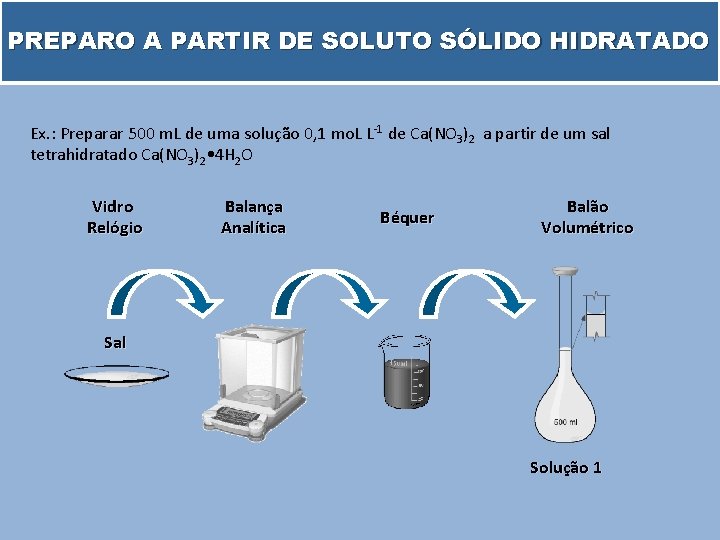
PREPARO A PARTIR DE SOLUTO SÓLIDO HIDRATADO Ex. : Preparar 500 m. L de uma solução 0, 1 mo. L L-1 de Ca(NO 3)2 a partir de um sal tetrahidratado Ca(NO 3)2 • 4 H 2 O Vidro Relógio Balança Analítica Béquer Balão Volumétrico Sal Solução 1

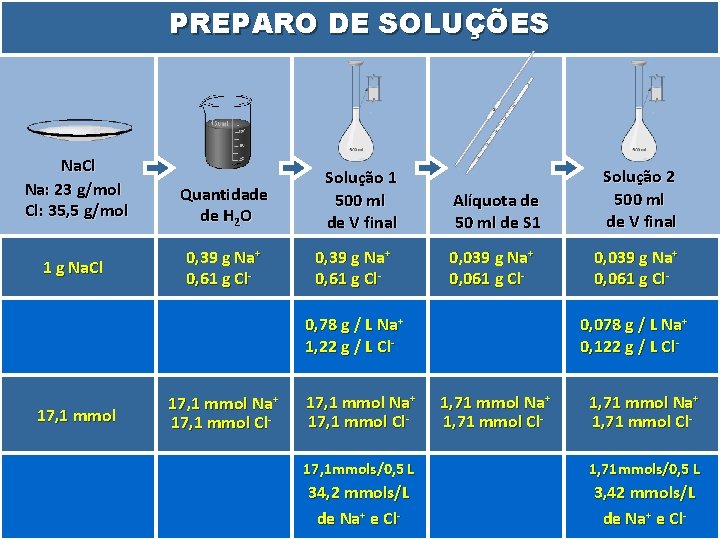
PREPARO DE SOLUÇÕES Na. Cl Na: 23 g/mol Cl: 35, 5 g/mol 1 g Na. Cl 0, 0171 mols 17, 1 mmols 1, 71 x 10 -2 mols Quantidade de H 2 O 1 g Na. Cl 17, 1 mmols Solução 1 500 ml de V final 1 g Na. Cl Alíquota de 50 ml de S 1 0, 1 g Na. Cl Solução 2 500 ml de V final 0, 1 g Na. Cl 1 g / 0, 5 L 0, 1 g / 0, 5 L 2 g/L 2000 mg / L 2000 ppm 0, 2 g / L 200 mg / L 200 ppm 17, 1 mmols 17, 1 mmols/0, 5 L 34, 2 mmols/L 1, 71 mmols 1, 71 mmols/0, 5 L 3, 42 mmols/L

PREPARO DE SOLUÇÕES Na. Cl Na: 23 g/mol Cl: 35, 5 g/mol 1 g Na. Cl Quantidade de H 2 O 0, 39 g Na+ 0, 61 g Cl- Solução 1 500 ml de V final 0, 39 g Na+ 0, 61 g Cl- Alíquota de 50 ml de S 1 Solução 2 500 ml de V final 0, 039 g Na+ 0, 061 g Cl- 0, 78 g / L Na+ 1, 22 g / L Cl- 17, 1 mmol Na+ 17, 1 mmol Cl- 0, 078 g / L Na+ 0, 122 g / L Cl 1, 71 mmol Na+ 1, 71 mmol Cl- 17, 1 mmols/0, 5 L 1, 71 mmols/0, 5 L 34, 2 mmols/L de Na+ e Cl- 3, 42 mmols/L de Na+ e Cl-

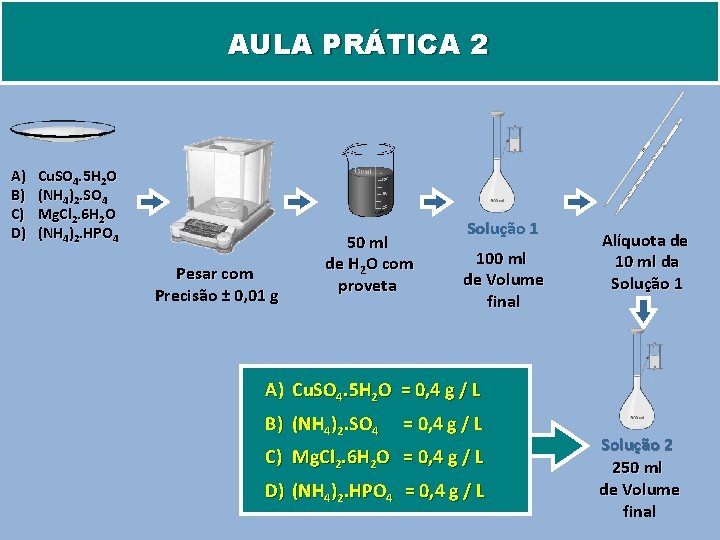
AULA PRÁTICA 2 A) B) C) D) Cu. SO 4. 5 H 2 O (NH 4)2. SO 4 Mg. Cl 2. 6 H 2 O (NH 4)2. HPO 4 Pesar com Precisão ± 0, 01 g 50 ml de H 2 O com proveta Solução 1 100 ml de Volume final Alíquota de 10 ml da Solução 1 A) Cu. SO 4. 5 H 2 O = 0, 4 g / L B) (NH 4)2. SO 4 = 0, 4 g / L C) Mg. Cl 2. 6 H 2 O = 0, 4 g / L D) (NH 4)2. HPO 4 = 0, 4 g / L Solução 2 250 ml de Volume final

QUESTÃO: Calcular as concentrações das soluções 1 e 2? Solução 1 Solução 2 ? g/L ? mol / L A) B) C) D) Cu. SO 4. 5 H 2 O (NH 4)2. SO 4 Mg. Cl 2. 6 H 2 O (NH 4)2. HPO 4 A) B) C) D) Cu 2+ NH 4+ Mg 2+ NH 4+ ? g/L ? mol / L A) B) C) D) SO 42 Cl. HPO 42 - ? g/L ? mol / L
 Pvifa equation
Pvifa equation 360-108-108
360-108-108 Meteorologia cesar
Meteorologia cesar Paulo sentelhas e angelocci geadas aula lce 306
Paulo sentelhas e angelocci geadas aula lce 306 Lce leaving cert
Lce leaving cert Lce reading
Lce reading Paulo sentelhas e angelocci geadas aula lce 306
Paulo sentelhas e angelocci geadas aula lce 306 Analtica
Analtica Analtica
Analtica Analtica
Analtica Analtica
Analtica Analtica
Analtica Analtica
Analtica Equação cartesiana da superficie esferica
Equação cartesiana da superficie esferica Arco supranasal
Arco supranasal Biomec nica
Biomec nica Peta konsep perjuangan mempertahankan kemerdekaan indonesia
Peta konsep perjuangan mempertahankan kemerdekaan indonesia Nica a
Nica a Adolf x nica
Adolf x nica Biomec nica
Biomec nica Nica ny results
Nica ny results Mutiara adik cahya
Mutiara adik cahya Campus virtual uhu
Campus virtual uhu Manfrine aulas
Manfrine aulas Aulas virtuales lae
Aulas virtuales lae Exemplo de parecer do avaliador externo
Exemplo de parecer do avaliador externo Aulas de discipulado
Aulas de discipulado Ecocentro aulas
Ecocentro aulas Aulas em haver
Aulas em haver La vida en las aulas
La vida en las aulas Mis aulas cads
Mis aulas cads Fazemos sempre o que queremos
Fazemos sempre o que queremos Hidrocarburos
Hidrocarburos