Qumica General e Inorgnica A Qumica General e












- Slides: 34

Química General e Inorgánica A Química General e Inorgánica I Química General Energías de Interacción Tema 7

Fuerzas intermoleculares son fuerzas de atracción entre las moléculas Fuerzas intramoleculares mantienen juntos a los átomos en una molécula fuerza intermolecular vs. fuerza intramolecular • 41 k. J para evaporar 1 mol de agua (inter) • 930 k. J para romper todos los enlaces O-H en 1 mol de agua (intra) “Medida” de fuerza intermolecular punto de ebullición Por lo general, las fuerzas intermoleculares son mucho más débiles que las fuerzas intramoleculares punto de fusión DHvap DHfus DHsub 7. 1

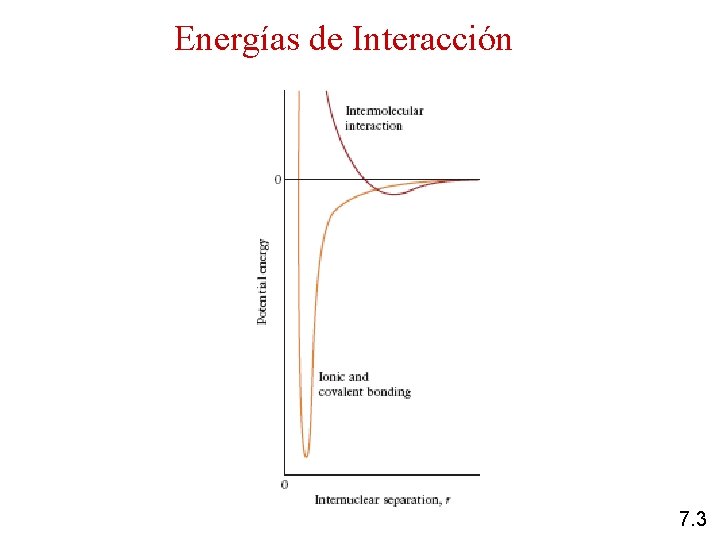
Energías de Interacción Las propiedades macroscópicas de la materia dependen de las interacciones que se producen a nivel molecular entre las partículas que la constituyen Se entiende por partículas a iones, átomos o moléculas Ecuación General = Modelo de interacción E. I. A = - m r + B rn A y B: son constantes que dependen del tipo de partículas involucradas m y n: dependen del tipo de interacción “r” es la distancia entre las partículas 7. 2

Energías de Interacción 7. 3

Clasificación de las Interacciones E • Interacciones iónicas: Interacción ión-ión Interacción ión-dipolo inducido • Interacciones de Van der Waals: Interacción puente hidrógeno Interacción dipolo-dipolo inducido Interacción dipolo inducido-dipolo inducido Cuando aumentan las energías de interacción aumentan las propiedades macroscópicas (densidad, viscosidad, puntos de fusión y ebullición, etc. ), excepto la presión de vapor que disminuye 7. 4

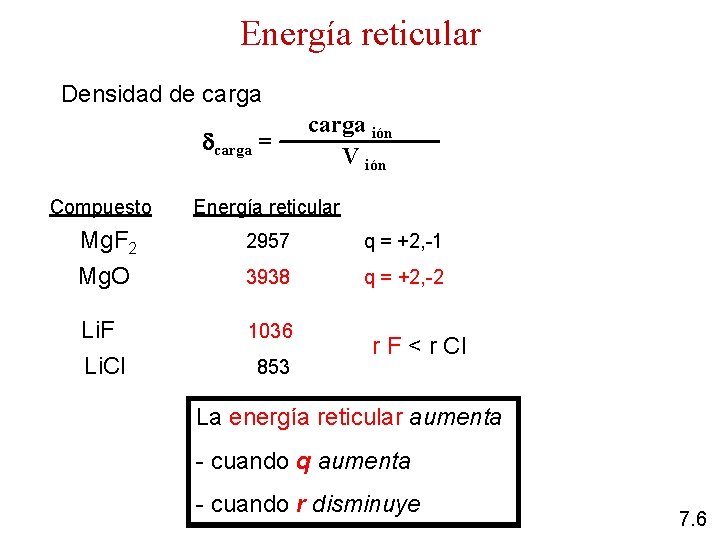
Interacciones iónicas 1) Interacción ión-ión En esta interacción las partículas participantes son iones Energía reticular (Er) es la energía que se libera cuando se forma un mol de un compuesto iónico cristalino Er = - N | n+ n- | q 1 q 2 M r q 1 es la carga en el catión q 2 es la carga en el anión r es la distancia entre los iones M es la constante de Madelung 7. 5

Energía reticular Densidad de carga = Compuesto carga ión V ión Energía reticular Mg. F 2 2957 q = +2, -1 Mg. O 3938 q = +2, -2 Li. F Li. Cl 1036 853 r F < r Cl La energía reticular aumenta - cuando q aumenta - cuando r disminuye 7. 6

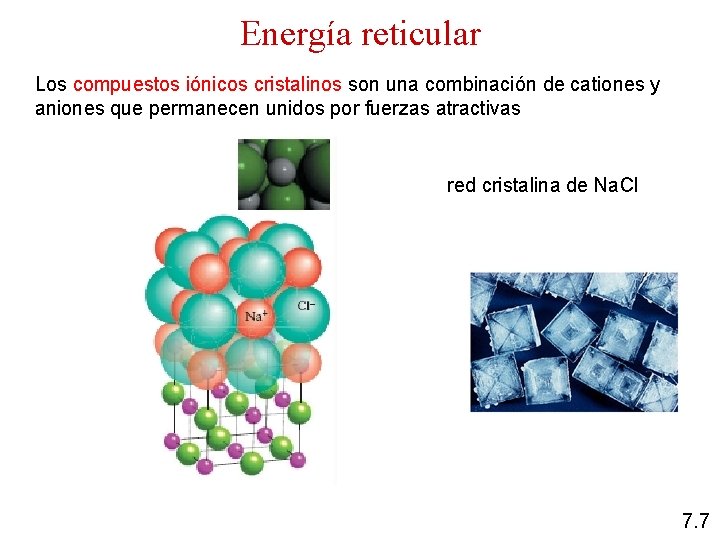
Energía reticular Los compuestos iónicos cristalinos son una combinación de cationes y aniones que permanecen unidos por fuerzas atractivas red cristalina de Na. Cl 7. 7

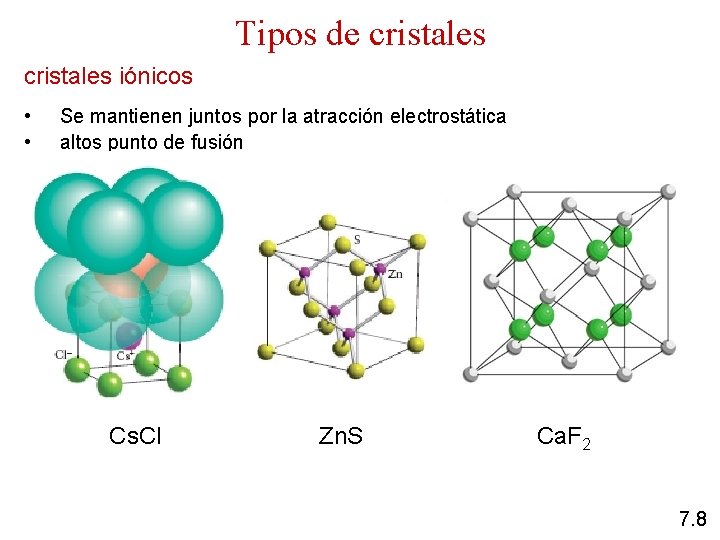
Tipos de cristales iónicos • • Se mantienen juntos por la atracción electrostática altos punto de fusión Cs. Cl Zn. S Ca. F 2 7. 8

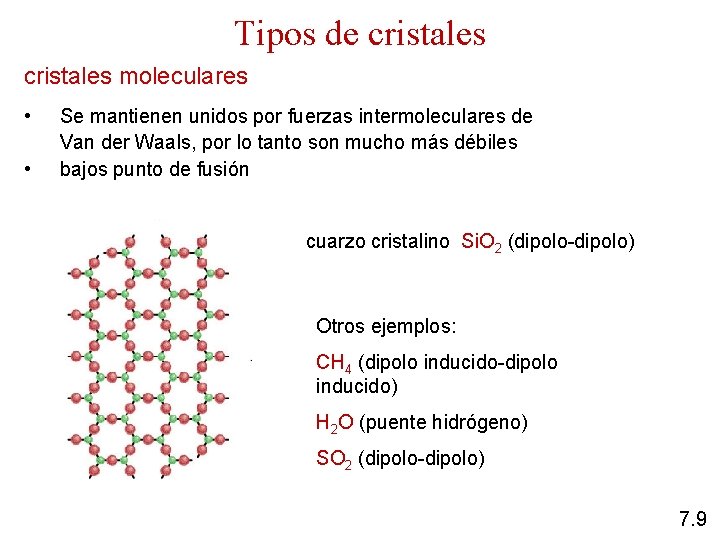
Tipos de cristales moleculares • • Se mantienen unidos por fuerzas intermoleculares de Van der Waals, por lo tanto son mucho más débiles bajos punto de fusión cuarzo cristalino Si. O 2 (dipolo-dipolo) Otros ejemplos: CH 4 (dipolo inducido-dipolo inducido) H 2 O (puente hidrógeno) SO 2 (dipolo-dipolo) 7. 9

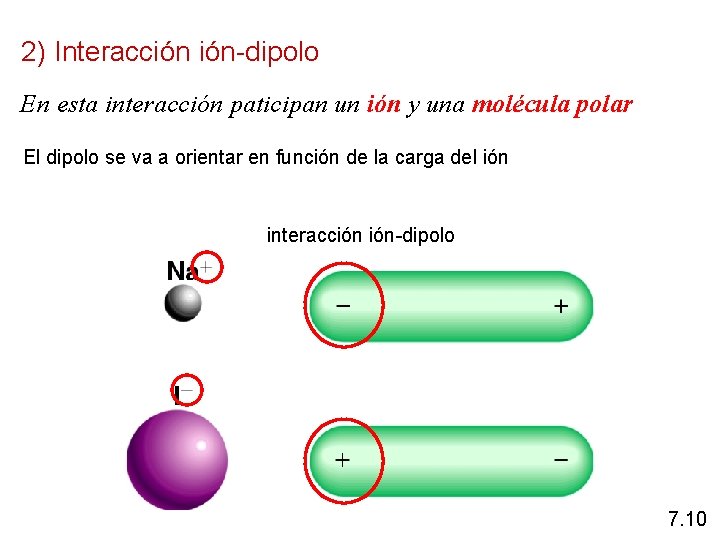
2) Interacción ión-dipolo En esta interacción paticipan un ión y una molécula polar El dipolo se va a orientar en función de la carga del ión interacción ión-dipolo 7. 10

Energía de hidratación El fenómeno por el cual interaccionan los iones de un cristal con las moléculas polares de un disolvente se denomina solvatación Cuando el disolvente es agua se denomina hidratación Ehid. - q r 2 La energía de hidratación aumenta - cuando q aumenta - cuando r disminuye 7. 11

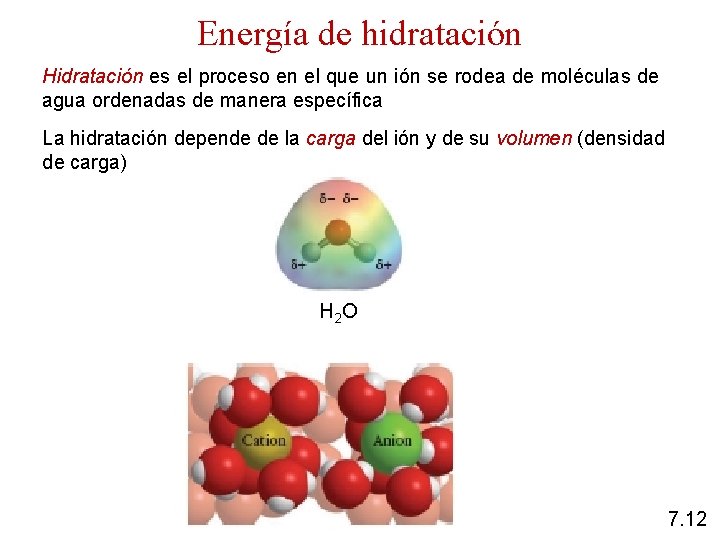
Energía de hidratación Hidratación es el proceso en el que un ión se rodea de moléculas de agua ordenadas de manera específica La hidratación depende de la carga del ión y de su volumen (densidad de carga) H 2 O 7. 12

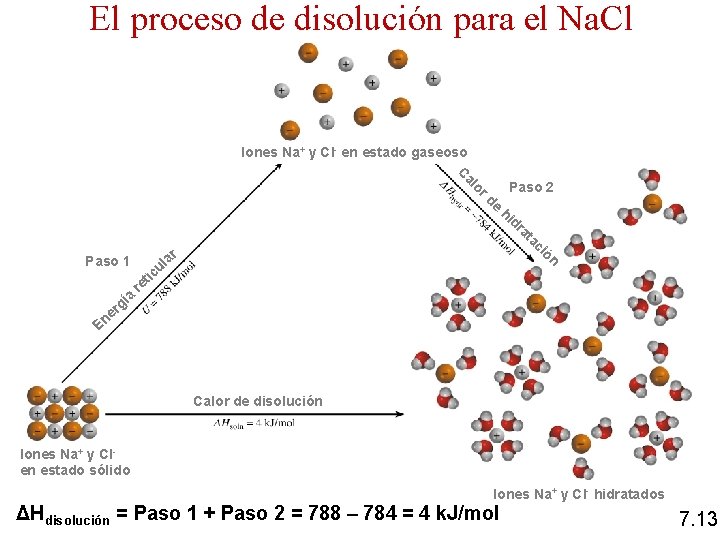
El proceso de disolución para el Na. Cl Iones Na+ y Cl- en estado gaseoso C al or de Paso 2 hi dr r Paso 1 ía la u c at ac ió n ti re g er En Calor de disolución Iones Na+ y Clen estado sólido Iones Na+ y Cl- hidratados ΔHdisolución = Paso 1 + Paso 2 = 788 – 784 = 4 k. J/mol 7. 13

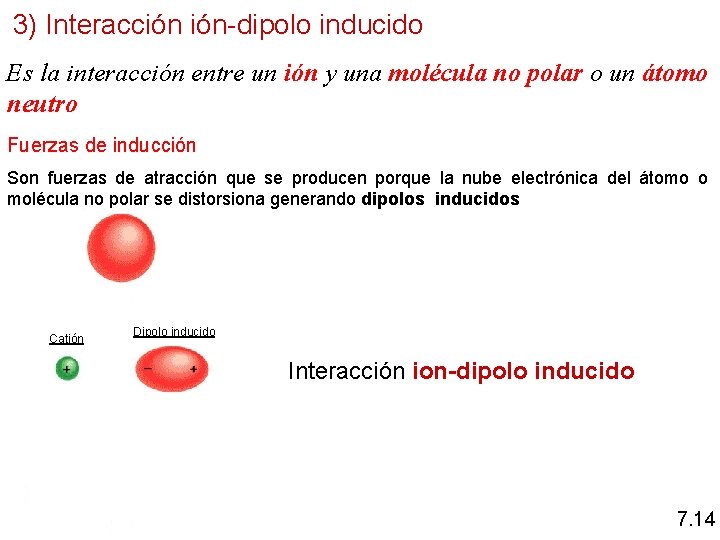
3) Interacción ión-dipolo inducido Es la interacción entre un ión y una molécula no polar o un átomo neutro Fuerzas de inducción Son fuerzas de atracción que se producen porque la nube electrónica del átomo o molécula no polar se distorsiona generando dipolos inducidos Catión Dipolo inducido Interacción ion-dipolo inducido 7. 14

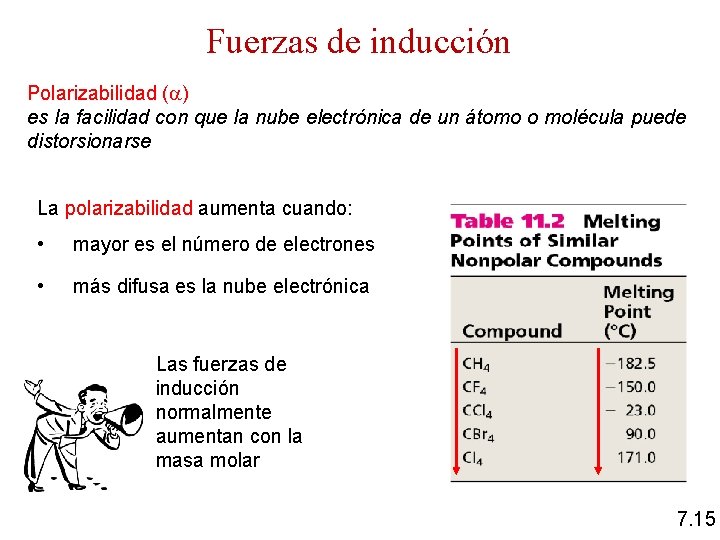
Fuerzas de inducción Polarizabilidad ( ) es la facilidad con que la nube electrónica de un átomo o molécula puede distorsionarse La polarizabilidad aumenta cuando: • mayor es el número de electrones • más difusa es la nube electrónica Las fuerzas de inducción normalmente aumentan con la masa molar 7. 15

Fuerzas de inducción pentano C 5 H 12 pentadecano C 15 H 32 octadecano C 18 H 38 7. 16

Fuerzas de inducción E. I. - q r 4 La energía de interacción ión-dipolo inducido aumenta - cuando q aumenta - cuando r disminuye Ejemplo: I 2 no se disuelve en agua I 2 (s) + I- (ac) → I-3 (ac) solución pardo oscura ión- dipolo inducido 7. 17

Interacciones de Van der Waals Este tipo de interacciones se producen entre átomos neutros o moléculas polares o no polares. No participan iones E Interacción puente hidrógeno --------------------------Interacción dipolo-dipolo inducido Interacción dipolo inducido-dipolo inducido E. I. A = - m r + B rn Potencial de Lennard-Jones o potencial 6 -12 cuando m = 6 y n = 12 7. 18

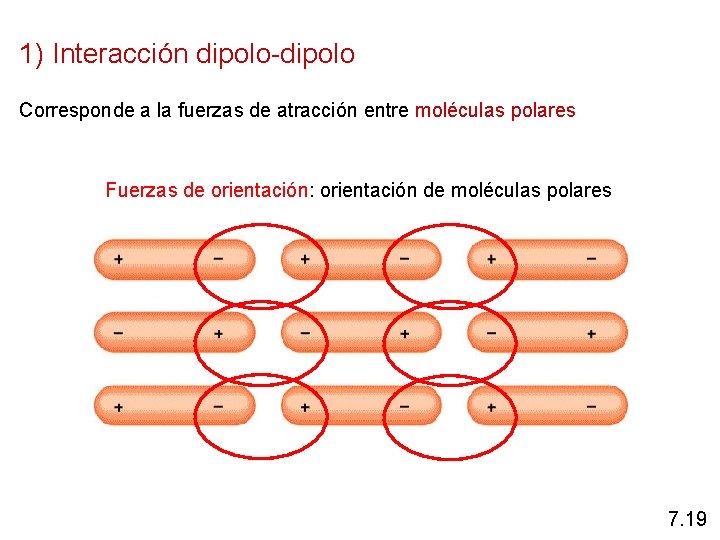
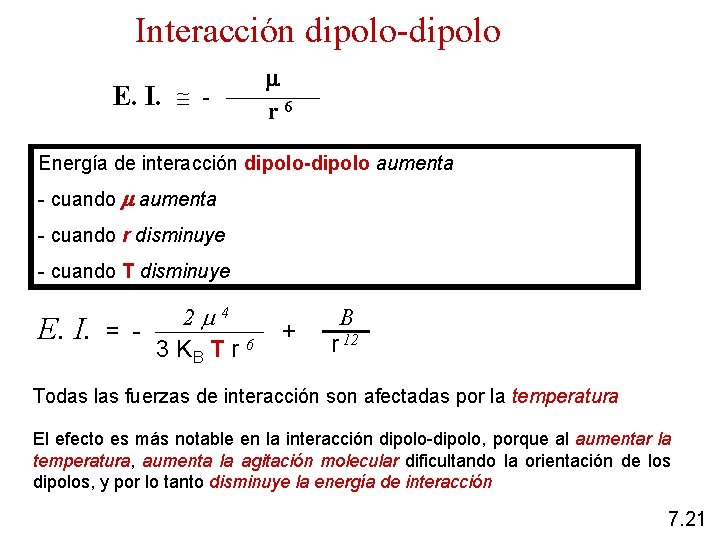
1) Interacción dipolo-dipolo Corresponde a la fuerzas de atracción entre moléculas polares Fuerzas de orientación: orientación de moléculas polares 7. 19

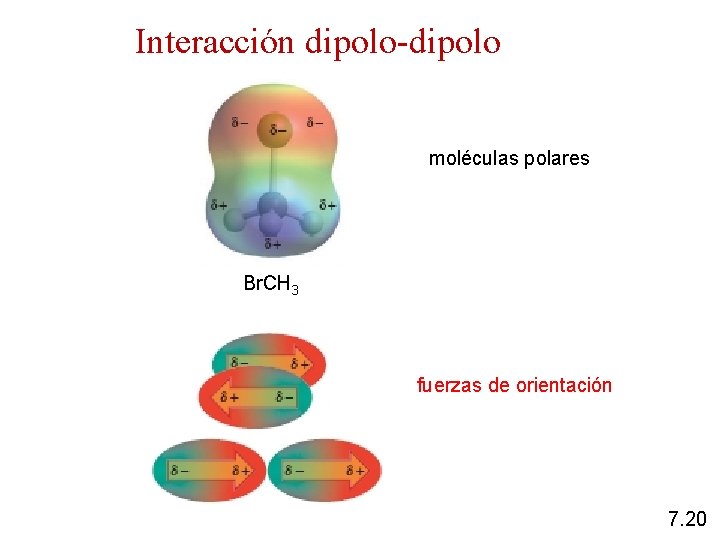
Interacción dipolo-dipolo moléculas polares Br. CH 3 fuerzas de orientación 7. 20

Interacción dipolo-dipolo E. I. - r 6 Energía de interacción dipolo-dipolo aumenta - cuando r disminuye - cuando T disminuye E. I. 2 4 = 3 KB T r 6 + B r 12 Todas las fuerzas de interacción son afectadas por la temperatura El efecto es más notable en la interacción dipolo-dipolo, porque al aumentar la temperatura, aumenta la agitación molecular dificultando la orientación de los dipolos, y por lo tanto disminuye la energía de interacción 7. 21

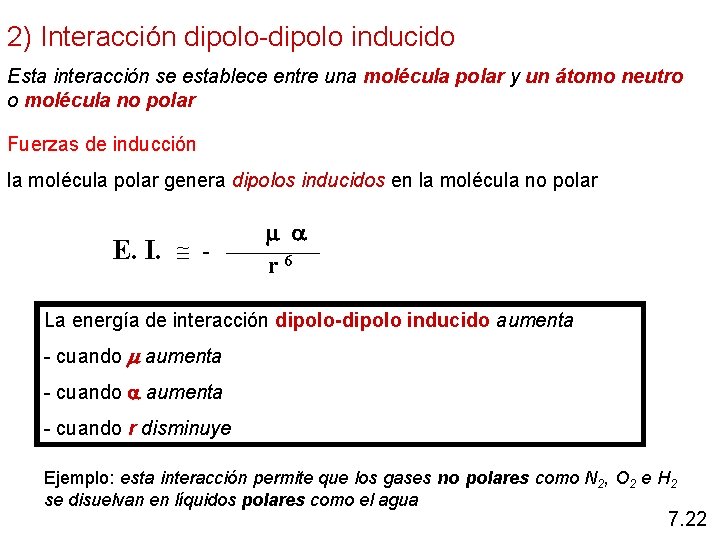
2) Interacción dipolo-dipolo inducido Esta interacción se establece entre una molécula polar y un átomo neutro o molécula no polar Fuerzas de inducción la molécula polar genera dipolos inducidos en la molécula no polar E. I. - r 6 La energía de interacción dipolo-dipolo inducido aumenta - cuando r disminuye Ejemplo: esta interacción permite que los gases no polares como N 2, O 2 e H 2 se disuelvan en líquidos polares como el agua 7. 22

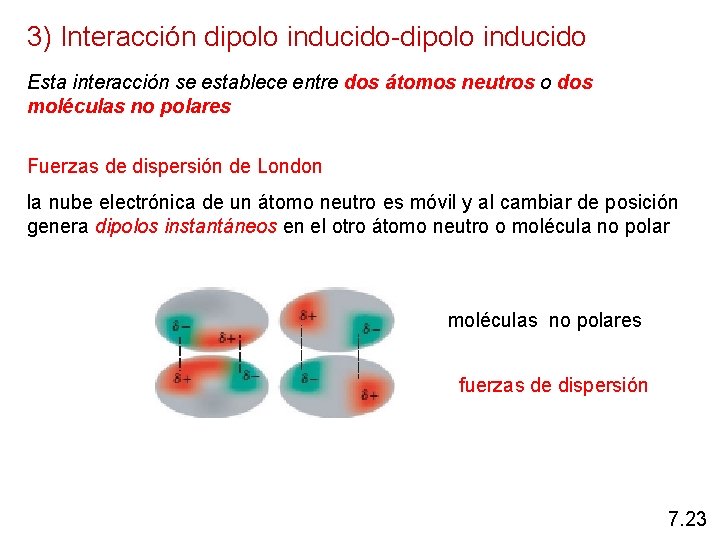
3) Interacción dipolo inducido-dipolo inducido Esta interacción se establece entre dos átomos neutros o dos moléculas no polares Fuerzas de dispersión de London la nube electrónica de un átomo neutro es móvil y al cambiar de posición genera dipolos instantáneos en el otro átomo neutro o molécula no polar moléculas no polares fuerzas de dispersión 7. 23

Interacción dipolo inducido –dipolo inducido E. I. - r 6 La energía de interacción dipolo inducido-dipolo inducido aumenta: - cuando aumenta - cuando r disminuye Ejemplo: esta interacción es la que permite la licuación de sustancias no polares como los gases nobles y los hidrocarburos 7. 24

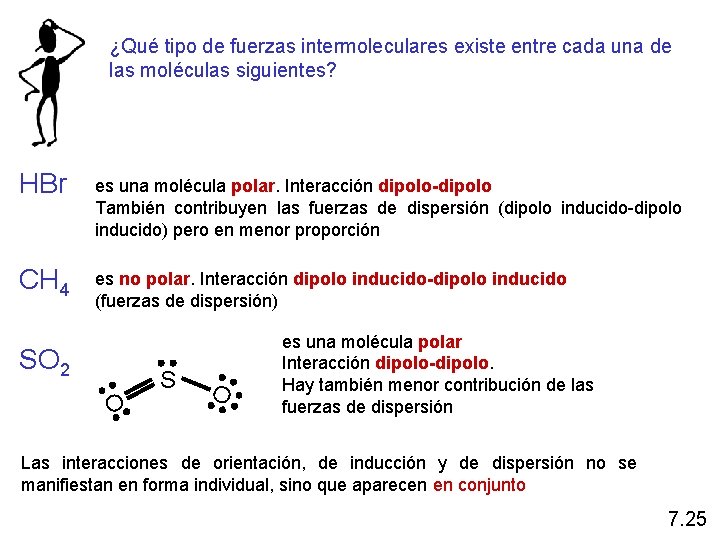
¿Qué tipo de fuerzas intermoleculares existe entre cada una de las moléculas siguientes? HBr es una molécula polar. Interacción dipolo-dipolo También contribuyen las fuerzas de dispersión (dipolo inducido-dipolo inducido) pero en menor proporción CH 4 es no polar. Interacción dipolo inducido-dipolo inducido (fuerzas de dispersión) SO 2 O S O es una molécula polar Interacción dipolo-dipolo. Hay también menor contribución de las fuerzas de dispersión Las interacciones de orientación, de inducción y de dispersión no se manifiestan en forma individual, sino que aparecen en conjunto 7. 25

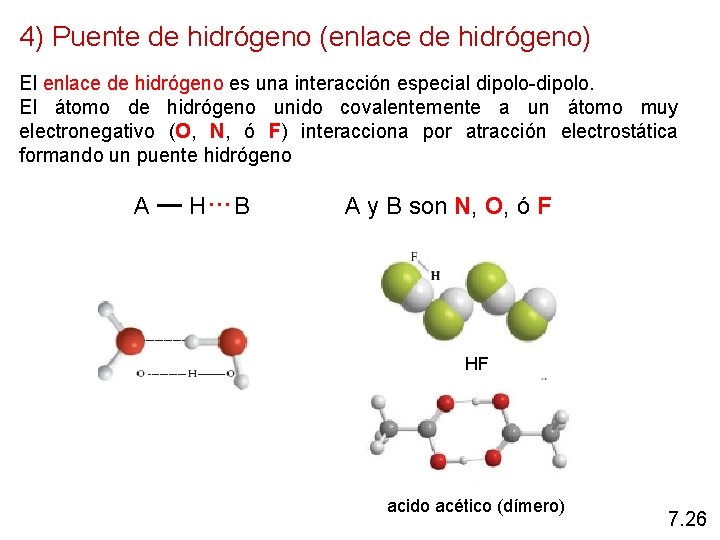
4) Puente de hidrógeno (enlace de hidrógeno) El enlace de hidrógeno es una interacción especial dipolo-dipolo. El átomo de hidrógeno unido covalentemente a un átomo muy electronegativo (O, N, ó F) interacciona por atracción electrostática formando un puente hidrógeno A H…B A y B son N, O, ó F HF acido acético (dímero) 7. 26

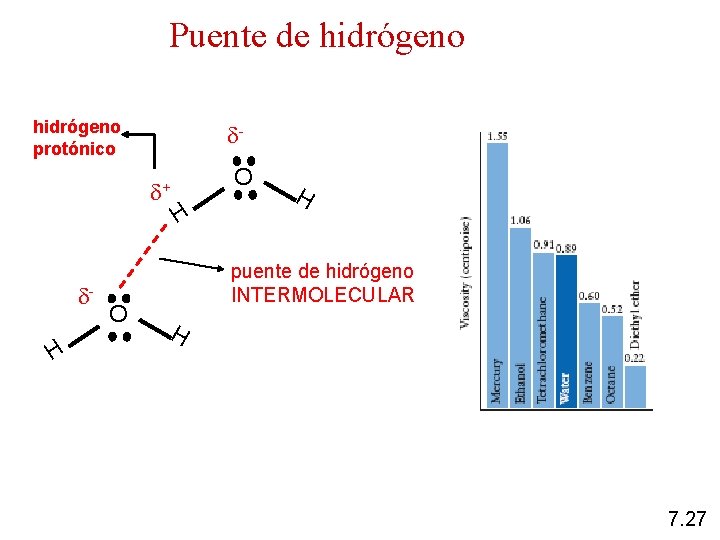
Puente de hidrógeno protónico + H O O H H puente de hidrógeno INTERMOLECULAR H 7. 27

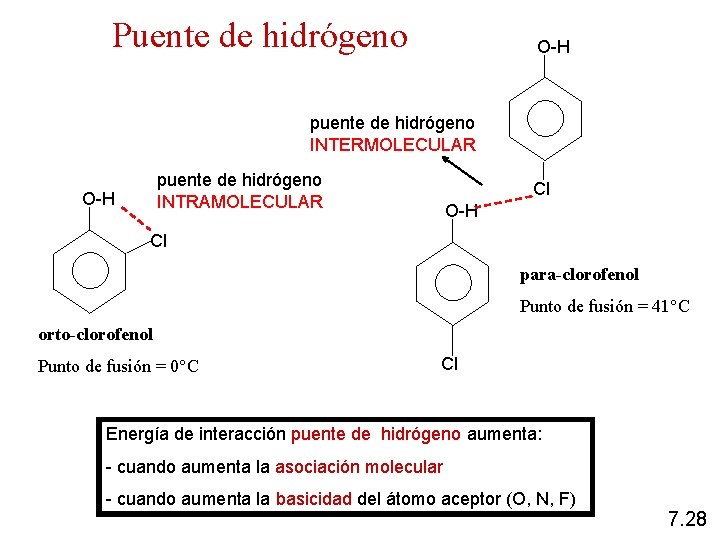
Puente de hidrógeno O-H puente de hidrógeno INTERMOLECULAR puente de hidrógeno INTRAMOLECULAR O-H Cl para-clorofenol Punto de fusión = 41°C orto-clorofenol Punto de fusión = 0°C Cl Energía de interacción puente de hidrógeno aumenta: - cuando aumenta la asociación molecular - cuando aumenta la basicidad del átomo aceptor (O, N, F) 7. 28

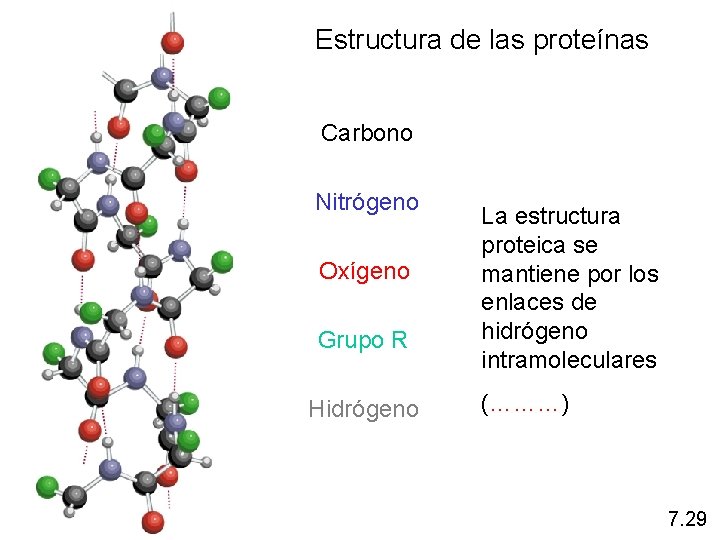
Estructura de las proteínas Carbono Nitrógeno Oxígeno Grupo R Hidrógeno La estructura proteica se mantiene por los enlaces de hidrógeno intramoleculares (………) 7. 29

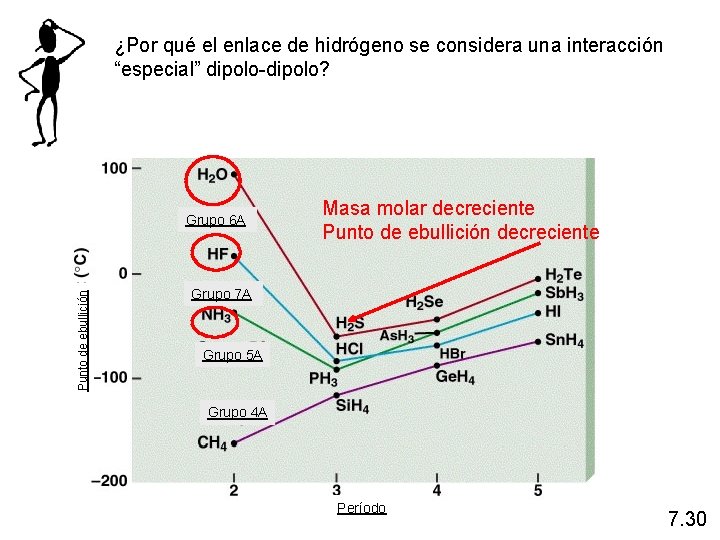
¿Por qué el enlace de hidrógeno se considera una interacción “especial” dipolo-dipolo? Punto de ebullición Grupo 6 A Masa molar decreciente Punto de ebullición decreciente Grupo 7 A Grupo 5 A Grupo 4 A Período 7. 30

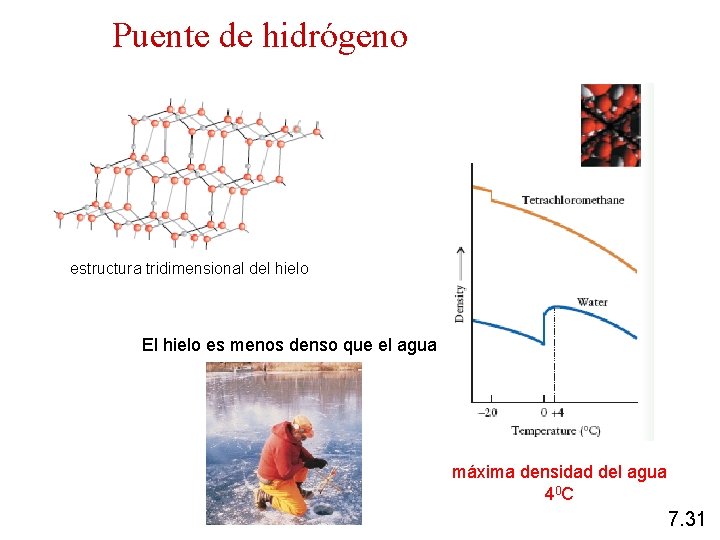
Puente de hidrógeno estructura tridimensional del hielo El hielo es menos denso que el agua máxima densidad del agua 40 C 7. 31

Puente de hidrógeno AGUA BENCENO 7. 32

Estrategia de trabajo 1) Identificar si las especies que interaccionan son iones Las interacciones iónicas son las más fuertes 2) Identificar si las especies que interaccionan tienen un hidrógeno protónico Los enlaces de hidrógeno son las interacciones más fuertes dentro de las de Van der Waals 3) Determinar si la especie que interacciona es polar o no polar Cuando la molécula es polar la interacción es del tipo dipolo Si la molécula es no polar, la interacción es del tipo dipolo inducido Recordar: - cuando aumenta la energía de interacción aumentan las propiedades macroscópicas (menos la presión de vapor) - cuando aumenta la temperatura, disminuyen las interacciones y por lo tanto disminuyen las propiedades macroscópicas 7. 33