FUNES INORG NICAS Funes Qumicas Funo qumica corresponde





























- Slides: 40

FUNÇÕES INORG NICAS

Funções Químicas • Função química corresponde a um conjunto de substâncias que apresentam propriedades químicas semelhantes. • As substâncias inorgânicas podem ser classificadas em quatro funções: § Ácidos § Bases § Sais § Óxidos • Assim, numa reação química, todos os ácidos, por exemplo, terão comportamento semelhante.

Ácidos • Ácidos de Arrhenius: são substâncias compostas que em solução aquosa liberam como único e exclusivo cátion o hidrônio (H 3 O+). Ionização de um Ácido HCl + H 2 O H 3 O+ + Cl. H 2 SO 4 + 2 H 2 O 2 H 3 O+ + SO 42 H 3 PO 4 + 3 H 2 O 3 H 3 O+ + PO 43 -

Hidrogênios ionizáveis • Os hidrogênios que fornecem H 3 O+ são chamados de hidrogênios ionizáveis. • São aqueles que se ligam ao elemento mais eletronegativo na molécula do ácido. • Geralmente a quantidade de hidrogênios do ácido é a mesma que pode ionizar, mas existem exceções: H 3 PO 3 + 2 H 2 O 2 H 3 O+ + HPO 32 - apenas 2 H+ H 3 PO 2 + H 2 O H 3 O+ + H 2 PO 21 - apenas 1 H+

Classificação dos Ácidos • Quanto a presença ou ausência de carboxila (-COOH): - Orgânicos - Inorgânicos (CH 3 -COOH, HOOC-COOH) (H 2 CO 3, H 2 S, HCN) • Quanto a presença ou ausência de oxigênio: - Hidrácidos (HCl, H 2 S, HBr) - Oxiácidos (H 2 SO 4, H 3 PO 4, HCl. O 4)

• Quanto ao número de elementos químicos: - Binário (HCl, HBr, HF) - Ternário (H 2 SO 4, H 3 PO 4, HCN) - Quaternário (H 4[Fe(CN)6]) • Quanto ao número de hidrogênios ionizáveis: - Monoácidos (HCl, HI, H 3 PO 2) - Diácidos (H 2 SO 4, H 2 S, H 3 PO 3) - Triácidos (H 3 PO 4, H 3 BO 3) - Tetrácidos (H 4 P 2 O 7)

• Quanto ao Grau de Ionização ( ): - Ácidos fracos: 0 < a < 5% - Ácidos moderados: 5% < α < 50% - Ácidos fortes : 50% < α < 100% a = Nº de Mol Ionizados Nº de Mol Inicial Ácido fraco: HCl. O Ácido moderado: H 3 PO 4 Ácido forte : H 2 SO 4 HCl. O 4

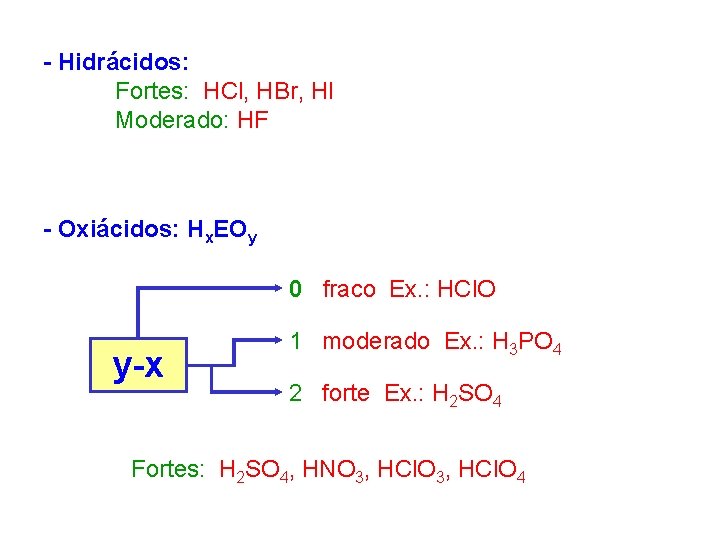
- Hidrácidos: Fortes: HCl, HBr, HI Moderado: HF - Oxiácidos: Hx. EOy 0 fraco Ex. : HCl. O y-x 1 moderado Ex. : H 3 PO 4 2 forte Ex. : H 2 SO 4 Fortes: H 2 SO 4, HNO 3, HCl. O 4

Nomenclatura Oficial • Hidrácidos: Seguem a seguinte regra: Ácido + ídrico Radical do Elemento Exemplos: HCl ácido clorídrico HBr ácido bromídrico HF ácido fluorídrico HI ácido iodídrico HCN ácido cianídrico

• Oxiácidos: Seguem a seguinte regra: ico (+ oxigênio) Ácido _________ + Radical do Elemento Exemplos: H 2 SO 4 ácido sulfúrico H 2 SO 3 ácido sulfuroso H 2 CO 3 ácido carbônico H 3 BO 3 ácido bórico HNO 3 ácido nítrico oso (- oxigênio)

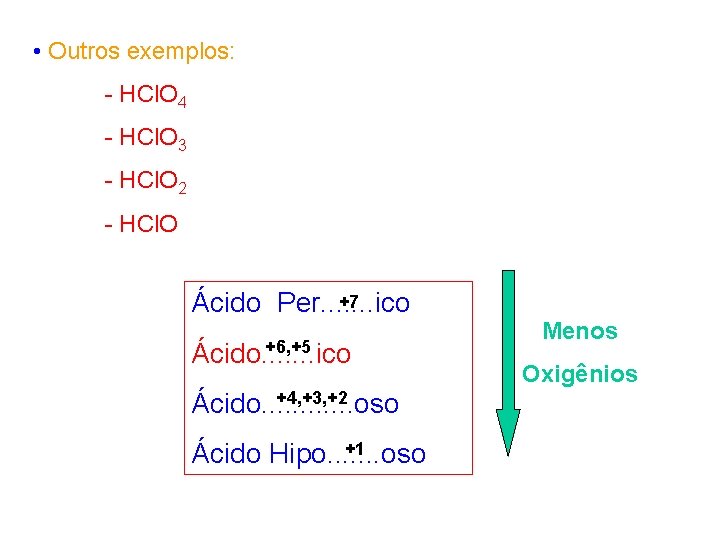
• Outros exemplos: - HCl. O 4 - HCl. O 3 - HCl. O 2 - HCl. O +7 Ácido Per. . . . ico +6, +5 Ácido. . . . ico +4, +3, +2 Ácido. . . oso +1 Ácido Hipo. . . . oso Menos Oxigênios

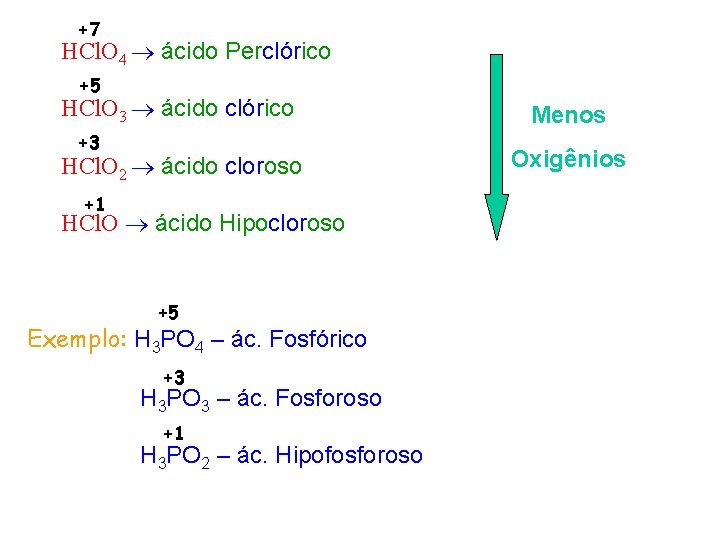
+7 HCl. O 4 ácido Perclórico +5 HCl. O 3 ácido clórico +3 HCl. O 2 ácido cloroso +1 HCl. O ácido Hipocloroso +5 Exemplo: H 3 PO 4 – ác. Fosfórico +3 H 3 PO 3 – ác. Fosforoso +1 H 3 PO 2 – ác. Hipofosforoso Menos Oxigênios

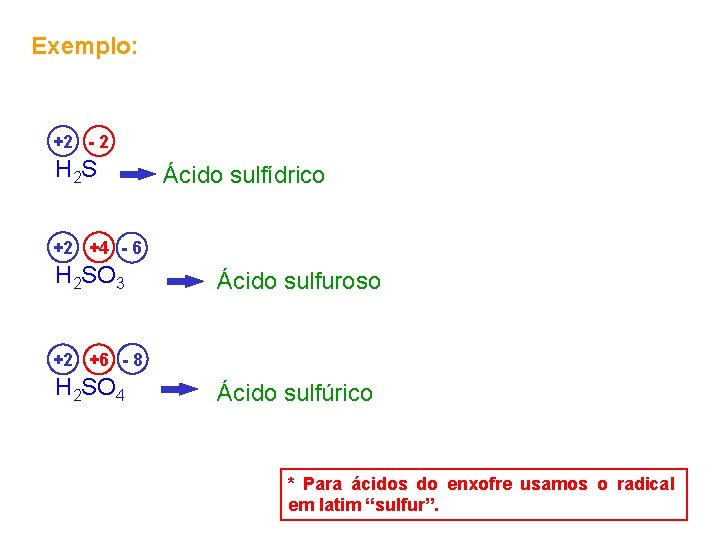
Exemplo: +2 - 2 H 2 S Ácido sulfídrico +2 +4 - 6 H 2 SO 3 Ácido sulfuroso +2 +6 - 8 H 2 SO 4 Ácido sulfúrico * Para ácidos do enxofre usamos o radical em latim “sulfur”.

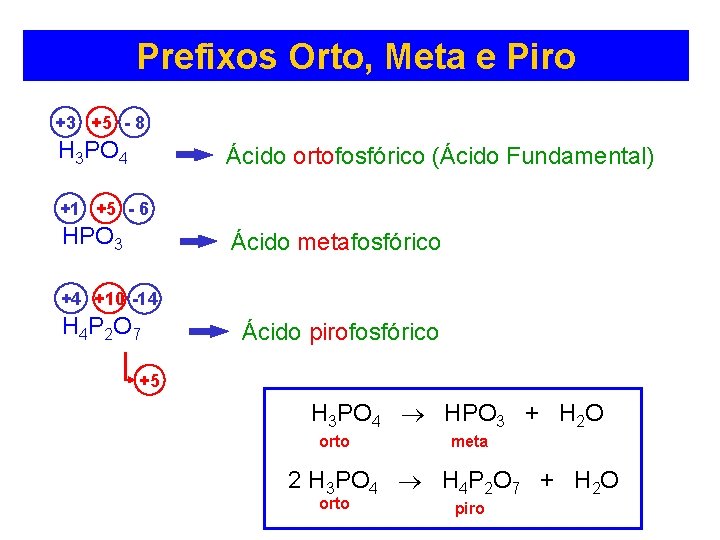
Prefixos Orto, Meta e Piro +3 +5 - 8 H 3 PO 4 Ácido ortofosfórico (Ácido Fundamental) +1 +5 - 6 HPO 3 Ácido metafosfórico +4 +10 -14 H 4 P 2 O 7 Ácido pirofosfórico +5 H 3 PO 4 HPO 3 + H 2 O orto meta 2 H 3 PO 4 H 4 P 2 O 7 + H 2 O orto piro

Características gerais dos ácidos ü Apresentam sabor azedo; ü Desidratam a matéria orgânica; ü Deixam incolor a solução alcoólica de fenolftaleína; ü Neutralizam bases formando sal e água.

Bases • De acordo com Arrhenius, base ou hidróxido é toda substância que, dissolvida em água, dissocia-se fornecendo como ânion exclusivamente OH- (hidroxila). Na. OH Na+ + OHCa(OH)2 Ca 2+ + 2 OH- § Possuem OH-; § Metais; § Ligações Iônicas; § Sólidos; Al(OH)3 Al 3+ + 3 OH- § Solúveis em água: (metais alcalinos).

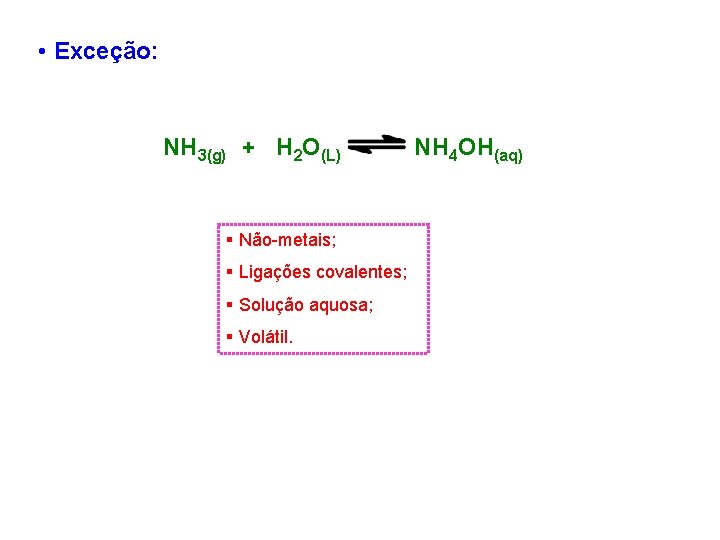
• Exceção: NH 3(g) + H 2 O(L) § Não-metais; § Ligações covalentes; § Solução aquosa; § Volátil. NH 4 OH(aq)

Nomenclatura Hidróxido de _________ Nome do Elemento (metal) Na. OH hidróxido de sódio Fe(OH)2 hidróxido de ferro II Fe(OH)3 hidróxido de ferro III

Classificação • Quanto ao número de hidroxilas: - Monobases: - Dibases: - Tribases: - Tetrabases: Na. OH; NH 4 OH Ca(OH)2; Mg(OH)2 Al(OH)3; Fe(OH)3 Pb(OH)4; Sn(OH)4

• Quanto ao grau de dissociação iônica: - Fortes: Os hidróxidos de metais alcalinos (G 1) e metais alcalinos terrosos (G 2). - Fracas: Nesse grupo incluem-se o hidróxido de amônio (NH 4 OH) e as demais bases.

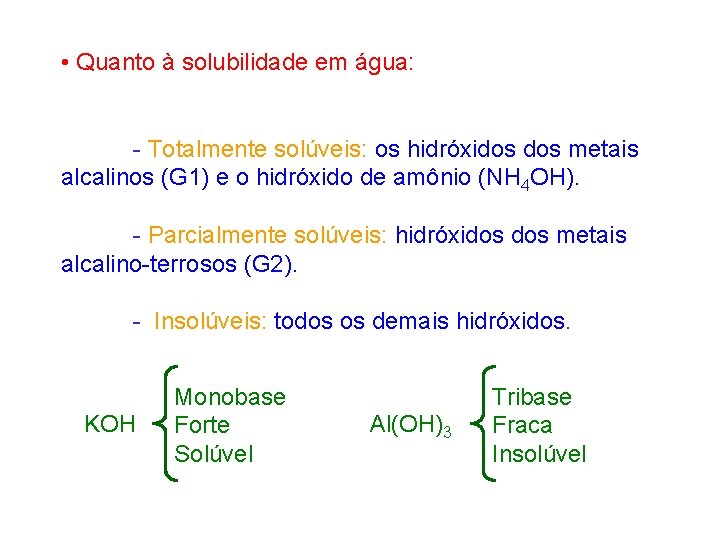
• Quanto à solubilidade em água: - Totalmente solúveis: os hidróxidos metais alcalinos (G 1) e o hidróxido de amônio (NH 4 OH). - Parcialmente solúveis: hidróxidos metais alcalino-terrosos (G 2). - Insolúveis: todos os demais hidróxidos. KOH Monobase Forte Solúvel Al(OH)3 Tribase Fraca Insolúvel

Características gerais das bases ü Apresentam sabor caústico; üDeixam vermelha a solução alcoólica de fenolftaleína; ü Neutralizam ácidos formando sal e água.

Sais • Sal de Arrhenius - Composto resultante da neutralização de um ácido por uma base, com eliminação de água. • É formado por um cátion proveniente de uma base e um ânion proveniente de um ácido. Ácido + Base Sal + Água • A reação de um ácido com uma base recebe o nome de neutralização. HCl + Na. OH Na. Cl + H 2 O

Nomenclatura • Obedece à expressão: (nome do ânion) de (nome do cátion) Sufixo do ácido ídrico oso H 2 SO 4 + Ca(OH)2 Ácido Sulfúrico Sufixo do ânion eto ato ito Ca. SO 4 + 2 H 2 O Sulfato de cálcio (gesso)

Sais neutros ou normais • São obtidos por neutralização total (H+ ioniz = OH-): H 2 CO 3 + Ca(OH)2 Ca. CO 3 + 2 H 2 O 2 Na. OH + H 2 SO 4 Na 2 SO 4 + 2 H 2 O

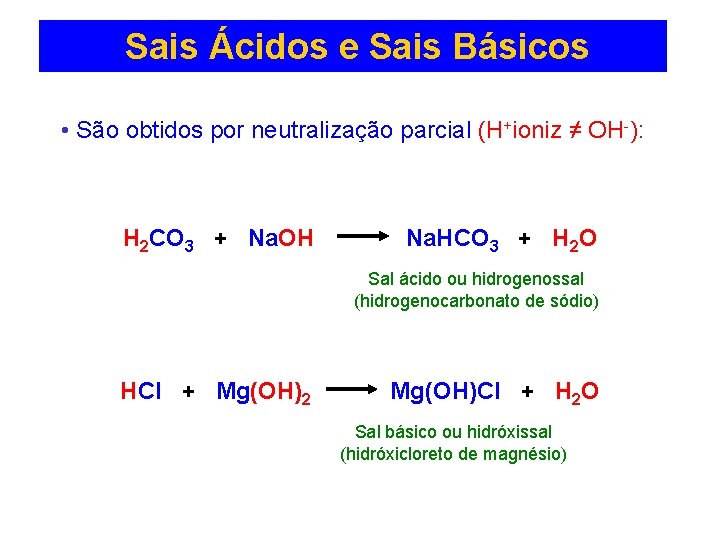
Sais Ácidos e Sais Básicos • São obtidos por neutralização parcial (H+ioniz ≠ OH-): H 2 CO 3 + Na. OH Na. HCO 3 + H 2 O Sal ácido ou hidrogenossal (hidrogenocarbonato de sódio) HCl + Mg(OH)2 Mg(OH)Cl + H 2 O Sal básico ou hidróxissal (hidróxicloreto de magnésio)

Classificação • Quanto à presença de oxigênio: Oxissais : Ca. SO 4 , Ca. CO 3 , KNO 3 - Halóides: Na. Cl , Ca. Cl 2 , KCl • Quanto ao número de elementos: - Binários: Na. Cl , KBr , Ca. Cl 2 - Ternários: Ca. SO 4 , Al 2(SO 4)3 - Quaternários: Na. CNO , Na 4 Fe(CN)6

• Quanto à presença de água: - Hidratados: Cu. SO 4. 5 H 2 O; Ca. SO 4. 2 H 2 O - Anidros: KCl; Na. Cl; Ca. SO 4 • Quanto à natureza: - Neutros ou normais: Na. Br; Ca. CO 3 - Ácidos ou Hidrogenossais: Na. HCO 3; Ca. HPO 4 - Básicos ou Hidroxissais: Ca(OH)Br - Duplos ou mistos: Na. KSO 4; Ca. Cl. Br

Óxidos • Óxido é todo composto binário oxigenado, no qual o oxigênio é o elemento mais eletronegativo. Fórmula geral dos óxidos: Ex+2 O 2 -X Exemplos: CO 2, H 2 O, Mn 2 O 7, Fe 2 O 3

Nomenclatura Regra geral: (Prefixo) + óxido de (prefixo) + elemento CO monóxido de monocarbono N 2 O 5 pentóxido de dinitrogênio P 2 O 3 trióxido de difósforo H 2 O monóxido de diidrogênio

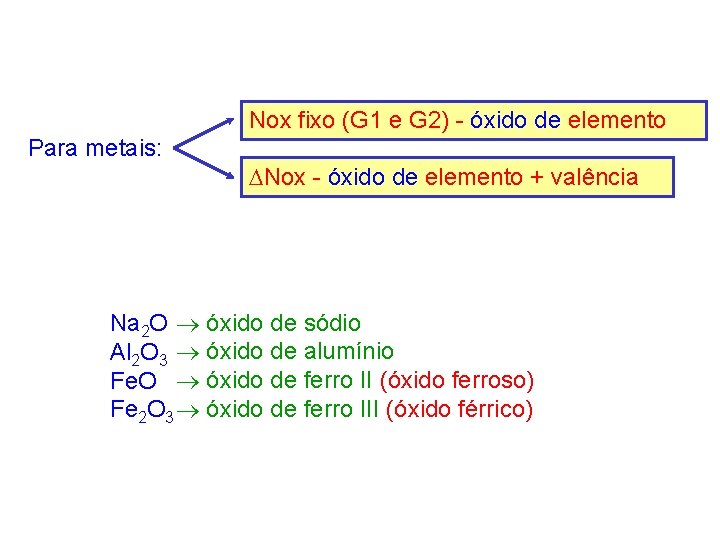
Nox fixo (G 1 e G 2) - óxido de elemento Para metais: Nox - óxido de elemento + valência Na 2 O óxido de sódio Al 2 O 3 óxido de alumínio Fe. O óxido de ferro II (óxido ferroso) Fe 2 O 3 óxido de ferro III (óxido férrico)

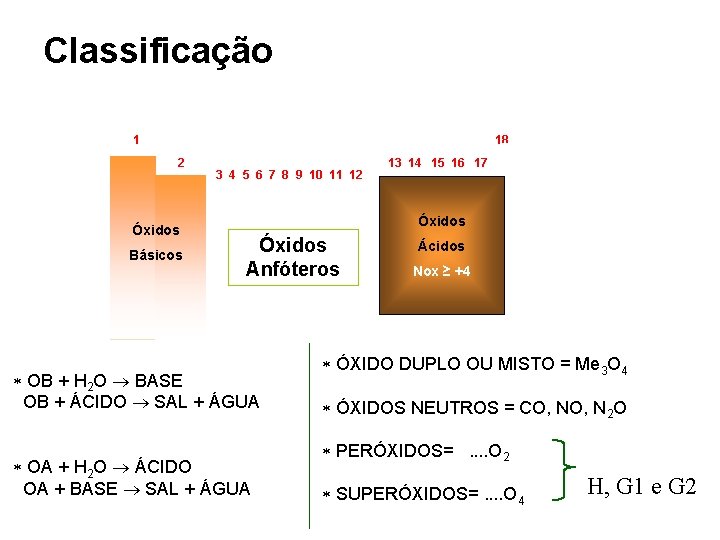
Classificação • Óxidos Ácidos • Óxidos Básicos • Óxidos Anfóteros • Óxidos Neutros • Óxidos Duplos • Peróxidos • Superóxidos

Óxidos Básicos (metálicos) • São formados por metais alcalinos e alcalinos terrosos e reagem com água formando bases e com ácidos formando sal e água. Óxido básico + H 2 O base Na 2 O + H 2 O 2 Na. OH Ca. O + H 2 O Ca(OH)2 Ca. O (cal virgem, cal viva ) Óxido básico + ácido sal + H 2 O Mg. O + 2 HCl Mg. Cl 2 + H 2 O

Óxidos Ácidos (anidridos) • São formados por não-metais e reagem com água formando ácidos e com bases formando sal e água. Óxido ácido + H 2 O ácido (CO 2 – EFEITO ESTUFA) CO 2 + H 2 O H 2 CO 3 N 2 O 5 + H 2 O 2 HNO 3 “chuva ácida” SO 3 + H 2 O H 2 SO 4 Óxido ácido + base sal + H 2 O CO 2 + Ca(OH)2 Ca. CO 3 + H 2 O

Óxidos Anfóteros (anfipróticos) • São óxidos de caráter intermediário entre ácido e básico. Reagem com ácidos e bases formando sal e água. Óxido anfótero + ácido/base sal + água Zn. O + 2 HCl Zn. Cl 2 + H 2 O Zn. O + 2 Na. OH Na 2 Zn. O 2 + H 2 O Al 2 O 3 ; Zn. O (hipoglós) Al 2 O 3 (alumina)

Óxidos Neutros (indiferentes) • São todos covalentes e não reagem com base, ácido ou água; mas podem reagir com oxigênio. CO + H 2 O Não ocorre reação NO + HCl Não ocorre reação Óxido Neutro + O 2 Oxidação CO + ½O 2 CO 2 CO ; NO

Óxidos Duplos (mistos) • São óxidos que, quando aquecidos, originam dois outros óxidos. M 3 O 4 Fe, Pb, Mn Fe 3 O 4 Fe. O + Fe 2 O 3 (magnetita, imã) Fe 3 O 4; Pb 3 O 4; Mn 3 O 4

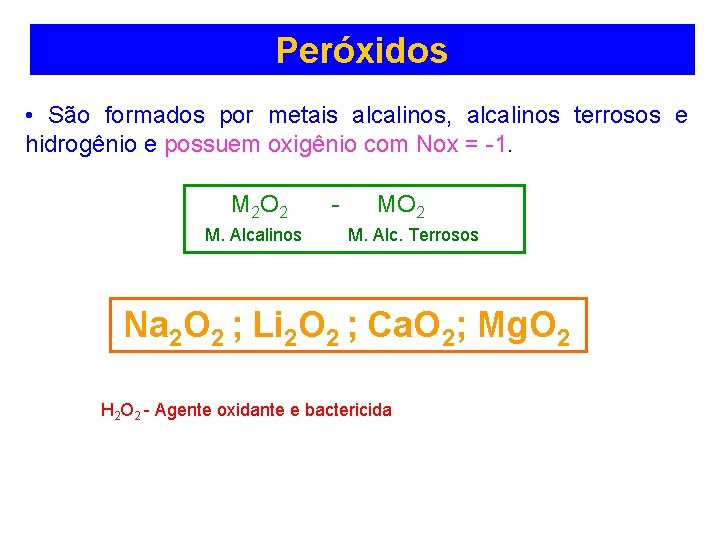
Peróxidos • São formados por metais alcalinos, alcalinos terrosos e hidrogênio e possuem oxigênio com Nox = -1. M 2 O 2 M. Alcalinos - MO 2 M. Alc. Terrosos Na 2 O 2 ; Li 2 O 2 ; Ca. O 2; Mg. O 2 H 2 O 2 - Agente oxidante e bactericida

Superóxidos (polióxidos) • São formados por metais alcalinos, alcalinos terrosos e hidrogênio e possuem oxigênio com Nox = - ½. M 2 O 4 M. Alcalinos - MO 4 M. Alc. Terrosos Na 2 O 4 ; Li 2 O 4 ; Ca. O 4 ; Mg. O 4

Classificação 18 1 2 Óxidos Básicos 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Óxidos Anfóteros OB + H 2 O BASE OB + ÁCIDO SAL + ÁGUA OA + H 2 O ÁCIDO OA + BASE SAL + ÁGUA Ácidos Nox ≥ +4 ÓXIDO DUPLO OU MISTO = Me 3 O 4 ÓXIDOS NEUTROS = CO, N 2 O PERÓXIDOS=. . O 2 SUPERÓXIDOS=. . O 4 H, G 1 e G 2
 Qumicas
Qumicas Nicas level 3 assessment criteria
Nicas level 3 assessment criteria Nicas de estudio
Nicas de estudio C
C Main funes
Main funes Carta informal
Carta informal Main funes
Main funes Main funes
Main funes Funo
Funo Funo
Funo Tecido adiposo
Tecido adiposo Funo
Funo Funo
Funo Funo
Funo Bacinete rim
Bacinete rim Empresa funo
Empresa funo Ventrículo direito função
Ventrículo direito função Funo
Funo Anisofilia
Anisofilia Funo
Funo Funo
Funo Funo
Funo Funo
Funo Depuração plasmática
Depuração plasmática Funo
Funo Função inversa
Função inversa Signo de puntuación de pausa intermedia
Signo de puntuación de pausa intermedia Porcentaje concepto
Porcentaje concepto Antihispano es hiato
Antihispano es hiato Te amo y no quiero perderte poema
Te amo y no quiero perderte poema Las invitaciones que tipo de texto son
Las invitaciones que tipo de texto son Ecuacion de la recta punto pendiente
Ecuacion de la recta punto pendiente 7 dal de gasolina corresponde a quantos decilitros
7 dal de gasolina corresponde a quantos decilitros Nerviaciones de las hojas
Nerviaciones de las hojas Que dibujo es
Que dibujo es Cual delos siguientes desarrollos corresponden a un prisma
Cual delos siguientes desarrollos corresponden a un prisma A que tipo de texto corresponde
A que tipo de texto corresponde Qué es la energía sonora
Qué es la energía sonora Corresponde a
Corresponde a Corresponde
Corresponde Ejemplos de descenso crioscopico en la vida cotidiana
Ejemplos de descenso crioscopico en la vida cotidiana