TEMA 6 CINTICA QUMICA IB CINTICA QUMICA 6

TEMA 6: CINÉTICA QUÍMICA IB

CINÉTICA QUÍMICA 6. 1 Finalidad de la cinética química 6. 2 Velocidad de reacción 6. 3 Ecuación de velocidad: órdenes de reacción 6. 4 Teoría cinético-molecular de los gases 6. 5 Teoría de las colisiones 6. 6 Teoría del complejo activado 6. 7 Distribución de energía de Maxwell. Boltzmann 6. 8 Factores que influyen en la velocidad de reacción

CINÉTICA QUÍMICA

CINÉTICA QUÍMICA Cinética química: parte de la química que estudia la velocidad con que transcurren las reacciones químicas, los factores que afectan a dicha velocidad y los mecanismos a través de los cuales los reactivos se transforman en productos.

CINÉTICA QUÍMICA Velocidad de reacción: representa la rapidez con que tiene lugar la transformación química de unas sustancias, los reactivos, en otras distintas, los productos. Velocidad media: de una reacción se mide a partir de la variación de la concentración de un reactivo o producto en un intervalo de tiempo. a A + b B → c C + d D La velocidad suele medirse en mol dm-3 s-1
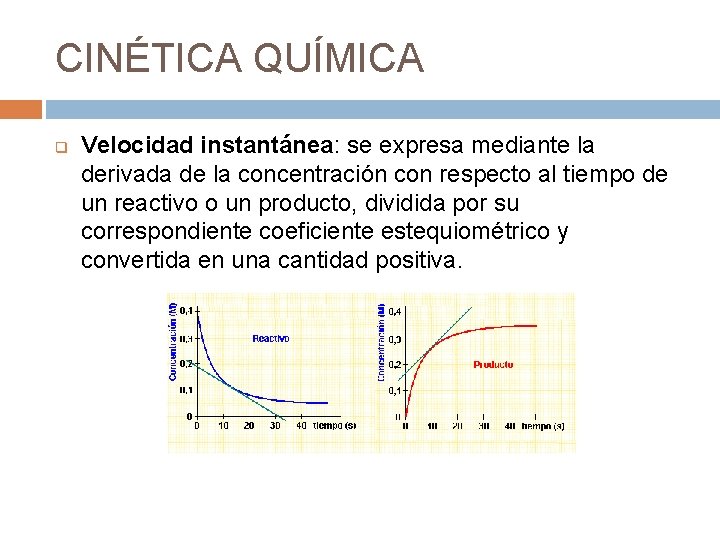
CINÉTICA QUÍMICA q Velocidad instantánea: se expresa mediante la derivada de la concentración con respecto al tiempo de un reactivo o un producto, dividida por su correspondiente coeficiente estequiométrico y convertida en una cantidad positiva.

CINÉTICA QUÍMICA Ecuación de velocidad: es una expresión matemática que relaciona la velocidad instantánea de una reacción en un momento dado con las concentraciones de los reactivos en ese momento. v = k [A]x [B]y … Orden de reacción: el orden de una reacción respecto de un reactivo es el exponente al que se eleva la concentración de éste en la ecuación de velocidad. Orden global de una reacción: es la suma de los exponentes a los que están elevadas las concentraciones de los reactivos en la ecuación de velocidad.

CINÉTICA QUÍMICA § § § Relación entre las concentraciones de los reactivos y el tiempo: los órdenes de reacción más frecuentes son cero, uno y dos. La oxidación de algunos metales sigue una cinética de orden cero, estas oxidaciones transcurren a velocidad constante. La mayoría de los fármacos que utilizamos siguen una eliminación con una cinética de primer orden. Las descomposiciones radiactivas siguen cinéticas de primer orden.

CINÉTICA QUÍMICA
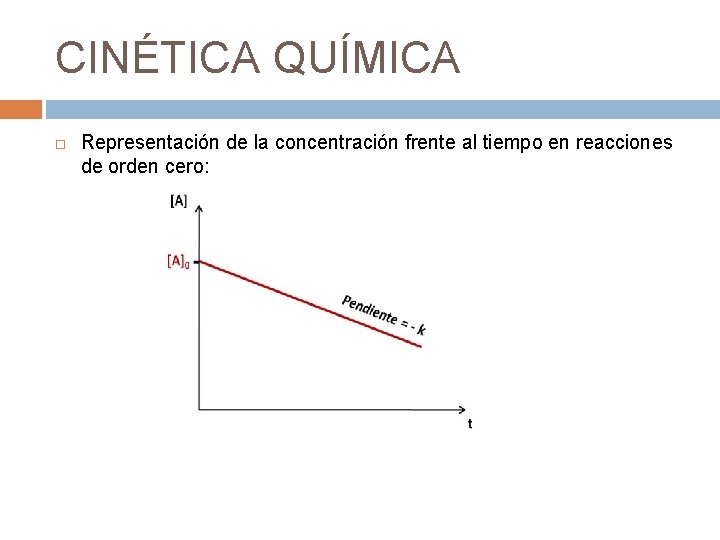
CINÉTICA QUÍMICA Representación de la concentración frente al tiempo en reacciones de orden cero:

CINÉTICA QUÍMICA

CINÉTICA QUÍMICA Representación de la concentración frente al tiempo en cinéticas de orden uno:

CINÉTICA QUÍMICA

CINÉTICA QUÍMICA § Mecanismos de reacción: En muchas reacciones los órdenes parciales de reacción no coinciden con los coeficientes estequiométricos de los reactivos correspondientes. Esto es debido a que estas reacciones transcurren en varios pasos, cada uno de ellos recibe el nombre de etapa elemental o reacción elemental, representan el modo en el que transcurre la reacción a nivel molecular. § § § Se denomina mecanismo de reacción a la secuencia de etapas elementales que explican el modo en que los reactivos se transforman en productos. Se denomina molecularidad, únicamente en las reacciones elementales, al número de especies químicas que intervienen en el proceso. La molecularidad y el orden de reacción coinciden si el proceso es elemental.

CINÉTICA QUÍMICA

CINÉTICA QUÍMICA § § Teoría cinético-molecular de los gases Los gases están formados por un elevado número de partículas que se mueven a altas velocidades en cualquier dirección El tamaño de las partículas que constituyen el gas es despreciable (se considera que tienen masa pero su volumen es despreciable) Los choques entre las partículas del gas son totalmente elásticos (la energía cinética total se conserva) La energía cinética media de las partículas del gas es directamente proporcional a la temperatura absoluta.
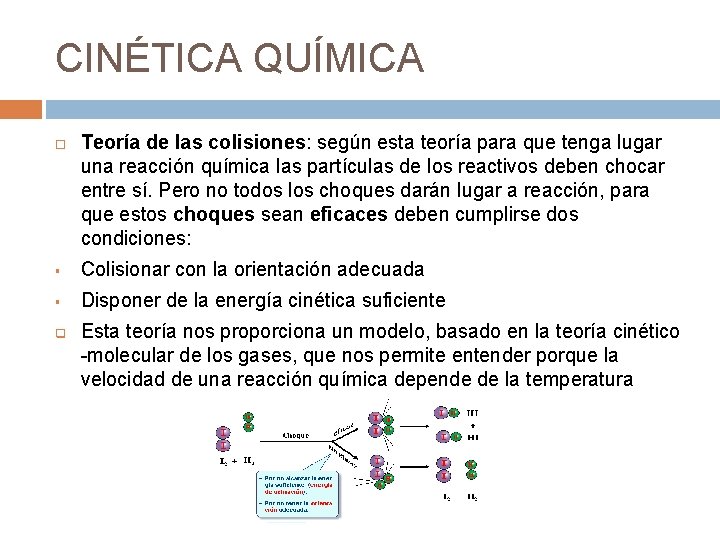
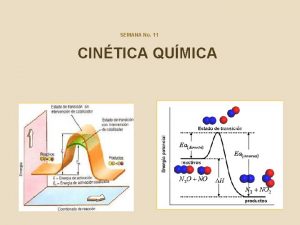
CINÉTICA QUÍMICA Teoría de las colisiones: según esta teoría para que tenga lugar una reacción química las partículas de los reactivos deben chocar entre sí. Pero no todos los choques darán lugar a reacción, para que estos choques sean eficaces deben cumplirse dos condiciones: § Colisionar con la orientación adecuada § Disponer de la energía cinética suficiente q Esta teoría nos proporciona un modelo, basado en la teoría cinético -molecular de los gases, que nos permite entender porque la velocidad de una reacción química depende de la temperatura

CINÉTICA QUÍMICA § § Teoría del complejo activado o del estado de transición: según esta teoría, las moléculas de los reactivos experimentan una deformación que en el choque da lugar a un estado intermedio de alta energía y corta duración, llamado complejo activado. El complejo activado puede dar lugar a los productos o volver a producir los reactivos iniciales. Para que llegue a formarse las moléculas de los reactivos deben tener una energía igual o superior a la denominada energía de activación Energía de activación: es la energía adicional que deben absorber las moléculas de los reactivos para que, al chocar, formen el complejo activado.
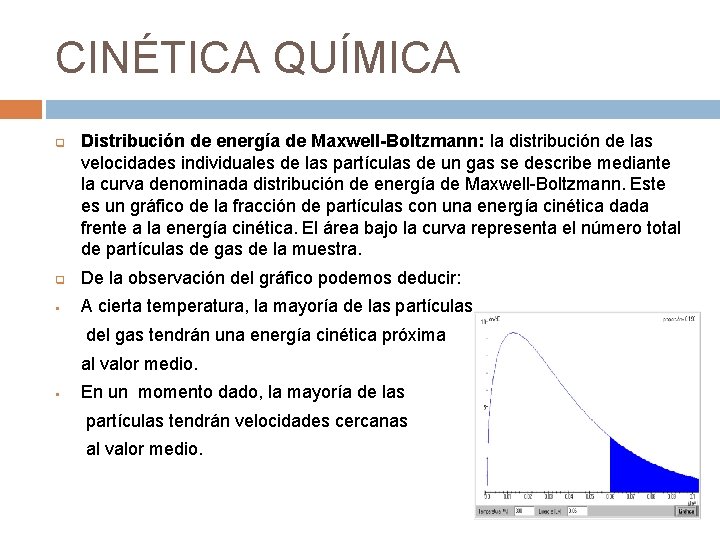
CINÉTICA QUÍMICA q Distribución de energía de Maxwell-Boltzmann: la distribución de las velocidades individuales de las partículas de un gas se describe mediante la curva denominada distribución de energía de Maxwell-Boltzmann. Este es un gráfico de la fracción de partículas con una energía cinética dada frente a la energía cinética. El área bajo la curva representa el número total de partículas de gas de la muestra. q De la observación del gráfico podemos deducir: § A cierta temperatura, la mayoría de las partículas del gas tendrán una energía cinética próxima al valor medio. § En un momento dado, la mayoría de las partículas tendrán velocidades cercanas al valor medio.
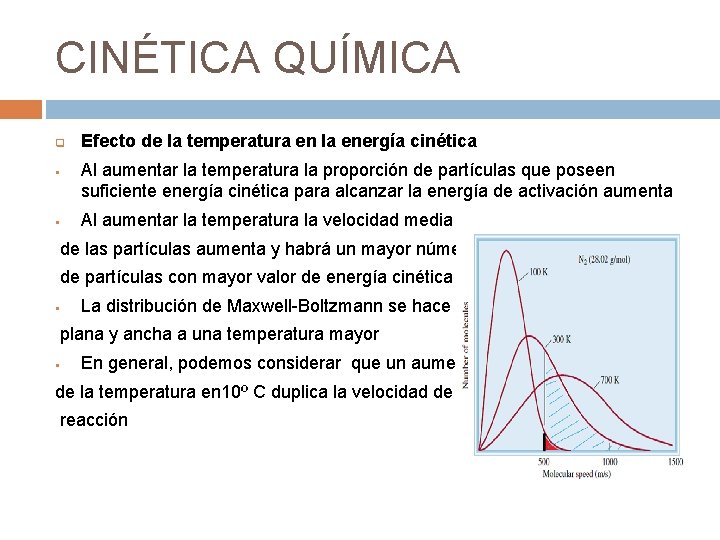
CINÉTICA QUÍMICA q § § Efecto de la temperatura en la energía cinética Al aumentar la temperatura la proporción de partículas que poseen suficiente energía cinética para alcanzar la energía de activación aumenta Al aumentar la temperatura la velocidad media de las partículas aumenta y habrá un mayor número de partículas con mayor valor de energía cinética § La distribución de Maxwell-Boltzmann se hace más plana y ancha a una temperatura mayor § En general, podemos considerar que un aumento de la temperatura en 10º C duplica la velocidad de reacción

TOK § § La temperatura puede considerarse como una medida de la cantidad media de energía cinética de las partículas. Al aumentar la temperatura aumenta la energía cinética. La temperatura más baja alcanzable teóricamente es el cero absoluto (-273, 15 ºC), cero grados en la escala Kelvin. A 0 K, las partículas no poseerán ninguna energía cinética y carecerán de movimiento. Sin embargo, si se considera el principio de incertidumbre de Heisenberg, todo movimiento molecular no puede cesar completamente a 0 K. ¿Sabrías razonar por qué?

CINÉTICA QUÍMICA: FACTORES QUE AFECTAN A LA VELOCIDAD DE REACCIÓN 1. 2. 3. 4. TEMPERATURA DE REACCIÓN CONCENTRACIÓN DE LOS REACTIVOS NATURALEZA, ESTADO FÍSICO Y GRADO DE DIVISIÓN CATALIZADORES

FACTORES QUE AFECTAN A LA VELOCIDAD DE REACCIÓN Temperatura de reacción: ya hemos comentado en efecto de la temperatura en la velocidad de reacción. Como ejemplo podemos considerar la conservación de la leche u otros alimentos en un frigorífico.

FACTORES QUE AFECTAN A LA VELOCIDAD DE REACCIÓN Concentración de los reactivos: en general puede considerarse, en las reacciones homogéneas, que un aumento de la concentración de los reactivos favorece la velocidad. El aumento del número de partículas por unidad de volumen produce un aumento del número de colisiones entre las partículas.

FACTORES QUE AFECTAN A LA VELOCIDAD DE REACCIÓN q § § § Naturaleza, estado físico y grado de división: Por su propia naturaleza, unas sustancias reaccionan más rápidamente que otras. (Las sustancias que presentan enlaces covalentes de gran energía reaccionan, en general, más lentamente que las iónicas) (La reactividad de los metales alcalinos aumenta con su número atómico) Estado físico: Las reacciones homogéneas entre gases o sustancias disueltas suceden generalmente con mayor rapidez que si las sustancias están en estado sólido. El grado de división de los sólidos: Cuanto más aumenta la superficie efectiva de contacto, mayor es la probabilidad de choques entre moléculas.

FACTORES QUE AFECTAN A LA VELOCIDAD DE REACCIÓN Reacción de sodio en agua Reacción del carbonato de calcio con ácido clorhídrico
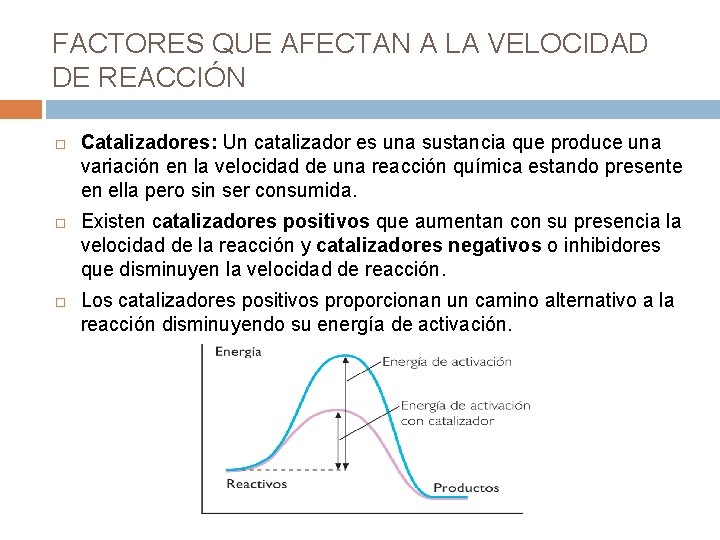
FACTORES QUE AFECTAN A LA VELOCIDAD DE REACCIÓN Catalizadores: Un catalizador es una sustancia que produce una variación en la velocidad de una reacción química estando presente en ella pero sin ser consumida. Existen catalizadores positivos que aumentan con su presencia la velocidad de la reacción y catalizadores negativos o inhibidores que disminuyen la velocidad de reacción. Los catalizadores positivos proporcionan un camino alternativo a la reacción disminuyendo su energía de activación.

FACTORES QUE AFECTAN A LA VELOCIDAD DE REACCIÓN

FACTORES QUE AFECTAN A LA VELOCIDAD DE REACCIÓN

FACTORES QUE AFECTAN A LA VELOCIDAD DE REACCIÓN

Bibliografía POZAS MAGARIÑOS, A. et al. (2016) Química 2º de Bachillerato. Madrid: Mc Graw Hill BYLIKIN, S. et al. (2014) Chemistry. Great Britain: Oxford GARCÍA POZO, T. y GARCÍA-SERNA, J. (2003) Química 2º Bachillerato. Barcelona: Edebé
- Slides: 31