Qumica General v Enlace Qumico v Nomenclatura Qumica














- Slides: 16

Química General v Enlace Químico v Nomenclatura Química

¡Triste época la nuestra¡ es más fácil desintegrar un átomo que un prejuicio.

Objetivos �Analizar las uniones de los elementos químicos, destacando sus características, indicando sus propiedades. �Analizar las reglas de nomenclatura de los compuestos binarios. �Fomentar el respeto entre los integrantes del equipo

Contenidos �Enlaces Químicos �Nomenclatura de los compuestos binarios

�Estructura de Lewis, en la cuales los electrones de valencia son representados por puntos alrededor del símbolo de los elementos:

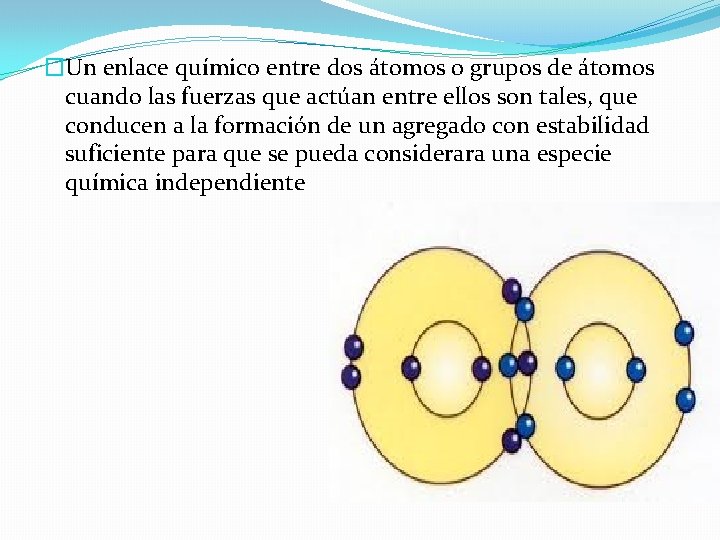
�Un enlace químico entre dos átomos o grupos de átomos cuando las fuerzas que actúan entre ellos son tales, que conducen a la formación de un agregado con estabilidad suficiente para que se pueda considerara una especie química independiente

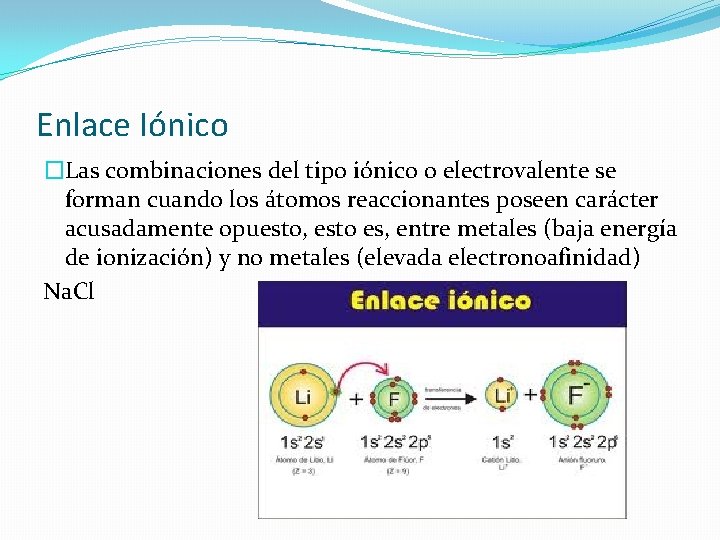
Enlace Iónico �Las combinaciones del tipo iónico o electrovalente se forman cuando los átomos reaccionantes poseen carácter acusadamente opuesto, esto es, entre metales (baja energía de ionización) y no metales (elevada electronoafinidad) Na. Cl

�A la unión de no metales entre si; es decir, es otra forma mediante la cual los átomos de ciertos elementos pueden adquirir la configuración electrónica de los gases nobles, es decir es aquel que se da mediante el compartimiento de electrones

Cuando se combinan dos átomos idénticos, no puede tener lugar la atracción unilateral del par electrónico enlazante por uno de los átomos. En este caso, el par electrónico será igualmente compartido por los átomos enlazados, encontrándose vinculado a ambos núcleos.

�El enlace formado se denomina enlace covalente y es característicos de la unión de los no metales entre sí; es decir, es otra forma mediante la cual los átomos de ciertos elementos pueden adquirir la configuración electrónica de gas noble. Mediante el compartimiento de electrones entre dos o más átomos, este tipo de enlace llamado covalente, es característico de aquellos átomos que no difieren grandemente en sus energía de ionización y electroafinidades (no metales)

Polaridad del enlace �El enlace realizado por un par de e- que pertenecen por igual a los dos átomos participantes en la combinación se llama enlace apolar

En este particular la electronegatividad juega un papel importante, si la diferencia de electronegatividad de los dos átomos que se enlazan es de 1, 7, o más, se forma un enlace iónico, mientras que si la diferencia es inferior a 1, 7 el resultado es un enlace covalente polar. Cuando la diferencia es cero el enlace covalente es apolar

Propiedades de las sustancias de acuerdo al tipo de enlace �Iónicas: Los compuestos que resultan de un enlace iónico producen sólidos iónicos o cristales iónicos: - Elevadas T de fusión y ebullición - Se disuelven en disolventes polares como el agua - Los cristales iónicos son malos conductores de la electricidad - Elevada dureza �Covalentes: s, l o gas, aunque cabe destacar que esto no es por el resultado de sus enlaces en sí, si no que se debe a las interacciones moleculares y a la intensidad de estas. �Sólidos a T ambiente: - Temperaturas de fusión y ebullición bajas - Se disuelven en disolventes generalmente apolares

�En el caso de sustancias covalentes cuyos átomos están unidos covalentemente formando los cristales covalentes - Son muy duros, frágiles, rígidos y funden a T muy elevadas, para originar líquidos no conductores (el diamante)

Nomenclatura de los compuestos inorgánicos

Bibliografía - Chang, R. (2006). Principios Esenciales de Química General. Madrid, España: Mc. Graw - Hill. - Malone, L. J. (2000). Introducción a la Química. México: LIMUSA, S. A - León. Ramírez, Rebeca. Química General, La Habana: Pueblo y Educación