El Enlace Qumico El Enlace Qumico Tipos de












- Slides: 23

El Enlace Químico

El Enlace Químico Ø Ø Ø Ø Tipos de enlace químico Símbolos de puntos de Lewis El enlace iónico El enlace covalente Estructuras de Lewis El concepto de resonancia Polaridad del enlace covalente. Electronegatividad.

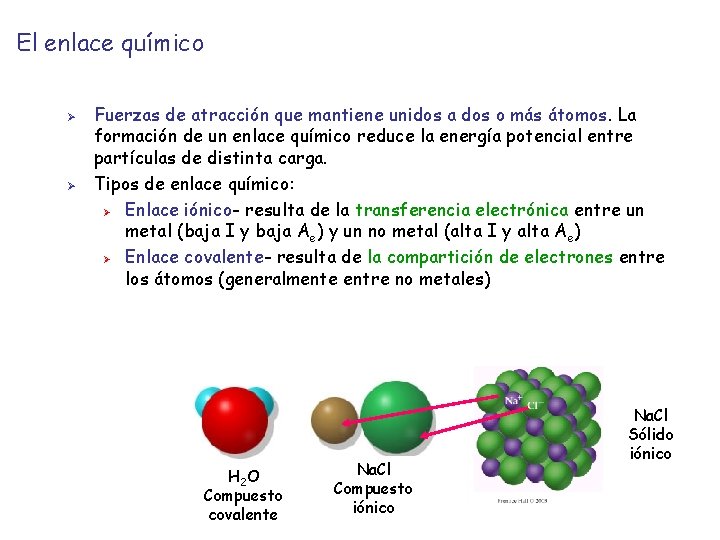
El enlace químico Ø Ø Fuerzas de atracción que mantiene unidos a dos o más átomos. La formación de un enlace químico reduce la energía potencial entre partículas de distinta carga. Tipos de enlace químico: Ø Enlace iónico- resulta de la transferencia electrónica entre un metal (baja I y baja Ae) y un no metal (alta I y alta Ae) Ø Enlace covalente- resulta de la compartición de electrones entre los átomos (generalmente entre no metales) H 2 O Compuesto covalente Na. Cl Compuesto iónico Na. Cl Sólido iónico

Símbolos de puntos de Lewis Ø Ø Una forma de representar los electrones de valencia de un átomo Se dibujan los electrones como puntos alrededor del símbolo del átomo X Ø Ø . . . F. . El número de electrones disponibles para el enlace se representa por puntos aislados Los puntos se dibujan alrededor del átomo, disponiéndolos en el lugar de los cuadrados que se representan en la figura

Símbolos de puntos de Lewis Ø Símbolos de Lewis para los elementos del segundo periodo (n = 2). Li Be B C N O F Ne

El enlace iónico Ø Ø Se forma entre elementos que tienen bajas energías de ionización (forman cationes fácilmente) y elementos que tienen altas afinidades electrónicas (forman anionescon facilidad) Resultan de la combinación de metales alcalinos y alcalinotérreos con los halógenos u oxígeno Las fuerzas de unión entre iones son de tipo electrostático (ley de Coulomb) Li. F es un compuesto iónico típico. El Li pierde un electrón y forma Li+ y el F gana un electrón y forma F. Nótese que el Li+ tiene la configuración electrónica del He y el F la del Ne Li + F Li. F

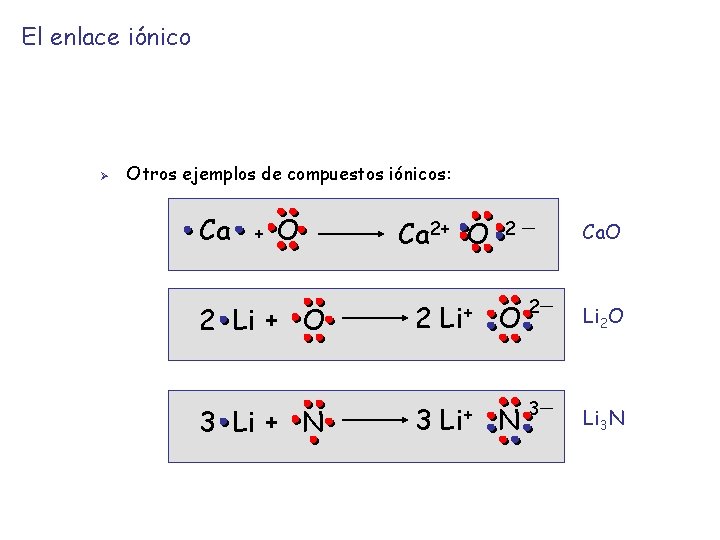
El enlace iónico Ø Otros ejemplos de compuestos iónicos: Ca + O 2 Li + O 3 Li + N Ca 2+ O 2 2 Li+ O 3 Li+ N Ca. O 2 Li 2 O 3 Li 3 N

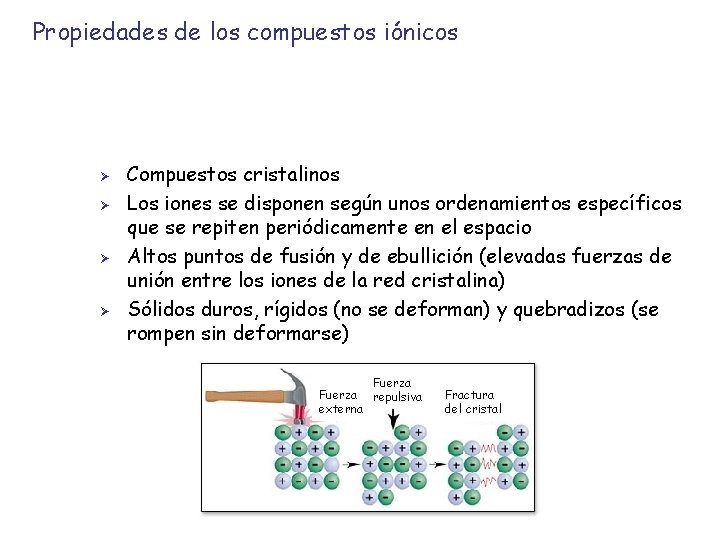
Propiedades de los compuestos iónicos Ø Ø Compuestos cristalinos Los iones se disponen según unos ordenamientos específicos que se repiten periódicamente en el espacio Altos puntos de fusión y de ebullición (elevadas fuerzas de unión entre los iones de la red cristalina) Sólidos duros, rígidos (no se deforman) y quebradizos (se rompen sin deformarse) Fuerza repulsiva externa Fractura del cristal

Propiedades de los compuestos iónicos Ø No son conductores de la electricidad en estado sólido pero sí lo hacen en estado fundido o en disolución Sólido iónico fundido Sólido iónico disuelto en agua

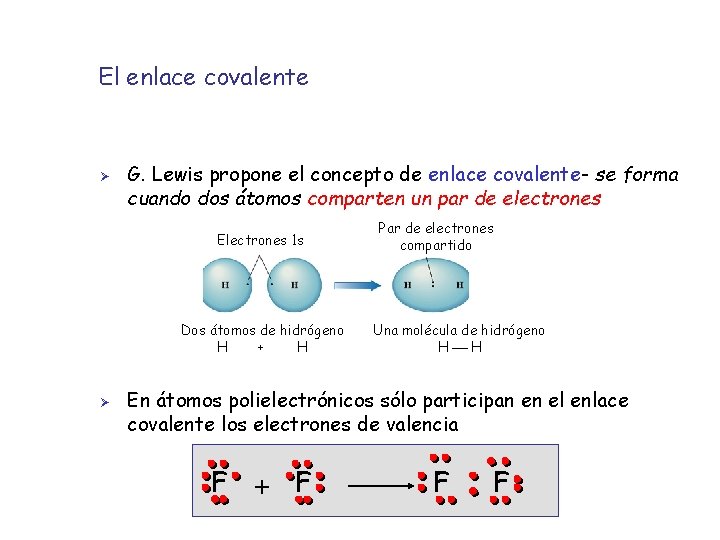
El enlace covalente Ø G. Lewis propone el concepto de enlace covalente- se forma cuando dos átomos comparten un par de electrones Electrones 1 s Dos átomos de hidrógeno H + H Ø Par de electrones compartido Una molécula de hidrógeno H H En átomos polielectrónicos sólo participan en el enlace covalente los electrones de valencia F + F F F

El enlace covalente Ø Los pares de enlace que no forman parte del enlace se denominan pares libres (no enlace) F + F F F Par enlace Ø Tipos de enlace: Ø Ø Ø Sencillo (1 par de d electrones) H 2 Doble (2 pares de electrones) O 2 Triple (3 pares de electrones) N 2 Pares libres

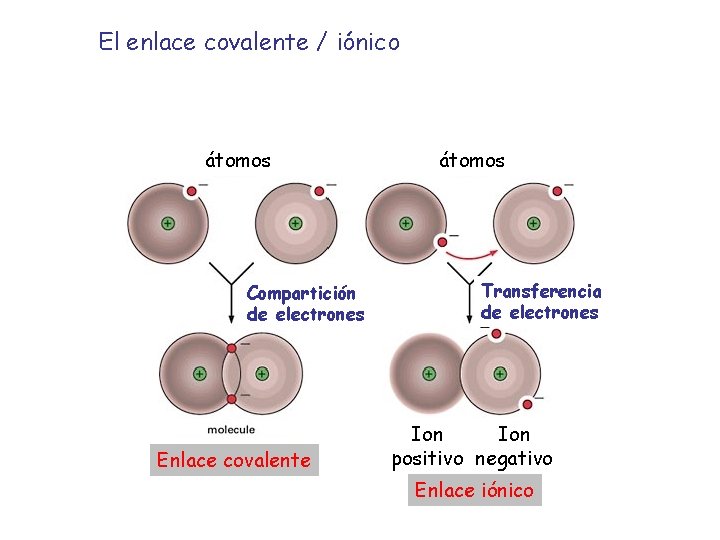
El enlace covalente / iónico átomos Compartición de electrones Enlace covalente átomos Transferencia de electrones Ion positivo negativo Enlace iónico

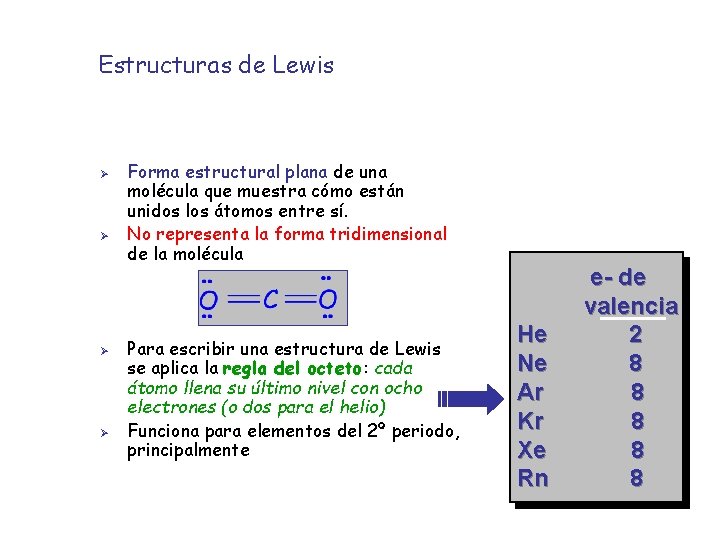
Estructuras de Lewis Ø Ø Forma estructural plana de una molécula que muestra cómo están unidos los átomos entre sí. No representa la forma tridimensional de la molécula Para escribir una estructura de Lewis se aplica la regla del octeto: cada átomo llena su último nivel con ocho electrones (o dos para el helio) Funciona para elementos del 2º periodo, principalmente He Ne Ar Kr Xe Rn e- de valencia 2 8 8 8

Estructuras de Lewis: ejemplos Para escribir una estructura de Lewis se siguen. . . Ejemplo- dióxido de carbono CO 2 Ø Ø Paso 1 - Escribir la estructura fundamental mediante símbolos químicos. El átomo menos EN en el centro. H y F ocupan siempre posiciones terminales O C O Paso 2 - Calcular nº total de electrones de valencia C: [He]2 s 22 p 2 1 carbono x 4 electrones = 4 O: [He]2 s 22 p 4 2 oxígeno x 6 electrones = 12 número total de e= 16 Ø 8 pares de electrones

Estructuras de Lewis: ejemplos Ejemplo CO 2 Ø Paso 3 - Dibujar enlace covalente sencillo por cada dos átomos. Completar el octeto de los átomos enlazados al central: Hemos colocado todos los electrones (8 pares) y el C no tiene completo su octeto Ø Paso 4 - Agregar dobles o triples enlaces hasta completar el octeto del átomo central: Estructura de Lewis del CO 2

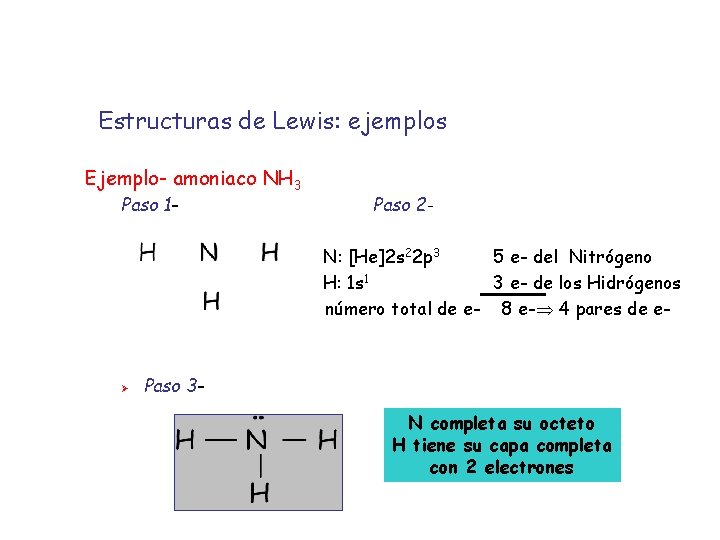
Estructuras de Lewis: ejemplos Ejemplo- amoniaco NH 3 Paso 1 - Paso 2 N: [He]2 s 22 p 3 5 e- del Nitrógeno H: 1 s 1 3 e- de los Hidrógenos número total de e- 8 e- 4 pares de e- Ø Paso 3 N completa su octeto H tiene su capa completa con 2 electrones

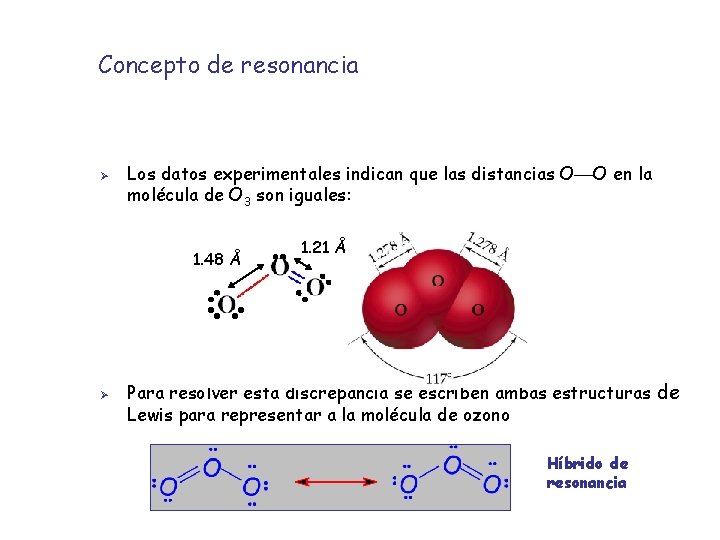
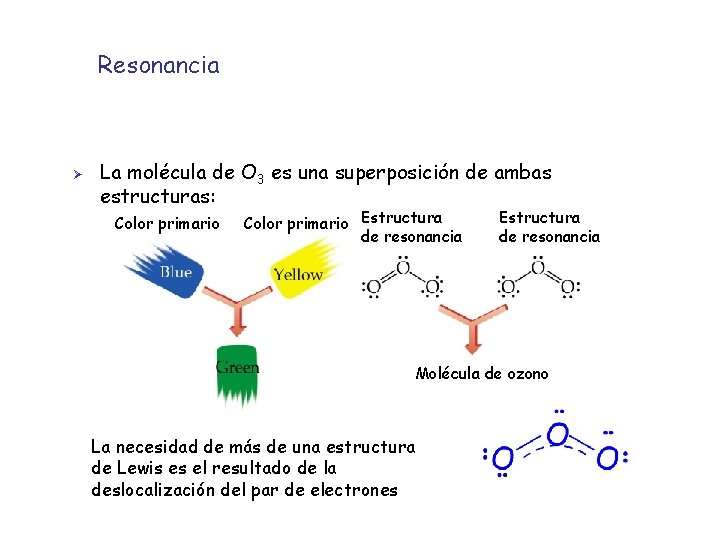
Concepto de resonancia Ø Ø A veces hay moléculas que no se describen por una única estructura de Lewis Generalmente son compuestos con enlaces múltiples. Se pueden escribir estructuras que difieren en la posición de los enlaces dobles o triples. Estas estructuras que se diferencian en la posición de los enlaces múltiples se denominan estructuras de resonancia Ejemplo: la molécula de ozono (O 3) Ambas formas de resonancia son posibles

Concepto de resonancia Ø Los datos experimentales indican que las distancias O O en la molécula de O 3 son iguales: 1. 48 Å Ø 1. 21 Å Para resolver esta discrepancia se escriben ambas estructuras de Lewis para representar a la molécula de ozono Híbrido de resonancia

Resonancia Ø La molécula de O 3 es una superposición de ambas estructuras: Color primario Estructura de resonancia Molécula de ozono La necesidad de más de una estructura de Lewis es el resultado de la deslocalización del par de electrones

Enlaces covalente polares Ø Ø En un enlace covalente implica compartir electrones entre dos átomos En la molécula de H 2 los electrones se comparten por igual entre los dos átomos de H Asimetría de la nube electrónica simétrica H H Ø H Cl En la molécula de HCl el par de electrones no se comparte por igual entre el H y el Cl porque son dos átomos distintos. El enlace H-Cl es un enlace covalente polar o enlace polar Consecuencia de la distinta electronegatividad de los átomos

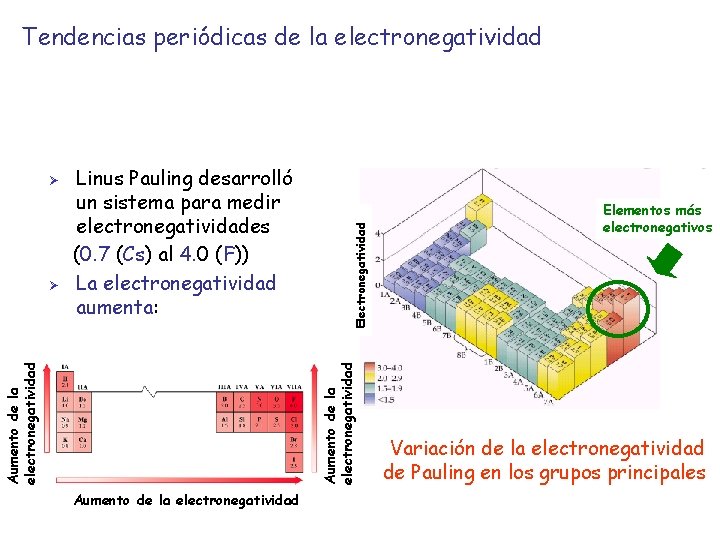
Electronegatividad Ø Ø Electronegatividad: capacidad de un átomo para atraer hacia sí los electrones de un enlace químico La diferencia de electronegatividad entre los átomos resulta en la transferencia parcial de carga hacia el átomo más electronegativo En consecuencia, el enlace covalente que se forma es un enlace polar Los enlaces polares posen un extremo negativo y un extremo positivo. La molécula es, por tanto, un dipolo. • H Menor densidad electrónica Polo positivo (d+) F • Mayor densidad electrónica Polo negativo (d )

Aumento de la electronegatividad Ø Linus Pauling desarrolló un sistema para medir electronegatividades (0. 7 (Cs) al 4. 0 (F)) La electronegatividad aumenta: Aumento de la electronegatividad Ø Electronegatividad Tendencias periódicas de la electronegatividad Aumento de la electronegatividad Elementos más electronegativos Variación de la electronegatividad de Pauling en los grupos principales

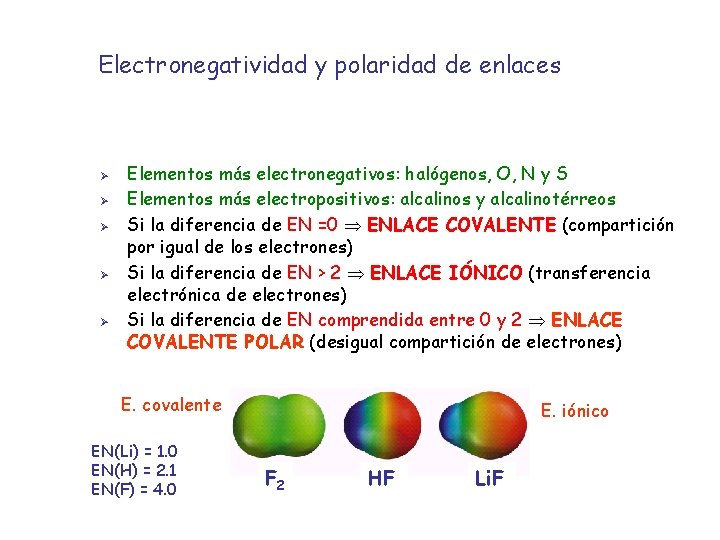
Electronegatividad y polaridad de enlaces Ø Ø Ø Elementos más electronegativos: halógenos, O, N y S Elementos más electropositivos: alcalinos y alcalinotérreos Si la diferencia de EN =0 ENLACE COVALENTE (compartición por igual de los electrones) Si la diferencia de EN > 2 ENLACE IÓNICO (transferencia electrónica de electrones) Si la diferencia de EN comprendida entre 0 y 2 ENLACE COVALENTE POLAR (desigual compartición de electrones) E. covalente EN(Li) = 1. 0 EN(H) = 2. 1 EN(F) = 4. 0 E. iónico F 2 HF Li. F
 Enlace covalente coordinado
Enlace covalente coordinado Oxígeno tipo de enlace
Oxígeno tipo de enlace Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace sigma pi
Enlace sigma pi Tipos de enlaces quimicos
Tipos de enlaces quimicos Ion nitrato geometria molecular
Ion nitrato geometria molecular Regla del dueto
Regla del dueto Tipos de tipos de
Tipos de tipos de Tipo de enlace
Tipo de enlace Enrutamiento por estado de enlace
Enrutamiento por estado de enlace (a+b)^2
(a+b)^2 Monosacaridos en el adn
Monosacaridos en el adn Cloruro de magnesio enlace
Cloruro de magnesio enlace Enlaces sigma y pi
Enlaces sigma y pi Redes covalentes
Redes covalentes Enlace
Enlace Lipidos animacion
Lipidos animacion Enlace triple
Enlace triple Mgf2 electronegatividad
Mgf2 electronegatividad Enlace glicosídico
Enlace glicosídico Enlace n-n
Enlace n-n Angulo de enlace
Angulo de enlace