EL ENLACE QUMICO EL ENLACE QUMICO Los tomos








- Slides: 14

EL ENLACE QUÍMICO

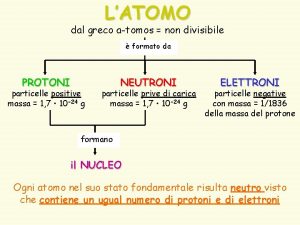
EL ENLACE QUÍMICO Los átomos se enlazan porque tienen tendencia a adquirir configuración estable, es decir: 8 electrones en su último nivel de energía Los gases nobles no se enlazan porque ya tienen configuración estable, su molécula es monoatómica

ENLACES • METÁLICO POLAR • COVALENTE APOLAR • IÓNICO O ELECTROVALENTE • COVALENTE COORDINADO • POR PUENTE DE HIDRÓGENO

ENLACE METÁLICO IONES POSITIVOS NADANDO EN UN MAR DE ELECTRONES MÓVILES • • PROPIEDADES DE LOS METALES SÓLIDOS BRILLO DÚCTILES MALEABLES CONDUCTORES DEL CALOR Y LA ELECTRICIDAD ALTOS PUNTOS DE FUSION ALTA DENSIDAD DUROS

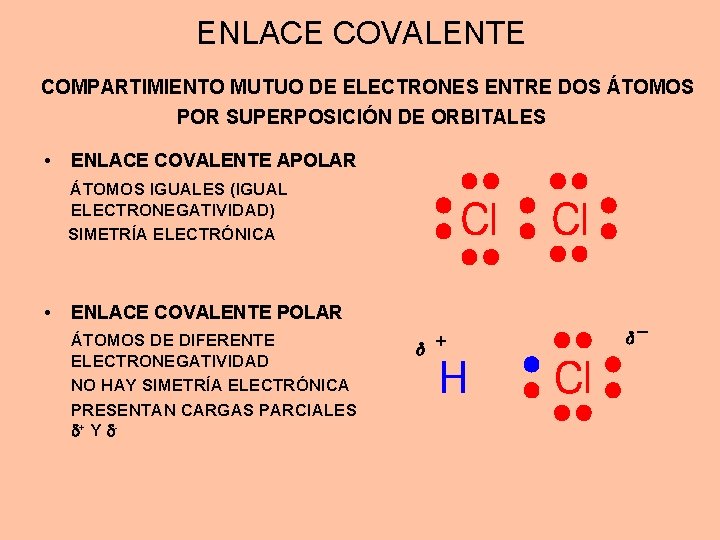
ENLACE COVALENTE COMPARTIMIENTO MUTUO DE ELECTRONES ENTRE DOS ÁTOMOS POR SUPERPOSICIÓN DE ORBITALES • ENLACE COVALENTE APOLAR ÁTOMOS IGUALES (IGUAL ELECTRONEGATIVIDAD) SIMETRÍA ELECTRÓNICA • ENLACE COVALENTE POLAR ÁTOMOS DE DIFERENTE ELECTRONEGATIVIDAD NO HAY SIMETRÍA ELECTRÓNICA PRESENTAN CARGAS PARCIALES + Y - +

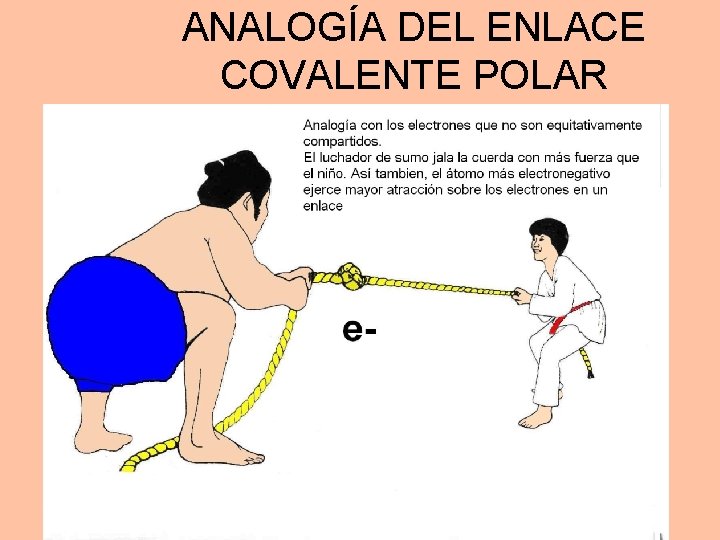
ANALOGÍA DEL ENLACE COVALENTE POLAR

CARACTERISTICAS DE LOS COMPUESTOS FORMADOS CON UN ENLACE COVALENTE APOLAR O NO POLAR • FORMAN MOLÉCULAS • SOLUBLES EN DISOLVENTES NO POLARES • PUNTOS DE FUSIÓN BAJOS • NO CUNDUCEN LA CORRIENTE ELÉCTRICA POLAR • FORMAN MOLÉCULAS • SOLUBLES EN DISOLVENTES POLARES • PUNTOS DE FUSIÓN Y EBULLICIÓN MAYORES QUE LOS APOLARES PERO MENORES QUE LOS IÓNICOS • NO CONDUCEN LA CORRIENTE ELÉCTRICA

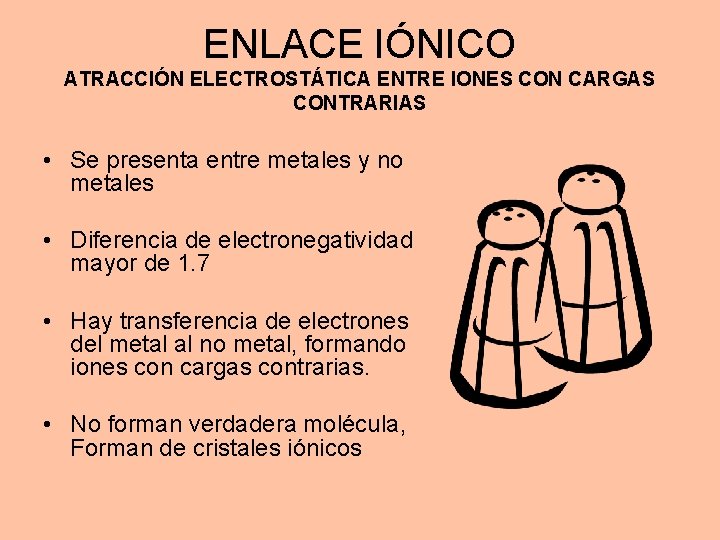
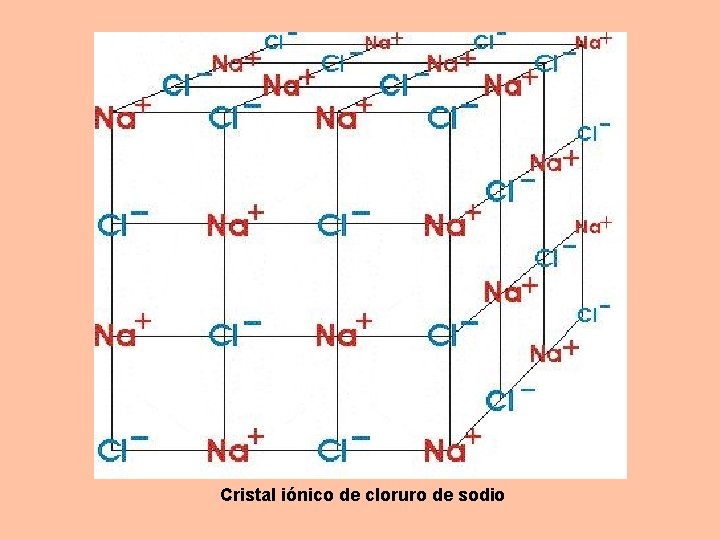
ENLACE IÓNICO ATRACCIÓN ELECTROSTÁTICA ENTRE IONES CON CARGAS CONTRARIAS • Se presenta entre metales y no metales • Diferencia de electronegatividad mayor de 1. 7 • Hay transferencia de electrones del metal al no metal, formando iones con cargas contrarias. • No forman verdadera molécula, Forman de cristales iónicos

Cristal iónico de cloruro de sodio

CARACTERÍSTICAS DE LOS COMPUESTOS CON EL ENLACE IÓNICO • Forman cristales iónicos • Sus sales fundidas o en solución acuosa conducen la corriente eléctrica • Solubles en disolventes polares como el agua • Puntos de fusión y ebullición elevados

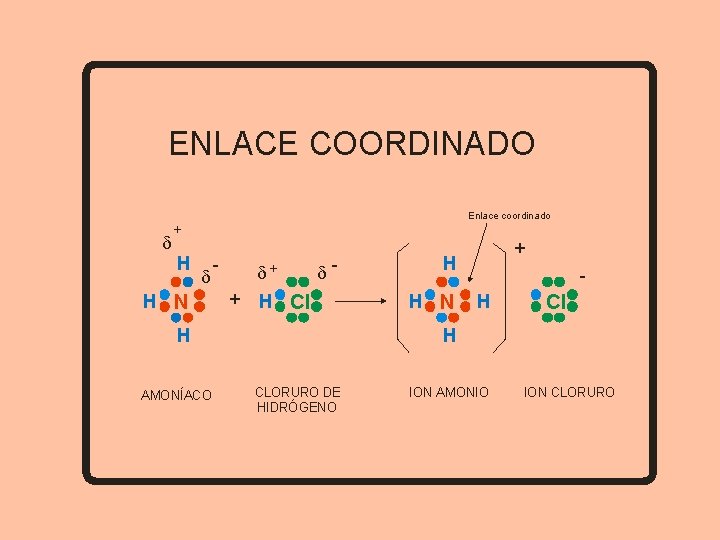
ENLACE COORDINADO Unión de dos átomos, compartiendo un par de electrones aportados por uno solo de ellos • Se presenta cuando existe un átomo que tiene un par de electrones sin compartir y otro átomo con un orbital vacío, donde se pueda acomodar dicho par

ENLACE COORDINADO d Enlace coordinado + H d H N - d+ d- + H Cl H AMONÍACO + H H N H Cl H CLORURO DE HIDRÓGENO ION AMONIO ION CLORURO

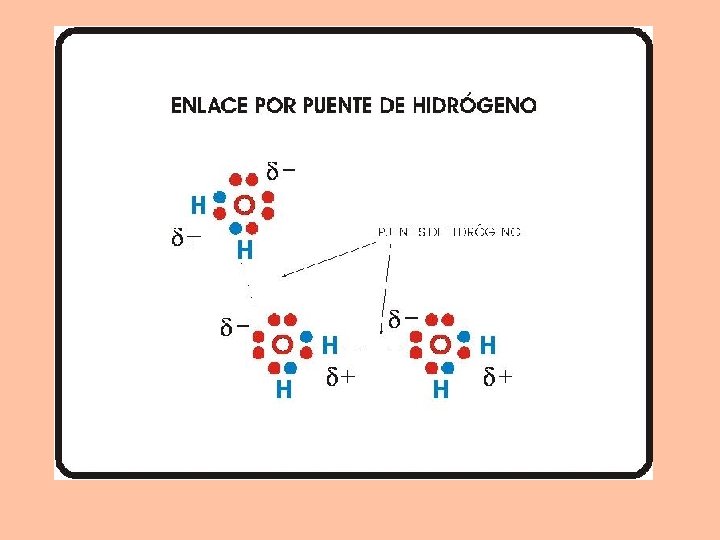
ENLACE POR PUENTE DE HIDRÓGENO Se presenta en moléculas que contienen hidrogeno unido a un átomo muy electronegativo, como el oxígeno, nitrógeno flúor. etc “H”