ENLACE QUMICO El enlace qumico es la unin

















- Slides: 21

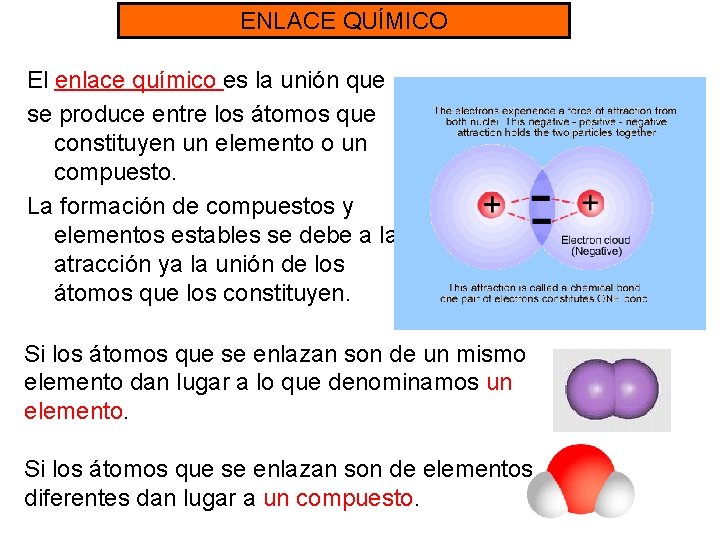
ENLACE QUÍMICO El enlace químico es la unión que se produce entre los átomos que constituyen un elemento o un compuesto. La formación de compuestos y elementos estables se debe a la atracción ya la unión de los átomos que los constituyen. Si los átomos que se enlazan son de un mismo elemento dan lugar a lo que denominamos un elemento. Si los átomos que se enlazan son de elementos diferentes dan lugar a un compuesto.

ENLACE QUÍMICO Teoría del enlace químico: Regla del octeto. Los átomos de los diferentes elementos químicos tienden a unirse a otros átomos para poder tener ocho electrones en la última capa, el llamado octeto, y, de este modo conseguir una mayor estabilidad. Esto lo pueden lograr mediante tres tipos de enlaces: - Enlace iónico. - Enlace covalente. - Enlace metálico.

ENLACE QUÍMICO: Enlace iónico El enlace iónico consiste en la unión de iones de signo opuesto por fuerzas de atracción electrostática. El enlace iónico se forma a partir de un átomo del tipo metal y uno del tipo no metal. El de tipo metal, pierde electrones (se transforma en un catión) y el átomo de tipo no metal, gana electrones (se transforma en un anión). Cuando se unen los dos átomos de cargas opuestas forman un cristal iónico: una red tridimensional.

ENLACE QUÍMICO: Enlace iónico

ENLACE QUÍMICO: Enlace iónico Xarxes cristal·lines de Na. Cl Xarxa cristal·lina de Mg. Cl 2

ENLACE QUÍMICO: Enlace iónico PROPIEDADES DE LAS SUBSTANCIAS IÓNICAS - Son siempre sólidos cristalinos. - Tienen puntos de fusión y ebullición altos. - Son duros y quebradizos. - No conducen calor ni la electricidad en estado sólido pero sí en estado fundido. - Solubilidad en agua variable. - Si son solubles generan iones que conducen la electricidad a través de las disoluciones. EJEMPLOS: Na. Cl (sal de cocina), KCl (sal de potasio), Fe. O (óxido de hierro).

ENLACE QUÍMICO: Enlace iónico EJEMPLOS

ENLACE QUÍMICO: Enlace covalente El enlace covalente consiste en la unión de átomos mediante la compartición de electrones de valencia. El enlace covalente se forma cuando se unen dos átomos del tipo no metal. Los dos átomos necesitan electrones para alcanzar capa llena, y esto lo consiguen gracias a la compartición de electrones con el otro átomo. La compartición puede ser: simple (2 electrones), C-C doble (4 electrones) , C=C triple (6 electrones) C_C =

ENLACE QUÍMICO: Enlace covalente Molècula de metà CH 4

ENLACE QUÍMICO: Enlace covalente Estructuras de Lewis: Estructuras que se utilizan para representar moléculas covalentes y los enlaces entre los átomos que las constituyen. Los electrones se representan con puntitos o crucecitas. Un enlace simple se representa por un guión Enlace doble dos guiones = Enlace triple tres guiones Molécula de metano CH 4 Molécula de nitrógeno Molécula de dióxido de carbono

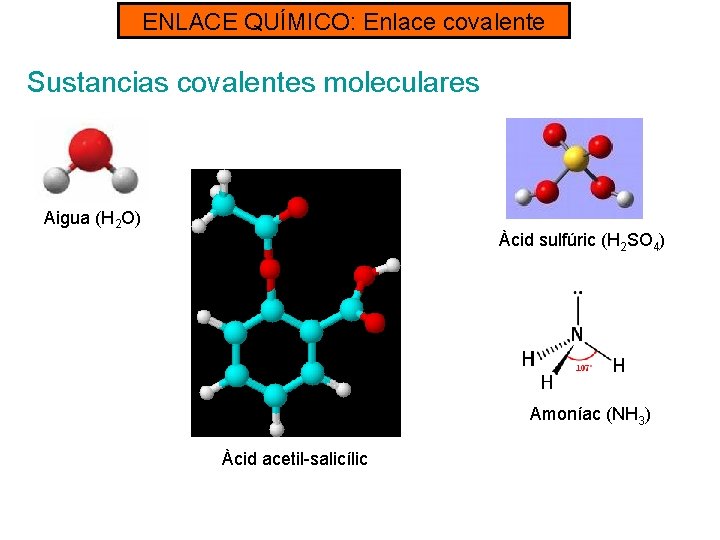
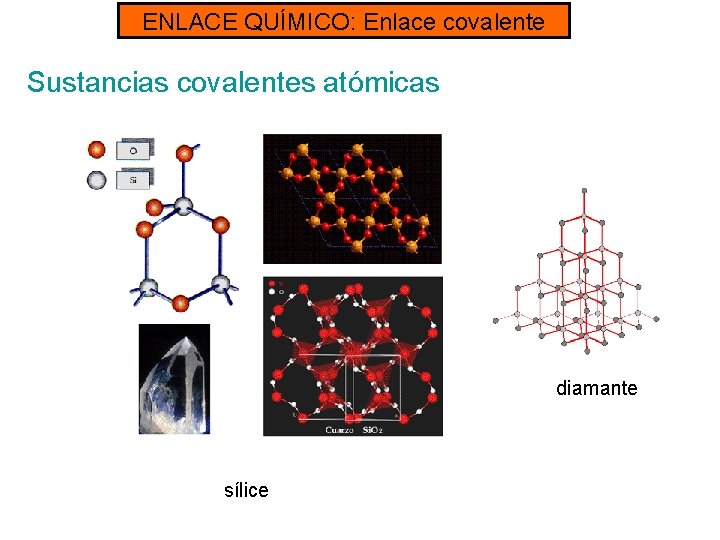
ENLACE QUÍMICO: Enlace covalente TIPO DE SUSTANCIAS COVALENTES: - Sustancias covalentes moleculares: constituidas por moléculas discretas. Pueden encontrarse en los tres estados, en función de las interacciones que hay entre ellos. Ejemplos: CO 2, H 2 O, NH 3, CH 4. . . - Sustancias covalentes atómicas: constituidas por redes cristalinas. Ejemplos: sílice Si. O 2, carbono diamante, carbono grafito

ENLACE QUÍMICO: Enlace covalente Sustancias covalentes moleculares - Tienen puntos de ebullición bajos y por eso la mayoría, a temperatura ambiente son sustancias gaseosas, líquidos volátiles o sólidos que subliman fácilmente. - No son conductores de la electricidad. - Algunas son solubles en agua y otros en disolventes orgánicos. EJEMPLOS: H 2 (hidrógeno), O 2 (oxígeno), CO 2 (dióxido de carbono), NO 2 (dióxido de nitrógeno), SO 3 (trióxido de azufre), H 2 SO 4 (ácido sulfúrico).

ENLACE QUÍMICO: Enlace covalente Sustancias covalentes moleculares Aigua (H 2 O) Àcid sulfúric (H 2 SO 4) Amoníac (NH 3) Àcid acetil-salicílic

ENLACE QUÍMICO: Enlace covalente Sustancias covalentes atómicas - Son sólidos densos y muy duros. - Son insolubles en cualquier disolvente. - No conducen la electricidad, excepto el carbono grafito, porque no tienen electrones que puedan moverse libremente. EJEMPLOS: Carbono diamante, carbono grafito, sílice (Si. O 2)

ENLACE QUÍMICO: Enlace covalente Sustancias covalentes atómicas diamante sílice

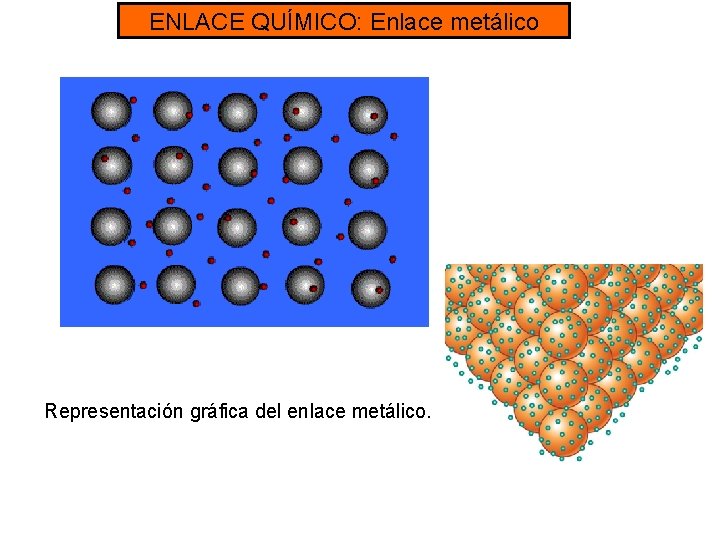
ENLACE QUÍMICO: Enlace metálico • El enlace metálico se forma con dos átomos del tipo metal. • Los dos átomos pierden los electrones de la última capa, y estos se disponen alrededor de los cationes formando una nube electrónica. • Los electrones restantes se mueven por la nube permitiendo la conducción de la electricidad

ENLACE QUÍMICO: Enlace metálico Representación gráfica del enlace metálico.

ENLACE QUÍMICO: Enlace metálico - Son buenos conductores del calor y de la electricidad. - Son sólidos con puntos de fusión y ebullición altos - Son maleables y dúctiles. - Son insolubles en cualquier disolvente corriente. - Tienen un brillo metálico debido a la nube de electrones. -EJEMPLOS: Fe (hierro), Ag (plata), Au (oro), Cu (cobre), Pb (plomo).

ENLACE QUÍMICO: Enlace metálico

ENLACE QUÍMICO

 Enlace qumico
Enlace qumico Enlace dativo
Enlace dativo Estructura de lewis de hf
Estructura de lewis de hf Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Ejemplo de enlace sigma
Ejemplo de enlace sigma Arandela grower
Arandela grower Tratados de la ue
Tratados de la ue Unin
Unin Unin europea
Unin europea Unin
Unin Unin
Unin Unin europea
Unin europea Unin merlin
Unin merlin Unin
Unin Teoria de enlace de valencia
Teoria de enlace de valencia Enlace ionico
Enlace ionico Enlace n-n
Enlace n-n Enlace so
Enlace so Uniones metalicas ejemplos
Uniones metalicas ejemplos Estructura de lewis de ccl
Estructura de lewis de ccl Enfermera de enlace
Enfermera de enlace