Qumica Clase 6 Enlace qumico II Qumica ID












- Slides: 18

Química Clase 6: Enlace químico II: Química - ID IN 1004 Unidad de Ciencias de la Ingeniería Universidad de O'Higgins

Tópicos de la Clase 1. Carga formal 2. Resonancia 3. Modelos RPECV Capítulo 10: Enlace químico I y II. Química 7ª Ed. , R. Chang; Mc. Graw Hill. 2002.

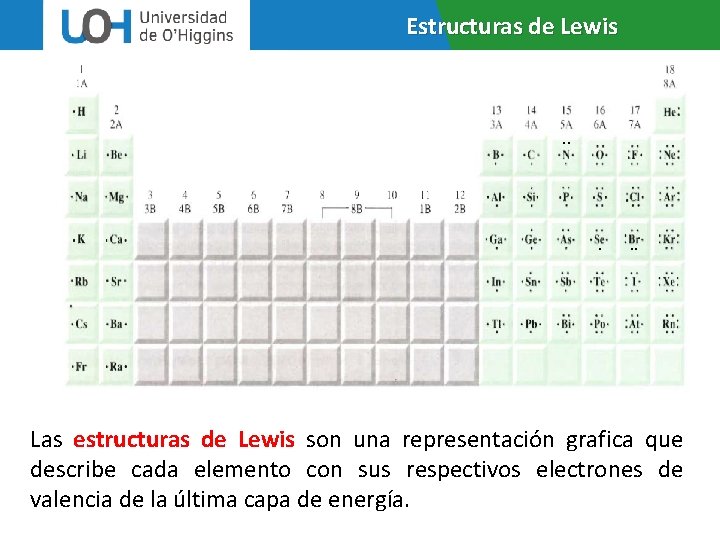
Estructuras de Lewis . . . Las estructuras de Lewis son una representación grafica que describe cada elemento con sus respectivos electrones de valencia de la última capa de energía.

Carga Formal Ejemplo: Ozono (O 3) 1. Determinar la configuración electrónica del último nivel para cada átomo de la molécula Oxígeno (O): 1 s 2 2 p 4 2. Escribir la estructura de Lewis para cada átomo. O 3. Escribir la estructura de Lewis de la molécula respetando la regla del octeto. De ser necesario, agregue dobles o triples enlaces en el átomo central. 1. 2. 8 e 6 e 8 e 8 e 4. La Carga Formal es la diferencia entre los electrones de valencia de un átomo aislado y el número de electrones asignados a ese átomo en una estructura de Lewis. Se calcula con la siguiente ecuación: Libro Chang, Ecuación 9. 3

Carga Formal Ejemplo: Ozono (O 3) O 2. 1. 3. 1. 2. 3. Carga neta: 0, molécula neutra

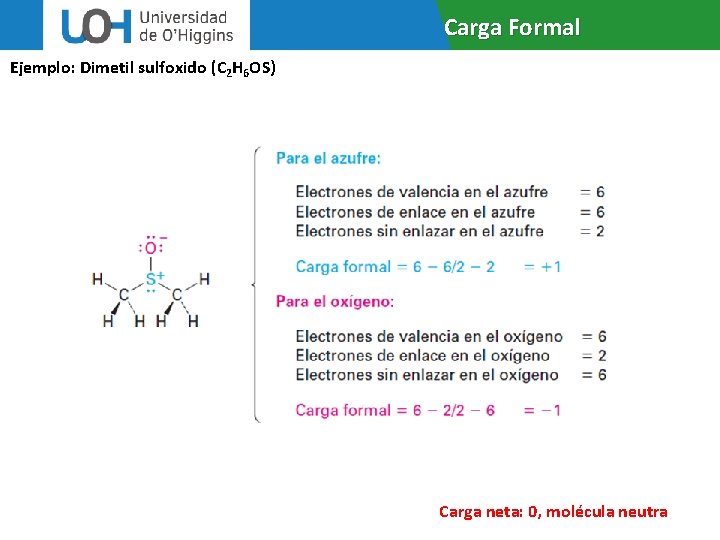
Carga Formal Ejemplo: Dimetil sulfoxido (C 2 H 6 OS) Carga neta: 0, molécula neutra

Carga Formal Ejercicio: Determine la estructura de Lewis y calcule la carga formal para las siguientes moléculas.

Carga Formal Carga formal en Iones (cationes o aniones) Ejemplo: Carbonato (CO 3 -2) O C

Carga Formal Ejercicio: Determine la estructura de Lewis y calcule la carga formal para la molécula de NCl 3. Número atómico (z): N = 7 ; Cl = 17 Configuración electrónica: N = 1 s 2 2 p 3 = 7 e Cl = 1 s 2 2 p 6 3 s 2 3 p 5 = 17 e b. a. d. N c. Cl a. b. c. d. 5 – 2 – ½ (6) = 0 7 – 6 – ½ (2) = 0 Carga formal = 0

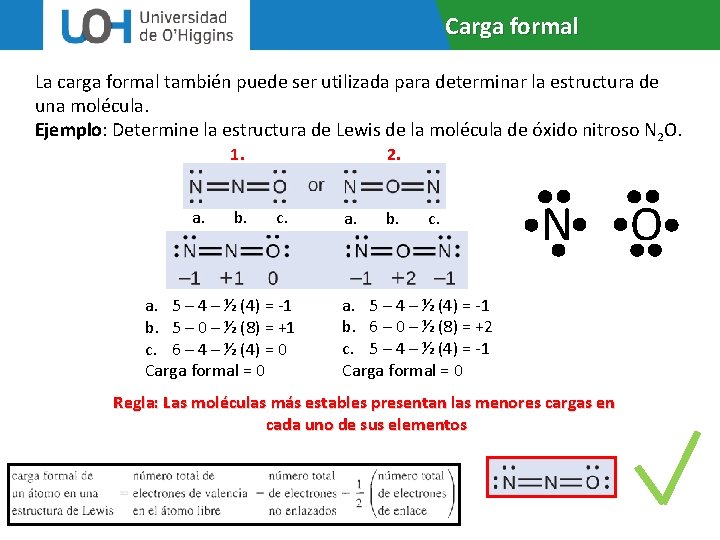
Carga formal La carga formal también puede ser utilizada para determinar la estructura de una molécula. Ejemplo: Determine la estructura de Lewis de la molécula de óxido nitroso N 2 O. 1. a. b. 2. c. a. 5 – 4 – ½ (4) = -1 b. 5 – 0 – ½ (8) = +1 c. 6 – 4 – ½ (4) = 0 Carga formal = 0 a. b. c. N a. 5 – 4 – ½ (4) = -1 b. 6 – 0 – ½ (8) = +2 c. 5 – 4 – ½ (4) = -1 Carga formal = 0 Regla: Las moléculas más estables presentan las menores cargas en cada uno de sus elementos O

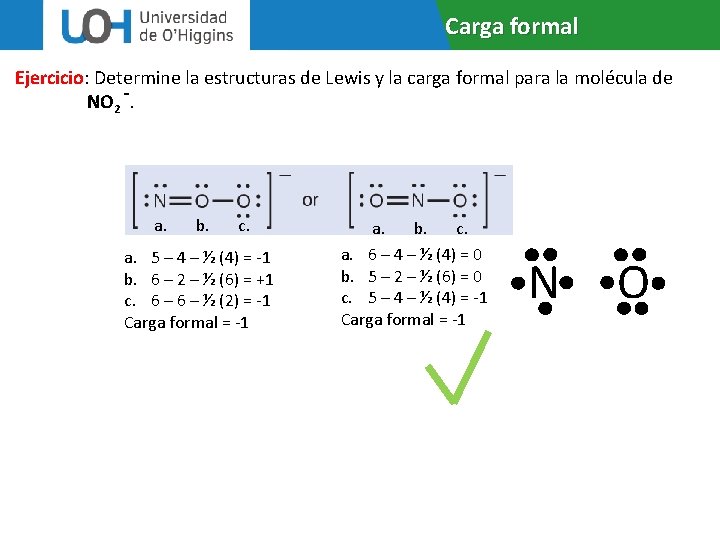
Carga formal Ejercicio: Determine la estructuras de Lewis y la carga formal para la molécula de NO 2 -. a. b. c. a. 5 – 4 – ½ (4) = -1 b. 6 – 2 – ½ (6) = +1 c. 6 – ½ (2) = -1 Carga formal = -1 a. b. c. a. 6 – 4 – ½ (4) = 0 b. 5 – 2 – ½ (6) = 0 c. 5 – 4 – ½ (4) = -1 Carga formal = -1 N O

Resonancia: Una sola molécula puede tener más de una representación de estructura de Lewis. Ejemplo: Ozono (O 3)

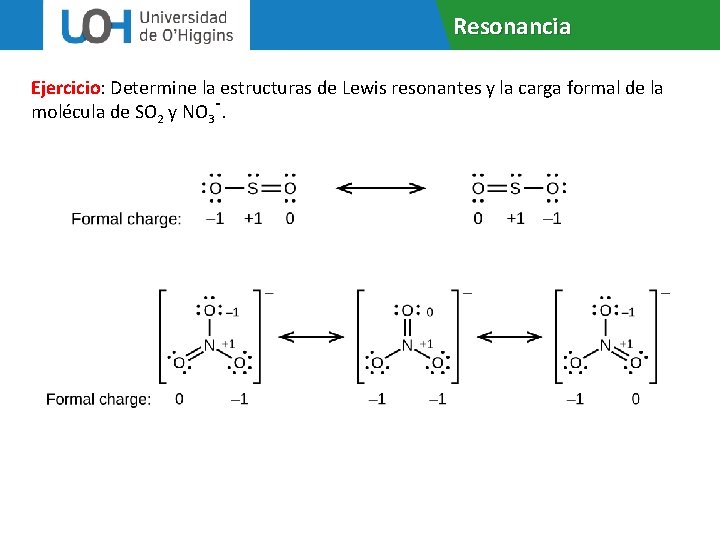
Resonancia Ejercicio: Determine la estructuras de Lewis resonantes y la carga formal de la molécula de SO 2 y NO 3 -.

MODELOS RPECV Los modelos de repulsión de los pares electrónicos de la capa de valencia o RPECV explica la distribución geométrica de los pares electrónicos que rodean al átomo central en términos de la repulsión electroestática entre dichos pares. Reglas generales de construcción: 1. Los modelos aplican a moléculas con un átomo central. 2. Todos los enlaces (simples, doble y triples) pueden ser considerados como simples. 3. Si una molécula tiene más de una estructura resonante en todos los casos se puede generar un modelo RPECV. Tipos de moléculas: 1. Molécula central sin pares de electrones libres. 2. Molécula central con pares de electrones libres. 3. Molécula con más de un átomo central.

MODELOS RPECV Molécula central sin pares de electrones libres: ABn Molécula central con pares de electrones libres: ABn. En

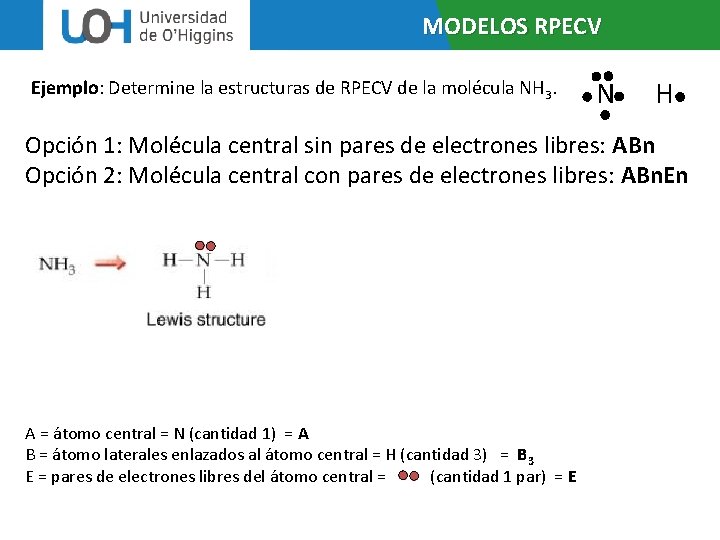
MODELOS RPECV Ejemplo: Determine la estructuras de RPECV de la molécula NH 3. N H Opción 1: Molécula central sin pares de electrones libres: ABn Opción 2: Molécula central con pares de electrones libres: ABn. En A = átomo central = N (cantidad 1) = A B = átomo laterales enlazados al átomo central = H (cantidad 3) = B 3 E = pares de electrones libres del átomo central = (cantidad 1 par) = E

MODELOS RPECV Ejercicio: Determine la estructuras de RPECV de la molécula de formaldehído CH 2 O. C H O A=1 Molécula del B=3 tipo AB 3 E=0 Trigonal Plana

Conceptos vistos en clases 1. La estructura de Lewis es una representación gráfica que muestra los pares de electrones de enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existir. 2. La electronegatividad es la capacidad de un átomo para atraer a los electrones, cuando forma un enlace químico en una molécula. 3. La carga formal de una molécula depende se calcula en relación al numero de enlaces para cada átomo de la molécula. 4. Los RPECV explican la distribución geométrica de los pares electrónicos que rodean al átomo central. 5. Ejercicios en sección Preguntas y Problemas del Capítulo 10: Química 7ª Ed. , R. Chang; Mc. Graw Hill. 2002.
 Que es enlace coordinado
Que es enlace coordinado Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Fqcolindres 2 eso
Fqcolindres 2 eso Orbital sigma y pi
Orbital sigma y pi Reacciones de los halogenuros de alquilo
Reacciones de los halogenuros de alquilo Qumica
Qumica Compuestos quimicos inorganicos
Compuestos quimicos inorganicos Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Reação endergônica
Reação endergônica Funcion quimica y grupo funcional
Funcion quimica y grupo funcional Reacciones de orden cero
Reacciones de orden cero Dipolo dipolo inducido
Dipolo dipolo inducido O que são açucares redutores
O que são açucares redutores Qumica
Qumica