Enlace Qumico ENLACE QUMICO Es la forma de























- Slides: 38

Enlace Químico

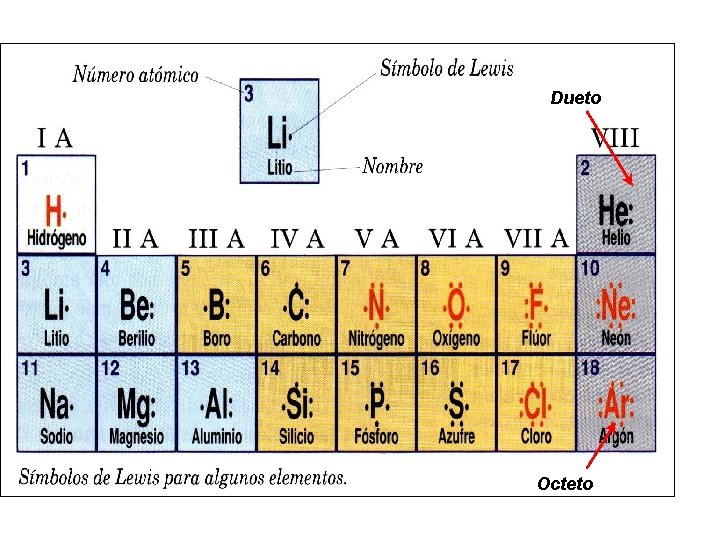
ENLACE QUÍMICO • Es la forma de unión entre dos o más átomos. • Un átomo adquiere estabilidad cuando posee 8 electrones en la capa electrónica más externa (o 2 electrones cuando sólo tienen 1 nivel de energía). • Capa de valencia es la última capa electrónica de un átomo y la denominación electrón de valencia designa los electrones existentes en esa capa. 2 2 s 2 2 p 3 N: 1 s 7 capa de valencia 5 electrones de valencia Grupo VA

ENLACE QUÍMICO Dos reglas que se deben cumplir son: • Regla del Dueto: Un átomo debe tener dos electrones en su entorno. • Regla del Octeto: Un átomo debe tener ocho electrones alrededor.

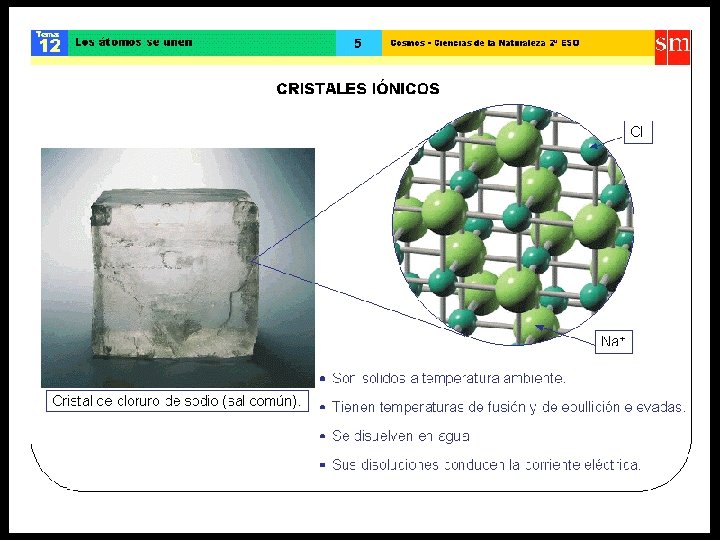
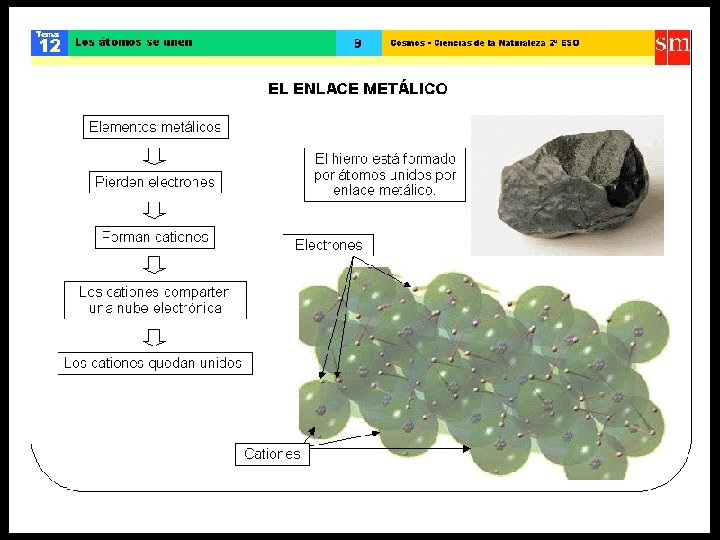
ENLACE IÓNICO • Entre dos átomos de electronegatividades muy distintas (diferencia de E. N. igual o superior a 1, 7) • Transferencia de uno o más electrones, generalmente desde un elemento metálico hacia otro no metálico. • Un átomo cede electrones, quedando con carga positiva y el otro átomo capta electrones, quedando con carga negativa.

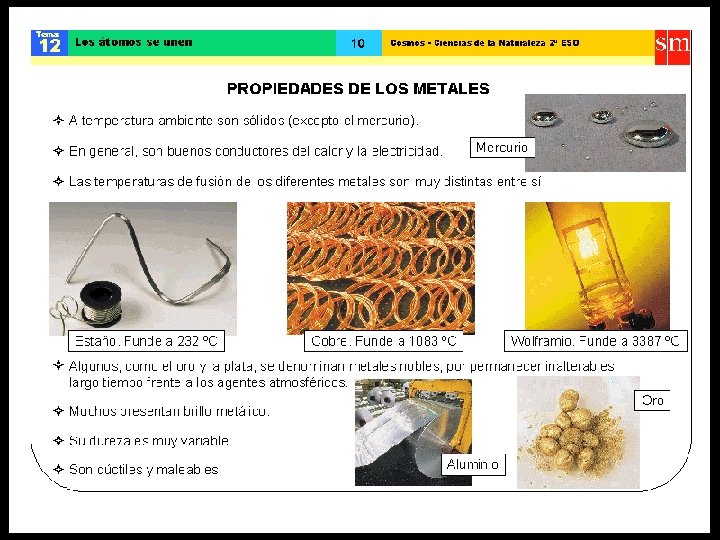
ENLACE IÓNICO • Las sustancias iónicas conducen la corriente eléctrica (electrolitos) cuando están fundidos o en solución acuosa. • El enlace iónico se establece principalmente entre átomos de los grupos: I A - VI A I A - VII A • Ejemplo: la sal de mesa (Na. Cl), el salitre (KNO 3), el sulfato de cobre (Cu. SO 4).





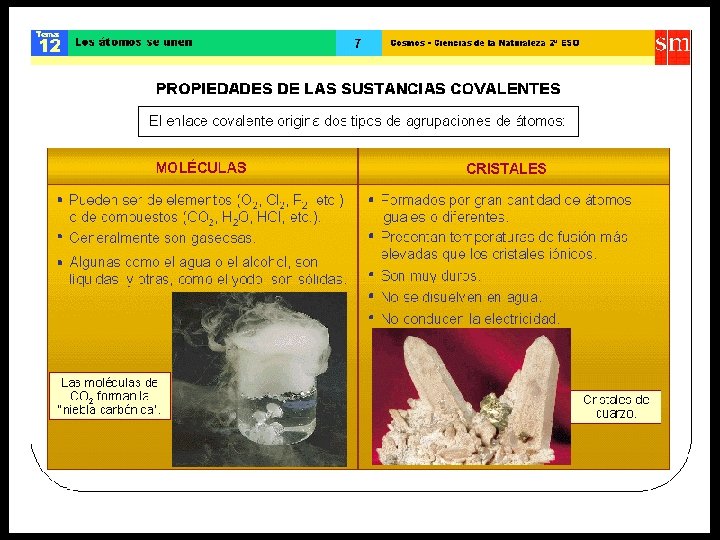
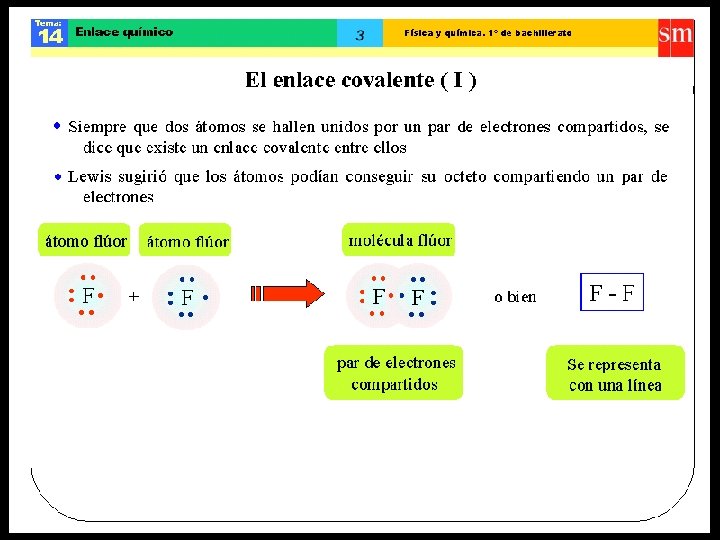
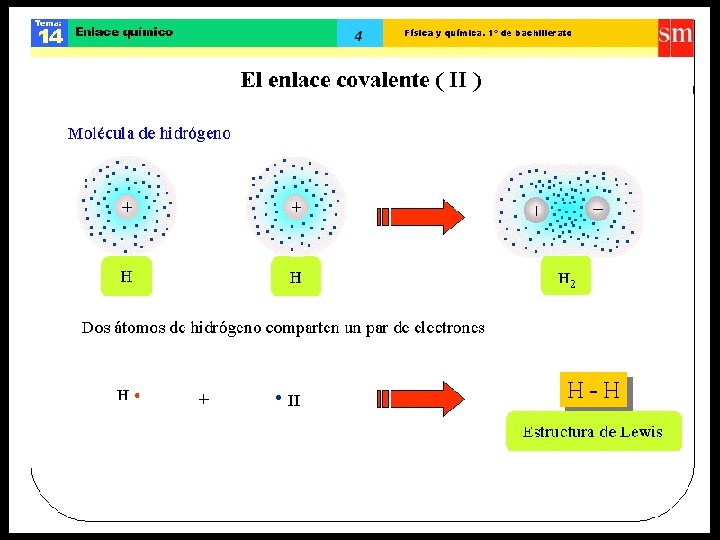
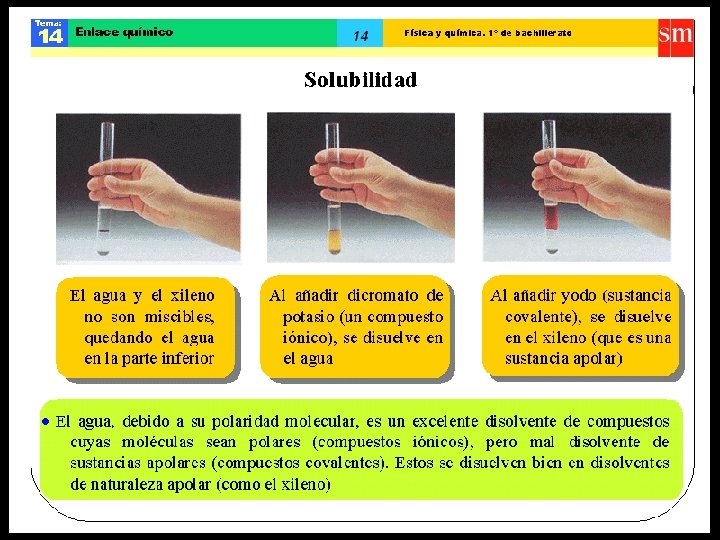
ENLACE COVALENTE • Átomos enlazantes comparten electrones, formando ambos un octeto y/o dueto. • Las sustancias con enlaces covalentes son, generalmente, insolubles en agua, no conducen la corriente eléctrica. Dentro de este enlace, se distinguen dos tipos: • Enlace covalente apolar. • Enlace covalente polar.




Enlace covalente apolar • Se da entre átomos de igual electronegatividad (diferencia de EN = 0). • Este enlace lo presentan, principalmente, los gases diatómicos, tales como el H 2, O 2, N 2, etc.



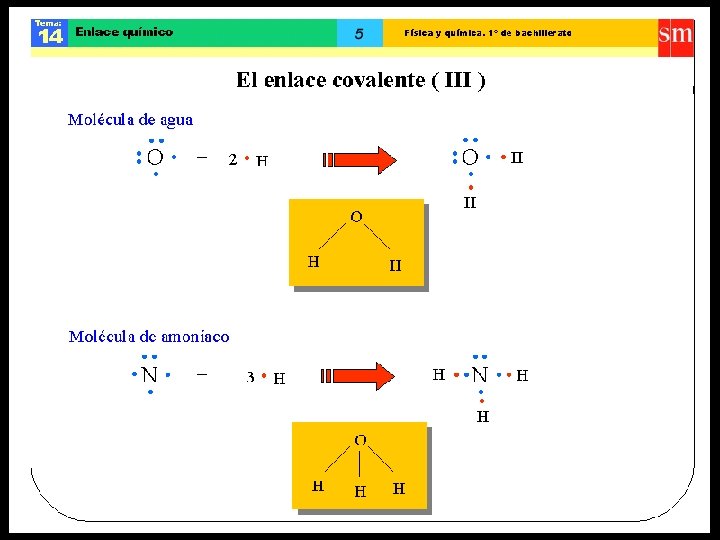
Enlace covalente polar • Se presenta entre átomos que tienen electronegatividades muy similares (diferencia de E. N. mayor a 0 y menor a 1, 7). • Al producirse la unión entre átomos con electronegatividades similares, se establece una zona donde se concentra una mayor densidad electrónica, generándose un polo positivo y otro negativo o dipolo. • Ejemplo: H 2 O y NH 3



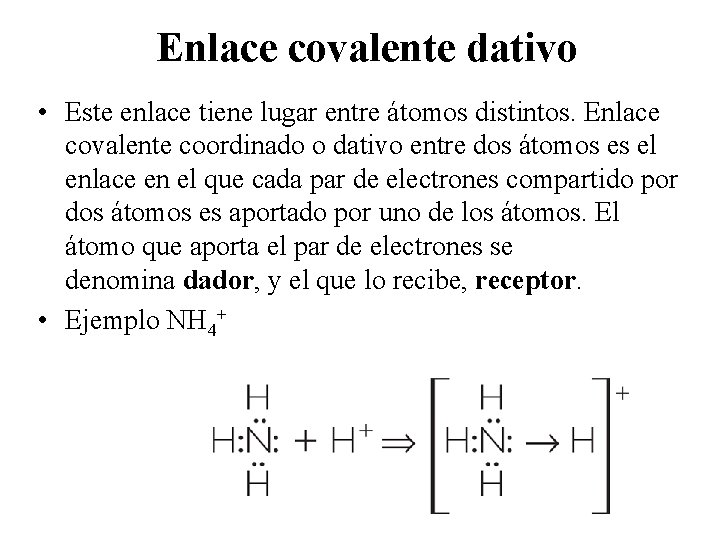
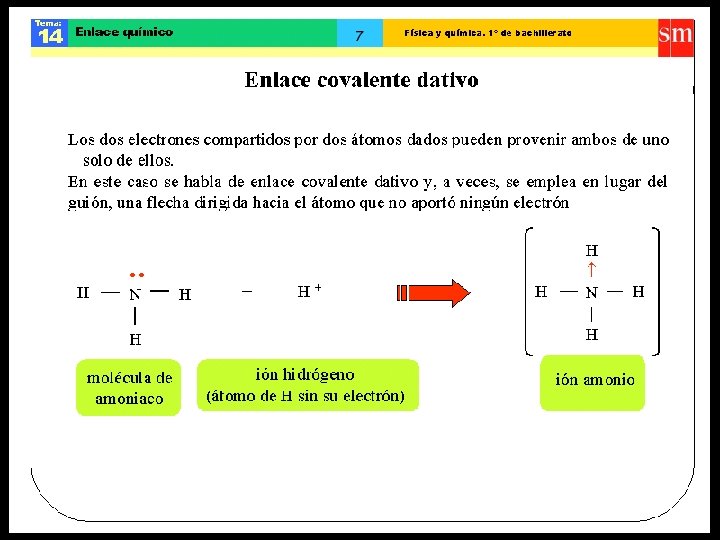
Enlace covalente dativo • Este enlace tiene lugar entre átomos distintos. Enlace covalente coordinado o dativo entre dos átomos es el enlace en el que cada par de electrones compartido por dos átomos es aportado por uno de los átomos. El átomo que aporta el par de electrones se denomina dador, y el que lo recibe, receptor. • Ejemplo NH 4+






Estructura de Lewis • Es la representación de la distribución de los electrones del último nivel o capa más externa (grupo del elemento), que participan en el átomo.

Dueto Octeto

Pregunta ¿Cuántos pares no enlazantes presenta la molécula de amoniaco (NH 3)? A) 1 B) 2 C) 3 D) 4 E) 5 A

Pregunta 9. Respecto de los enlaces. I. En el enlace iónico se comparten electrones. II. En el compuesto Cl 2 existen 6 pares de electrones no enlazantes. III. Si el enlace es covalente polar , se comparten igualmente los electrones. Es (son) correcta (s) A) Sólo I B) Sólo II C) Sólo III D) Sólo I y II E) Sólo I y III B

Pregunta 10. La electronegatividades del hidrógeno y el flúor son, respectivamente, 2, 1 y 4. De acuerdo con la información, es posible deducir que la molécula de ácido fluorhídrico (HF) A) es iónica. B) es covalente polar. C) es covalente dativa. D) presenta geometría molecular lineal. E) forma redes cristalinas. B



Geometría molecular • En el modelo de repulsión de los pares electrónicos de la capa de valencia (RPECV) , las moléculas se dividen en dos categorías: – Las que tienen pares de electrones libres en el átomo central. – Las que no tienen pares de electrones libres en el átomo central.

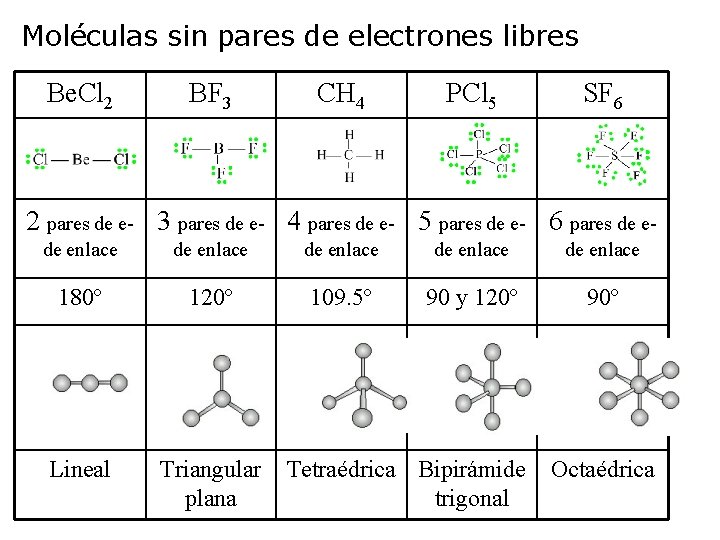
Moléculas sin pares de electrones libres Be. Cl 2 BF 3 CH 4 PCl 5 SF 6 2 pares de e- 3 pares de e- 4 pares de e- 5 pares de e- 6 pares de e- de enlace de enlace 180º 120º 109. 5º 90 y 120º 90º Lineal Triangular Tetraédrica Bipirámide Octaédrica plana trigonal

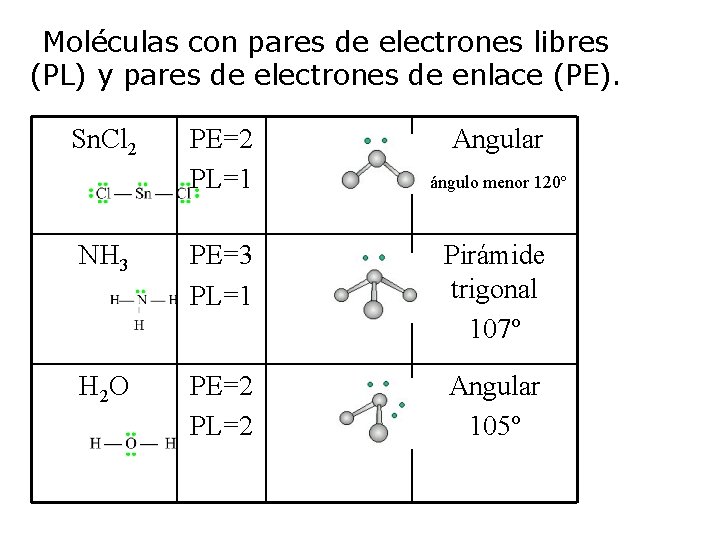
Moléculas con pares de electrones libres (PL) y pares de electrones de enlace (PE). Sn. Cl 2 PE=2 PL=1 Angular ángulo menor 120º NH 3 PE=3 PL=1 Pirámide trigonal 107º H 2 O PE=2 PL=2 Angular 105º

Moléculas con pares de electrones libres y pares de electrones de enlace. SF 4 PE=4 PL=1 Balancín Cl. F 3 PE=3 PL=2 Forma de T Br. F 5 PE=5 PL=1 Pirámide cuadrada Xe. F 4 PE=4 PL=2 Plano cuadrada

Pregunta 15. ¿Qué ángulo de enlace se establece entre los átomos en la molécula de BF 3? A) 90° B) 104, 5° C) 119, 5° D) 120° E) 180° D

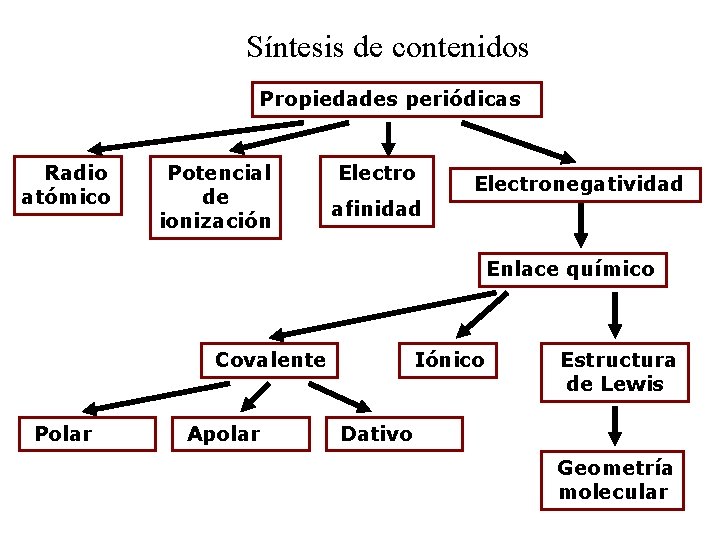
Síntesis de contenidos Propiedades periódicas Radio atómico Potencial de ionización Electronegatividad afinidad Enlace químico Covalente Polar Apolar Iónico Estructura de Lewis Dativo Geometría molecular