1780 qumica orgnica qumica inorgnica TEORIA DO VITALISMO








- Slides: 19

1780 : química orgânica química inorgânica TEORIA DO VITALISMO 1828: Friedrich Wöhler sintetizou uréia a partir de cianato de amônio “Alimento Orgânico”

Regra do Octeto Um átomo estará estável quando sua camada de valência possuir 8 e-, assemelhando-se à configuração eletrônica de um gás nobre (exceção H e He - 2 e-) - Ligações iônicas - Ligações covalentes - Ligações dativas

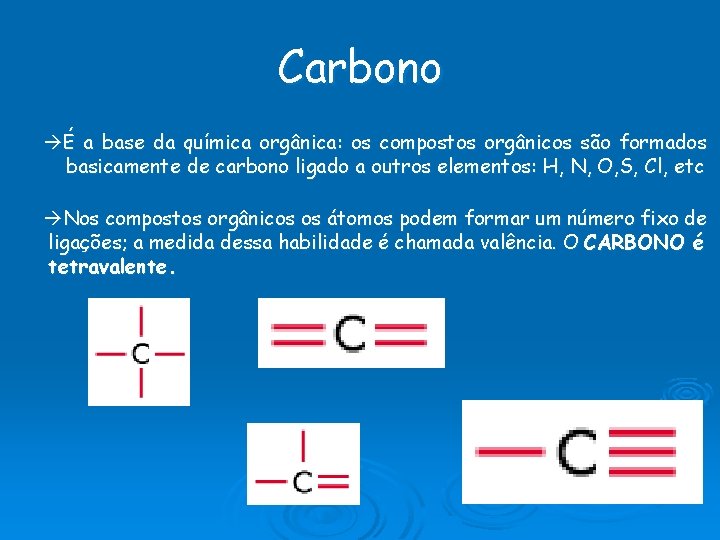
Carbono É a base da química orgânica: os compostos orgânicos são formados basicamente de carbono ligado a outros elementos: H, N, O, S, Cl, etc Nos compostos orgânicos os átomos podem formar um número fixo de ligações; a medida dessa habilidade é chamada valência. O CARBONO é tetravalente.

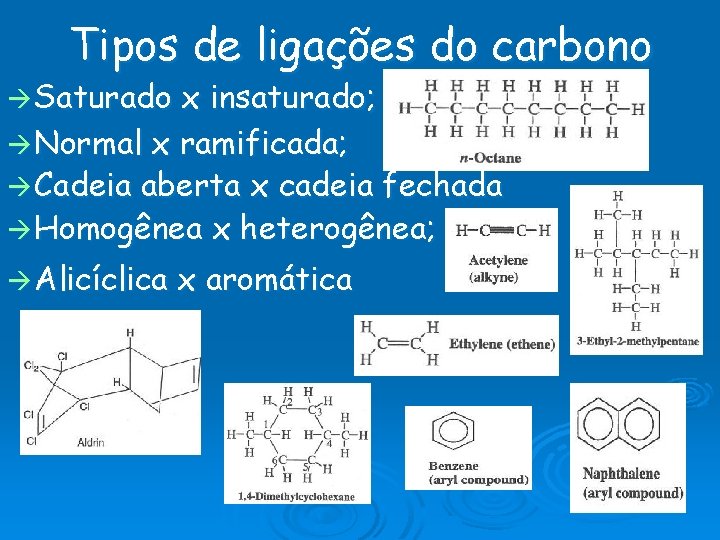
Tipos de ligações do carbono Saturado x insaturado; Normal x ramificada; Cadeia aberta x cadeia fechada Homogênea x heterogênea; Alicíclica x aromática

Geometria molecular O arranjo tri-dimensional dos átomos em uma molécula geometria molecular A teoria da repulsão dos pares de elétrons (ligantes e não-ligantes) procura explicar o arranjo dos átomos numa molécula.

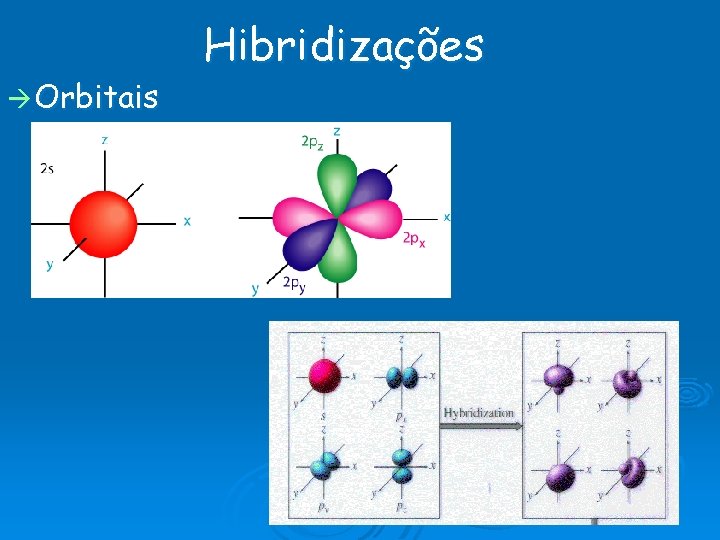
Teoria da repulsão dos elétrons Electrons são cargas carregadas negativamente, portanto se repelem mutuamente. Os elétrons ocuparão posições tais que minimizem os efeitos de suas repulsões (ocupando regiões o mais afastado possível uns dos outros). Num átomo os elétrons ocupam determinados espaços chamados orbitais (máximo 2 e num orbital). Tipos de orbitais mais comuns: orbitais s ; p ;

Orbitais Hibridizações

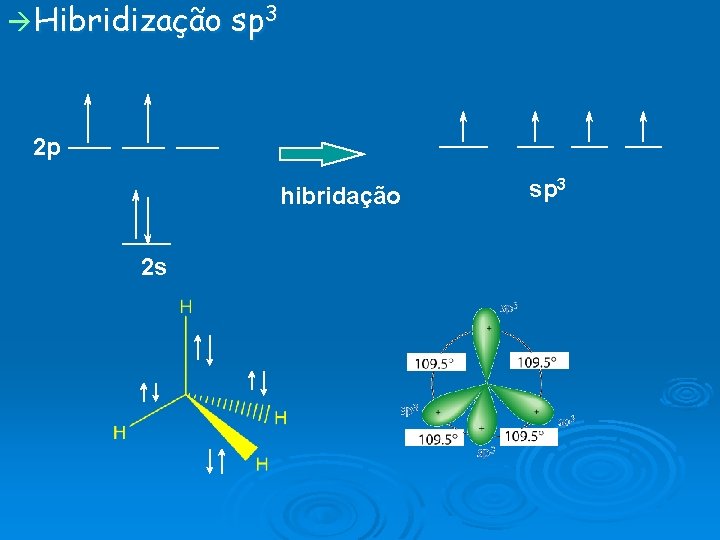
Hibridização sp 3 2 p hibridação 2 s sp 3

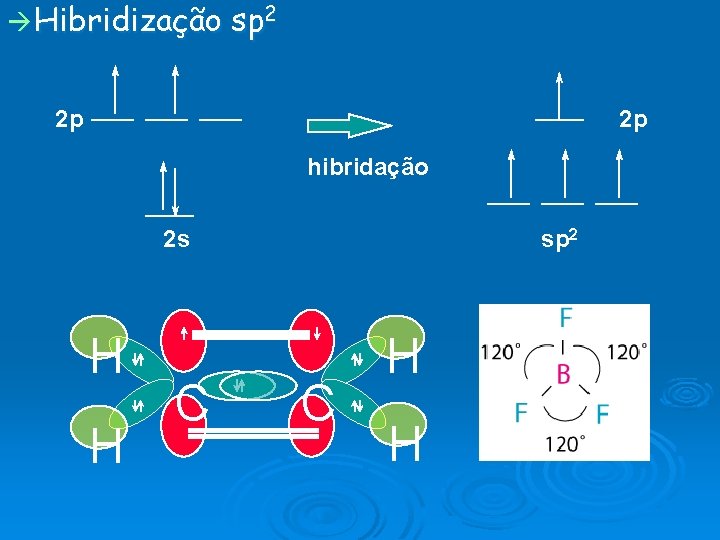
Hibridização sp 2 2 p 2 p hibridação 2 s H H C sp 2 C H H

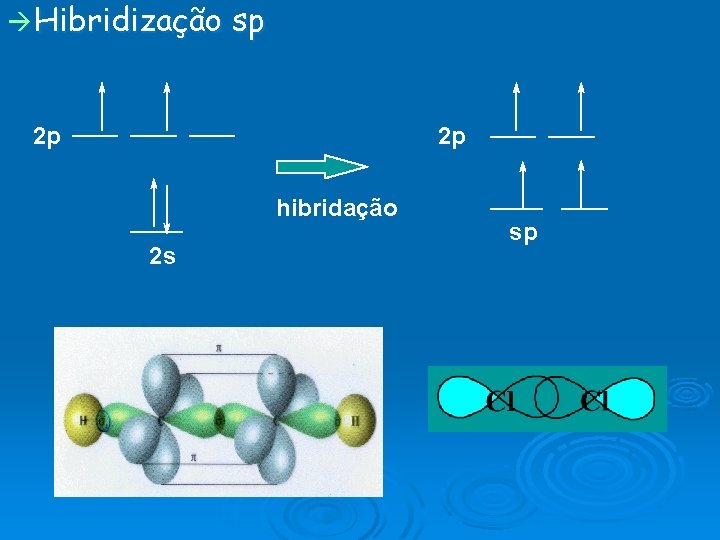
Hibridização sp 2 p 2 p hibridação 2 s sp

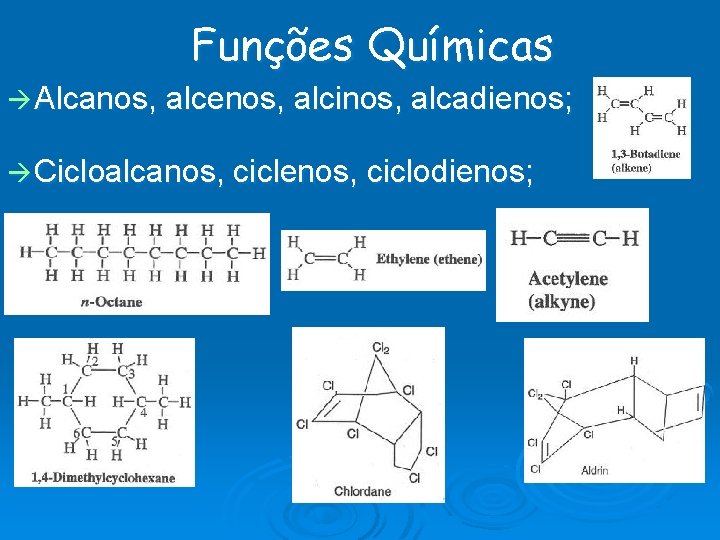
Funções Químicas Alcanos, alcenos, alcinos, alcadienos; Cicloalcanos, ciclenos, ciclodienos;

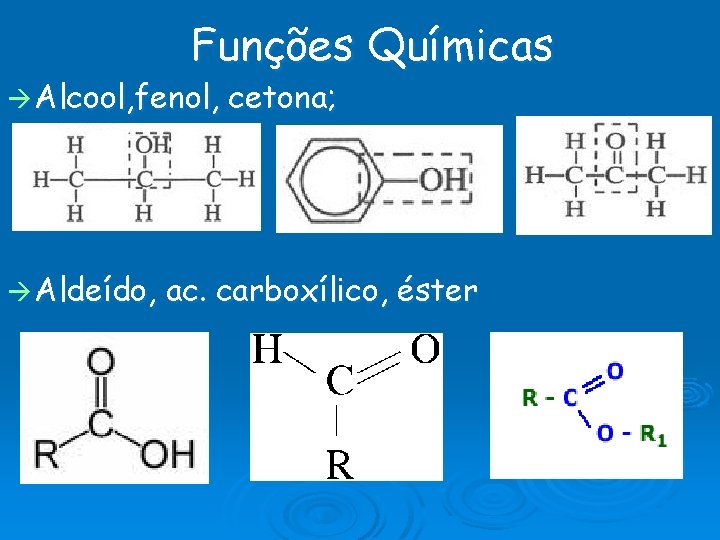
Funções Químicas Alcool, fenol, Aldeído, cetona; ac. carboxílico, éster

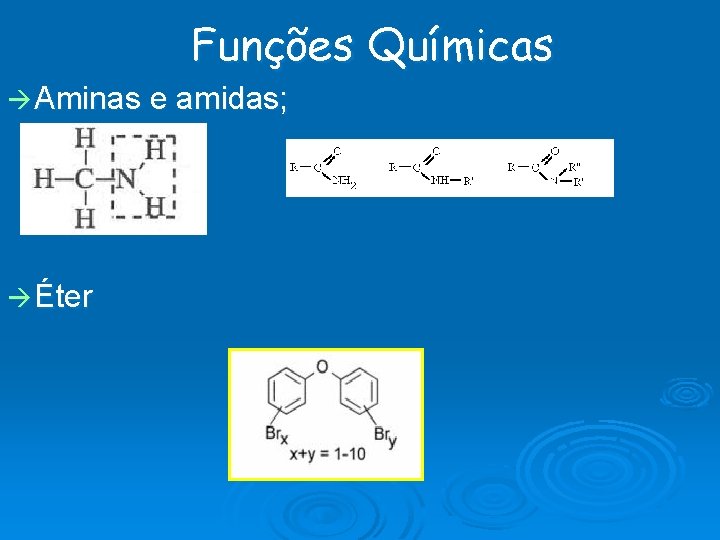
Funções Químicas Aminas e amidas; Éter

Isomeria Isomerismo ou Isomeria (iso = mesmo , meros = partes) é o fenômeno caracterizado pela existência de duas ou mais substâncias diferentes que apresentam fórmulas químicas idênticas, porém diferentes fórmulas estruturais. Isomeria constitucional Isomeria espacial

Isomeria constitucional - De posição - De função - De cadeia

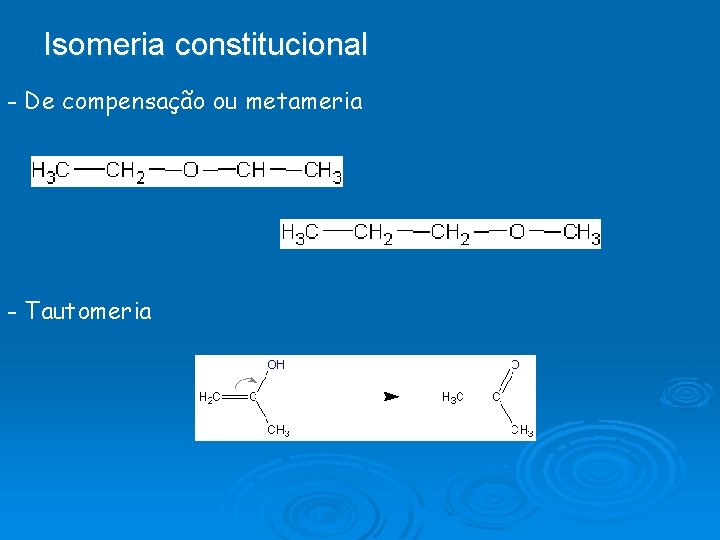
Isomeria constitucional - De compensação ou metameria - Tautomeria

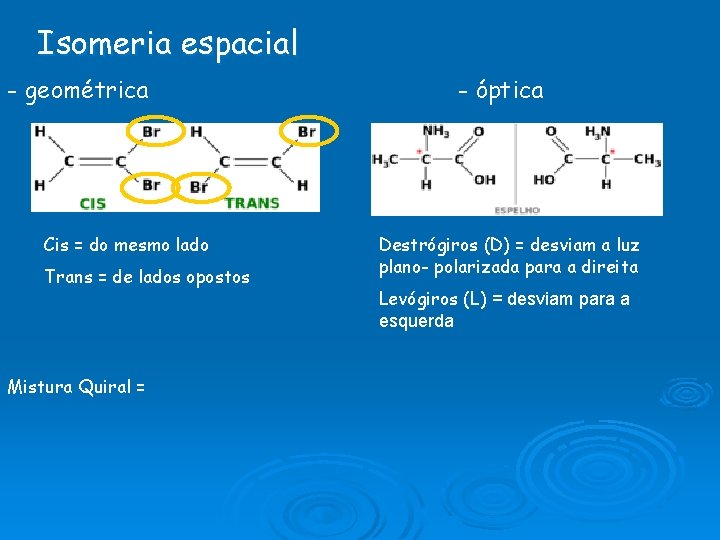
Isomeria espacial - geométrica Cis = do mesmo lado Trans = de lados opostos Mistura Quiral = - óptica Destrógiros (D) = desviam a luz plano- polarizada para a direita Levógiros (L) = desviam para a esquerda


 Edward irving
Edward irving Against the gods 1780
Against the gods 1780 May 19, 1780
May 19, 1780 Wilhelm dilthey vitalismo
Wilhelm dilthey vitalismo Características de la transvaloración
Características de la transvaloración Vitalismo decadentismo
Vitalismo decadentismo Paul joseph barthez vitalismo
Paul joseph barthez vitalismo Escuela filosofica idealismo
Escuela filosofica idealismo Vitalismo di pirandello
Vitalismo di pirandello El vitalismo de nietzsche
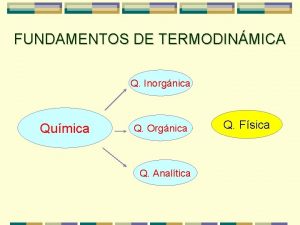
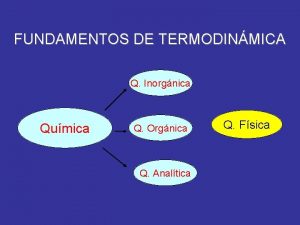
El vitalismo de nietzsche Qumica
Qumica Qumica
Qumica Qumica moderna
Qumica moderna Características del ácido clorhídrico
Características del ácido clorhídrico Qumica
Qumica Qumica
Qumica Qumica
Qumica Hidrocarburos
Hidrocarburos Qumica
Qumica Características de los alquinos
Características de los alquinos