TERMODIN MICA QUMICA PROF FLIX Ementa Sistemas de



















- Slides: 21

TERMODIN MICA QUÍMICA – PROF. FÉLIX Ementa: - Sistemas de composição variável e equilíbrio químico; - Equilíbrio de fases em sistemas simples – a regra das fases; - Solução ideal. Soluções com mais de um componente volátil; - Equilíbrio de fases em misturas; - Equilíbrio em sistemas não ideais. Bibliografia: Castellan, G. FUNDAMENTOS DE FÍSICO-QUÍMICA – SI, editora: LTC, 1986.

REVISÃO Espontaneidade e equilíbrio: Condições gerais de espontaneidade e equilíbrio: Ex: A + B C Sendo G a energia livre de Gibbs e os coeficientes estequiométricos : __ __ __ G 0 = ( G 0 f)produtos - ( G 0 f)reagentes= ( G 0 f)C – [( G 0 f)A + ( G 0 f)B ] __ __ Obs: valores de G 0 f , H 0 f , S 0 e Cp 0 podem ser obtidos no apêndice V do Castellan. 1ª Lei da Termodinâmica: U=Q-W Entropia: d. S = Qrev/T Desigualdade de Clausius: d. S Q/T ( = reversível, > irreversível ) Td. S Q; Td. S d. U+ W ; –d(U+PV-TS) 0; –d(H-TS) 0; –d(G) 0 ou d(G) 0 Para uma transformação finita: G 0 ( = sistema em equilíbrio para um valor mínimo de G, < reação espontânea) Se G > 0 a reação não é espontânea.

SISTEMAS DE COMPOSIÇÃO VARIÁVEL A equação fundamental: Sem variação da composição: G=G(T, P) d. G = ( G/ T)pd. T +( G/ p)Tdp= -Sd. T+Vdp Considerando que a composição muda: G=G(T, P, n 1, n 2, …) d. G = ( G/ T)p, nid. T +( G/ p)T, nidp +( G/ n 1)T, p, njdn 1 +( G/ n 2)T, p, njdn 2 +… ni o número de mols de todos os componentes são constantes. nj o número de mols de todos os componentes, excluindo o componente da diferencial são constantes. Definindo potencial químico como sendo: I = G/ ni d. G = -Sd. T+Vdp+ idni

SISTEMAS DE COMPOSIÇÃO VARIÁVEL As propriedades de i: Propriedade intensiva de um sistema (valor constante em qualquer ponto do sistema): I = G/ ni Suponha que em duas regiões (A e B) de um sistema os potenciais químicos fossem diferentes. Considerando constantes T, P e nj. Transferindo dni moles de i da região A para a região B: d. GA= i. A(-dni) e d. GB= i. B(-dni). A ( i. A) B ( i. B) A variação total da energia de Gibbs será: d. G = d. GA+d. GB = ( i. B - i. A) dni Para o processo ser espontâneo: d. G<0, o que só ocorre se i. B< i. A, ou seja: “A substância escoa espontaneamente da região de potencial químico mais alto para a região de potencial químico mais baixo”.

SISTEMAS DE COMPOSIÇÃO VARIÁVEL Energia livre de uma mistura: Considere o seguinte processo de mistura (T e p constantes): Estado inicial Estado final Substância 1 2 3. . . Número de moles 0 0 0. . . n 1 n 2 n 3 Energia de Gibbs G=0 G d. G = -Sd. T+Vdp+ idni = idni G = idni Para substância pura: G 0 = 0 n (T e p constantes)

SISTEMAS DE COMPOSIÇÃO VARIÁVEL O potencial químico de um gás ideal puro: d. G = -Sd. T+Vdp+ idni Para T constante: Sendo p 0=1 atm G/n = = 0+RT ln(p) (energia de Gibbs molar de um gás ideal)

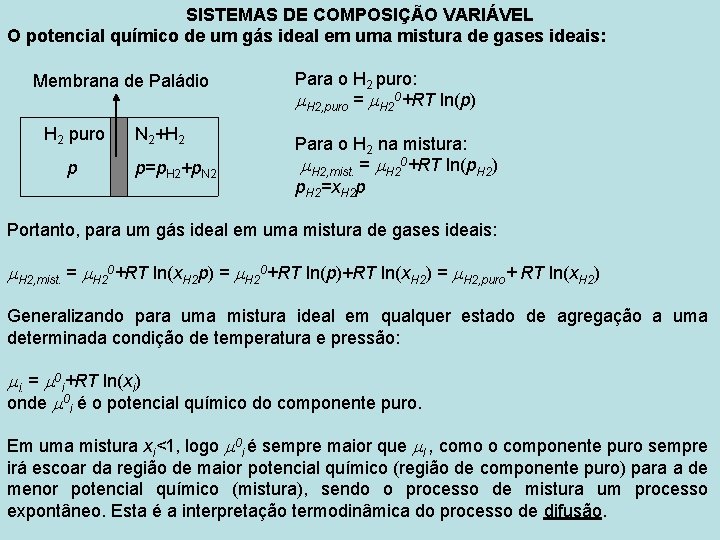
SISTEMAS DE COMPOSIÇÃO VARIÁVEL O potencial químico de um gás ideal em uma mistura de gases ideais: Membrana de Paládio H 2 puro p N 2+H 2 p=p. H 2+p. N 2 Para o H 2 puro: H 2, puro = H 20+RT ln(p) Para o H 2 na mistura: H 2, mist. = H 20+RT ln(p. H 2) p. H 2=x. H 2 p Portanto, para um gás ideal em uma mistura de gases ideais: H 2, mist. = H 20+RT ln(x. H 2 p) = H 20+RT ln(p)+RT ln(x. H 2) = H 2, puro+ RT ln(x. H 2) Generalizando para uma mistura ideal em qualquer estado de agregação a uma determinada condição de temperatura e pressão: i. = 0 i+RT ln(xi) onde 0 i é o potencial químico do componente puro. Em uma mistura xi<1, logo 0 i é sempre maior que I , como o componente puro sempre irá escoar da região de maior potencial químico (região de componente puro) para a de menor potencial químico (mistura), sendo o processo de mistura um processo expontâneo. Esta é a interpretação termodinâmica do processo de difusão.

SISTEMAS DE COMPOSIÇÃO VARIÁVEL Energia de Gibbs do processo de mistura: Considere o processo de mistura apresentado nas figuras a seguir. T, p n 1 T, p n 2 T, p n 3 T, p N=n 1+n 2+n 3 Estado inicial Estado final Energia de Gibbs: Gmist=Gfinal-Ginicial = n 1( 1 - 10)+n 2( 2 - 20)+n 3( 3 - 30)= ni( i- i 0) Sendo: ( i- i 0)=RTln(xi) ni=Nxi Obtem-se: Gmist=NRT xiln(xi) Observa-se que Gmist é sempre negativo, reafirmando a espontaneidade do processo de mistura.

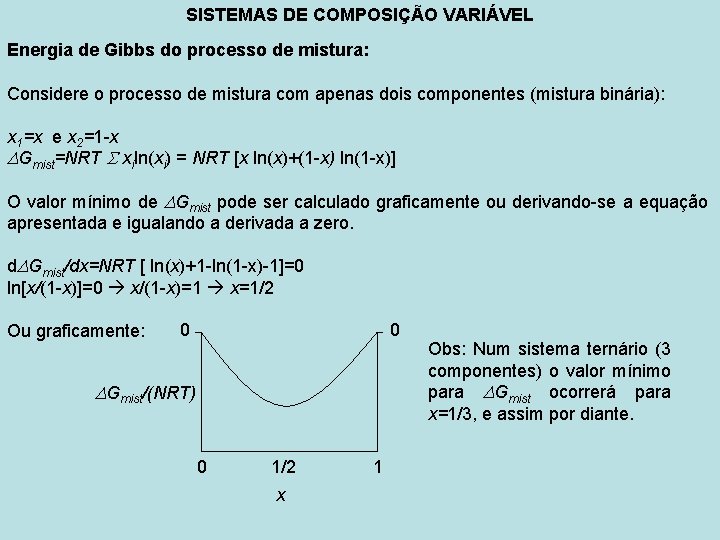
SISTEMAS DE COMPOSIÇÃO VARIÁVEL Energia de Gibbs do processo de mistura: Considere o processo de mistura com apenas dois componentes (mistura binária): x 1=x e x 2=1 -x Gmist=NRT xiln(xi) = NRT [x ln(x)+(1 -x) ln(1 -x)] O valor mínimo de Gmist pode ser calculado graficamente ou derivando-se a equação apresentada e igualando a derivada a zero. d Gmist/dx=NRT [ ln(x)+1 -ln(1 -x)-1]=0 ln[x/(1 -x)]=0 x/(1 -x)=1 x=1/2 Ou graficamente: 0 0 Gmist/(NRT) 0 1/2 x 1 Obs: Num sistema ternário (3 componentes) o valor mínimo para Gmist ocorrerá para x=1/3, e assim por diante.

SISTEMAS DE COMPOSIÇÃO VARIÁVEL Entropia do processo de mistura: S=-( G/ T)p, ni Smist= - NR xi ln(xi) O valor máximo para Smist para uma mistura binária ocorrerá para x=1/2, para uma mistura ternária, x=1/3. . . Smist/(NR) 0 0 0 1/2 x 1

SISTEMAS DE COMPOSIÇÃO VARIÁVEL Entalpia do processo de mistura: Gmist= Hmist - T Smist NRT xiln(xi)= Hmist +NRT xiln(xi) Portanto: Hmist=0 Não há efeito de calor associado com o processo de mistura de gases ideais. Gmist= - T Smist A força responsável pelo processo de mistura é um efeito inteiramente da entropia. O estado misturado é um estado mais caótico e, portanto, mais provável. Volume do processo de mistura: Vmist=( Gmist/ p)T, ni=0 Misturas ideais formam-se sem qualquer variação de volume. Exercícios propostos: 11. 2; 11. 3; 11. 4; 11. 5

EQUILÍBRIO QUÍMICO Equilíbrio químico numa mistura: Considere a seguinte reação: A + B C a) Se Gmist < 0 reação expontânea (ocorre até atingir o equilíbrio Gmin) b) Se Gmist > 0 reação ocorre no sentido inverso. c) Para T e p constantes: d) d. G= idni e) Introduzindo o conceito de avanço da reação ( ) f) = (ni - ni 0)/ i g) ni = ni 0 + i h) i) j) k) Onde: n 0 é o número de mols no início da reação; n é número de mols após a reação avançar mols; é o coeficiente estequiométrico (positivo para produtos e negativo para reagentes)

EQUILÍBRIO QUÍMICO Equilíbrio químico numa mistura: d. G= idni ni = ni 0 + i dni = i d Portanto: d. G= i i d A reação entrará em equilíbrio quando d. G/ d = 0, logo: ( i i)eq=0 A variação da energia de Gibbs na reação química é: G= i i , logo, no equilíbrio: G=( i i)eq = 0

EQUILÍBRIO QUÍMICO O comportamento de G em função de : Para qualquer composição, a energia de Gibbs na mistura tem a forma: G= ni i Reagentes Produtos d. G/d = + G d. G/d = - b e = b A concentração de um ou mais produtos é zero (avanço baixo) = a A concentração de um ou mais reagentes é zero d. G/d = 0 (avanço alto) = A reação está em equilíbrio d. G/d = 0 a e (avanço de equilíbrio) Se d. G/d = - a reação é espontânea no sentido direto da reação. Se d. G/d = + a reação é espontânea no sentido inverso da reação. Se d. G/d = 0 a reação está em equilíbrio químico.

EQUILÍBRIO QUÍMICO O comportamento de G em função de : Adicionando e subtraindo 0 i na equação da energia de Gibbs na mistura: G= ni i = ni ( 0 i + i - 0 i) = ni 0 i + ni (+ i - 0 i) = Gpuro + Gmist. G = Gpuro + Gmist Diferenciando: d. G/d = d. Gpuro/d + d Gmist/d No equilíbrio d. G/d = 0: (d. Gpuro/d )eq = - (d Gmist/d )eq No equilíbrio, Gmist diminui tanto quanto o Gpuro aumenta.

EQUILÍBRIO QUÍMICO Equilíbrio químico em uma mistura de gases ideais: Para um gás ideal: i. = 0 i+RT ln(pi) Considere a reação: A + B C + D G= i i = 0 C+ RT ln(p. C)+ 0 D+ RT ln(p. D) - 0 A - RT ln(p. A) - 0 B - RT ln(p. B) Seja: G 0 = 0 C + 0 D - 0 A - 0 B e combinando os logaritmos: G= G 0 + RT ln[(p. C p. D ) / (p. A p. B )] O argumento do logaritmo é chamado de quociente próprio das pressões (Qp): Qp= (p. C p. D ) / (p. A p. B ) G= G 0 + RT ln Qp No equilíbrio G= 0 e o quociente próprio de pressões é a constante de equilibrio em função das pressões (Kp): Kp= [(p. C)eq (p. D)eq ] / [(p. A)eq (p. B)eq ]

EQUILÍBRIO QUÍMICO Equilíbrio químico em uma mistura de gases reais: Para gases reais: i. = 0 i+RT ln(fi) Sendo f, nomeada de fugacidade do gás. A fugacidade mede a energia de Gibbs de um gás real da mesma forma que a pressão mede a energia de Gibbs para um gás ideal. Considerando a reação: A + B C + D Kf= [(f. C)eq (f. D)eq ] / [(f. A)eq (f. D)eq )

EQUILÍBRIO QUÍMICO As constantes de equilíbrio Kx e. Kc: Considerando a reação: A + B C + D Kp= [(p. C)eq (p. D)eq ] / [(p. A)eq (p. B)eq ]=[(px. C)eq (px. D)eq ] / [(px. A)eq (px. B)eq ] Kp = [(x. C)eq (x. D)eq p ] / [(x. A)eq (x. B)eq ] = Kxp Onde: = + - - Kx = [(x. C)eq (x. D)eq p ] / [(x. A)eq (x. B)eq ] constante de equilíbrio em termos de frações molares Sendo: pi=ci. RT Kp= [(RTc. C)eq (RTc. D)eq ] / [(RTc. A)eq (RTc. B)eq ]=[(c. C)eq (c. D)eq (RT) ] / [(c. A)eq (c. B)eq ] Kp = Kc (RT) = Kc(0, 0820568 T) Onde: Kc=[(c. C)eq (c. D)eq (RT) ] / [(c. A)eq (c. B)eq ] ci é em mol/L T é em K.

EQUILÍBRIO QUÍMICO Energia de Gibbs padrão de formação: A partir de valores de G 0 de medidas experimentais das constantes de equilíbrio, é possível calcular os valores convencionais da energia de Gibbs padrão molar 0 dos compostos individuais. À energia de Gibbs dos elementos em seu estado de agregação mais estável, a 250 C e 1 atm é atribuído o valor zero. 0(H 2, g)=0, 0(Br 2, l)=0, 0(S, rômbico)=0 Para a reação de formação de um composto como o CO, temos: C(grafita)+1/2 O 2(g) CO(g) G 0 f = 0(CO, g) - 0(C, grafita) – ½ 0(O 2, g) Por convenção, 0(C, grafita) = 0 e 0(O 2, g)=0, portanto: G 0 f = 0(CO, g) É sempre possível relacionar a composição de uma mistura em equilíbrio com o valor de equilíbrio do avanço, e , com os números de mols iniciais, ni 0 e com os coeficientes estequiométricos. Ver exemplos 11. 2 e 11. 3 do Castellan.

EQUILÍBRIO QUÍMICO A dependência da constante de equilíbrio com a temperatura: Todo o desenvolvimento do equacionamento pode ser encontrado no Castellan. Resumindo: ln(Kp) = ln(Kp, 0) – ( H 0/R)(1/T– 1/T 0) Do conhecimento de H 0 e de um valor de Kp, 0 a qualquer temperatura T 0 pode-se calcular Kp para qualquer outra temperatura. Se H 0 não for constante, poderá ser expresso como uma série de potência em função da temperatura. H 0 = H 00+A’T+B’T 2+C’T 3+. . . Sendo a variação de Kp em função da temperatura, representada pela seguinte forma: ln(Kp)= ln(Kp, 0) – ( H 0/R)(1/T– 1/T 0)+(A’/R)ln(T/T 0)+(B’/R)(T-T 0)+(C’/R)(T 2 -T 02)+. . . Que tem a seguinte forma funcional: ln(Kp)= A/T +B+Cln(T)+DT+ET 2+. . .

EQUILÍBRIO QUÍMICO Equilíbrio entre gases ideais e fases condensadas puras: Fazer exemplos 11. 14. 1, 11. 14. 2 e 11. 14. 3 do Castellan. Reações Acopladas: Fazer exemplo 11. 18 A Equação de Gibbs-Duhen Diferencindo-se a equação: G= i ni obtem-se: d. G= nid i+ i dni Sendo: d. G = -Sd. T+Vdp+ nid i , obtem-se: nid i= -Sd. T+Vdp Equação de Gibbs-Duhen. Caso especial – T e p constantes: nid i=0 Logo, se a composição variar, os potenciais químicos não variam de forma independente, mas sim de um modo inter-relacionado dado pela equação. Exercícios propostos: 11. 2, 11. 3, 11. 4, 11. 5, 11. 8, 11. 10, 11. 12, 11. 14, 11. 15, 11. 16, 11. 17, 11. 18, 11. 19, 11. 20, 11. 21, 11. 22, 11. 23, 11. 24, 11. 25, 11. 26, 11. 27, 11. 28, 11. 29, 11. 30, 11. 32, 11. 33, 11. 34
 Proiect tematic animale domestice grupa mica
Proiect tematic animale domestice grupa mica Cele 7 minuni ale lumii gradinile suspendate
Cele 7 minuni ale lumii gradinile suspendate Mica viotti
Mica viotti Liceul tehnologic nicolae teclu copsa mica
Liceul tehnologic nicolae teclu copsa mica Ano qu mica
Ano qu mica Mica splitting test room
Mica splitting test room Mica plate auxin
Mica plate auxin The major advantage of a mica capacitor over other types is
The major advantage of a mica capacitor over other types is Cea mai mica unitate de masura a informatiei
Cea mai mica unitate de masura a informatiei Bioqu¡mica
Bioqu¡mica Luster
Luster Mica splitting test room
Mica splitting test room Mica village
Mica village Stema mica unire
Stema mica unire La mia prof
La mia prof Mica mote
Mica mote Mica mineral hardness
Mica mineral hardness Sais insoluveis
Sais insoluveis Enric flix
Enric flix Absolute refractory period and relative refractory period
Absolute refractory period and relative refractory period Dr flix
Dr flix Adductor hallucis longus
Adductor hallucis longus









































