Prof Dr Thomaz Augusto Guisard Restivo TERMODIN MICA











- Slides: 14

Prof. Dr. Thomaz Augusto Guisard Restivo

TERMODIN MICA Dedução (energia livre): H = U + PV ; mas U = q – w d. U = dq – Pd. V d. H = dq – Pd. V + Vd. P d. H = dq +Vd. P Definição de entropia: d. S = qrev/T (entropia) d. S = q/T para processos reversíveis d. S = qrev/T d. S > q/T para processos espontâneos (reais) Definimos: G = U + PV - TS (energia livre de Gibbs) d. G = d. U + Pd. V + Vd. P –Td. S – Sd. T = d. H – Td. S – Sd. T P cte Em T cte d. G = d. H – Td. S G = H - T S G estima a afinidade do processo em P e T cte

TERMODIN MICA

TERMODIN MICA Equilíbrio Químico a. A + b. B c. C + d. D

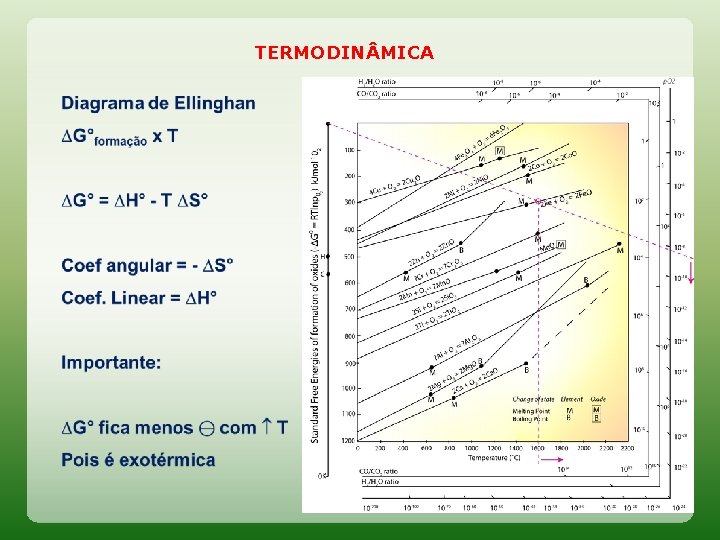
TERMODIN MICA

TERMODIN MICA

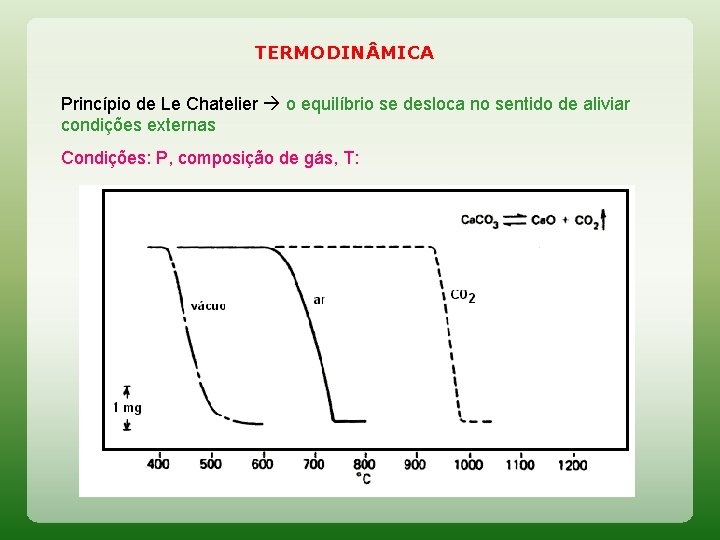
TERMODIN MICA Princípio de Le Chatelier o equilíbrio se desloca no sentido de aliviar condições externas Condições: P, composição de gás, T:

TERMODIN MICA Princípio de Le Chatelier o equilíbrio se desloca no sentido de aliviar condições externas

TERMODIN MICA

TERMODIN MICA Aplicações H < 0 reação exotérmica formação de ligações Oxidação/ combustão: M-O; C-O Adsorção: liga na superfície Solidificação: No. coordenação Cristalização: semelhante Polimerização: semelhante Neutralização Transição de fase H > 0 reação endotérmica quebra de ligações redução dessorção Fusão/ evaporação dissolução Decomposição: quebra ligações Transição de fase Entalpia G = H – T. S Se H < 0 G tem boas chances de ser negativo e a reação espontânea Se H > 0 precisa fornecer energia ou S deve ser muito positivo Exemplo: CO 2 + C = 2 CO S é alto pois aumenta o número de moles de gás

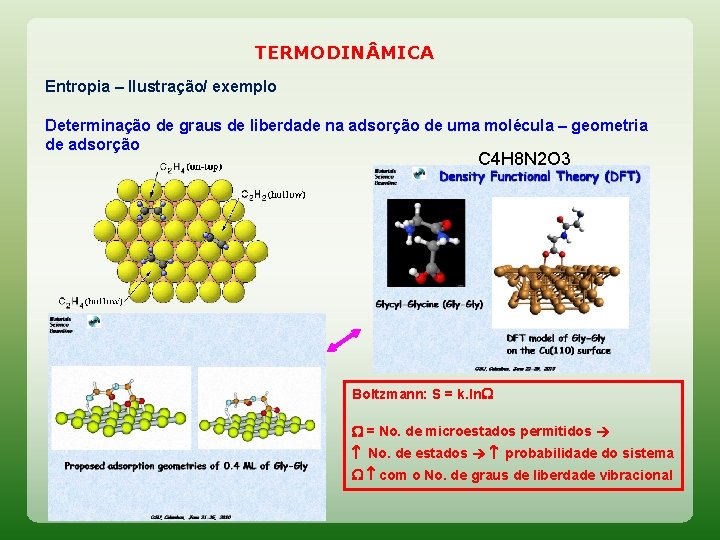
TERMODIN MICA Entropia – Ilustração/ exemplo Determinação de graus de liberdade na adsorção de uma molécula – geometria de adsorção C 4 H 8 N 2 O 3 Boltzmann: S = k. ln = No. de microestados permitidos No. de estados probabilidade do sistema com o No. de graus de liberdade vibracional

TERMODIN MICA

TERMODIN MICA DEFINIÇÕES Mesmo se G < 0 reação/ transformação pode não ocorrer cinética Exemplo: chuva! Cl 2 + H 2 O HCl F 2 + H 2 O HF SO 3 + H 2 O H 2 SO 4 : N 2 + H 2 O HNO 3 cinética muito lenta. . . Ainda bem!

CINÉTICA Velocidade de reação a. A + b. B = c. C r. C = dn. C/Vdt = k 1(T). CAa. CBb – k 2(T). CCc Em cinética usamos a conversão (varia de 0 a 1) Por exemplo: = (m. Ai-m. A(t))/m. Ai Busca-se identificar e testar funções segundo 2 métodos: 1) 2) Método Diferencial: Método Integral: d /dt = k(T). f( ) g( ) = k(T). t O mecanismo controlador da reação é etapa mais lenta k(T) é a constante de velocidade que obedece a equação de Arrhenius: k = A exp(-Ea/RT)
 Stephane guisard
Stephane guisard Guisard
Guisard Fundamentos do grego bíblico william mounce
Fundamentos do grego bíblico william mounce Maria teresa thomaz
Maria teresa thomaz Maria teresa thomaz
Maria teresa thomaz Concentração molar
Concentração molar Mica viotti
Mica viotti The major advantage of a mica capacitor over other types is
The major advantage of a mica capacitor over other types is Mass interviewing programme
Mass interviewing programme Oat coleoptile
Oat coleoptile Liceul tehnologic nicolae teclu copsa mica
Liceul tehnologic nicolae teclu copsa mica Cea mai mica unitate de masura a informatiei
Cea mai mica unitate de masura a informatiei Mica village
Mica village Mica
Mica Dibujos sobre el agua
Dibujos sobre el agua



























