TERMODIN MICA Estudo dos gases X SAIR TERMODIN
















- Slides: 24

TERMODIN MICA Estudo dos gases X SAIR

TERMODIN MICA A Termodinâmica (do grego therme = calor e dynamis = movimento) é o ramo da Física que estuda os efeitos da mudança de temperatura, volume e pressão, empregados em sistemas físicos em escala macroscópica. De uma forma mais simples, a termodinâmica procura explicar os mecanismos de transferência de energia térmica a fim de que estes realizem algum tipo de trabalho. Ela não trabalha com modelos da microestrutura da substância e tampouco é capaz de fornecer detalhes desse tipo de estrutura, mas uma vez que alguns dados sejam conhecidos, algumas propriedades podem ser determinadas. X SAIR

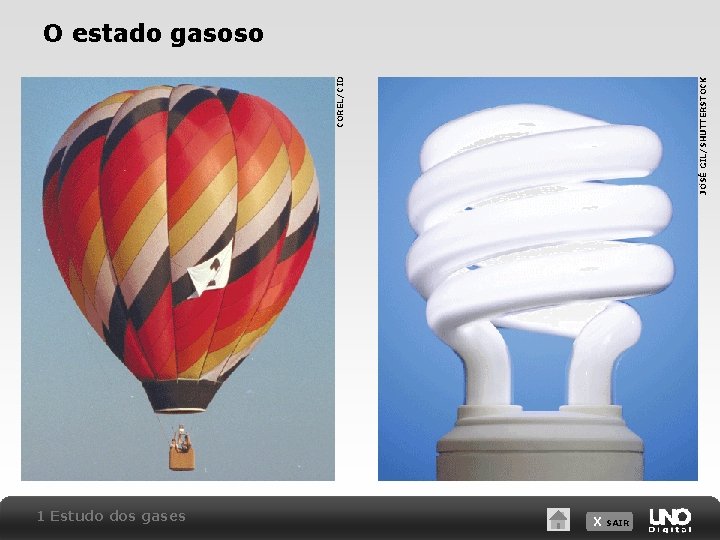
1 Estudo dos gases JOSÉ GIL/SHUTTERSTOCK COREL/CID O estado gasoso X SAIR

Definição Os gases representam o estado físico da matéria cujos valores de volume, densidade ou forma própria não são definidos. Apresentam alto grau de desordem causado pelo deslocamento livre das partículas que os constituem (átomos, moléculas ou íons – geralmente moléculas) e são objetos de estudos por possuírem grande aplicabilidade no cotidiano, e por ser a camada material na qual mais mantemos contato, afinal, normalmente todo o nosso corpo fica em contato com gases (ar atmosférico). X SAIR

Gás e Vapor A diferença entre gás e vapor é dada a partir da temperatura crítica. O vapor é a matéria no estado gasoso, estado esse que pode ser liquefeito com o aumento da pressão. Com o gás não ocorre o mesmo. Ele é um fluido impossível de ser liquefeito com um simples aumento de pressão. Isso faz com o gás seja diferente do vapor. X SAIR

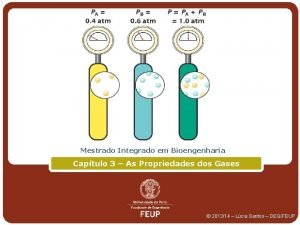
O estado gasoso Variáveis de estado Pressão (p) Volume (V) Temperatura (T) A transformação gasosa ocorre quando pelo menos uma das variáveis de estado se modifica. 1 Estudo dos gases X SAIR

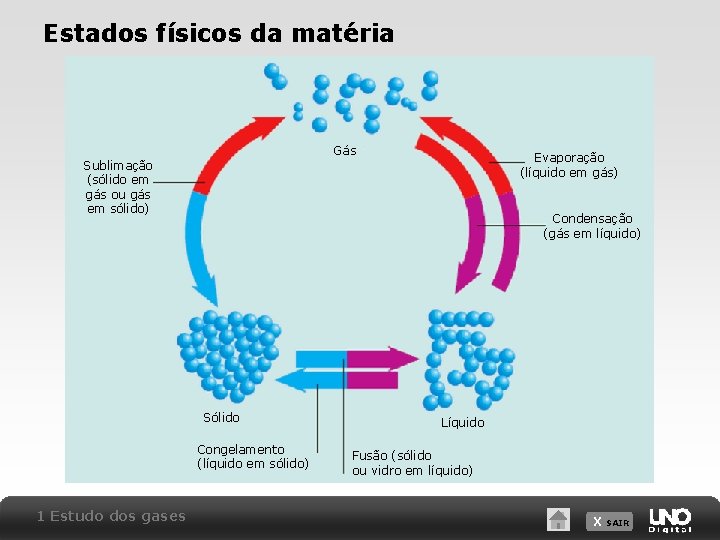
Estados físicos da matéria Gás Evaporação (líquido em gás) Sublimação (sólido em gás ou gás em sólido) Condensação (gás em líquido) Sólido Congelamento (líquido em sólido) 1 Estudo dos gases Líquido Fusão (sólido ou vidro em líquido) X SAIR

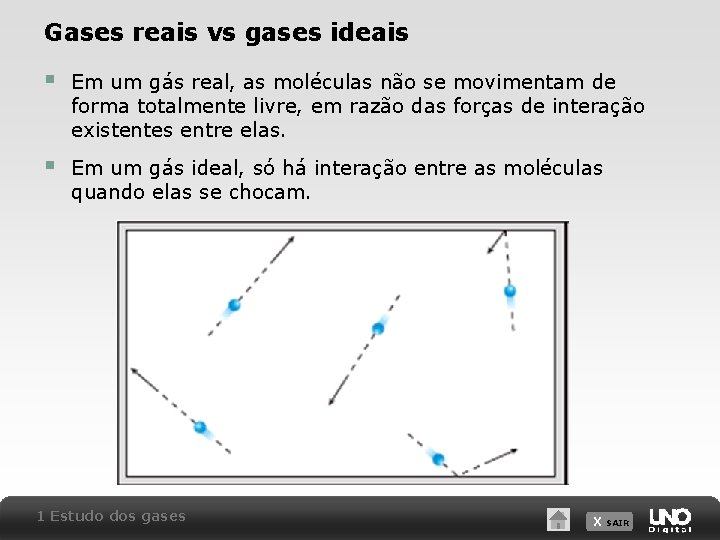
Gases reais vs gases ideais § Em um gás real, as moléculas não se movimentam de forma totalmente livre, em razão das forças de interação existentes entre elas. § Em um gás ideal, só há interação entre as moléculas quando elas se chocam. 1 Estudo dos gases X SAIR

Transformações gasosas § Isotérmicas: a temperatura do sistema permanece constante. § Isobáricas: a pressão é mantida constante. § Isovolumétricas (isométricas ou isocóricas): o volume permanece constante. 1 Estudo dos gases X SAIR

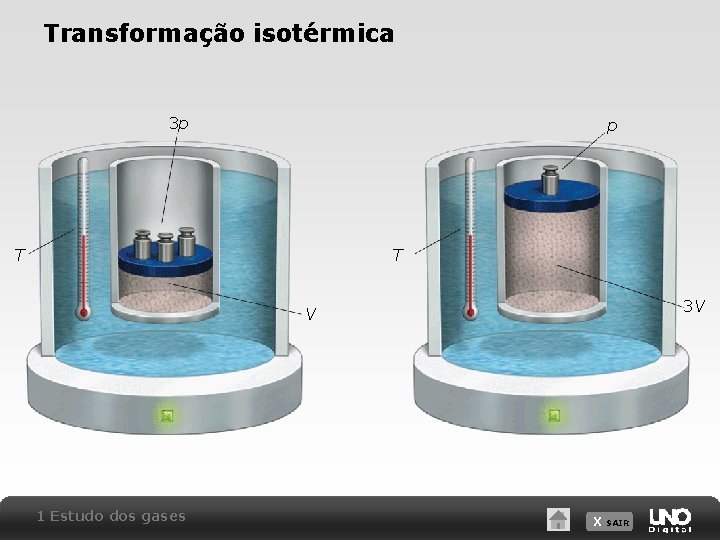
Transformação isotérmica DORLING KINDERSLEY/GETTY IMAGES Lei de Boyle: a pressão exercida por um gás ideal é inversamente proporcional ao seu volume. p V = constante Considerando o estado inicial A e final B de um gás ideal sofrendo uma transformação isotérmica, temos: p. A V A = p. B V B 1 Estudo dos gases X SAIR

Transformação isotérmica 3 p p T T 3 V V 1 Estudo dos gases X SAIR

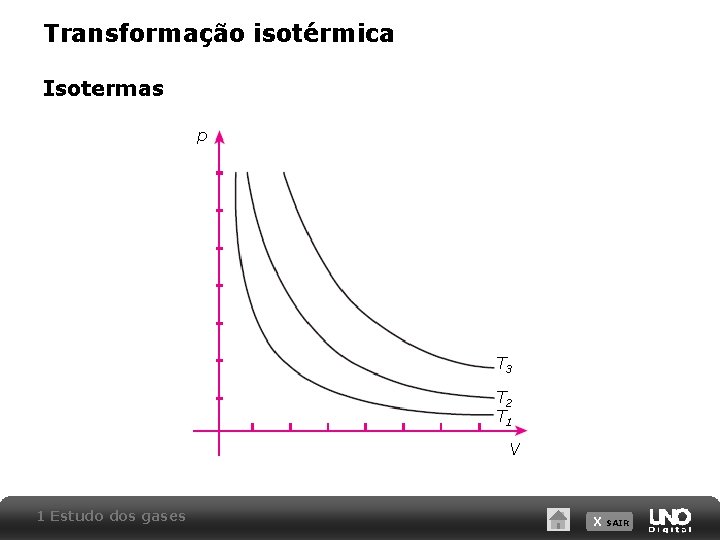
Transformação isotérmica Isotermas p T 3 T 2 T 1 V 1 Estudo dos gases X SAIR

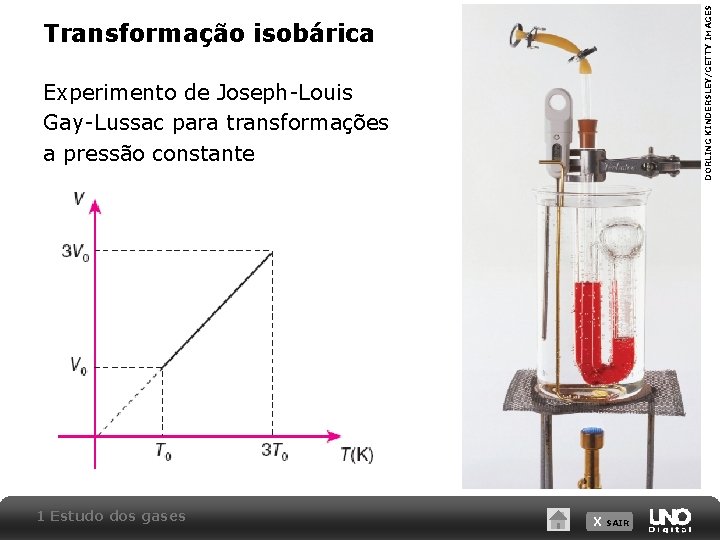
DORLING KINDERSLEY/GETTY IMAGES Transformação isobárica Experimento de Joseph-Louis Gay-Lussac para transformações a pressão constante 1 Estudo dos gases X SAIR

Transformação isobárica Lei de Charles e Gay-Lussac: o volume ocupado por um gás é diretamente proporcional a sua temperatura absoluta (em kelvins). V=k T (k = constante) Considerando o estado inicial A e final B de um gás ideal sofrendo uma transformação isobárica, temos: 1 Estudo dos gases X SAIR

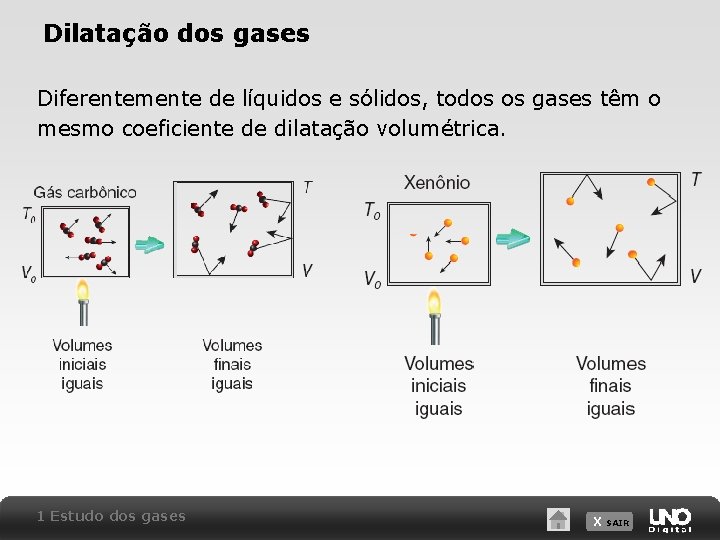
Dilatação dos gases Diferentemente de líquidos e sólidos, todos os gases têm o mesmo coeficiente de dilatação volumétrica. 1 Estudo dos gases X SAIR

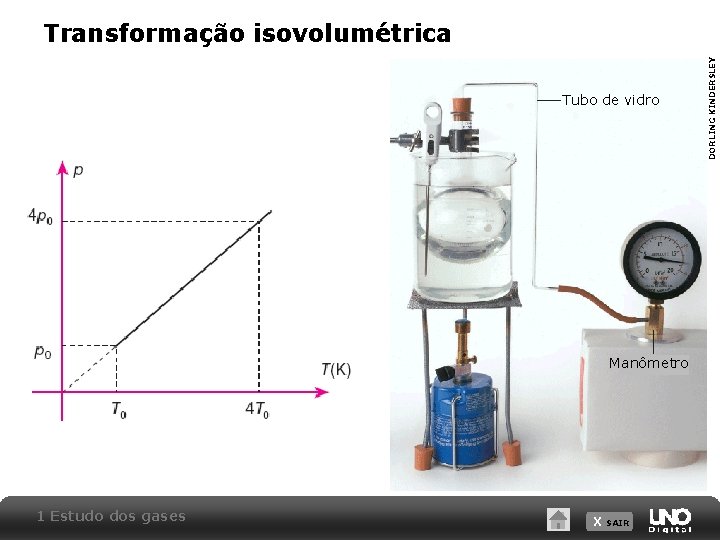
Tubo de vidro Manômetro 1 Estudo dos gases X SAIR DORLING KINDERSLEY Transformação isovolumétrica

Transformação isovolumétrica Lei de Charles para transformações a volume constante: a pressão do gás é diretamente proporcional a sua temperatura absoluta (em kelvins): p=k T (k = constante) Considerando o estado inicial A e final B de um gás ideal sofrendo uma transformação isobárica, temos: 1 Estudo dos gases X SAIR

Equação de um gás ideal X SAIR

Alteração simultânea das três variáveis de estado de um gás § Número de Avogadro: 6, 023 1023 § Mol: 1 mol contém 6, 023 1023 partículas (átomos, moléculas, elétrons etc. ) § Massa molar (M): a massa de 1 mol de moléculas, medida em gramas. § Número de mols (n): 2 Equação de um gás ideal n= m M X SAIR

Analisando a densidade e a massa molar Sob pressão e temperaturas constantes, a densidade d de um gás é uma grandeza diretamente proporcional à massa molar M. MB = m. B = 2 Equação de um gás ideal 1 3 MA m. A X SAIR

Analisando as transformações isobáricas Sob pressão constante, a densidade de um sistema gasoso é uma grandeza inversamente proporcional à temperatura do sistema. 2 Equação de um gás ideal X SAIR

Analisando as transformações isotérmicas Sob temperatura constante, a densidade de um sistema gasoso é uma grandeza diretamente proporcional à pressão do sistema. 2 Equação de um gás ideal X SAIR

Equação de Clapeyron As variáveis de estado pressão (p), volume (V ) e temperatura (T ) de uma massa de gás ideal contendo n mols de gás estão relacionadas pela equação de estado dos gases perfeitos (ou ideais): p V=n R T 2 Equação de um gás ideal X SAIR

Lei geral dos gases ideais (ou perfeitos) Igualando I e II, chegamos à lei geral dos gases ideais: 2 Equação de um gás ideal X SAIR
 Estudo dos gases
Estudo dos gases O que e semivogais
O que e semivogais Estudo do animal
Estudo do animal Os temperamentos
Os temperamentos Cea mai mica unitate de masura a informatiei
Cea mai mica unitate de masura a informatiei Ionizador de agua
Ionizador de agua Luster
Luster Mica splitting test room
Mica splitting test room Produto de solubilidade
Produto de solubilidade Stema mica unire
Stema mica unire La mia prof
La mia prof Mica mote
Mica mote Mica hardness
Mica hardness Fórmula da concentração molar
Fórmula da concentração molar Metoda diamantului gradinita
Metoda diamantului gradinita The major advantage of a mica capacitor over other types is
The major advantage of a mica capacitor over other types is Cele 7 minuni ale lumii gradinile suspendate
Cele 7 minuni ale lumii gradinile suspendate Mica viotti
Mica viotti Liceul tehnologic nicolae teclu copsa mica
Liceul tehnologic nicolae teclu copsa mica Mass interviewing programme
Mass interviewing programme Oat coleoptile
Oat coleoptile Mica village
Mica village Lei de charles
Lei de charles Constante dos gases ideais
Constante dos gases ideais 8 314 constante
8 314 constante