TERMOMETRIA CALORIMETRIA E TERMODIN MICA Aula 4 Maria



































- Slides: 53

TERMOMETRIA, CALORIMETRIA E TERMODIN MICA – Aula 4 Maria Augusta Constante Puget (Magu)

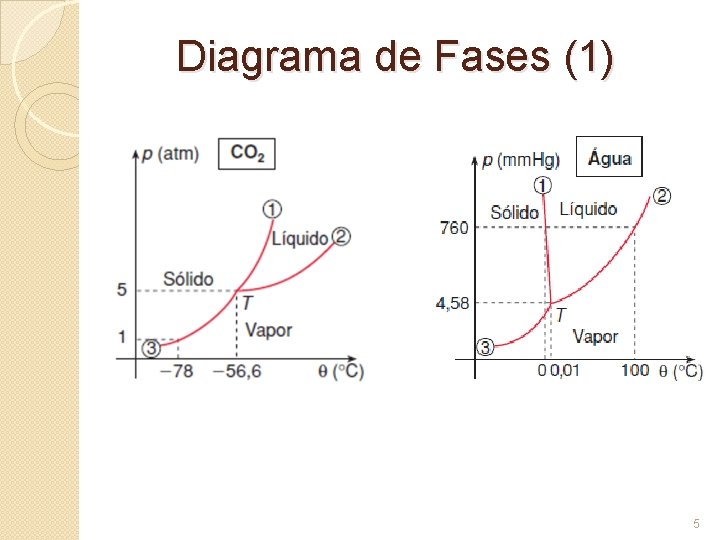
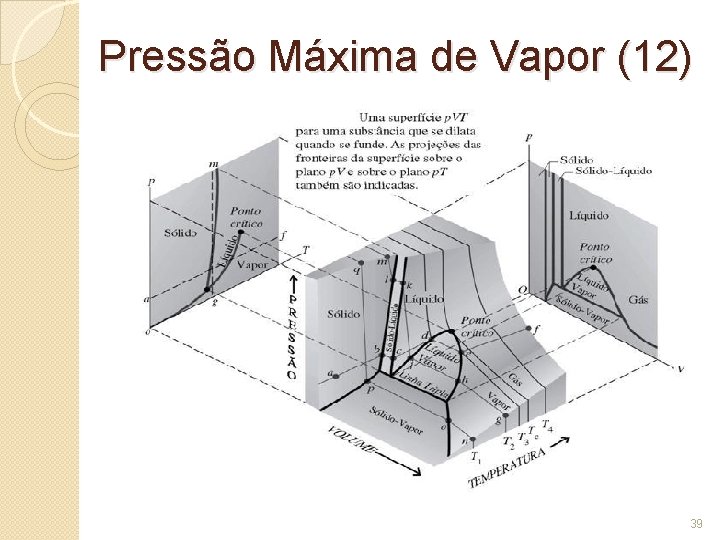
Diagrama de Fases (1) �Denomina-se estado de uma substância a situação em que ela se apresenta em um dado instante, sendo caracterizado pelos valores de sua temperatura, pressão e volume. �Representando os diferentes estados da substância em um gráfico de pressão por temperatura, obtemos o chamado diagrama de fases da substância. 2

Pressão (1) � 3

Pressão (2) � No SI, a unidade padrão para pressão é o Pascal (em homenagem a Blaise Pascal, eminente físico, matemático e filósofo francês), que corresponde a 1 N/m 2. � A pressão exercida pela atmosfera ao nível do mar corresponde a aproximadamente 1, 01325× 105 Pa. Esse valor é normalmente associado a uma unidade chamada atmosfera padrão, simbolizada por atm. � Milímetro de mercúrio (mm. Hg), também chamado torricelli, é uma unidade de pressão antiga. Surgiu quando Evangelista Torricelli (físico e matemático italiano) inventou o barômetro de mercúrio, em 1643. 1 atm = 760 mm Hg 4

Diagrama de Fases (1) 5

Diagrama de Fases (2) 1. A curva 1 é a curva de fusão: delimita as regiões correspondentes às fases sólida e líquida, sendo representativa dos estados de equilíbrio entre sólido e líquido. 6

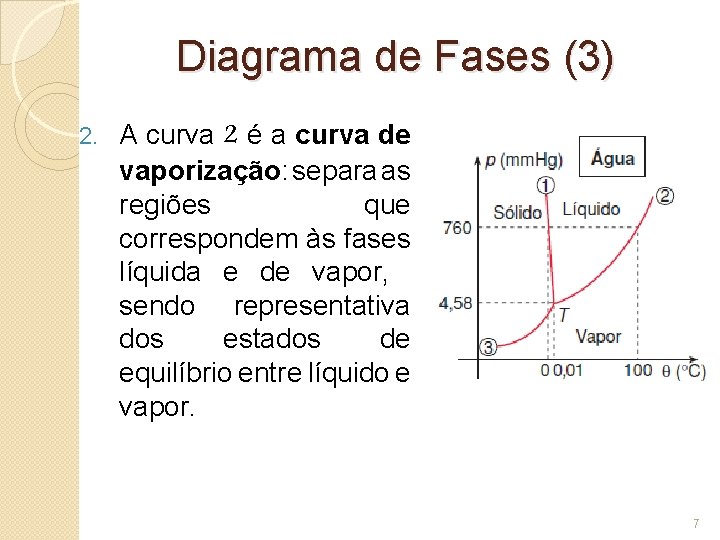
Diagrama de Fases (3) 2. A curva 2 é a curva de vaporização: separa as regiões que correspondem às fases líquida e de vapor, sendo representativa dos estados de equilíbrio entre líquido e vapor. 7

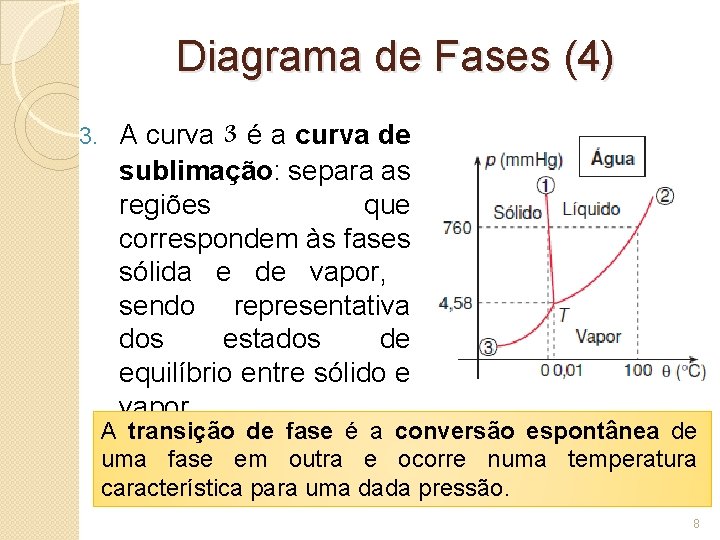
Diagrama de Fases (4) 3. A curva 3 é a curva de sublimação: separa as regiões que correspondem às fases sólida e de vapor, sendo representativa dos estados de equilíbrio entre sólido e vapor. A transição de fase é a conversão espontânea de uma fase em outra e ocorre numa temperatura característica para uma dada pressão. 8

Diagrama de Fases (5) �O estado representado pelo ponto comum às três curvas (T) é denominado ponto triplo ou ponto tríplice e corresponde ao equilíbrio entre as três fases da substância. � Sob pressão de 4, 58 mm. Hg e à temperatura de 0, 010 C, podemos obter, para a água, um sistema constituído por gelo, água líquida e vapor de água, em equilíbrio. 9

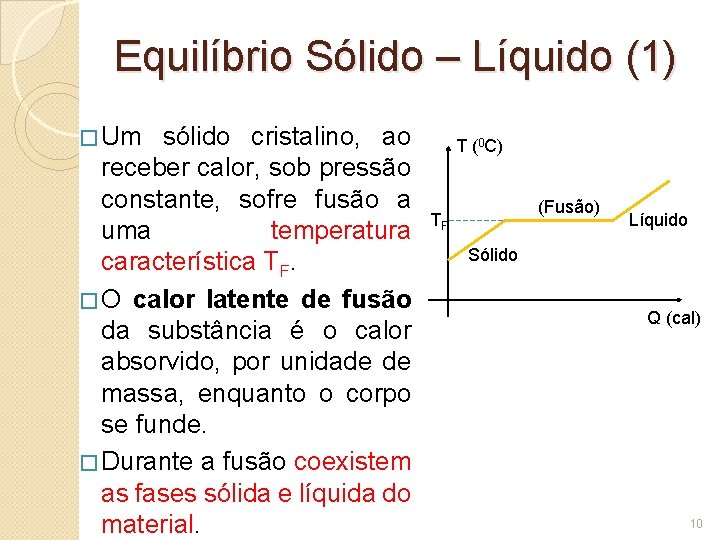
Equilíbrio Sólido – Líquido (1) � Um sólido cristalino, ao receber calor, sob pressão constante, sofre fusão a uma temperatura característica TF. � O calor latente de fusão da substância é o calor absorvido, por unidade de massa, enquanto o corpo se funde. � Durante a fusão coexistem as fases sólida e líquida do material. T (0 C) (Fusão) TF Líquido Sólido Q (cal) 10

Equilíbrio Sólido – Líquido (2) mesmo modo, se um líquido perder calor sob pressão constante, sofrerá solidificação à mesma temperatura na qual o sólido se funde (sob mesma pressão). � Durante a solidificação, a temperatura permanece constante. �O calor latente de solidificação da substância é o calor perdido por unidade de massa, enquanto o líquido se solidifica. O seu valor é igual, em módulo, ao calor latente de fusão. T (0 C) � Do Ts Líquido (Solidificação) Sólido |Q| (cal) Para a água, os calores latentes de fusão e de solidificação, sob pressão normal, valem: LF = 80 cal/g LS = -80 cal/g 11

Equilíbrio Sólido – Líquido (3) �Há dois tipos de substâncias no que diz respeito à influência da pressão sobre o ponto de fusão: 1. Substâncias que se dilatam na fusão: Têm um aumento no seu volume, isto é: Vlíquido > Vsólido. 2. Substâncias que se contraem na fusão: Têm uma diminuição no seu volume, isto é: Vlíquido < Vsólido. 12

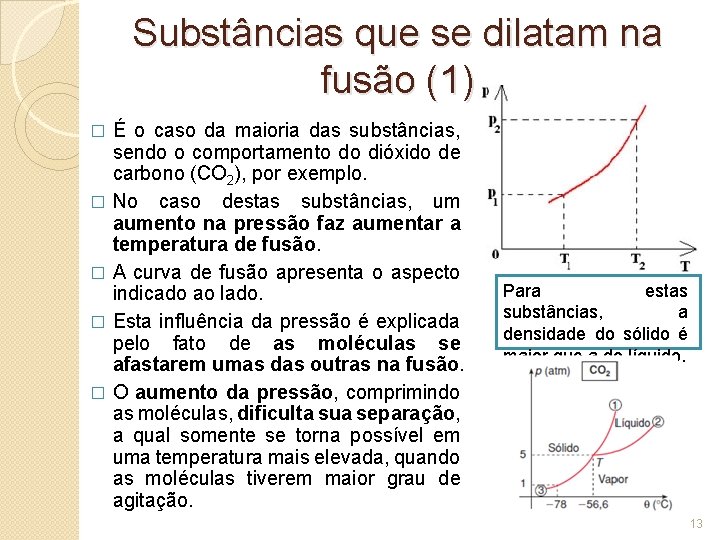
Substâncias que se dilatam na fusão (1) É o caso da maioria das substâncias, sendo o comportamento do dióxido de carbono (CO 2), por exemplo. � No caso destas substâncias, um aumento na pressão faz aumentar a temperatura de fusão. � A curva de fusão apresenta o aspecto indicado ao lado. � Esta influência da pressão é explicada pelo fato de as moléculas se afastarem umas das outras na fusão. � O aumento da pressão, comprimindo as moléculas, dificulta sua separação, a qual somente se torna possível em uma temperatura mais elevada, quando as moléculas tiverem maior grau de agitação. � Para estas substâncias, a densidade do sólido é maior que a do líquido. 13

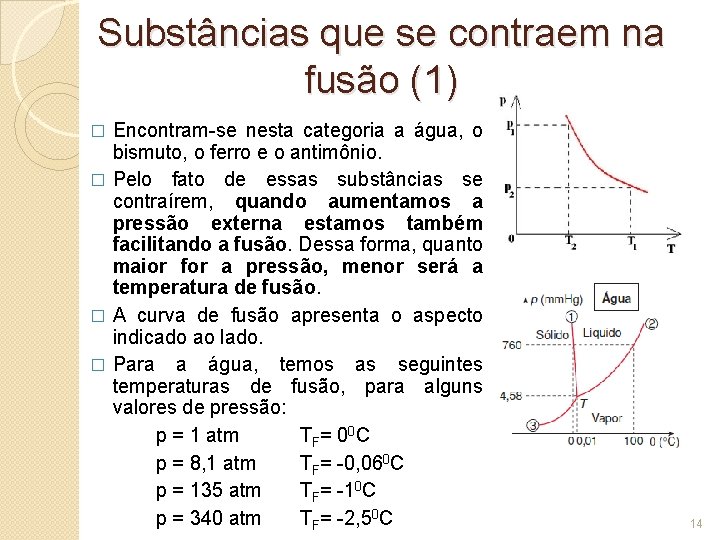
Substâncias que se contraem na fusão (1) Encontram-se nesta categoria a água, o bismuto, o ferro e o antimônio. � Pelo fato de essas substâncias se contraírem, quando aumentamos a pressão externa estamos também facilitando a fusão. Dessa forma, quanto maior for a pressão, menor será a temperatura de fusão. � A curva de fusão apresenta o aspecto indicado ao lado. � Para a água, temos as seguintes temperaturas de fusão, para alguns valores de pressão: p = 1 atm TF = 0 0 C p = 8, 1 atm TF= -0, 060 C p = 135 atm TF= -10 C p = 340 atm TF= -2, 50 C � 14

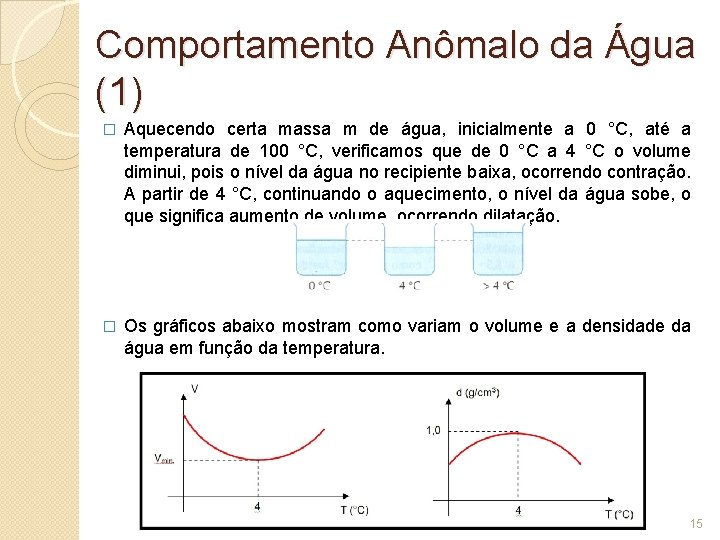
Comportamento Anômalo da Água (1) � Aquecendo certa massa m de água, inicialmente a 0 °C, até a temperatura de 100 °C, verificamos que de 0 °C a 4 °C o volume diminui, pois o nível da água no recipiente baixa, ocorrendo contração. A partir de 4 °C, continuando o aquecimento, o nível da água sobe, o que significa aumento de volume, ocorrendo dilatação. � Os gráficos abaixo mostram como variam o volume e a densidade da água em função da temperatura. 15

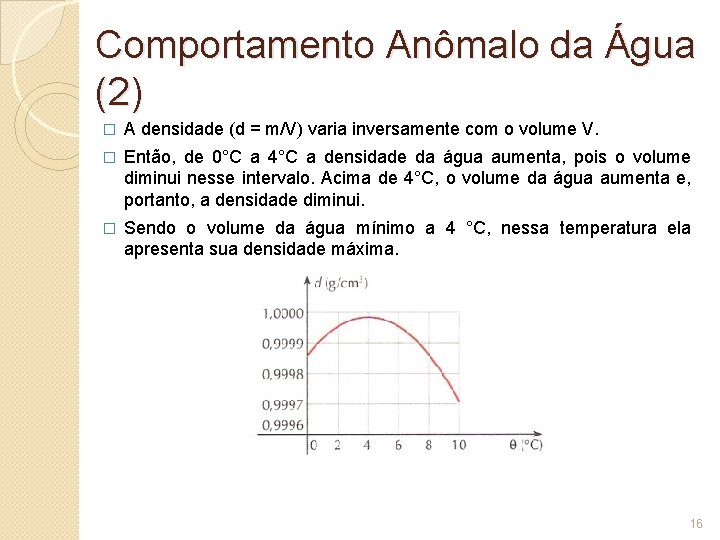
Comportamento Anômalo da Água (2) � A densidade (d = m/V) varia inversamente com o volume V. � Então, de 0°C a 4°C a densidade da água aumenta, pois o volume diminui nesse intervalo. Acima de 4°C, o volume da água aumenta e, portanto, a densidade diminui. � Sendo o volume da água mínimo a 4 °C, nessa temperatura ela apresenta sua densidade máxima. 16

Comportamento Anômalo da Água (3) � � 1. 2. � O comportamento irregular da água, ao ter sua temperatura variada, é explicado pela existência de um tipo especial de ligação entre suas moléculas: as pontes de hidrogênio. Essa ligação é de natureza elétrica e ocorre entre átomos de hidrogênio de moléculas diferentes. Então, quando a temperatura de certa quantidade de água aumenta a partir de 0 °C, ocorrem dois efeitos que se opõem quanto à sua manifestação: A maior agitação térmica molecular produz um aumento na distância média entre as moléculas, o que se traduz em um aumento de volume (dilatação); As pontos de hidrogênio se rompem e, devido a esse rompimento, na nova situação de equilíbrio as moléculas se aproximam umas das outras, o que se traduz em uma diminuição de volume (contração). Ambos os efeitos estão sempre ocorrendo. A predominância de um ou de outro efeito é o que pode acarretar a dilatação ou contração da água. 17

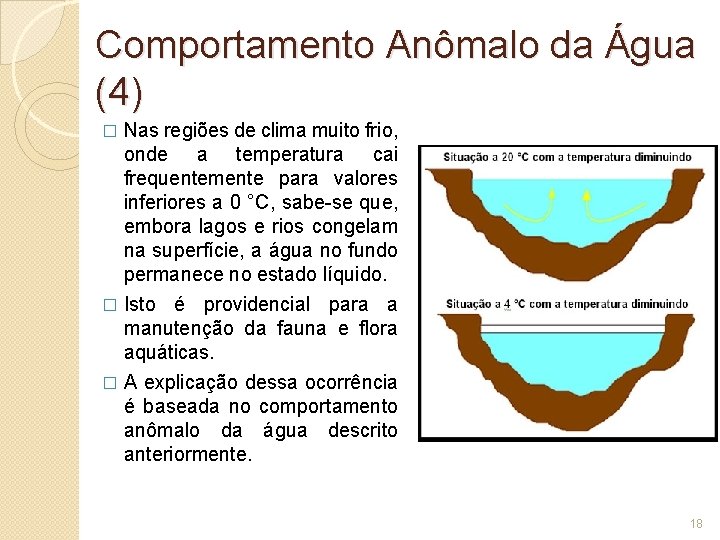
Comportamento Anômalo da Água (4) Nas regiões de clima muito frio, onde a temperatura cai frequentemente para valores inferiores a 0 °C, sabe-se que, embora lagos e rios congelam na superfície, a água no fundo permanece no estado líquido. � Isto é providencial para a manutenção da fauna e flora aquáticas. � A explicação dessa ocorrência é baseada no comportamento anômalo da água descrito anteriormente. � 18

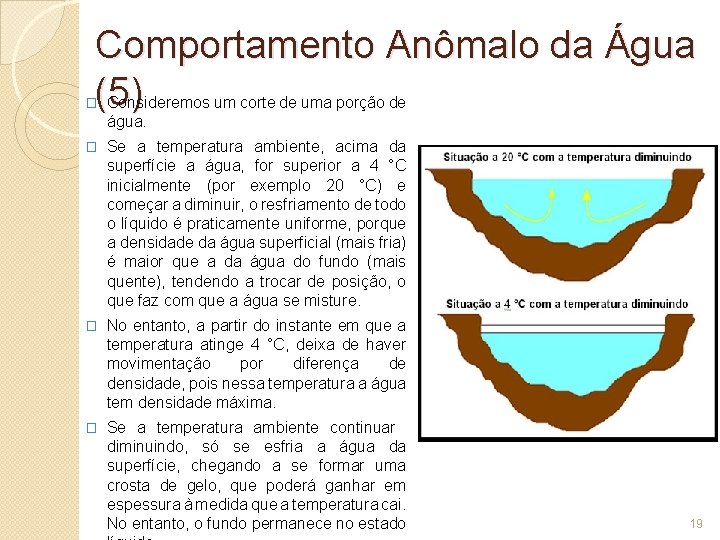
Comportamento Anômalo da Água (5) Consideremos um corte de uma porção de � água. � Se a temperatura ambiente, acima da superfície a água, for superior a 4 °C inicialmente (por exemplo 20 °C) e começar a diminuir, o resfriamento de todo o líquido é praticamente uniforme, porque a densidade da água superficial (mais fria) é maior que a da água do fundo (mais quente), tendendo a trocar de posição, o que faz com que a água se misture. � No entanto, a partir do instante em que a temperatura atinge 4 °C, deixa de haver movimentação por diferença de densidade, pois nessa temperatura a água tem densidade máxima. � Se a temperatura ambiente continuar diminuindo, só se esfria a água da superfície, chegando a se formar uma crosta de gelo, que poderá ganhar em espessura à medida que a temperatura cai. No entanto, o fundo permanece no estado 19

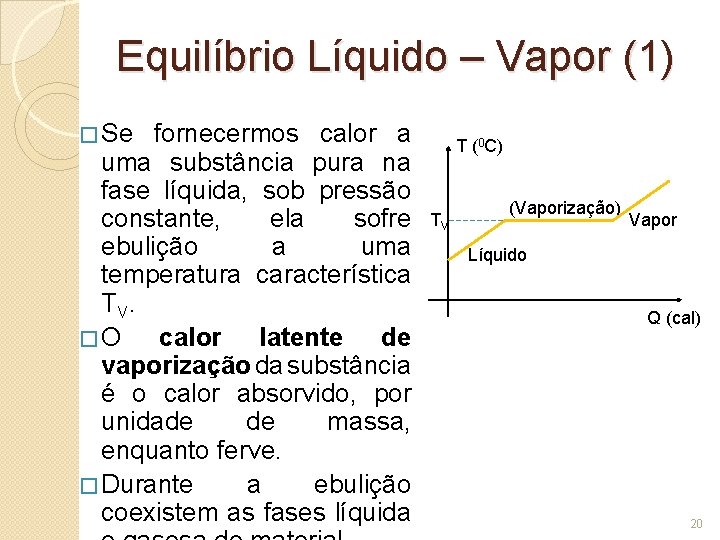
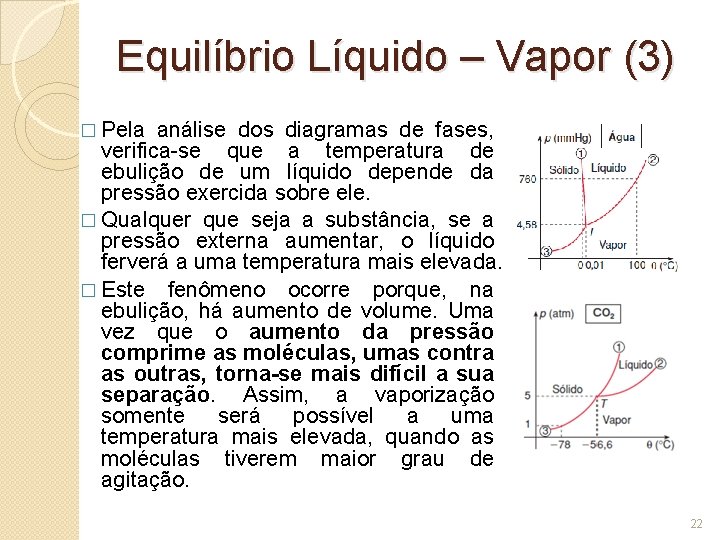
Equilíbrio Líquido – Vapor (1) � Se fornecermos calor a uma substância pura na fase líquida, sob pressão constante, ela sofre ebulição a uma temperatura característica TV. �O calor latente de vaporização da substância é o calor absorvido, por unidade de massa, enquanto ferve. � Durante a ebulição coexistem as fases líquida T (0 C) TV (Vaporização) Vapor Líquido Q (cal) 20

Equilíbrio Líquido – Vapor (2) mesmo modo, se um vapor perder calor sob pressão constante, sofrerá condensação à mesma temperatura na qual o líquido vaporiza (sob mesma pressão). � Durante a condensação, a temperatura permanece constante. �O calor latente de condensação da substância é o calor perdido por unidade de massa, enquanto o vapor se transforma em líquido. O seu valor é igual, em módulo, ao calor latente de T (0 C) � Do Ts Vapor (Condensação) Líquido |Q| (cal) Para a água, os calores latentes de vaporização e de condensação, sob pressão normal, valem: LV = 540 cal/g LC = -540 cal/g 21

Equilíbrio Líquido – Vapor (3) � Pela análise dos diagramas de fases, verifica-se que a temperatura de ebulição de um líquido depende da pressão exercida sobre ele. � Qualquer que seja a substância, se a pressão externa aumentar, o líquido ferverá a uma temperatura mais elevada. � Este fenômeno ocorre porque, na ebulição, há aumento de volume. Uma vez que o aumento da pressão comprime as moléculas, umas contra as outras, torna-se mais difícil a sua separação. Assim, a vaporização somente será possível a uma temperatura mais elevada, quando as moléculas tiverem maior grau de agitação. 22

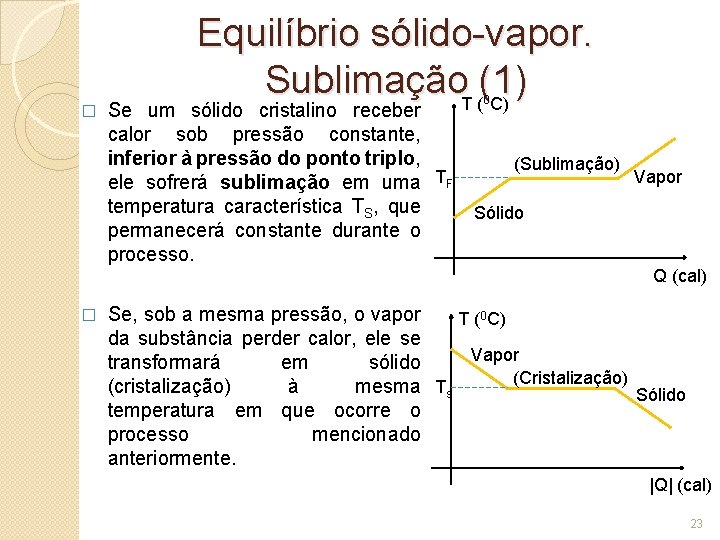
� Equilíbrio sólido-vapor. Sublimação. T ((1) C) Se um sólido cristalino receber calor sob pressão constante, inferior à pressão do ponto triplo, ele sofrerá sublimação em uma TF temperatura característica TS, que permanecerá constante durante o processo. 0 (Sublimação) Vapor Sólido Q (cal) � Se, sob a mesma pressão, o vapor T (0 C) da substância perder calor, ele se Vapor transformará em sólido (Cristalização) (cristalização) à mesma Ts Sólido temperatura em que ocorre o processo mencionado anteriormente. |Q| (cal) 23

Equilíbrio sólido-vapor. Sublimação (2) Qualquer substância (exceto o hélio) pode sublimar, dependendo das condições físicas a que esteja submetida. � O iodo e o gelo-seco (CO 2 solidificado) sublimam em condições fáceis de serem reproduzidas. � Em espetáculos teatrais e musicais, um efeito especial interessante consiste em se obter uma “nuvem de fumaça” mediante a colocação de pedaços de gelo seco em água. Quando o gelo-seco sublima, os vapores de CO 2 que se formam constituem uma densa neblina. � 24

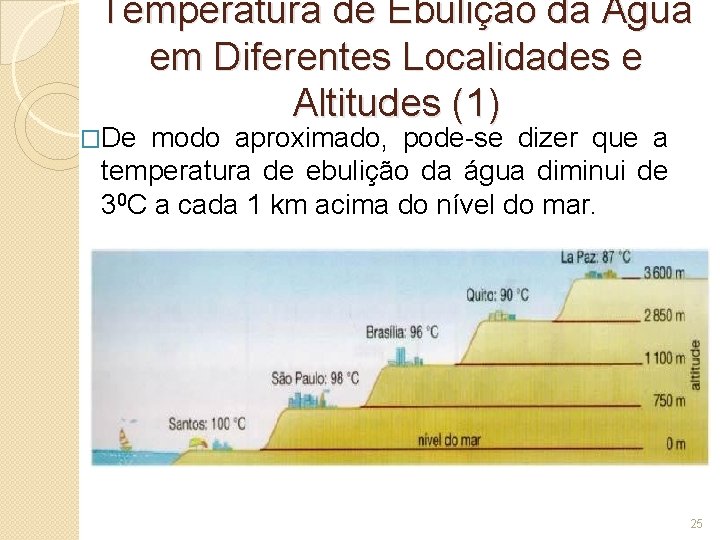
Temperatura de Ebulição da Água em Diferentes Localidades e Altitudes (1) �De modo aproximado, pode-se dizer que a temperatura de ebulição da água diminui de 30 C a cada 1 km acima do nível do mar. 25

Panela de Pressão (1) � Nas panelas abertas, a água ferve a temperatura próxima de 100°C, dependendo da altitude. � A panela de pressão é fechada, de maneira que o vapor d’água que se forma no seu interior, não se dissipa facilmente para o ambiente. � Desta maneira, a pressão interna da panela aumenta, podendo chegar a 2 atm. � Nesta pressão a água ferve a uma temperatura aproximadamente igual a 120°C. Como a água atinge uma temperatura maior, os alimentos são cozidos com maior rapidez. � A panela de pressão foi inventada pelo Físico francês Denis Papin. Por segurança, as panelas de pressão possuem uma válvula para controle de pressão, e uma válvula de segurança. � A válvula para controle de pressão permite a saída do vapor d’água quando a pressão deste vapor atinge um limite. � Caso a pressão interna ultrapassa o valor suportado pela panela, a 26 válvula de segurança se �

Gás Ideal (1) � Um gás ideal ou perfeito é um gás hipotético, idealizado. Características: 1. 2. É composto de partículas puntiformes, ou seja, de tamanho desprezível. As forças de interação elétrica entre as partículas do gás são desprezíveis. 3. As partículas só interagem durante as colisões, que são perfeitamente elásticas (ou seja, nestas colisões, não há perda de energia na forma de calor). � Um gás real (oxigênio, hidrogênio, nitrogênio) pode apresentar um comportamento que se aproxima muito do previsto para um gás ideal, sob certas circunstâncias. Nestas 27

Pressão Máxima de Vapor (1) Lei de Boyle (1) � Uma transformação gasosa na qual variam a pressão p e o volume V, com a temperatura T mantida constante é chamada de transformação isotérmica. � Imaginemos uma seringa, cujo orifício esteja fechado e o êmbolo pressionado. Veremos que quanto maior for a pressão externa aplicada sobre o êmbolo da seringa, menor será o volume do ar dentro da seringa. 28

Pressão Máxima de Vapor (2) Lei de Boyle (2) � Se mantivermos uma certa massa de gás ideal a uma temperatura constante T, verificamos experimentalmente que, se o volume for reduzido de um valor inicial V 1 para um valor final V 2, a pressão aumenta do valor inicial p 1 para o valor final p 2, de acordo com a fórmula: p 1 V 1 = p 2 V 2 A pressão e o volume de um gás ideal, mantido a uma temperatura constante, são inversamente proporcionais. Por inversamente proporcionais entende-se que, se a pressão aumenta, o volume diminui na mesma 29 proporção e vice-versa.

Pressão Máxima de Vapor (3) Lei de Boyle (3) � Esta relação é chamada Lei de Boyle em homenagem ao físico que a descobriu. � Robert Boyle (Lismore, 25 de janeiro de 1627 — Londres, 31 de dezembro de 1691) foi um filósofo natural, Químico e Físico irlandês que se destacou pelos seus trabalhos no âmbito da física e da química. 30

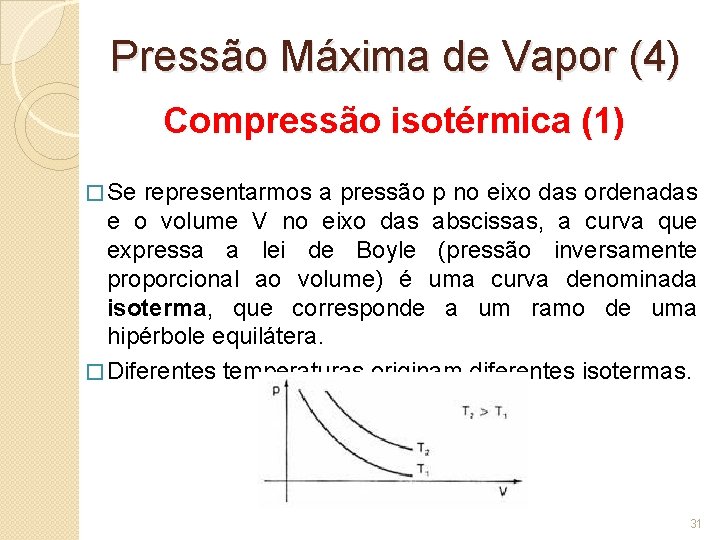
Pressão Máxima de Vapor (4) Compressão isotérmica (1) � Se representarmos a pressão p no eixo das ordenadas e o volume V no eixo das abscissas, a curva que expressa a lei de Boyle (pressão inversamente proporcional ao volume) é uma curva denominada isoterma, que corresponde a um ramo de uma hipérbole equilátera. � Diferentes temperaturas originam diferentes isotermas. 31

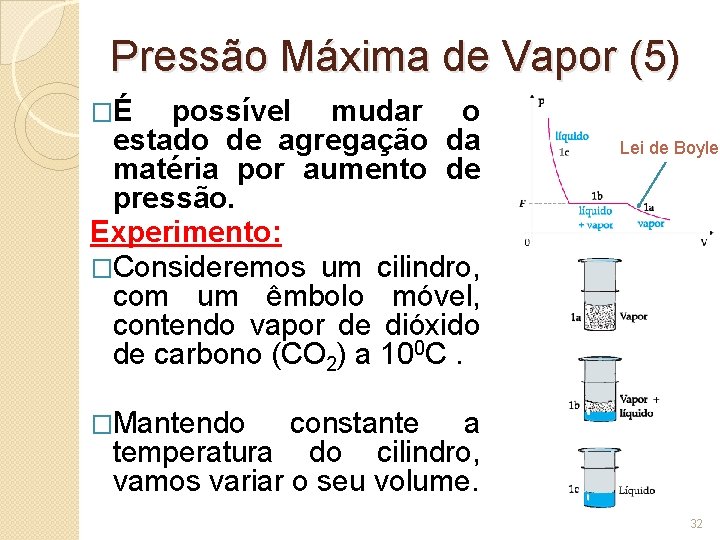
Pressão Máxima de Vapor (5) �É possível mudar o estado de agregação da matéria por aumento de pressão. Experimento: �Consideremos um cilindro, com um êmbolo móvel, contendo vapor de dióxido de carbono (CO 2) a 100 C. Lei de Boyle �Mantendo constante a temperatura do cilindro, vamos variar o seu volume. 32

Pressão Máxima de Vapor (6) � Inicialmente, diminuindo o volume do cilindro, a pressão exercida pelo vapor aumenta, valendo aproximadamente, a Lei de Boyle (curva 1 a). � Prosseguindo a redução do volume do cilindro, atinge-se a pressão F e, neste ponto, o vapor começa a se condensar. Deixa de valer a Lei de Boyle. � Durante a condensação do vapor a pressão se mantém constante (no seu valor F) no interior do cilindro até que todo o vapor se transforme em líquido. No gráfico isto é representado pela reta 1 b paralela ao eixo dos volumes, denominada patamar. � Na figura 1 c, todo vapor se transformou em líquido e uma pequena diminuição no volume do líquido é Lei de Boyle 33

Pressão Máxima de Vapor (7) Na temperatura em que se realiza a experiência (100 C), F é a maior pressão que o vapor de CO 2 pode exercer (antes de se transformar totalmente em líquido). � Esse valor F constitui a pressão máxima de vapor à temperatura da experiência. � A pressão máxima de vapor corresponde, ao equilíbrio líquido-vapor, sendo representada, no diagrama de fases, por um ponto na curva de vaporização. � Vapor saturante Vapor seco • Denomina-se vapor saturante ao vapor que se encontra em presença do líquido e, portanto, exercendo a pressão máxima F. • Chama-se vapor seco aquele que não se encontra em presença do líquido, exercendo então uma pressão menor que a máxima (p < F). • O vapor saturante não obedece à Lei de Boyle (p. V = constante). A pressão por ele exercida (pressão máxima de vapor F) não depende do volume ocupado pelo vapor. 34

Pressão Máxima de Vapor (8) � A influência da temperatura na pressão máxima de vapor foi bem estabelecida por Thomas Andrews (1813 – 1886), físico-químico irlandês. � Ele realizou compressões isotérmicas em diferentes temperaturas para uma mesma substância (o CO 2) e constatou que, quanto mais elevada a temperatura, maior é a pressão máxima F em que ocorre a condensação. � Além disso, o patamar do gráfico p X V diminui, isto é, com o aumento da pressão, a liquefação torna-se mais rápida. 35

Pressão Máxima de Vapor (9) � A uma temperatura característica da substância, denominada temperatura crítica (TC = 310 C no caso do CO 2), o patamar se reduz a um simples ponto, o ponto crítico, e a condensação do vapor aí é instantânea. � A curva obtida ligando-se as extremidades dos patamares (em azul) é denominada curva de saturação. �AConclusões: pressão máxima de vapor F de uma substância varia exclusivamente em função da temperatura. O maior valor possível para a pressão máxima de vapor de uma substância é a pressão crítica p. C, correspondente à temperatura crítica TC. 36

Pressão Máxima de Vapor (10) Se a compressão isotérmica for realizada em uma temperatura superior à temperatura crítica TC, verifica-se que não mais ocorre a condensação. � A substância estará então sempre na fase gasosa, obedecendo a Lei de Boyle. � Acima da temperatura crítica, a substância não é mais chamada de vapor, reservando -se a ela o nome de gás. � � Assim: Gás é a substância na fase gasosa numa temperatura superior à temperatura crítica. Um gás não se condensa por compressão isotérmica. 37

Pressão Máxima de Vapor (11) � Levando-se em conta que a pressão máxima de vapor corresponde ao equilíbrio líquido-vapor da substância, a curva das pressões máximas de vapor, no diagrama de fases, é a curva de vaporização, que se estende do ponto triplo T ao ponto crítico C. � Na tabela ao lado, tem-se os pontos críticos de algumas substâncias. � Observa-se que a água na fase gasosa é vapor até 3740 C. Acima dessa temperatura a água é gás, não podendo ser liquefeita por compressão isotérmica. 38

Pressão Máxima de Vapor (12) 39

Mistura de Gases (1) � 40

Mistura de Gases (2) �A lei de Dalton, ou lei das pressões parciais, estabelece que a pressão total de uma mistura gasosa é igual à soma da pressão parcial de cada um dos gases que compõem a mistura. � Assim, para uma mistura gasosa ideal de três componentes A, B e C, a pressão total (PT) é calculada da seguinte forma: PT = P A + P B + P C 41

Umidade do Ar (1) �O ar é uma mistura de gases da qual participa o vapor de água, exercendo uma pressão parcial f. � Diz-se que o ar está saturado de vapor quando este existe em quantidade tal que esteja exercendo a pressão máxima de vapor F. � Define-se umidade relativa ou grau higrométrico H do ar pela relação: � Frequentemente, a umidade relativa é expressa em porcentagem. Se o ambiente estiver saturado (f = F), a umidade relativa vale H = 1 (ou 100%). 42

Evaporação (1) �A evaporação é a vaporização espontânea de um líquido, sob quaisquer condições, como resultado da agitação térmica molecular. � As moléculas constituintes de um líquido, seja qual for sua temperatura, estão sempre em agitação, movimentando-se em todas as direções e também com velocidades diferentes umas das outras. � Tendo o líquido uma superfície livre, algumas moléculas alcançam esta superfície com alta velocidade e conseguem escapar dele. 43

Evaporação (2) A velocidade de evaporação v de um líquido (massa que se evapora por unidade de tempo) depende de uma série de fatores: 1. Natureza do líquido: Nas mesmas condições de temperatura e pressão (por exemplo, 1 atm e 200 C): � ◦ Há líquidos que se evaporam rapidamente. Ex: Éter, álcool, gasolina. São chamados de voláteis. ◦ Há líquidos que se evaporam lentamente. Ex: Mercúrio, óleos em geral. São chamados de fixos. Esta diferença está relacionada com a intensidade das forças de coesão entre as moléculas do líquido. 2. Pressão externa: A pressão externa (pe) sobre a superfície livre do líquido representa um obstáculo à passagem das moléculas para a fase gasosa. Por isso, quanto maior a pressão externa sobre o líquido, mais lentamente ele evapora. 44

Evaporação (3) Área da superfície livre: Quanto maior a área A pela qual as moléculas podem passar para a fase gasosa, maior a velocidade de evaporação. Obs: O que fazemos para que a roupa, após lavada, seque mais rapidamente? 4. Temperatura: Quanto maior a temperatura, maior a agitação térmica molecular. Por isso, aumentando-se a temperatura de um líquido, as moléculas passam a se agitar mais intensamente e um maior número delas abandona o líquido num dado intervalo de tempo, aumentando assim a velocidade de evaporação. 3. 45

Evaporação (4) Umidade: A passagem de moléculas do líquido para a fase de vapor e a passagem de moléculas de vapor para a fase líquida está constantemente ocorrendo junto à superfície do líquido. Trata-se de um processo dinâmico. O líquido evapora porque é maior a quantidade de moléculas que passam para a fase gasosa. Entretanto, se a umidade do ar for grande, isto é, a concentração de vapor junto à superfície do líquido for elevada, no balanço geral menos moléculas evaporam, o que representa uma diminuição na velocidade de evaporação. 5. 46

Evaporação (5) � O químico inglês John Dalton (1766 -1844) estabeleceu empiricamente uma fórmula para traduzir essas influências: onde: K Constante característica do líquido, alta para os líquidos voláteis e baixa para os líquidos fixos. A Área da superfície livre do líquido. pe Pressão externa sobre a superfície. F Pressão máxima de vapor, que depende da temperatura. f Pressão parcial de vapor na atmosfera, que caracteriza o grau de umidade no ambiente. 47

Evaporação (6) � Como as moléculas que se vaporizam absorvem calor, a evaporação provoca o chamado frio por evaporação: Um banhista sente mais frio ao sair da água, enquanto o seu corpo está molhado, porque a água que fica em sua pele evapora, retirando calor do seu corpo. 2. A água se conserva fresca em potes de barro porque, sendo o barro um material poroso, parte da água o atravessa e evapora, retirando calor da água que permanece dentro do pote. 3. A termoregulação do corpo humano baseia-se no fato de que o suor, ao evaporar, retira calor do corpo, mantendo constante a temperatura. 4. Em um dia quente, após uma chuvarada, a sensação de calor se acentua, pois aumenta a quantidade de vapor junto à pele, dificultando a evaporação do suor. 1. 48

O Psicrômetro (1) O psicrômetro é um aparelho constituído por dois termômetros idênticos colocados um ao lado do outro. �A diferença entre os dois termômetros é que um deles trabalha com o bulbo seco e o outro com o bulbo úmido. � O termômetro de bulbo úmido tem o bulbo coberto por uma malha porosa (geralmente de algodão), que fica mergulhada num recipiente contendo água destilada. Esta malha fica constantemente úmida. � 49

O Psicrômetro (2) A evaporação da água contida na malha úmida, se dá em decorrência da troca de calor entre o bulbo e a malha. O bulbo cede calor para a malha, fazendo com que o termômetro de bulbo úmido indique uma temperatura mais baixa do que a do outro termômetro, que indica a temperatura ambiente. � Essa evaporação, e consequente redução na temperatura de bulbo úmido, é tanto maior quanto mais seco está o ar atmosférico, e é nula quando a atmosfera está saturada de vapor de água. � 50

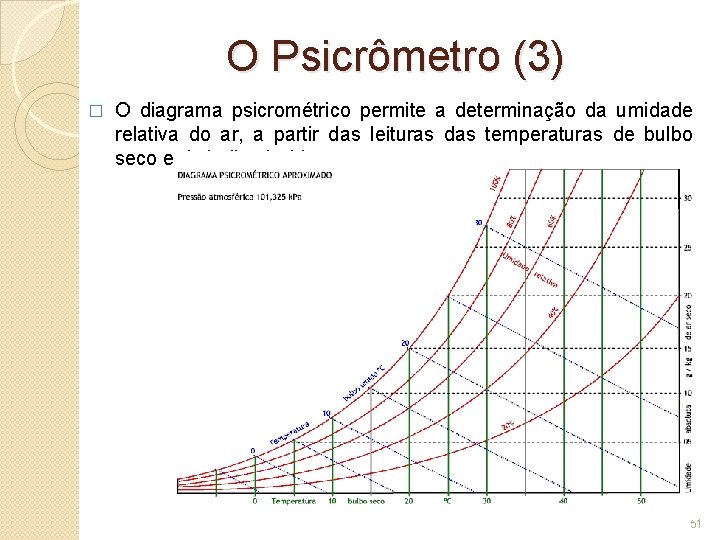
O Psicrômetro (3) � O diagrama psicrométrico permite a determinação da umidade relativa do ar, a partir das leituras das temperaturas de bulbo seco e de bulbo úmido. 51

Calefação (1) Calefação (nome popular para o Efeito de Leidenfrost) é um modo particular de vaporização, que opera de forma muito mais rápida e agressiva. � O fenômeno ocorre quando um líquido qualquer entra em contato com uma superfície que se encontra a uma temperatura muito maior que a sua temperatura de ebulição (no caso da água pura, acima de 100ºC). � Durante a calefação, o líquido se divide em partículas esferóides, que executam um movimento rápido e desordenado à medida que diminuem de volume. � 52

Calefação (2) � Exemplo clássico de calefação é o de uma gota de água sobre uma chapa muito quente, como a do ferro de passar. � O processo dura poucos segundos, e o líquido é convertido em vapor rapidamente. 53
 Equação termométrica
Equação termométrica Que estudia la termometria
Que estudia la termometria Termometria
Termometria Cele 7 minuni ale lumii gradinile suspendate
Cele 7 minuni ale lumii gradinile suspendate Mica viotti
Mica viotti Liceul nicolae teclu
Liceul nicolae teclu Bank wiring observation room experiment
Bank wiring observation room experiment Mica plate auxin
Mica plate auxin Mica village
Mica village The major advantage of a mica capacitor over other types is
The major advantage of a mica capacitor over other types is Cea mai mica unitate de masura a informatiei
Cea mai mica unitate de masura a informatiei Bioqu¡mica
Bioqu¡mica Mica
Mica Mica splitting study
Mica splitting study Ano qu mica
Ano qu mica Stema mica unire
Stema mica unire Mića jovanović
Mića jovanović Mica mote
Mica mote Gcse geology data sheet
Gcse geology data sheet Concentração comum
Concentração comum Activitate integrata animale salbatice prescolari
Activitate integrata animale salbatice prescolari Calor especifico del hierro
Calor especifico del hierro Calorimetría directa ventajas y desventajas
Calorimetría directa ventajas y desventajas Calorimetria
Calorimetria Calorimetria
Calorimetria Legge termologia
Legge termologia Calore specifico
Calore specifico Q m c t
Q m c t Calorimetria a scansione differenziale
Calorimetria a scansione differenziale Calorimetro di atwater
Calorimetro di atwater Um corpo de 400g e calor específico
Um corpo de 400g e calor específico Termogramma dsc
Termogramma dsc Equazione calorimetria
Equazione calorimetria Adiabatica
Adiabatica Maria felicia de jesús sacramentado maría teresa arminda
Maria felicia de jesús sacramentado maría teresa arminda Suma un
Suma un Aula virtual santa clara de asis
Aula virtual santa clara de asis Cmb aula virtual
Cmb aula virtual Stata aula
Stata aula Aula de recursos humanos
Aula de recursos humanos Plano de aula hidrografia 4o ano
Plano de aula hidrografia 4o ano El diagnostico en el aula elena luchetti ideas principales
El diagnostico en el aula elena luchetti ideas principales Ies cantabria aula virtual
Ies cantabria aula virtual Aula docencia chuo
Aula docencia chuo Aula constitucional
Aula constitucional Tambo
Tambo Uniagustiniana aula virtual
Uniagustiniana aula virtual Psicologia uba
Psicologia uba Plano de aula sobre os dez mandamentos
Plano de aula sobre os dez mandamentos Plan de aula grado cuarto
Plan de aula grado cuarto Plano de aula regras de convivência educação infantil
Plano de aula regras de convivência educação infantil Aula virtual filosofia
Aula virtual filosofia A aula de dança
A aula de dança Vida e morte ensino religioso 8 ano
Vida e morte ensino religioso 8 ano