CALORIMETRIA DIFFERENZIALE A SCANSIONE La Calorimetria differenziale a













- Slides: 21

CALORIMETRIA DIFFERENZIALE A SCANSIONE La Calorimetria differenziale a scansione (DSC) misura la temperatura ed il flusso di calore associato ad una transizione di un materiale in funzione del tempo e della temperatura. La tecnica fornisce informazioni qualitative e quantitative circa le evoluzioni chimiche e fisiche coinvolgono processi esotermici o endotermici variazioni della capacità termica. La quantità di materiale necessario è molto bassa. o

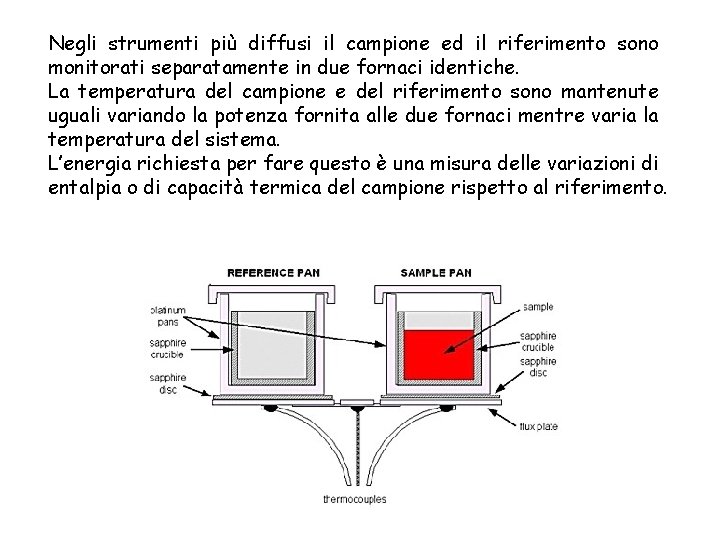
Negli strumenti più diffusi il campione ed il riferimento sono monitorati separatamente in due fornaci identiche. La temperatura del campione e del riferimento sono mantenute uguali variando la potenza fornita alle due fornaci mentre varia la temperatura del sistema. L’energia richiesta per fare questo è una misura delle variazioni di entalpia o di capacità termica del campione rispetto al riferimento.

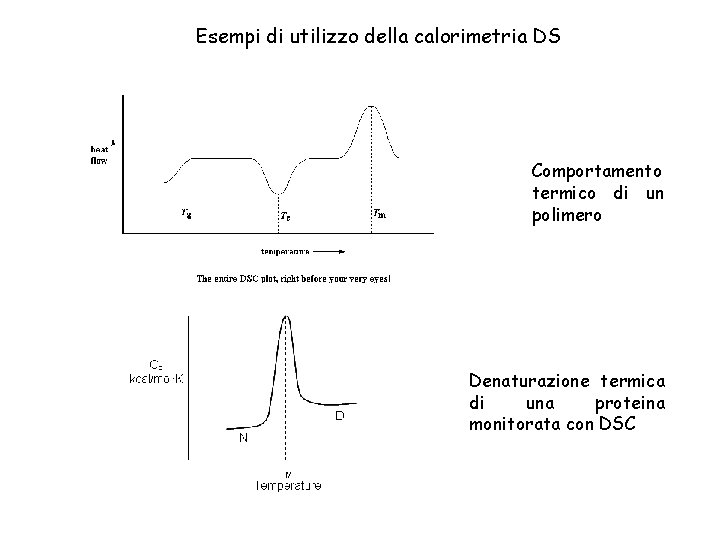
Esempi di utilizzo della calorimetria DS Comportamento termico di un polimero Denaturazione termica di una proteina monitorata con DSC

In un tipico esperimento vengono eseguite più scansioni in temperatura del campione. In esperimenti separati di controllo viene monitorata la soluzione tampone per determinare la linea di base. Anche in questo caso per una buona valutazione quantitativa dei dati sperimentali è richiesta una conoscenza accurata della concentrazione del campione. Spesso occorre variare i parametri sperimentali come concentrazione, velocità di scansione, p. H, forza ionica, ecc.

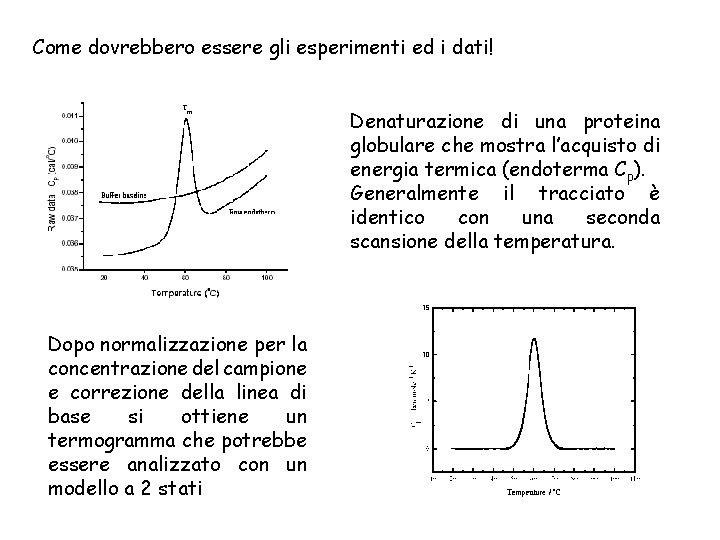
Come dovrebbero essere gli esperimenti ed i dati! Denaturazione di una proteina globulare che mostra l’acquisto di energia termica (endoterma Cp). Generalmente il tracciato è identico con una seconda scansione della temperatura. Dopo normalizzazione per la concentrazione del campione e correzione della linea di base si ottiene un termogramma che potrebbe essere analizzato con un modello a 2 stati

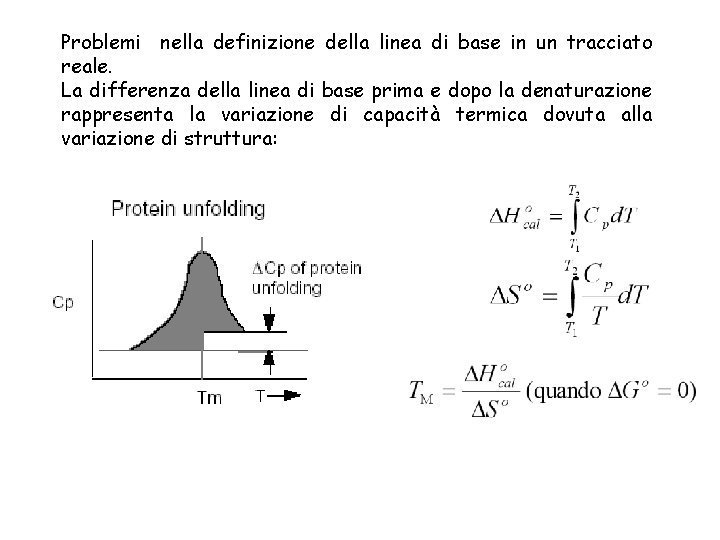
Problemi nella definizione della linea di base in un tracciato reale. La differenza della linea di base prima e dopo la denaturazione rappresenta la variazione di capacità termica dovuta alla variazione di struttura:

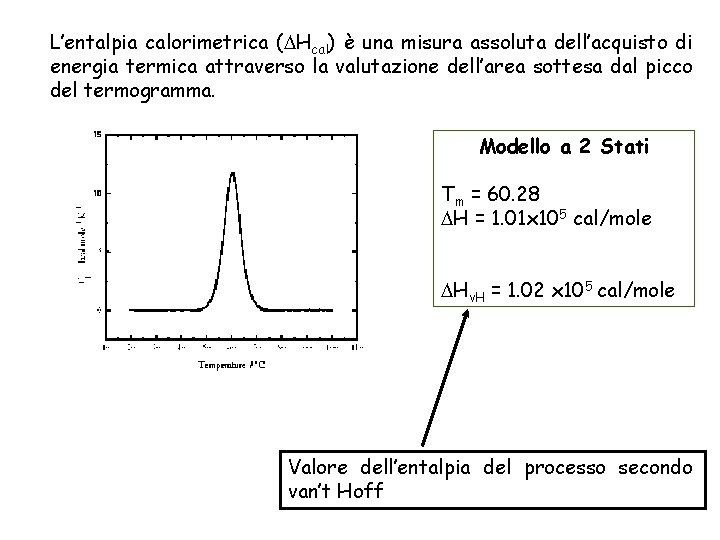
L’entalpia calorimetrica ( Hcal) è una misura assoluta dell’acquisto di energia termica attraverso la valutazione dell’area sottesa dal picco del termogramma. Modello a 2 Stati Tm = 60. 28 H = 1. 01 x 105 cal/mole Hv. H = 1. 02 x 105 cal/mole Valore dell’entalpia del processo secondo van’t Hoff

La denaturazione di una proteina: Il modello a due stadi





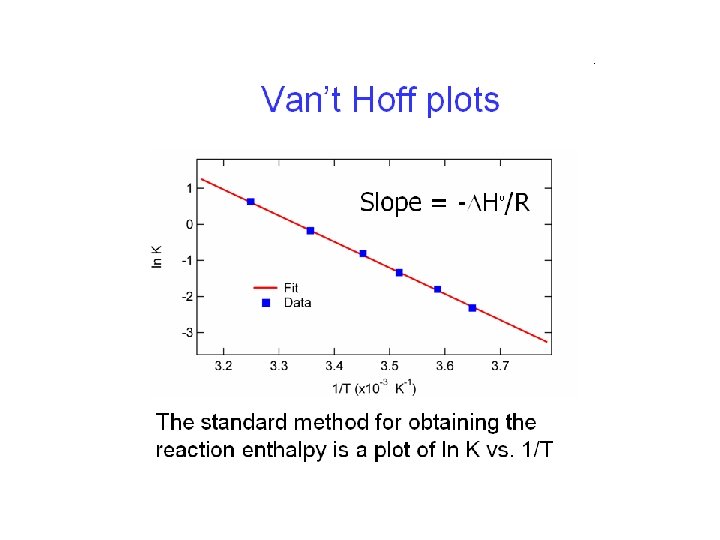
I due metodi descritti per determinare l’entalpia di una transizione, Hv. Hoff dalla dipendenza della costante di equilibrio dalla temperatura e Hcal dalle misure calorimetriche, generalmente non danno lo stesso valore. La differenza tra i due valori dipende dalla cooperatività della transizione: Se DHv. Hoff = DHcal allora la transizione coinvolge solo due stati Se DHv. Hoff < DHcal sono coinvolti degli stati intermedi Se DHv. Hoff > DHcal allora possono essere coinvolte interazioni intermolecolari che devono essere superate per passare da uno stato all’altro.

Vediamo meglio Hv. Hoff < hcal dove sono coinvolti degli stati intermedi. Il numero n di unità cooperative dalla relazione: Per esempio, se una proteina ha n domini indipendenti ed identici, che denaturano quindi in modo indipendente:

Sia Hv. Hoff che Hcal possono essere ottenute da misure calorimetriche. l’espressione trovata precedentemente: è riscritta:

In questo caso può essere visto come il grado di avanzamento del processo (la frazione di reagente convertito nel prodotto) che può essere valutato dalla curva calorimetria della capacità termica: dove Cp, ex (TM) è la capacità termica eccesso a metà transizione, che approssimativamente corrisponde al massimo della curva calorimetrica)

Tuttavia la valutazione dell’entalpia di van’t Hoff ( HVH) è legata alla forma dell’endoterma e richiede un vero meccanismo a due stati. E’ indipendente dalla quantità di proteina ed è una misura della cooperatività della transizione: maggiore è la cooperatività e più netta sarà la transizione con un valore di HVH più alto. Transizioni allungate hanno bassi valori di HVH.

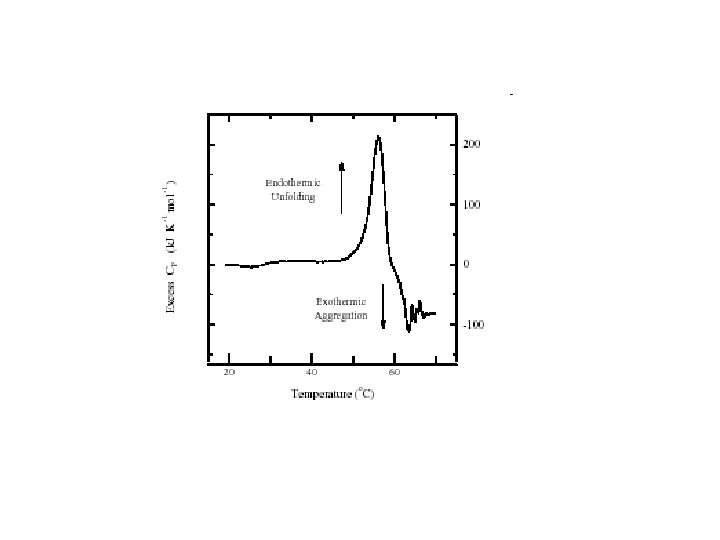
Cosa succede in realtà!!! Una proteina denaturata è una sostanza appiccicosa e spesso forma aggregati, specialmente a p. H intorno alla neutralità. L’aggregazione è spesso irreversibile e causa una distorsione endotermica del termogramma. L’aggregazione dipende da molti fattori fra cui la concentrazione della proteina e la velocità di scansione in temperatura. La distorsione causa un abbassamento del valore apparente minore della Tm, del Hcal e valori sovrastimati della HVH.


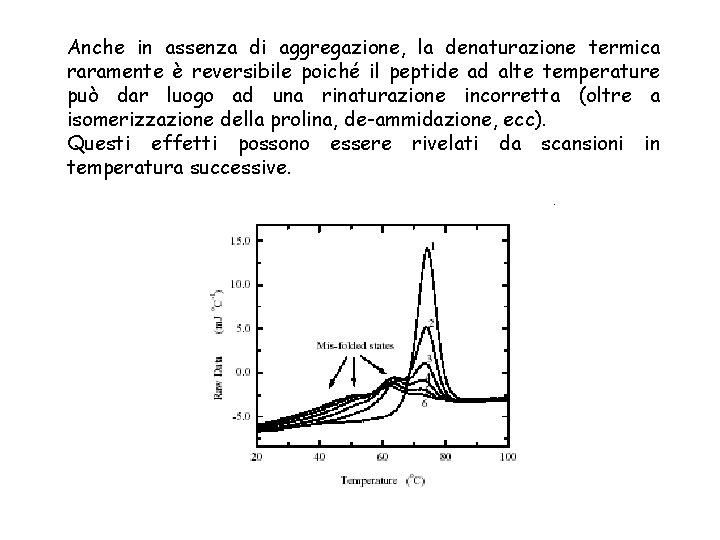
Anche in assenza di aggregazione, la denaturazione termica raramente è reversibile poiché il peptide ad alte temperature può dar luogo ad una rinaturazione incorretta (oltre a isomerizzazione della prolina, de-ammidazione, ecc). Questi effetti possono essere rivelati da scansioni in temperatura successive.

Quali sono i motivi per cui il H calorimetrico è diverso dal H van’t Hoff? Riprendendo anche le considerazioni già fatte: Se HCAL> HVH - la concentrazione della proteina è sottostimata - il processo non è a 2 stadi, ma coinvolge più stadi o domini proteici indipendenti - la conc della proteina è espressa in unità molari sbagliate (p. es. moli di dimero quando invece l’unità cooperativa è il monomero Se HCAL< HVH - la concentrazione della proteina è sovrastimata - la concentrazione della proteina è corretta, ma la proteina non è ripiegata correttamente - la conc della proteina è espressa in unità molari sbagliate (p. es. moli di dimero quando invece l’unità cooperativa è il monomero - il picco DSC è distorto artificialmente da effetti di aggregazione - la correzione della linea di base è sbagliata
 Calorimetria differenziale a scansione
Calorimetria differenziale a scansione Calorimetria ppt
Calorimetria ppt Dilatometro di gravesande
Dilatometro di gravesande Scansione assiale ecografia
Scansione assiale ecografia Calorimetria resumo
Calorimetria resumo Equazione calorimetria
Equazione calorimetria Legge fondamentale della termologia formula
Legge fondamentale della termologia formula Calorimetria esercizi
Calorimetria esercizi Medidas de temperatura
Medidas de temperatura Calorimetría directa ventajas y desventajas
Calorimetría directa ventajas y desventajas Calorimetria
Calorimetria Calorimetria e termometria
Calorimetria e termometria Calore specifico metallo
Calore specifico metallo Calorimetria diretta
Calorimetria diretta O que é quantidade de calor
O que é quantidade de calor Calorfica
Calorfica Analisi termica differenziale
Analisi termica differenziale Metodo di eulero equazioni differenziali
Metodo di eulero equazioni differenziali Differenziale angolo solido
Differenziale angolo solido Amplificatore a transimpedenza
Amplificatore a transimpedenza Cisti branchiale laterocervicale
Cisti branchiale laterocervicale Ecuații diferențiale
Ecuații diferențiale