TERMODIN MICA INTRODUO Um gs contido num cilindro








































- Slides: 63

TERMODIN MICA

INTRODUÇÃO Um gás, contido num cilindro provido de êmbolo, ao ser aquecido age com uma força F sobre o embolo, deslocando-o: d F O sistema recebe calor do meio exterior( ΔQ) e a força aplicada pelo sistema (gás) realiza trabalho (W) sobre o meio exterior. O trabalho, do mesmo modo que o calor, também se relaciona com transferência de energia. No entanto, o trabalho corresponde a trocas energéticas sem influência de diferenças de temperaturas e nisto se distingue do calor.

TRABALHO NUMA TRANSFORMAÇÃO GASOSA Considere um sistema gasoso que executa uma transformação isobárica, na qual o volume varia de V 1 para V 2: O trabalho pode ser obtido multiplicando a pressão do gás pela variação do seu volume: W = P. ΔV O trabalho é uma grandeza escalar que no SI é dado em joules (J).

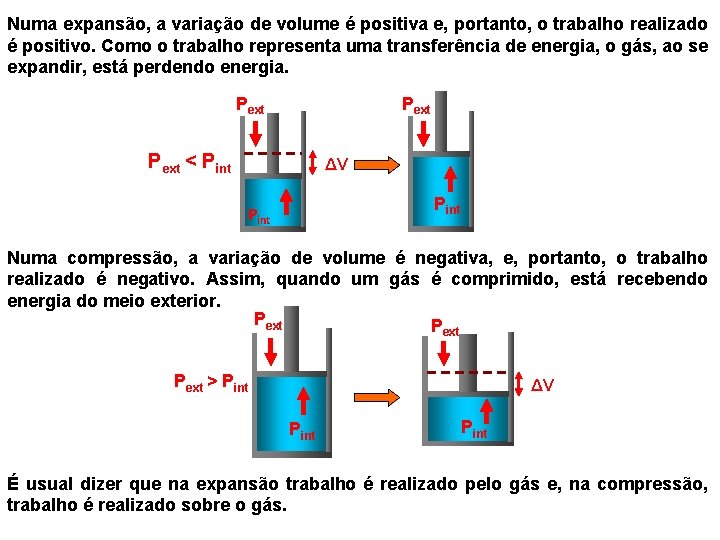
Numa expansão, a variação de volume é positiva e, portanto, o trabalho realizado é positivo. Como o trabalho representa uma transferência de energia, o gás, ao se expandir, está perdendo energia. Pext < Pint ΔV Pint Numa compressão, a variação de volume é negativa, e, portanto, o trabalho realizado é negativo. Assim, quando um gás é comprimido, está recebendo energia do meio exterior. Pext > Pint ΔV Pint É usual dizer que na expansão trabalho é realizado pelo gás e, na compressão, trabalho é realizado sobre o gás.

Representando essa transformação num diagrama da pressão em função do volume, esse produto P. ΔV ( que corresponde ao trabalho), é igual à área sob o gráfico pressão em função do volume: Pressão P Área = W Vinicial Vfinal Volume EXPANSÃO: W > 0 Pressão P Área = W Vfinal Vinicial Volume COMPRESSÃO: W < 0

Podemos generalizar e afirmar que para qualquer tipo de transformação, o trabalho realizado pelo sistema é igual à área delimitada entre a curva e o eixo horizontal do gráfico pressão em função do volume:

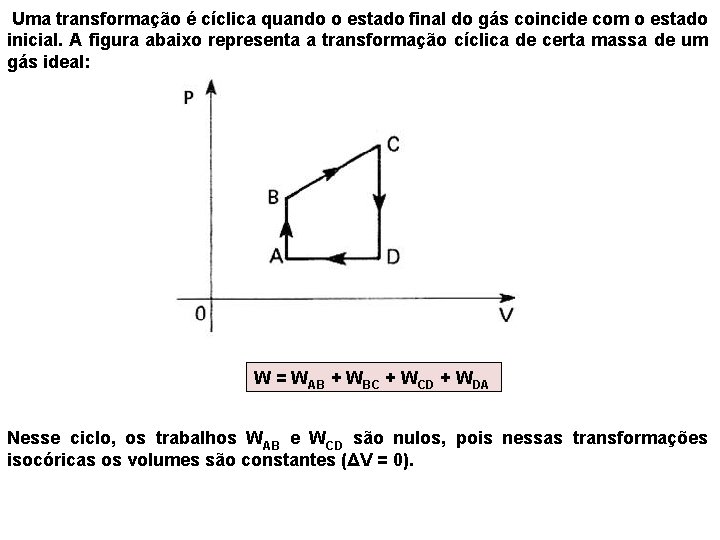
Uma transformação é cíclica quando o estado final do gás coincide com o estado inicial. A figura abaixo representa a transformação cíclica de certa massa de um gás ideal: W = WAB + WBC + WCD + WDA Nesse ciclo, os trabalhos WAB e WCD são nulos, pois nessas transformações isocóricas os volumes são constantes (ΔV = 0).

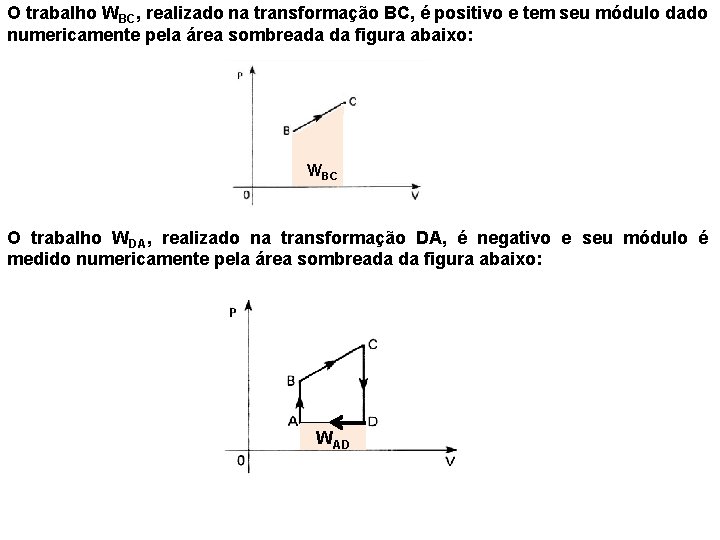
O trabalho WBC, realizado na transformação BC, é positivo e tem seu módulo dado numericamente pela área sombreada da figura abaixo: WBC O trabalho WDA, realizado na transformação DA, é negativo e seu módulo é medido numericamente pela área sombreada da figura abaixo: WAD

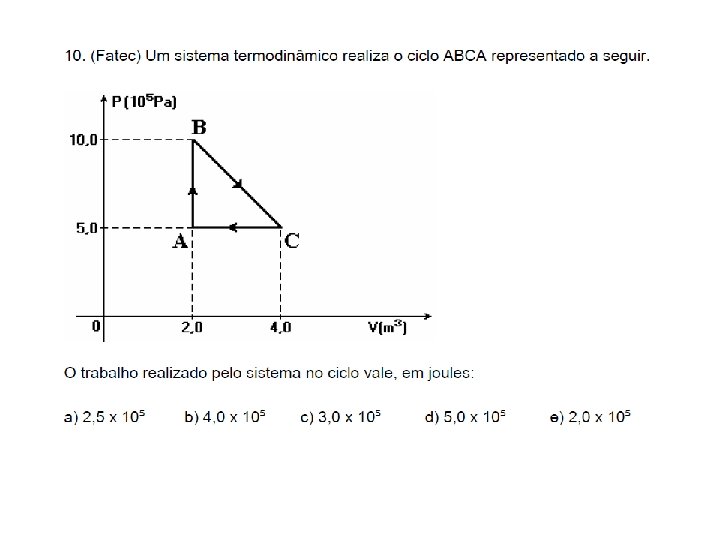
A comparação das duas áreas e, portanto, dos módulos dois trabalhos mostra que, na expansão BC, o gás realiza trabalho sobre o exterior maior que o trabalho realizado sobre o gás pelo exterior, na contração DA. Conseqüentemente, o trabalho resultante W é positivo, uma vez que o trabalho na expansão (positivo) tem módulo maior que o trabalho na compressão (negativo). O módulo desse trabalho é dado numericamente pela área interna do ciclo: W Se o ciclo for realizado no sentido horário, o trabalho realizado na expansão tem módulo maior que o trabalho realizado na contração. Em consequência, o trabalho resultante é positivo. O fato do trabalho resultante ser positivo significa que o gás, ao realizar o ciclo de transformações referido, está fornecendo energia mecânica para o meio ambiente.

Quando o gás realiza o ciclo no sentido anti-horário, o trabalho realizado na expansão AB tem módulo menor que o trabalho realizado na contração CD. Em conseqüência, o trabalho resultante, cujo módulo é dado pela área sombreada no gráfico é negativo ( W< 0). Portanto, o gás recebe energia mecânica do ambiente. W








ENERGIA INTERNA A energia interna ( U ) de um sistema é a soma de todos os tipos de energia (energia cinética média das moléculas, energia potencial de configuração, energias cinéticas de rotação das moléculas, dos movimentos das partículas elementares nos átomos, etc. ) possuída pelas partículas que compõem o sistema. A medição direta dessa energia não costuma ser realizada. Durante os processos termodinâmicos, pode ocorrer variação da energia interna ( ΔU) do gás. Verifica-se que só ocorre essa variação no caso de haver variação na temperatura do gás. A energia interna de determinada quantidade de gás ideal depende exclusivamente da temperatura: onde: n = número de moles R = constante universal dos gases ΔT = variação de temperatura.

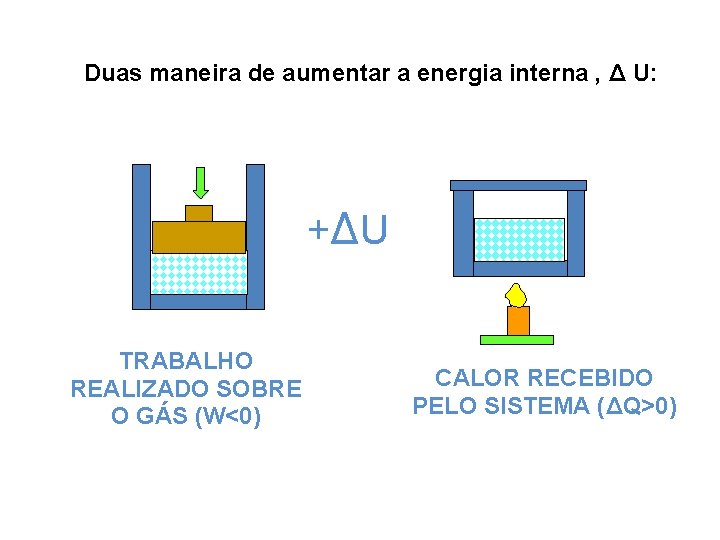
Duas maneira de aumentar a energia interna , Δ U: +ΔU TRABALHO REALIZADO SOBRE O GÁS (W<0) CALOR RECEBIDO PELO SISTEMA (ΔQ>0)

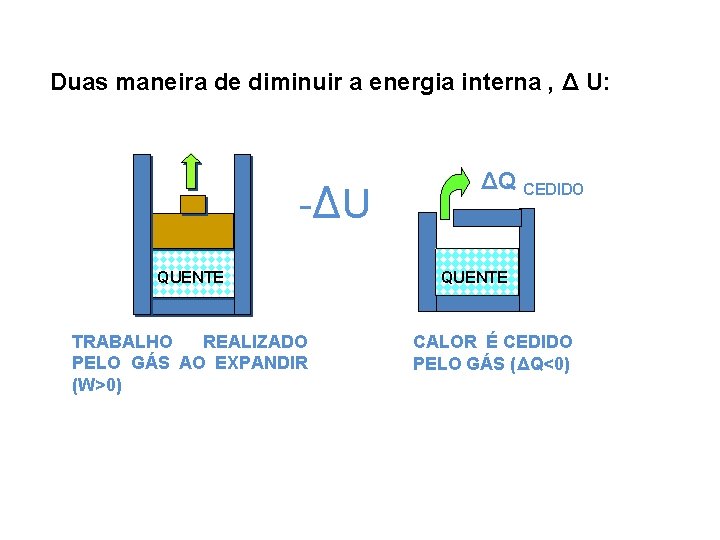
Duas maneira de diminuir a energia interna , Δ U: -Δ U QUENTE TRABALHO REALIZADO PELO GÁS AO EXPANDIR (W>0) ΔQ CEDIDO QUENTE CALOR É CEDIDO PELO GÁS (ΔQ<0)

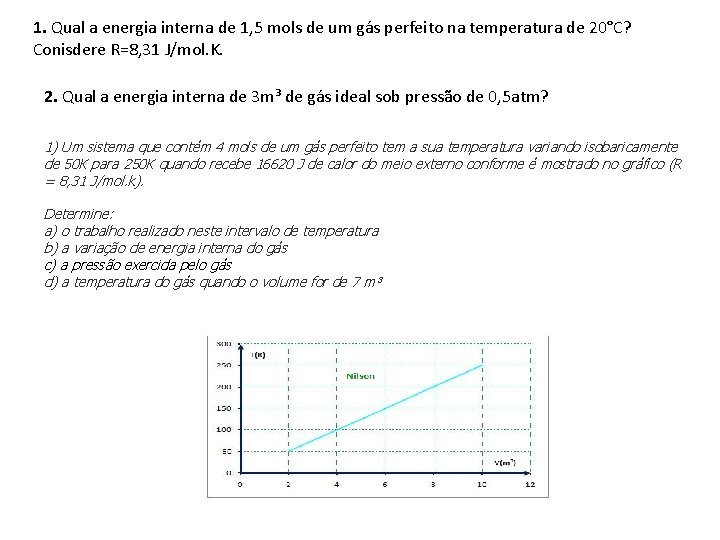
1. Qual a energia interna de 1, 5 mols de um gás perfeito na temperatura de 20°C? Conisdere R=8, 31 J/mol. K. 2. Qual a energia interna de 3 m³ de gás ideal sob pressão de 0, 5 atm? 1) Um sistema que contém 4 mols de um gás perfeito tem a sua temperatura variando isobaricamente de 50 K para 250 K quando recebe 16620 J de calor do meio externo conforme é mostrado no gráfico (R = 8, 31 J/mol. k). Determine: a) o trabalho realizado neste intervalo de temperatura b) a variação de energia interna do gás c) a pressão exercida pelo gás d) a temperatura do gás quando o volume for de 7 m³

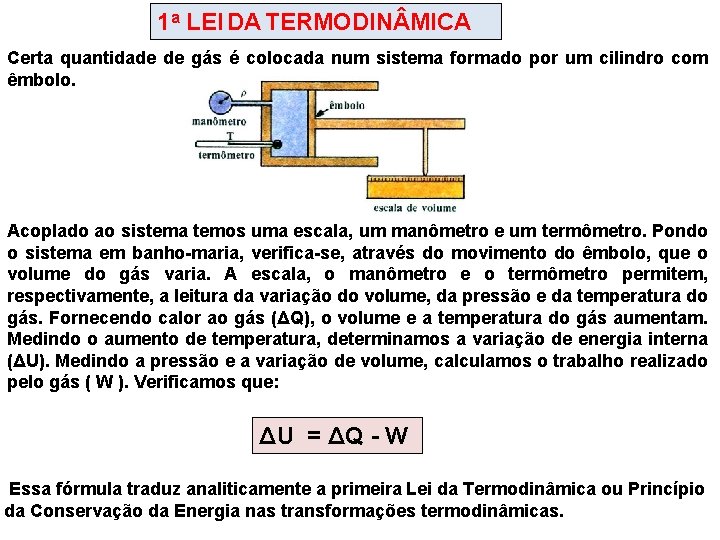
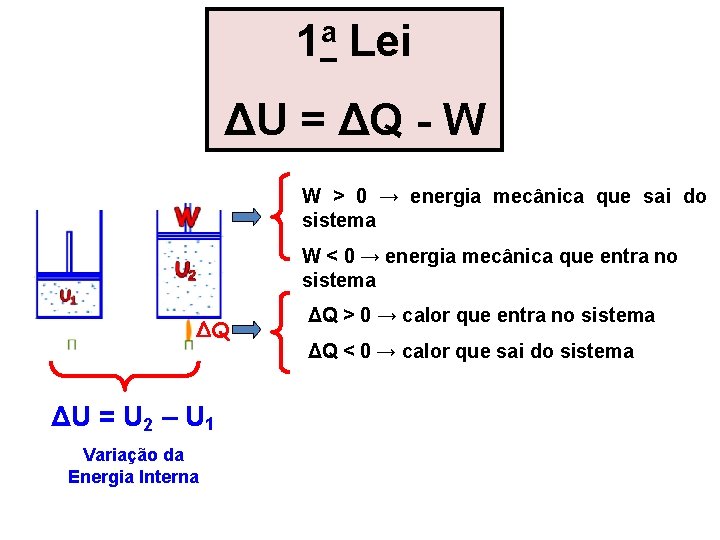
1 a LEI DA TERMODIN MICA Certa quantidade de gás é colocada num sistema formado por um cilindro com êmbolo. Acoplado ao sistema temos uma escala, um manômetro e um termômetro. Pondo o sistema em banho-maria, verifica-se, através do movimento do êmbolo, que o volume do gás varia. A escala, o manômetro e o termômetro permitem, respectivamente, a leitura da variação do volume, da pressão e da temperatura do gás. Fornecendo calor ao gás (ΔQ), o volume e a temperatura do gás aumentam. Medindo o aumento de temperatura, determinamos a variação de energia interna (ΔU). Medindo a pressão e a variação de volume, calculamos o trabalho realizado pelo gás ( W ). Verificamos que: ΔU = ΔQ - W Essa fórmula traduz analiticamente a primeira Lei da Termodinâmica ou Princípio da Conservação da Energia nas transformações termodinâmicas.

1 a Lei ΔU = ΔQ - W W > 0 → energia mecânica que sai do sistema W < 0 → energia mecânica que entra no sistema ΔQ ΔU = U 2 – U 1 Variação da Energia Interna ΔQ > 0 → calor que entra no sistema ΔQ < 0 → calor que sai do sistema

CASOS PARTICULARES a) TRANSFORMAÇÃO ISOBÁRICA PRESSÃO T 1 T 2 > T 1 Calor é fornecido ao gás, que aumentando sua temperatura apresenta um aumento na sua energia interna. Como o gás aumenta de volume, trabalho é realizado pelo gás. ISÓBARA P 2 = P 1 Podemos utilizar: VOLUME ΔQ W = P (V 2 - V 1) ΔU = ΔQ – W

Pressão B) TRANSFORMAÇÃO ISOTÉRMICA Isoterma T 1 = T 2 = T Isoterma: T 1 Volume ΔQ ΔT = 0 → ΔU = 0 ΔU = ΔQ – W ↓ 0 = ΔQ – W ↓ 2 ΔQ = W Todo calor fornecido ao gás é transformado em energia mecânica. Não sobra energia para variar a energia interna do gás. As transformações isotérmicas devem ser lentas, para que o gás troque calor na mesma medida que troca trabalho.

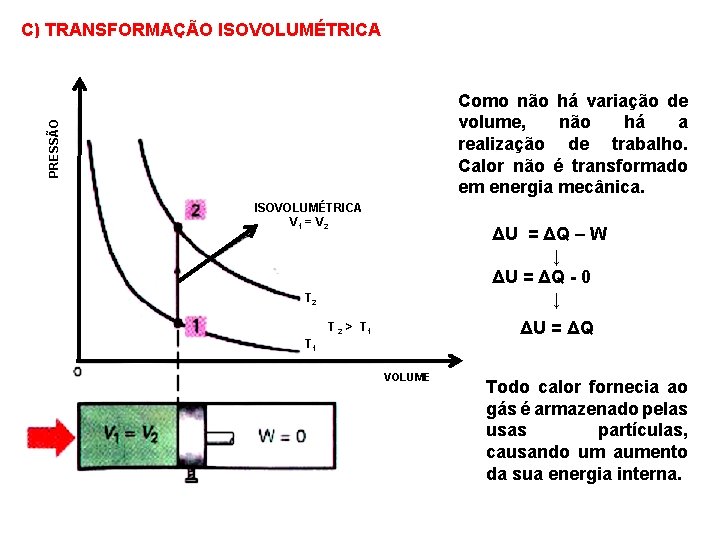
C) TRANSFORMAÇÃO ISOVOLUMÉTRICA PRESSÃO Como não há variação de volume, não há a realização de trabalho. Calor não é transformado em energia mecânica. ISOVOLUMÉTRICA V 1 = V 2 ΔU = ΔQ – W ↓ ΔU = ΔQ - 0 ↓ T 2 ΔU = ΔQ T 2 > T 1 VOLUME Todo calor fornecia ao gás é armazenado pelas usas partículas, causando um aumento da sua energia interna.

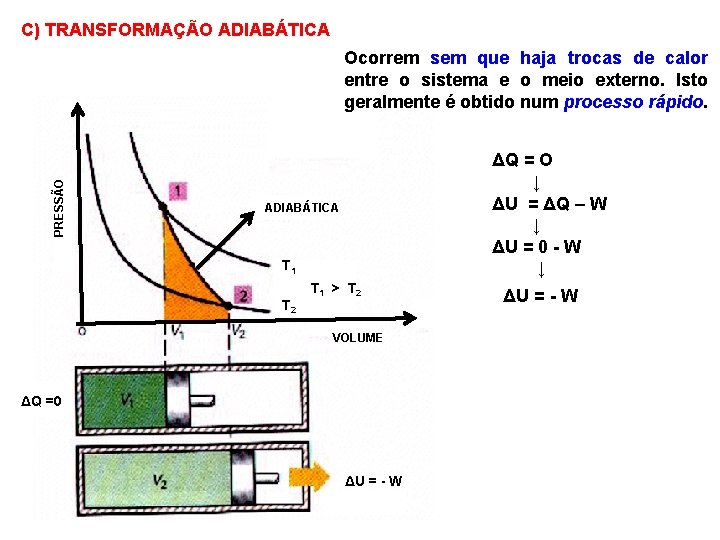
C) TRANSFORMAÇÃO ADIABÁTICA PRESSÃO Ocorrem sem que haja trocas de calor entre o sistema e o meio externo. Isto geralmente é obtido num processo rápido. ΔQ = O ↓ ΔU = ΔQ – W ↓ ΔU = 0 - W ↓ ADIABÁTICA T 1 T 2 T 1 > T 2 VOLUME ΔQ =0 ΔU = - W

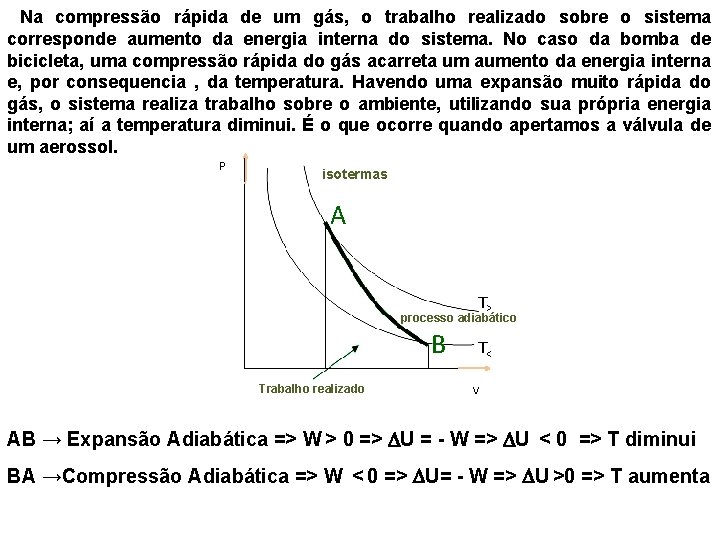
Na compressão rápida de um gás, o trabalho realizado sobre o sistema corresponde aumento da energia interna do sistema. No caso da bomba de bicicleta, uma compressão rápida do gás acarreta um aumento da energia interna e, por consequencia , da temperatura. Havendo uma expansão muito rápida do gás, o sistema realiza trabalho sobre o ambiente, utilizando sua própria energia interna; aí a temperatura diminui. É o que ocorre quando apertamos a válvula de um aerossol. isotermas A T> processo adiabático B T< Trabalho realizado AB → Expansão Adiabática => W > 0 => U = - W => U < 0 => T diminui BA →Compressão Adiabática => W < 0 => U= - W => U >0 => T aumenta






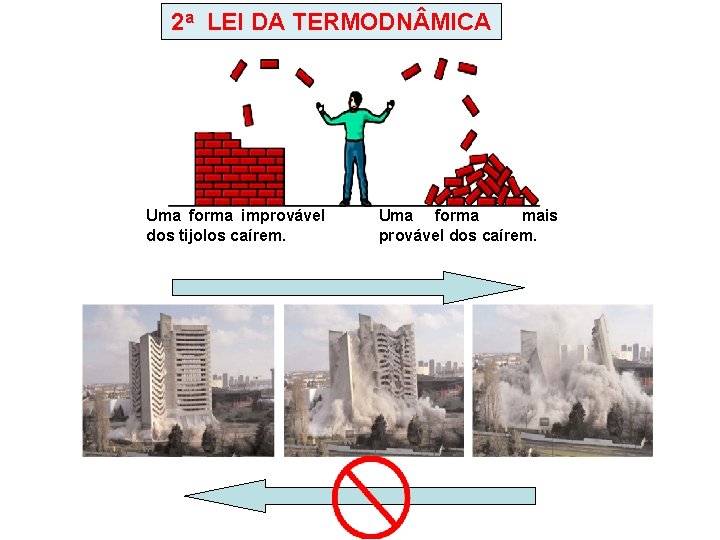
2 a LEI DA TERMODN MICA Uma forma improvável dos tijolos caírem. Uma forma mais provável dos caírem.

Algumas coisas não acontecem porque violam a conservação da energia. Porém, nem tudo que respeita a lei da conservação da energia pode acontecer! Falta uma lei que diga o que pode e o que não pode acontecer, que diga em que sentido energia prefere fluir. . . Algo que indique a seta do tempo!

A Primeira Lei da Termodinâmica reafirma a idéia da conservação da energia em todos os processos naturais, isto é, energia não é criada nem destruída nas transformações termodinâmicas. No entanto, essa primeira lei não diz a respeito da probabilidade ou possibilidade de ocorrência de determinado evento. A Segunda Lei da Termodinâmica tem um caráter estatístico, estabelecendo que os processos naturais apresentam um sentido preferencial de ocorrência, tendendo o sistema espontaneamente para um estado de equilíbrio. Na verdade, a segunda lei não estabelece, entre duas transformações possíveis que obedecem à primeira lei, qual que certamente acontece, mas sim qual a que tem maior probabilidade de acontecer. Na verdade a natureza apresenta um comportamento assimétrico. Observe os exemplos: 1 o) Se dois corpos em temperaturas diferentes forem colocados em contato, há passagem espontânea de calor do corpo de maior temperatura para o corpo de menor temperatura, tendendo par uma temperatura de equilíbrio. A passagem de calor em sentido contrário não é espontânea, exigindo, para que ela se realiza, uma intervenção externa com fornecimento adicional de energia. 2 o) As energias mecânica, elétrica, química, nuclear, etc. tendem a se degradar, espontaneamente e integralmente, em calor. No entanto, a conversão inversa, de calor em energia mecânica, por exemplo, é difícil e nunca integral. 3 o) Se uma gota de tinta for colocada num líquido, as partículas dessa gota se espalham espontaneamente, até que todo o líquido fique uniformemente tingido. Não é impossível, mas altamente improvável, que as moléculas da substância da tinta se reúnam de modo espontâneo para restaurar a gota original.

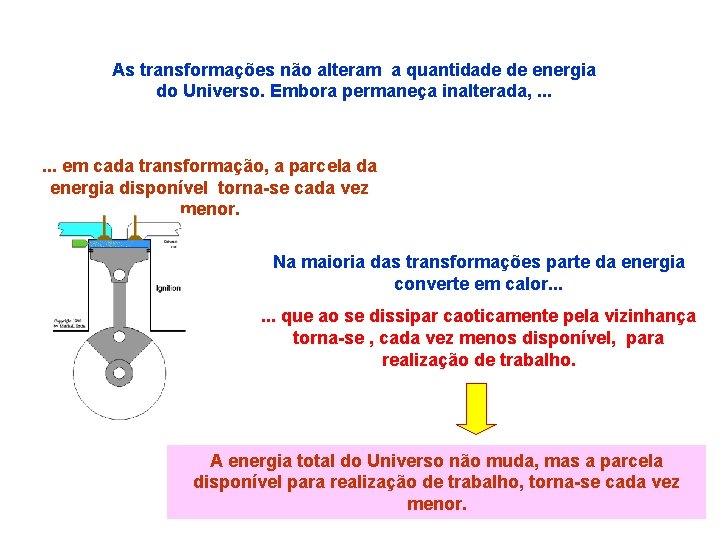
As transformações não alteram a quantidade de energia do Universo. Embora permaneça inalterada, . . . em cada transformação, a parcela da energia disponível torna-se cada vez menor. Na maioria das transformações parte da energia converte em calor. . . que ao se dissipar caoticamente pela vizinhança torna-se , cada vez menos disponível, para realização de trabalho. A energia total do Universo não muda, mas a parcela disponível para realização de trabalho, torna-se cada vez menor.

2ª Lei da Termodinâmica: É impossível construir uma máquina térmica que, trabalhando entre duas fontes térmicas, transforme integralmente calor em trabalho. Enunciado de Claussius da 2ª Lei O calor não flui espontaneamente da fonte fria para a fonte quente.

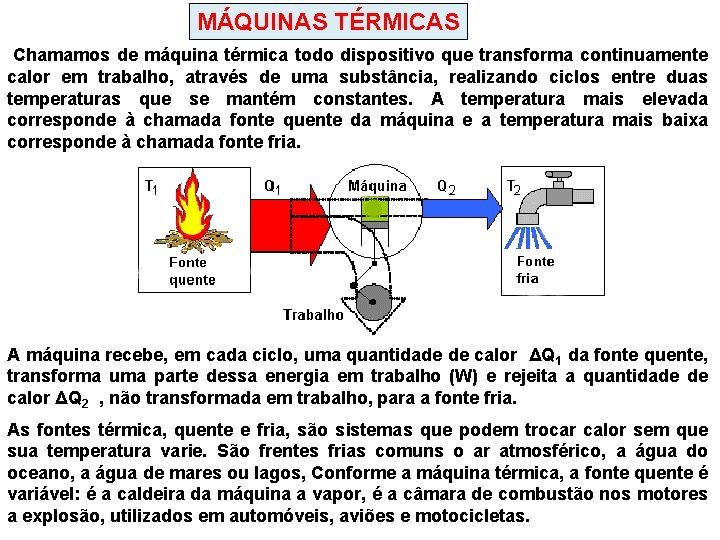
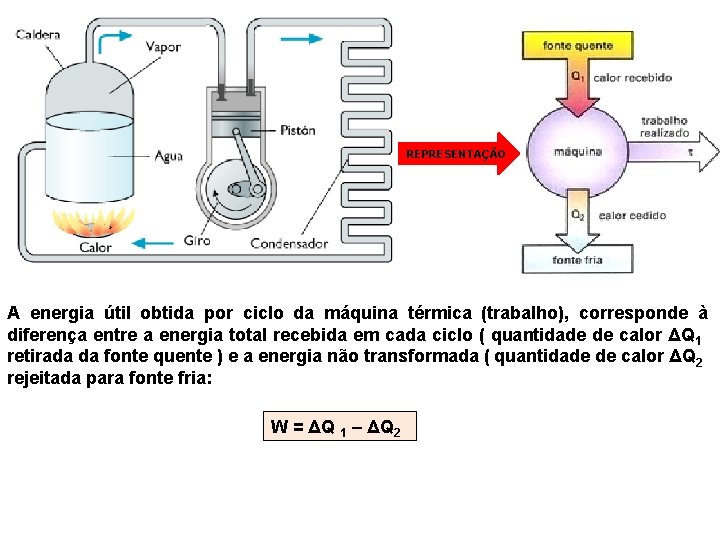
MÁQUINAS TÉRMICAS Chamamos de máquina térmica todo dispositivo que transforma continuamente calor em trabalho, através de uma substância, realizando ciclos entre duas temperaturas que se mantém constantes. A temperatura mais elevada corresponde à chamada fonte quente da máquina e a temperatura mais baixa corresponde à chamada fonte fria. A máquina recebe, em cada ciclo, uma quantidade de calor ΔQ 1 da fonte quente, transforma uma parte dessa energia em trabalho (W) e rejeita a quantidade de calor ΔQ 2 , não transformada em trabalho, para a fonte fria. As fontes térmica, quente e fria, são sistemas que podem trocar calor sem que sua temperatura varie. São frentes frias comuns o ar atmosférico, a água do oceano, a água de mares ou lagos, Conforme a máquina térmica, a fonte quente é variável: é a caldeira da máquina a vapor, é a câmara de combustão nos motores a explosão, utilizados em automóveis, aviões e motocicletas.

REPRESENTAÇÃO A energia útil obtida por ciclo da máquina térmica (trabalho), corresponde à diferença entre a energia total recebida em cada ciclo ( quantidade de calor ΔQ 1 retirada da fonte quente ) e a energia não transformada ( quantidade de calor ΔQ 2 rejeitada para fonte fria: W = ΔQ 1 – ΔQ 2

Podemos calcular o rendimento de uma máquina térmica se sabemos o quanto de trabalho ela produz (W) e o quanto de calor foi fornecido pela fonte quente (ΔQ 1): Nenhuma máquina térmica transforma todo calor retirado da fonte quente em energia mecânica. Sempre: ΔQ 1 < W. Logo, o rendimento de qualquer máquina térmica é menor que 1 (menor que 100%). Como Q = ΔQ 1 – ΔQ 2 , teremos: O rendimento de um motor a gasolina é de cerca de vinte por cento, quer dizer: por cada litro de gasolina queimada no motor, contendo uma energia calorífica de cerca de seis milhões de calorias, somente cerca de um milhão de calorias são utilizáveis para impulsionar o carro. Dos restantes oitenta por cento, cerca de três oitavos são absorvidos pelo sistema de arrefecimento e cinco oitavos perdidos como calor nos gases de escape e por atrito nos rolamentos.

MOTOR DE COMBUSTÃO INTERNA Quase todos os carros atualmente usam o que é chamado de ciclo de combustão de 4 tempos para converter a gasolina em movimento. Ele também é conhecido como ciclo Otto, em homenagem a Nikolaus Otto, que o inventou em 1867. Os 4 tempos são: 1 - Admissão 2 – Compressão 3 – Explosão e expansão 4 - Escapamento

10 Tempo – ADMISSÃO: O pistão desce enquanto aspira uma mistura gasosa de ar e combustível que pode ser gasolina, gás ou álcool, que entra no cilindro através da válvula de admissão (os motores a diesel admitem apenas ar). Durante esse tempo a válvula de escape permanece fechada para que a mistura não saia. A pressão máxima atingida é menor que 1 atmosfera, mantendo-se constante (processo isobárico) e a temperatura fica entre 340 e 400 K. 2 o Tempo: COMPRESSÃO: A válvula de admissão se fecha enquanto o pistão se move para cima, devido a inércia do virabrequim, comprimindo a mistura gasosa. Nesse tempo, além do aumento de pressão que fica entre 8 e 15 atm, há um aumento de temperatura que fica entre 600 e 750 K, porém é um processo adiabático, pois não há transferência de calor nem para fora nem para dentro da mistura.

3 o Tempo: EXPLOSÃO E EXPANSÃO: Quando ocorre a máxima compressão uma centelha elétrica na vela de ignição provoca uma explosão que causa um aumento de temperatura, de 2300 a 2700 K, nos gases resultantes e um aumento de pressão que fica entre 30 e 50 atm, no interior do cilindro, resultando na expansão da mistura gasosa. Também é um processo adiabático. 4 o Tempo: ESCAPAMENTO: No final da expansão a temperatura fica na faixa de 900 a 1100 K e a pressão fica na faixa de 4 a 6 atm. Abre-se então a válvula de escape e praticamente sem variar o volume, o gás que se encontra no interior do cilindro escapa para a atmosfera, reduzindo-se a pressão a 1 atm. A seguir, ainda com a válvula aberta, o pistão sobe, retomando o volume mínimo, expulsando quase todo o gás restante para a atmosfera. Assim se completou o ciclo, pois o volume e a pressão no interior do cilindro voltaram aos seus valores no início do 1 o tempo. Então, a válvula de admissão novamente se abre, reiniciando-se um novo ciclo.

v Há conservação de energia nesses motores. No quarto tempo a mistura gasosa é eliminada pelo escapamento com temperatura maior do que antes da explosão. Logo, parte do calor de combustão é transformado em energia interna dos gases, além da troca de calor que ocorre entre a carcaça do motor e o ambiente. A parte restante do calor de combustão é devida a energia de movimento do pistão. v No motor de combustão interna o trabalho (W) é realizado apenas no 3 o tempo, quando os gases empurram o pistão para baixo. Nos demais tempos o pistão se movimenta devido a inércia do sistema ligado ao virabrequim. v A 1 a Lei da termodinâmica também é obedecida. Uma parte da energia do combustível é utilizada na realização de trabalho e a outra parte é transferida ao meio ambiente, em cada ciclo, sendo necessário, a cada reinício, uma nova dose de combustível, ou seja, de energia. v O cálculo de rendimento para esses motores incluem as capacidades térmicas, pressão, volume, taxa de compressão, entre outros parâmetros. Para motores Otto, o rendimento real situa-se entre 22 a 30%, enquanto que para os motores Diesel situa-se na faixa de 30 a 38%. As perdas térmicas se devem aos gases que escapam a altas temperaturas, à troca de calor entre o motor e o meio ambiente feita pelo sistema de refrigeração e ao atrito entre as peças.

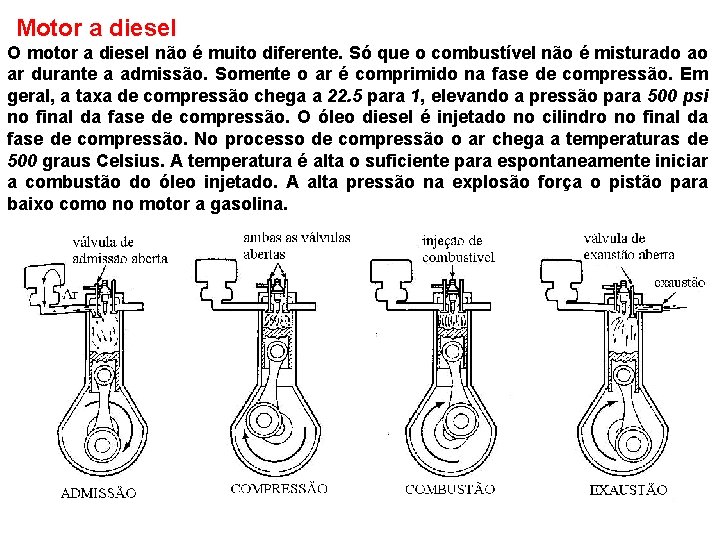
Motor a diesel O motor a diesel não é muito diferente. Só que o combustível não é misturado ao ar durante a admissão. Somente o ar é comprimido na fase de compressão. Em geral, a taxa de compressão chega a 22. 5 para 1, elevando a pressão para 500 psi no final da fase de compressão. O óleo diesel é injetado no cilindro no final da fase de compressão. No processo de compressão o ar chega a temperaturas de 500 graus Celsius. A temperatura é alta o suficiente para espontaneamente iniciar a combustão do óleo injetado. A alta pressão na explosão força o pistão para baixo como no motor a gasolina.

Motor de 2 tempos Nas motos o motor é, geralmente, de 2 tempos, pois ocorre apenas dois movimentos do pistão Mas também ocorrem a admissão, a compressão, a expansão e a exaustão. Esse motores, normalmente, não possuem válvulas e sim duas janelas laterais ( de admissão e de escape) que são abertas e fechadas pelo próprio pistão. A cada movimento do pistão, há uma explosão e os gases resultantes são expelidos pela janela de escape. O ciclo de dois tempos compõe-se de dois movimentos do êmbolo: um ascendente e outro descendente. No primeiro, o êmbolo cria uma depressão no cárter, admitindo a mistura ar/combustível. Essa mistura vem do carburador, entra pela janela de admissão e dirige-se para o cárter. Ao mesmo tempo o êmbolo comprime a mistura que está na câmara de combustão.

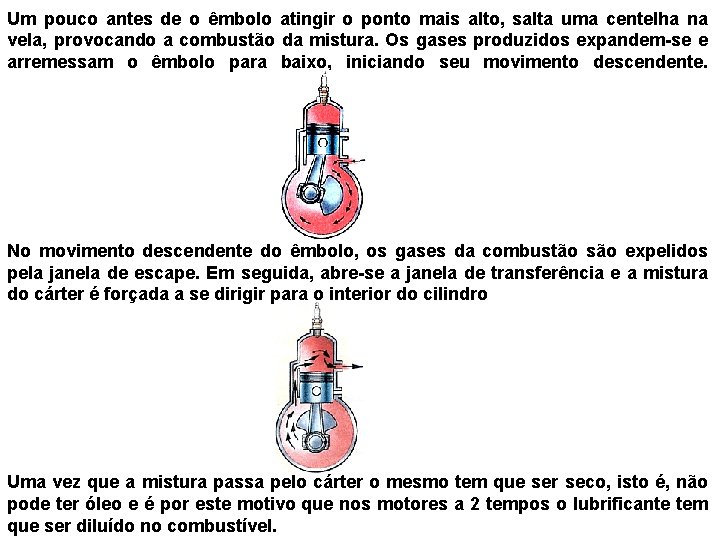
Um pouco antes de o êmbolo atingir o ponto mais alto, salta uma centelha na vela, provocando a combustão da mistura. Os gases produzidos expandem-se e arremessam o êmbolo para baixo, iniciando seu movimento descendente. No movimento descendente do êmbolo, os gases da combustão são expelidos pela janela de escape. Em seguida, abre-se a janela de transferência e a mistura do cárter é forçada a se dirigir para o interior do cilindro Uma vez que a mistura passa pelo cárter o mesmo tem que ser seco, isto é, não pode ter óleo e é por este motivo que nos motores a 2 tempos o lubrificante tem que ser diluído no combustível.

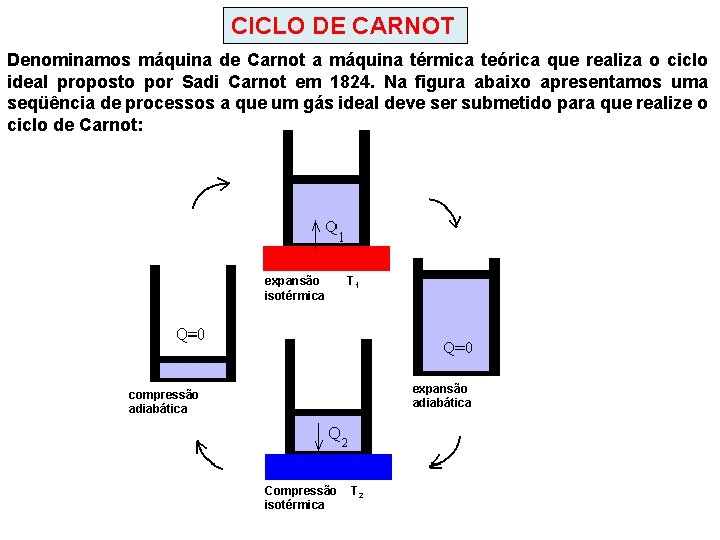
CICLO DE CARNOT Denominamos máquina de Carnot a máquina térmica teórica que realiza o ciclo ideal proposto por Sadi Carnot em 1824. Na figura abaixo apresentamos uma seqüência de processos a que um gás ideal deve ser submetido para que realize o ciclo de Carnot: expansão T 1 isotérmica c expansão c adiabática compressão adiabática c Compressão T 2 isotérmica c

V = volume p pressão T = temperatura W = trabalho compressão adiabática 4 → 1 compressão isotérmica 3 → 4 expansão isotérmica 1 → 2 expansão adiabática 2 → 3

1; AB: expansão isotérmica: o gás está em contato com um sistema de temperatura constante T 1 (fonte quente), recebendo dele uma quantidade de calor ΔQ 1; BC: expansão adiabática: o gás não recebe nem cede calor ao ambiente, sua temperatura diminui pois o gás realiza trabalho; CD: compressão isotérmica: o gás está em contato com um sistema de temperatura constante T 2 (fonte fria), cedendo a ele uma quantidade de calor ΔQ 2; DA: compressão adiabática: o gás não recebe nem cede calor ao ambiente, sua temperatura aumenta pois o trabalho é realizado sobre o gás; ΔQ 1 W ΔQ 2 T 1 V A B: B C: C D: D A: U = 0, W > 0 ΔQ = 0, W > 0 U = 0, W < 0 ΔQ = 0, W < 0

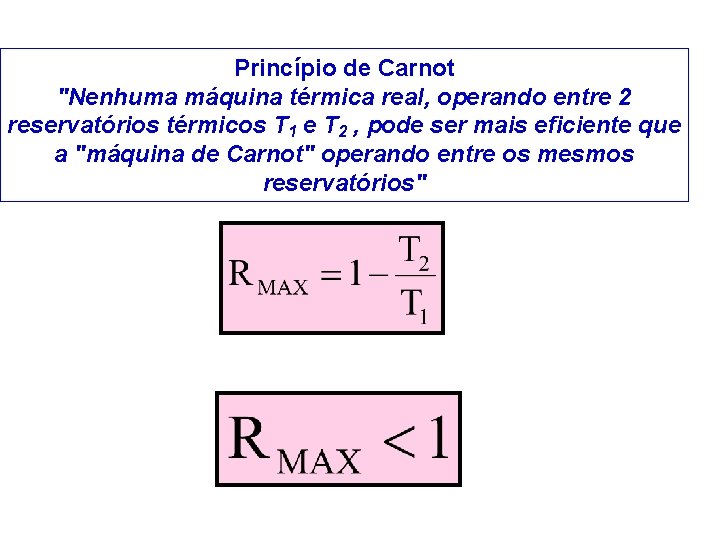
Princípio de Carnot "Nenhuma máquina térmica real, operando entre 2 reservatórios térmicos T 1 e T 2 , pode ser mais eficiente que a "máquina de Carnot" operando entre os mesmos reservatórios"

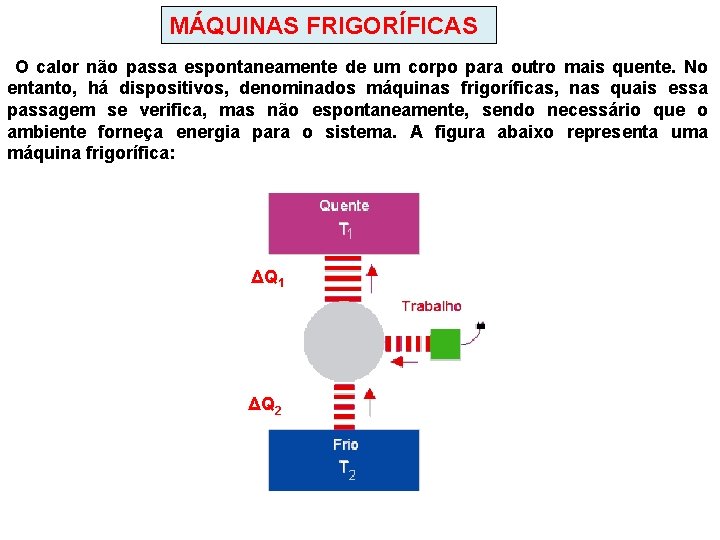
MÁQUINAS FRIGORÍFICAS O calor não passa espontaneamente de um corpo para outro mais quente. No entanto, há dispositivos, denominados máquinas frigoríficas, nas quais essa passagem se verifica, mas não espontaneamente, sendo necessário que o ambiente forneça energia para o sistema. A figura abaixo representa uma máquina frigorífica: ΔQ 1 ΔQ 2

Em cada ciclo é retirada uma quantidade de calor ΔQ 2 da fonte fria ( o congelador da geladeira) que, juntamente com o trabalho externo W (trabalho do compressor, nas geladeiras) é rejeitado para a fonte quente(ar atmosférico) ΔQ 2. Na máquinas frigoríficas ocorre conversão de trabalho em calor O rendimento de uma máquina frigorífica é dado pela relação entre a quantidade de calor ΔQ 2 retirada da fonte fria e o trabalho externo necessário para essa transferência:

GELADEIRA A dentro da geladeira B compressor C válvula de expansão Existem cinco partes básicas em qualquer geladeira: compressor, tubos para a troca de calor (serpentina ou conjunto de tubos fixados na parte de fora), válvula de expansão, tubos para troca de calor fixados na parte de dentro e fluido refrigerante. Muitas instalações industriais usam amônia pura como refrigerante. Amônia pura evapora a -32º C (27º F). O mecanismo básico de uma geladeira funciona assim: O compressor comprime o gás refrigerante. Isto eleva a pressão e temperatura do fluido refrigerante (laranja), de modo que as serpentinas externas de troca de calor da geladeira permitem que o fluido refrigerante dissipe o calor devido à pressurização; À medida que esfria, o fluido refrigerante se condensa em forma líquida (roxo) e flui pela válvula de expansão; Quando passa pela válvula de expansão, o líquido refrigerante se move da zona de alta pressão para a zona de baixa pressão, e se expande e evapora (azul claro); As serpentinas dentro da geladeira permitem que o fluido refrigerante absorva calor, fazendo com que a parte interna da geladeira fique fria. Então, o ciclo se repete.

AR CONDICIONADO Um ar condicionado é basicamente uma geladeira sem seu gabinete. Ele usa a evaporação de um fluido refrigerante para fornecer refrigeração. Os mecanismos do ciclo de refrigeração são os mesmos da geladeira e do ar condicionado. O termo Fréon é genericamente usado para qualquer dos vários fluorcarbonos não inflamáveis utilizados como refrigerantes e combustíveis nos aerossóis. A Válvula de expansão B Compressor 1 - O compressor comprime o gás frio, fazendo com que ele se torne gás quente de alta pressão (em vermelho no diagrama acima). 2 - Este gás quente corre através de um trocador de calor para dissipar o calor e se condensa para o estado líquido. 3 - O líquido escoa através de uma válvula de expansão e no processo ele vaporiza para se tornar gás frio de baixa pressão (em azul claro no diagrama acima). 4 - Este gás frio corre através de trocador de calor que permite que o gás absorva calor e esfrie o ar de dentro do prédio.

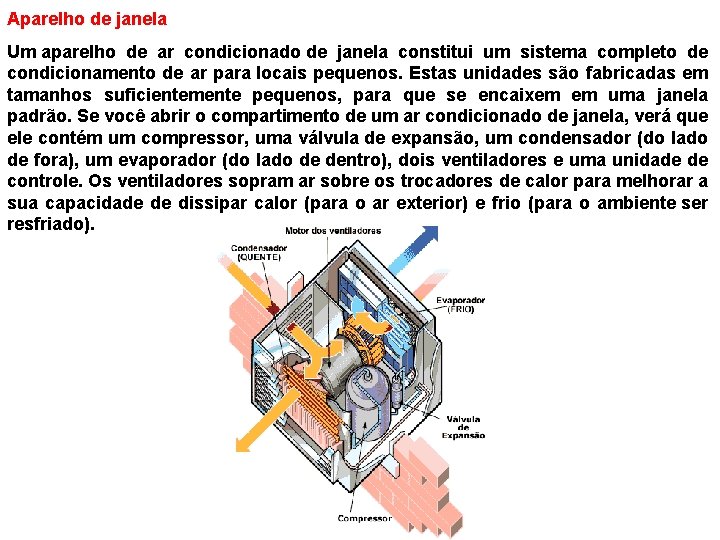
Aparelho de janela Um aparelho de ar condicionado de janela constitui um sistema completo de condicionamento de ar para locais pequenos. Estas unidades são fabricadas em tamanhos suficientemente pequenos, para que se encaixem em uma janela padrão. Se você abrir o compartimento de um ar condicionado de janela, verá que ele contém um compressor, uma válvula de expansão, um condensador (do lado de fora), um evaporador (do lado de dentro), dois ventiladores e uma unidade de controle. Os ventiladores sopram ar sobre os trocadores de calor para melhorar a sua capacidade de dissipar calor (para o ar exterior) e frio (para o ambiente ser resfriado).

A maioria dos condicionadores de ar têm a sua capacidade classificada em Unidade de Calor Britânica (BTU). De forma geral, uma BTU é a quantidade de calor necessária para aumentar a temperatura de 0, 45 kg de água em 0, 56º C. Especificamente, 1 BTU é igual a 1, 055 Joules. Em termos de aquecimento e refrigeração, uma tonelada de refrigeração equivale a 12 mil BTU. Um ar condicionado normal de janela pode ter uma capacidade de 10 mil BTU. Para comparação: uma casa de 185 m 2 pode ter um sistema de ar condicionado de 5 toneladas (60 mil BTU) de refrigeração, supondo que você precise de cerca de 300 BTU por m 2. A classificação da eficiência enérgica (EER) de um ar condicionado é a sua capacidade em BTU dividida pelo seu consumo. Se, por exemplo, um ar condicionado de 10 mil BTU consome 1. 200 watts, o seu EER é de 8, 3 (10 mil BTU/1. 200 watts). Obviamente, você vai querer que o EER seja o mais alto possível, mas normalmente um EER maior é acompanhado de um preço também maior.

1) Uma máquina térmica de Carnot recebe de uma fonte quente 1000 cal por ciclo. Sendo as temperaturas das fontes quente e fria, respectivamente, 127 °C e 427 °C, determinar a) o rendimento da máquina b) o trabalho, em joules, realizado pela máquina em cada ciclo c) a quantidade de calor, em joules, rejeitada para a fonte fria Usar como equivalência 1 cal = 4, 2 J 2) Qual o rendimento de uma máquina térmica que retira de uma fonte quente 200 cal e passa para uma fonte fria 50 cal. 3) O rendimento de uma máquina térmica de Carnot é de 25% e a fonte fria é a própria atmosfera a 27°C. Determinar a temperatura da fonte quente. 4) Uma máquina térmica recebe de uma fonte quente 100 cal e transfere para uma fonte fria 70 cal. Qual o rendimento desta máquina ?

1. Em uma máquina térmica são fornecidos 3 k. J de calor pela fonte quente para o início do ciclo e 780 J passam para a fonte fria. Qual o trabalho realizado pela máquina, se considerarmos que toda a energia que não é transformada em calor passa a realizar trabalho? 2. Qual o rendimento da máquina térmica do exercício anterior? 3. Uma máquina que opera em ciclo de Carnot tem a temperatura de sua fonte quente igual a 330°C e fonte fria à 10°C. Qual é o rendimento dessa máquina?

1. (G 1) Quando uma máquina recebe calor e transforma parte deste calor em trabalho útil, dizemos que essa máquina é um motor ou refrigerador? 2. (G 1) Quando uma máquina recebe trabalho e transforma este trabalho em calor, dizemos que essa máquina é um motor ou refrigerador? 3. (G 1) Se uma máquina térmica recebe da fonte quente 100 J de calor, realiza um trabalho de 80 J e rejeita para a fonte fria 30 J, qual lei termodinâmica está sendo desrespeitada? 4. (G 1) Se uma máquina térmica recebe da fonte quente 200 J de calor e realiza um trabalho de 200 J, qual lei da termodinâmica está sendo desrespeitada? 5. (G 1) O rendimento de uma máquina térmica é de 20%. Se em cada ciclo a máquina recebe da fonte quente 200 J de calor, qual o trabalho realizado por ela, por ciclo? 6. (G 1) Uma máquina recebe da fonte quente 1000 J por ciclo. Se em cada ciclo o trabalho realizado é de 200 J, qual a quantidade de calor que deve ser rejeitada para a fonte fria?

7. (Unicamp 2001) Com a instalação do gasoduto Brasil-Bolívia, a quota de participação do gás natural na geração de energia elétrica no Brasil será significativamente ampliada. Ao se queimar 1, 0 kg de gás natural obtém-se 5, 0× 10¨J de calor, parte do qual pode ser convertido em trabalho em uma usina termoelétrica. Considere uma usina queimando 7200 quilogramas de gás natural por hora, a uma temperatura de 1227°C. O calor não aproveitado na produção de trabalho é cedido para um rio de vazão 5000Ø/s, cujas águas estão inicialmente a 27°C. A maior eficiência teórica da conversão de calor em trabalho é dada por n = 1 - (Tmin/Tmáx), sendo T(min) e T(max) as temperaturas absolutas das fontes fria e quente respectivamente, ambas expressas em Kelvin. Considere o calor específico da água c = 4000 J/kg°C. a) Determine a potência gerada por uma usina cuja eficiência é metade da máxima teórica. b) Determine o aumento de temperatura da água do rio ao passar pela usina.

11. (Puccamp 99) A turbina de um avião tem rendimento de 80% do rendimento de uma máquina ideal de Carnot operando às mesmas temperaturas. Em vôo de cruzeiro, a turbina retira calor da fonte quente a 127°C e ejeta gases para a atmosfera que está a -33°C. O rendimento dessa turbina é de a) 80 % b) 64 % c) 50 % d) 40 % e) 32 %
 Volume cilindro oco
Volume cilindro oco Num = num + 1
Num = num + 1 ++
++ Num +1
Num +1 Mica plate auxin
Mica plate auxin Aspectos quantitativos das soluções
Aspectos quantitativos das soluções Test structura calculatorului online
Test structura calculatorului online The major advantage of a mica capacitor over other types is
The major advantage of a mica capacitor over other types is Mica
Mica Mica splitting test room
Mica splitting test room Liceul tehnologic nicolae teclu copsa mica
Liceul tehnologic nicolae teclu copsa mica Stema mica unire
Stema mica unire Mica village
Mica village Mica mote
Mica mote Mica hardness
Mica hardness Dibujos sobre el agua
Dibujos sobre el agua Activitati integrate grupa mare
Activitati integrate grupa mare Tabela de solubilidade de sais
Tabela de solubilidade de sais Farul din alexandria aflat pe o insulă mică numită
Farul din alexandria aflat pe o insulă mică numită Mica viotti
Mica viotti La mia prof
La mia prof Hawthorne studies
Hawthorne studies Cilindro superficie laterale
Cilindro superficie laterale Sobre o sistema
Sobre o sistema 6 caras iguales 12 aristas y 8 vértices
6 caras iguales 12 aristas y 8 vértices Propagação de incerteza
Propagação de incerteza Proiezioni ortogonali di gruppi di solidi geometrici
Proiezioni ortogonali di gruppi di solidi geometrici Dinamica de sistemas
Dinamica de sistemas Solidi
Solidi Volume de um cilindro oco
Volume de um cilindro oco Cilindro
Cilindro Inercia
Inercia Muelle percutor
Muelle percutor Campo electrico de un cilindro
Campo electrico de un cilindro Il cilindro
Il cilindro Objetos que tengan forma de cono
Objetos que tengan forma de cono Tronco de cilindro
Tronco de cilindro Volume dei liquidi
Volume dei liquidi Cilindros uratos amorfos
Cilindros uratos amorfos O capim elefante é uma designação
O capim elefante é uma designação Hiperboloide parabolico
Hiperboloide parabolico Directriz de un cilindro
Directriz de un cilindro Formula del volumen de un cilindro
Formula del volumen de un cilindro Cilindro de simple efecto
Cilindro de simple efecto Como calcular el area lateral de un cilindro
Como calcular el area lateral de un cilindro Area total do cilindro
Area total do cilindro Cilindro de ciro
Cilindro de ciro Hiperboloide de dos hojas
Hiperboloide de dos hojas Teoria overflow edema
Teoria overflow edema Ufersa tem peso
Ufersa tem peso Que es un cilindro en un disco duro
Que es un cilindro en un disco duro Hiperoxia
Hiperoxia Disegno tecnico
Disegno tecnico Tre asticelle identiche di lunghezza l=50 cm
Tre asticelle identiche di lunghezza l=50 cm Volume di un cilindro
Volume di un cilindro Planificação de um prisma pentagonal
Planificação de um prisma pentagonal Tipler
Tipler Que es un cilindro
Que es un cilindro Na inspeção de cilindro hidráulicos de vemos observar:
Na inspeção de cilindro hidráulicos de vemos observar: Cilindro obliquo
Cilindro obliquo Cone geometria descritiva
Cone geometria descritiva Area cilindro circular recto
Area cilindro circular recto Aceleracion angular
Aceleracion angular Tabella quadriche
Tabella quadriche