TERMODIN MICA Termodinmica a cincia que trata do
















- Slides: 28

TERMODIN MICA

Termodinâmica é a ciência que trata • do calor e do trabalho • das características dos sistemas e • das propriedades dos fluidos termodinâmicos

Alguns ilustres pesquisadores que construíram a termodinâmica James Joule 1818 - 1889 Sadi Carnot 1796 - 1832 Emile Claupeyron 1799 - 1864 Wiliam Thomson Lord Kelvin 1824 - 1907 Rudolf Clausius 1822 - 1888

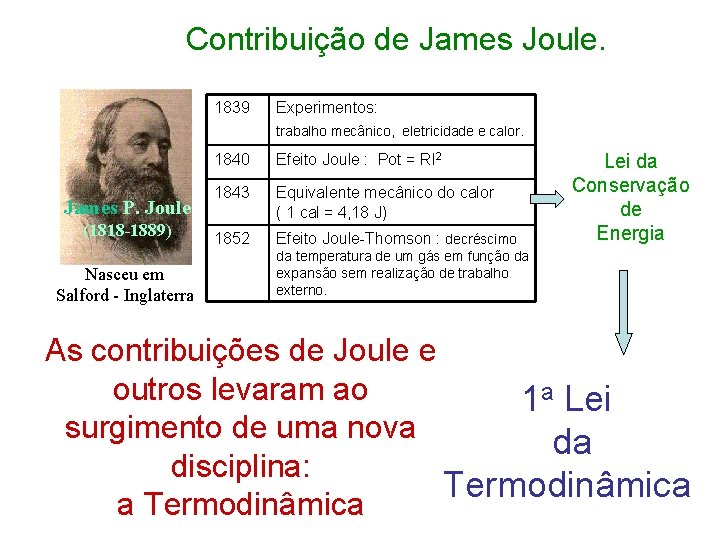
Contribuição de James Joule. 1839 Experimentos: trabalho mecânico, eletricidade e calor. James P. Joule (1818 -1889) Nasceu em Salford - Inglaterra 1840 Efeito Joule : Pot = RI 2 1843 Equivalente mecânico do calor ( 1 cal = 4, 18 J) 1852 Efeito Joule-Thomson : decréscimo Lei da Conservação de Energia da temperatura de um gás em função da expansão sem realização de trabalho externo. As contribuições de Joule e outros levaram ao 1 a Lei surgimento de uma nova da disciplina: Termodinâmica a Termodinâmica


Para entender melhor a 1 a Lei de Termodinâmica é preciso compreender as características dos sistemas termodinâmicos e os caminhos “percorridos” pelo calor. . .

Sistema Termodinâmico Certa massa delimitada por uma fronteira. Vizinhança do sistema. O que fica fora da fronteira Sistema isolado Sistema fechado Sistema que não troca energia nem massa com a sua vizinhança. Sistema que não troca massa com a vizinhança, mas permite passagem de calor e trabalho por sua fronteira.

Transformação Variáveis de estado P 1 V 1 T 1 U 1 Estado 1 P 2 V 2 T 2 U 2 Transformação Estado 2

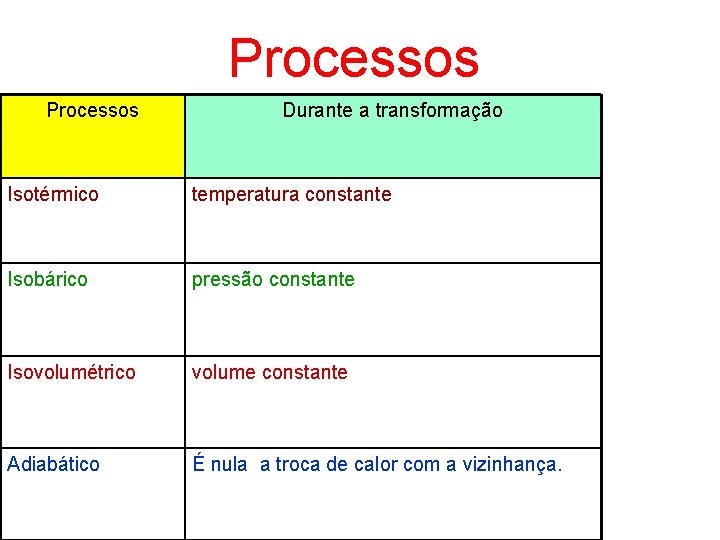
Processos Durante a transformação Isotérmico temperatura constante Isobárico pressão constante Isovolumétrico volume constante Adiabático É nula a troca de calor com a vizinhança.

Transformações 1 a Lei da Termodinâmica Sistema Fechado τ τ > 0 → energia que sai do sistema τ < 0 → energia que entra no sistema Q > 0 → calor que entra no sistema Q < 0 → calor que sai do sistema ΔU = U 2 – U 1 Variação Energia Interna 1 a Lei Q = τ + ΔU

Variação da Energia Interna ∆U = Q - τ Gás Expansão nula τ=0 ΔT = 0 → ΔU = 0 ΔT > 0 → ΔU > 0 ΔT < 0 → ΔU < 0 ΔU depende apenas de ΔT. Como U é uma variável de estado, ΔU não depende do processo. A energia interna de um gás é função apenas da temperatura absoluta T.

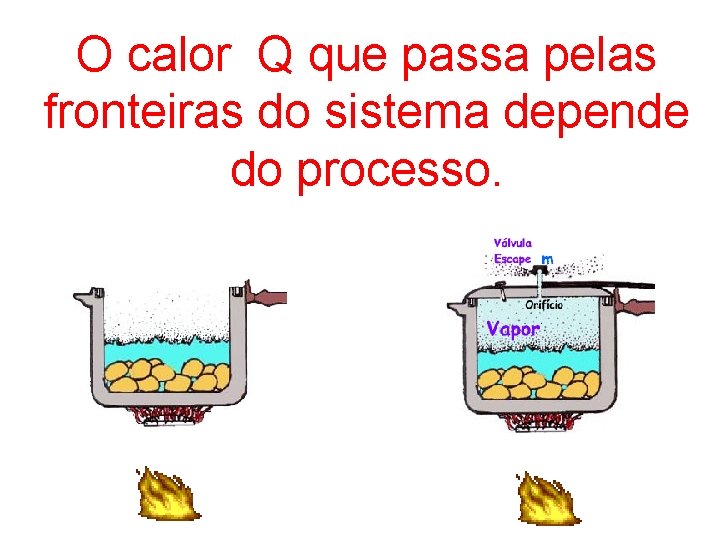
O calor Q que passa pelas fronteiras do sistema depende do processo.

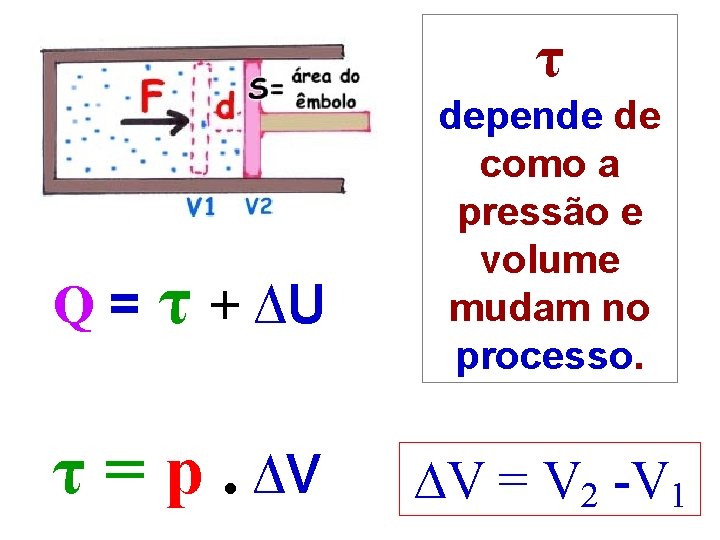
τ Q= τ + ∆U τ = p. ∆V depende de como a pressão e volume mudam no processo. ∆V = V 2 -V 1

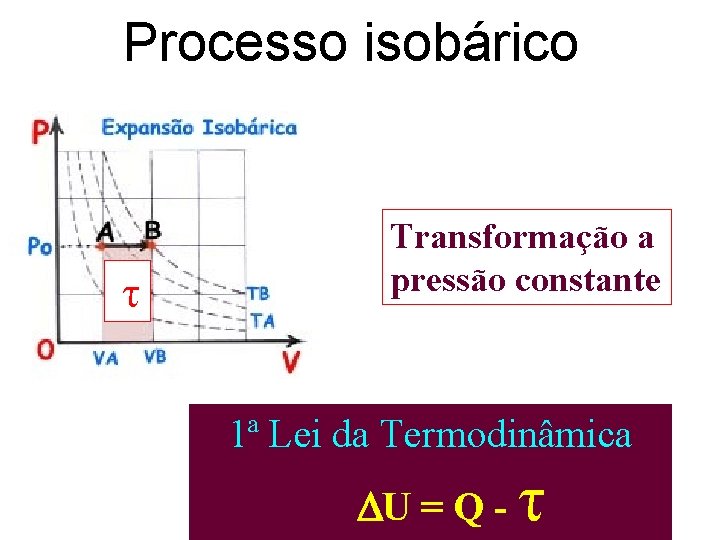
Processo isobárico τ Transformação a pressão constante 1ª Lei da Termodinâmica U = Q - τ

Processo isovolumétrico Transformação a volume constante ∆V = 0 τ = 0 1ª Lei da Termodinâmica U = Q

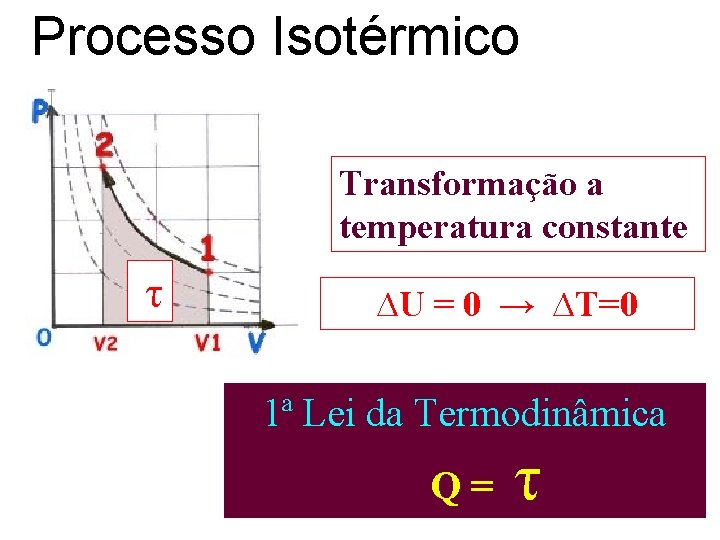
Processo Isotérmico Transformação a temperatura constante τ ∆U = 0 → ∆T=0 1ª Lei da Termodinâmica Q= τ

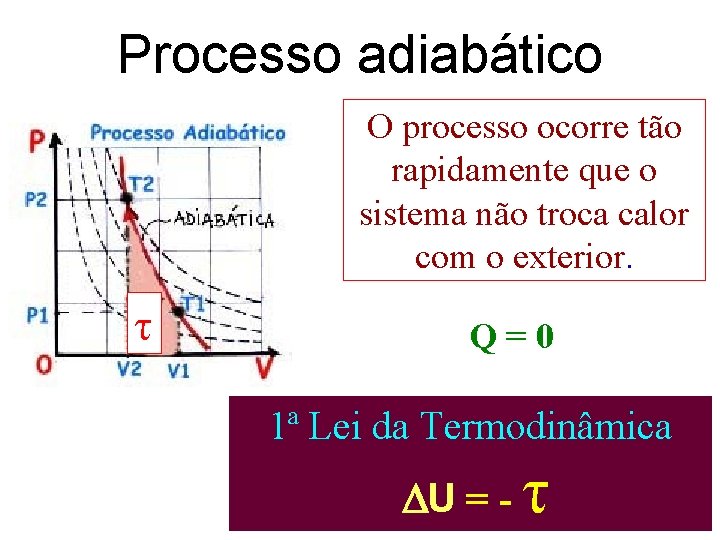
Processo adiabático O processo ocorre tão rapidamente que o sistema não troca calor com o exterior. τ Q=0 1ª Lei da Termodinâmica U = - τ

Máquinas Térmicas “Trabalham” em ciclos.

A máquina de Denis Papin 1647 - 1712 Trabalho Para onde a máquina rejeita calor QCold Fonte quente Fonte fria De onde a máquina retira calor QHot. Ciclo

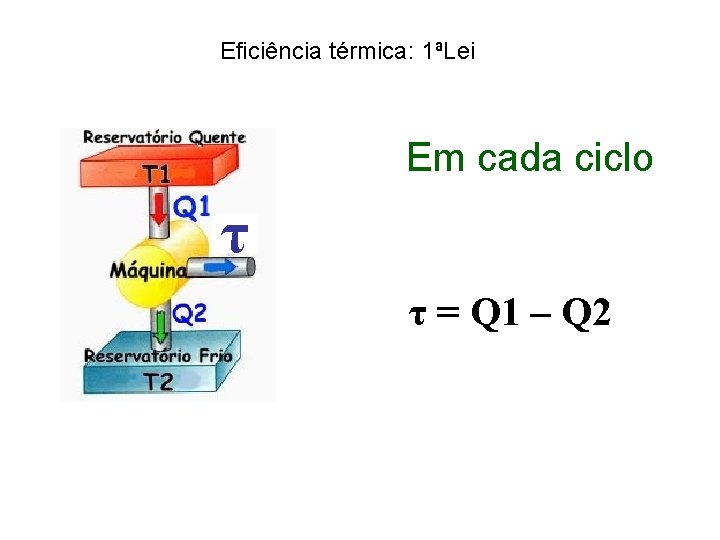
Eficiência térmica: 1ªLei Em cada ciclo τ τ = Q 1 – Q 2

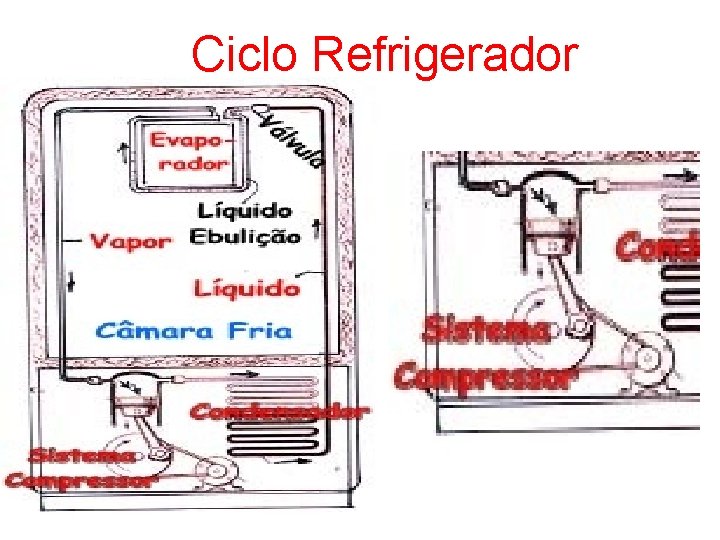
Ciclo Refrigerador


Quando expandimos um gás, sua pressão diminui, assim como sua temperatura. Por um cano fino que passa pelo interior da geladeira, um gás É solto e se expande a baixa pressão. Nessa expansão, a temperatura do gás diminui. Com isso, o gás retira calor do ambiente que está a sua volta, ou seja, do interior da geladeira.

Um compressor que está na geladeira comprime o gás (freon, em geral) que se encontra numa câmara. Atrás da geladeira existe outro cano, fino e comprido, por onde o gás sai do interior da geladeira. Ele libera o calor para a atmosfera, para novamente repetir o processo.

1) ADMISSÃO A válvula de admissão se abre, a mistura de ar+combustível entra no cilindro enquanto o pistão (ou êmbolo) desce. 3) EXPLOSÃO A vela de ignição dispara uma centelha elétrica provocando a combustão rápida (explosão) da mistura ar+combustível. Essa explosão gera calor e a conseqüente expansão dos gases dentro do cilindro, empurrando para baixo o pistão. Note que, dos quatro tempos, esse é o tempo em que há realização de trabalho feito pelo gás. 2) COMPRESSÃO A válvula de admissão se fecha, o pistão sobe, comprimindo no alto do cilindro a mistura ar+combustível. Como essa é uma compressão muito rápida, não há tempo de haver troca de calor entre a mistura combustível e o ambiente, isto é, trata-se de uma compressão adiabática e por causa disso, a temperatura da mistura aumenta. 4) DESCARGA (OU EXAUSTÃO) A válvula de descarga se abre enquanto o pistão sobe empurrando o gás queimado (fumaça) para fora do cilindro.

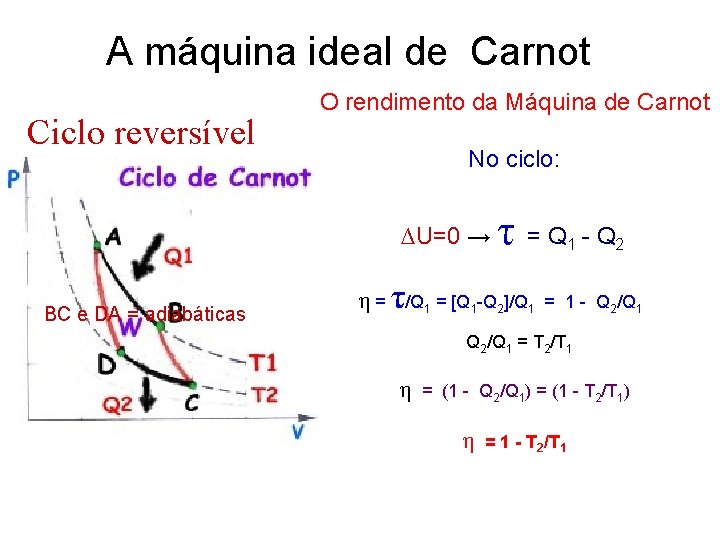
A máquina ideal de Carnot Ciclo reversível O rendimento da Máquina de Carnot No ciclo: τ ∆U=0 → = Q 1 - Q 2 BC e DA = adiabáticas τ η = /Q 1 = [Q 1 -Q 2]/Q 1 = 1 - Q 2/Q 1 = T 2/T 1 η = (1 - Q 2/Q 1) = (1 - T 2/T 1) η = 1 - T 2/T 1

Princípio de Carnot "Nenhuma máquina térmica real, operando entre 2 reservatórios térmicos T 1 e T 2 , pode ser mais eficiente que a "máquina de Carnot" operando entre os mesmos reservatórios"

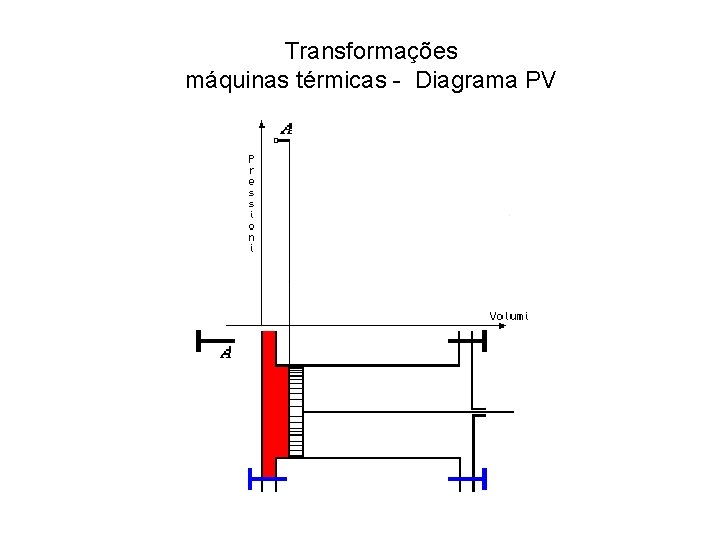
Transformações máquinas térmicas - Diagrama PV
 A cincia
A cincia ¿de qué crees que tratará el texto?
¿de qué crees que tratará el texto? Termodinmica
Termodinmica Equilibrio termodinamico
Equilibrio termodinamico Calor y trabajo
Calor y trabajo Variables que afectan el comportamiento de los gases
Variables que afectan el comportamiento de los gases Equilíbrio termico exemplo
Equilíbrio termico exemplo Termodinâmica
Termodinâmica 1 lei da termodinamica
1 lei da termodinamica Termodinmica
Termodinmica Termodinmica
Termodinmica Termodinmica
Termodinmica Termodinmica
Termodinmica Ejemplo sistema adiabatico
Ejemplo sistema adiabatico Oat coleoptile
Oat coleoptile Mica splitting test room
Mica splitting test room Mica mineral hardness
Mica mineral hardness Mica viotti
Mica viotti Cea mai mica unitate de masura a informatiei
Cea mai mica unitate de masura a informatiei Stema mica unire
Stema mica unire Activitate integrata animale salbatice prescolari
Activitate integrata animale salbatice prescolari Relay assembly experiment
Relay assembly experiment Luster
Luster Mica mote
Mica mote Cele 7 minuni ale lumii gradinile suspendate
Cele 7 minuni ale lumii gradinile suspendate The major advantage of a mica capacitor over other types is
The major advantage of a mica capacitor over other types is Mica village
Mica village Sais insoluveis
Sais insoluveis Concentração comum
Concentração comum