FSICA Captulo 1 Estudo dos gases Captulo 2









- Slides: 19

FÍSICA Capítulo 1: Estudo dos gases Capítulo 2: Equação de um gás ideal X SAIR

Capítulo 1 Estudo dos gases X SAIR MARTIN F. CHILLMAID/SCIENCE PHOTO LIBRARY/LATINSTOCK

1 Estudo dos gases JOSÉ GIL/SHUTTERSTOCK COREL/CID O estado gasoso X SAIR

O estado gasoso Variáveis de estado Pressão (p) Volume (V) Temperatura (T) A transformação gasosa ocorre quando pelo menos uma das variáveis de estado se modifica. 1 Estudo dos gases X SAIR

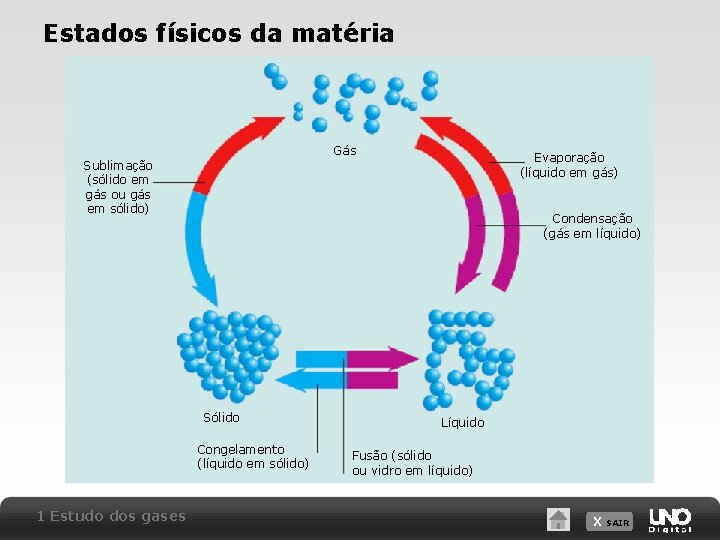
Estados físicos da matéria Gás Evaporação (líquido em gás) Sublimação (sólido em gás ou gás em sólido) Condensação (gás em líquido) Sólido Congelamento (líquido em sólido) 1 Estudo dos gases Líquido Fusão (sólido ou vidro em líquido) X SAIR

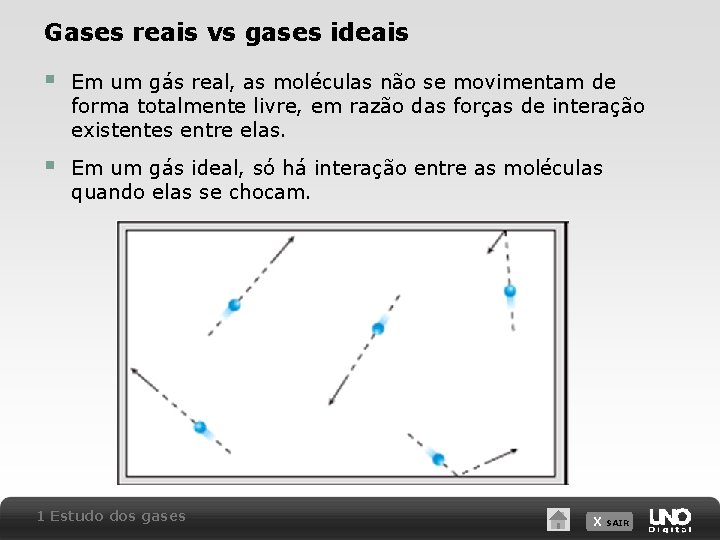
Gases reais vs gases ideais § Em um gás real, as moléculas não se movimentam de forma totalmente livre, em razão das forças de interação existentes entre elas. § Em um gás ideal, só há interação entre as moléculas quando elas se chocam. 1 Estudo dos gases X SAIR

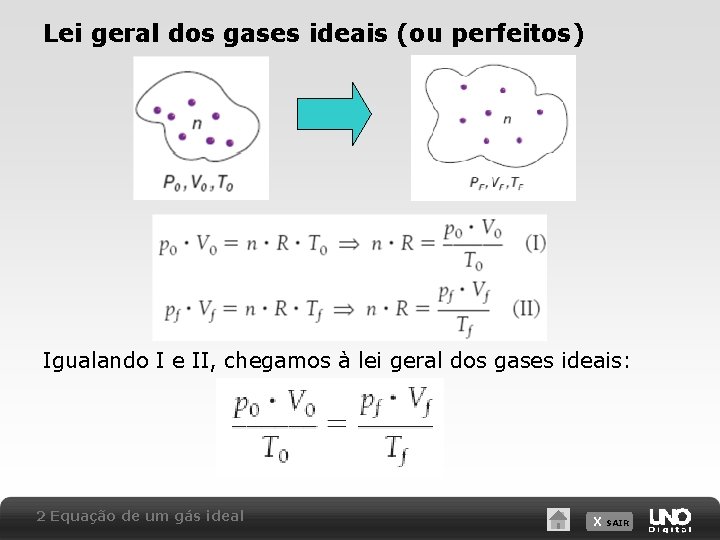
Lei geral dos gases ideais (ou perfeitos) Igualando I e II, chegamos à lei geral dos gases ideais: 2 Equação de um gás ideal X SAIR

Transformações gasosas § Isotérmicas: a temperatura do sistema permanece constante. § Isobáricas: a pressão é mantida constante. § Isovolumétricas (isométricas ou isocóricas): o volume permanece constante. 1 Estudo dos gases X SAIR

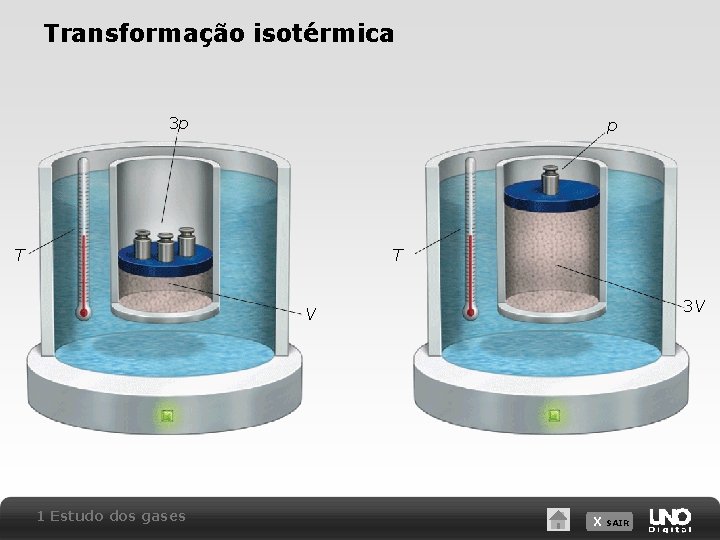
Transformação isotérmica DORLING KINDERSLEY/GETTY IMAGES Lei de Boyle: a pressão exercida por um gás ideal é inversamente proporcional ao seu volume. p V = constante Considerando o estado inicial A e final B de um gás ideal sofrendo uma transformação isotérmica, temos: p. A V A = p. B V B 1 Estudo dos gases X SAIR

Transformação isotérmica 3 p p T T 3 V V 1 Estudo dos gases X SAIR

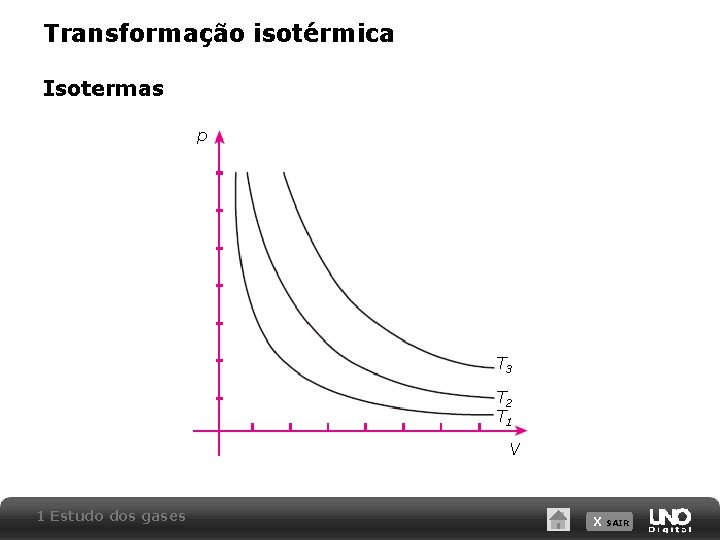
Transformação isotérmica Isotermas p T 3 T 2 T 1 V 1 Estudo dos gases X SAIR

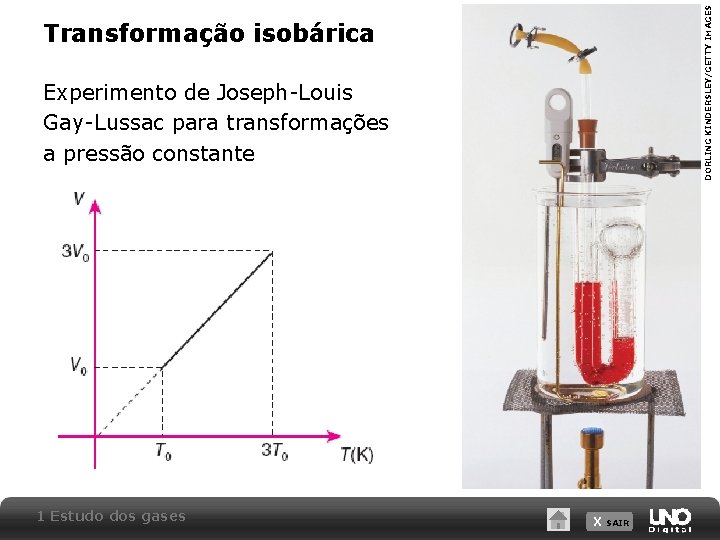
DORLING KINDERSLEY/GETTY IMAGES Transformação isobárica Experimento de Joseph-Louis Gay-Lussac para transformações a pressão constante 1 Estudo dos gases X SAIR

Transformação isobárica Lei de Charles e Gay-Lussac: o volume ocupado por um gás é diretamente proporcional a sua temperatura absoluta (em kelvins). V=k T (k = constante) Considerando o estado inicial A e final B de um gás ideal sofrendo uma transformação isobárica, temos: 1 Estudo dos gases X SAIR

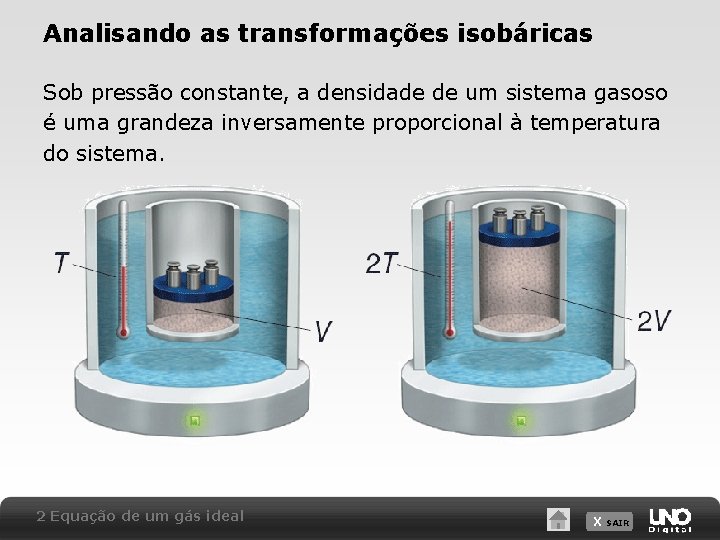
Analisando as transformações isobáricas Sob pressão constante, a densidade de um sistema gasoso é uma grandeza inversamente proporcional à temperatura do sistema. 2 Equação de um gás ideal X SAIR

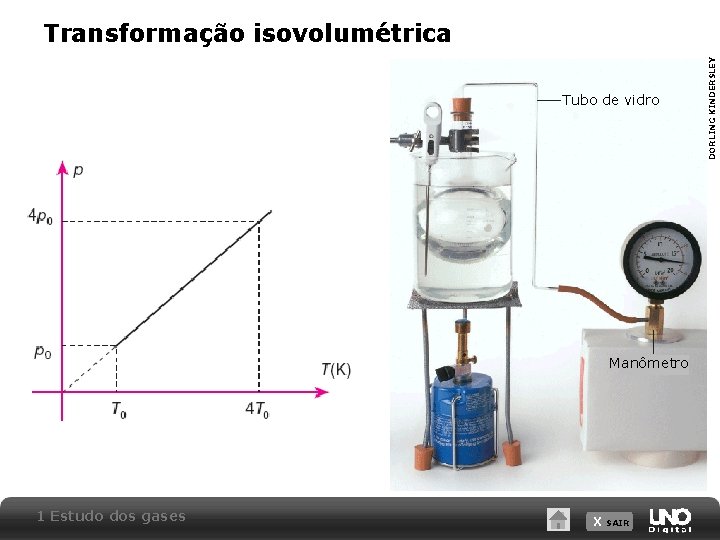
Tubo de vidro Manômetro 1 Estudo dos gases X SAIR DORLING KINDERSLEY Transformação isovolumétrica

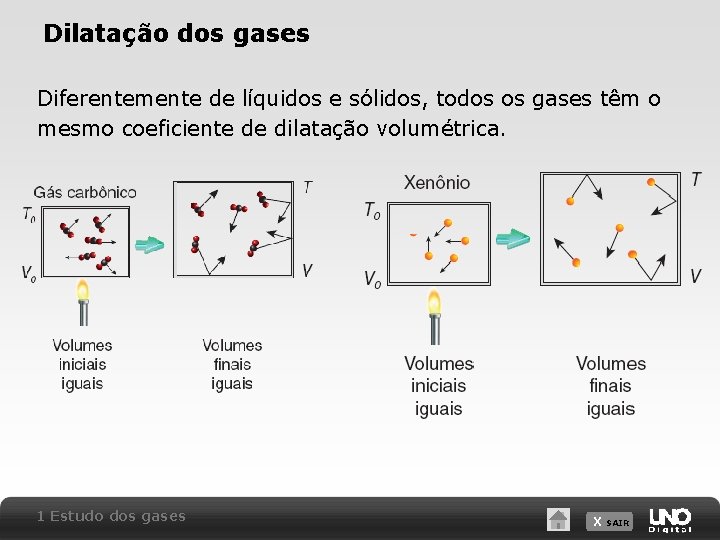
Dilatação dos gases Diferentemente de líquidos e sólidos, todos os gases têm o mesmo coeficiente de dilatação volumétrica. 1 Estudo dos gases X SAIR

Transformação isovolumétrica Lei de Charles para transformações a volume constante: a pressão do gás é diretamente proporcional a sua temperatura absoluta (em kelvins): p=k T (k = constante) Considerando o estado inicial A e final B de um gás ideal sofrendo uma transformação isobárica, temos: 1 Estudo dos gases X SAIR

Capítulo 2 Equação de um gás ideal X SAIR

Equação de Clapeyron As variáveis de estado pressão (p), volume (V ) e temperatura (T ) de uma massa de gás ideal contendo n mols de gás estão relacionadas pela equação de estado dos gases perfeitos (ou ideais): p V=n R T 2 Equação de um gás ideal X SAIR