Qumica General e Inorgnica A Qumica General e












![Molaridad (M) y Normalidad (N) M [=] mol/L N [=] equiv/L para un ácido Molaridad (M) y Normalidad (N) M [=] mol/L N [=] equiv/L para un ácido](https://slidetodoc.com/presentation_image/0fb62d2d933b8e3f45d386f18059ed43/image-24.jpg)













- Slides: 52

Química General e Inorgánica A Química General e Inorgánica I Química General Disoluciones Tema 8

Una disolución es una mezcla homogénea de dos o más sustancias disolución soluto disolvente El soluto es la sustancia que se encuentra en menor cantidad (pueden estar presentes varios solutos) El disolvente (dispersante) es la sustancia que está en mayor cantidad El soluto se dispersa en el disolvente. No hay reacción química 8. 1

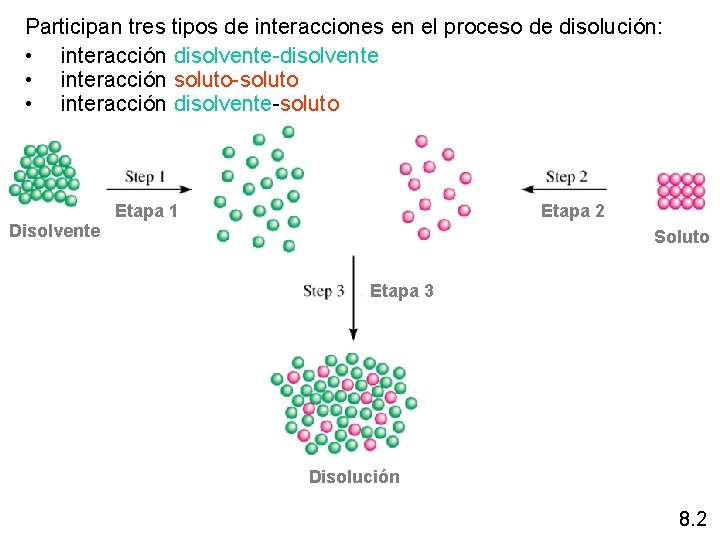
Participan tres tipos de interacciones en el proceso de disolución: • interacción disolvente-disolvente • interacción soluto-soluto • interacción disolvente-soluto Etapa 1 Etapa 2 Disolvente Soluto Etapa 3 Disolución 8. 2

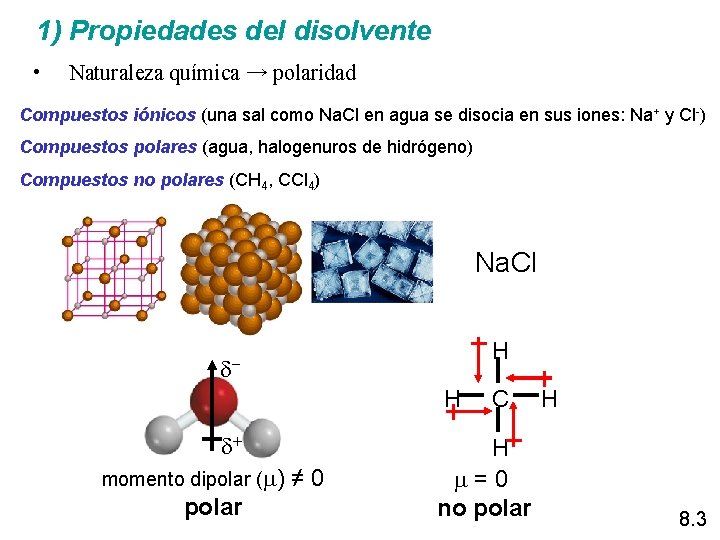
1) Propiedades del disolvente • Naturaleza química → polaridad Compuestos iónicos (una sal como Na. Cl en agua se disocia en sus iones: Na+ y Cl-) Compuestos polares (agua, halogenuros de hidrógeno) Compuestos no polares (CH 4, CCl 4) Na. Cl H d+ momento dipolar ( ) polar ≠ 0 C H =0 no polar H 8. 3

“lo semejante disuelve lo semejante” Dos sustancias con fuerzas intermoleculares similares se disuelven entre sí. Por lo tanto, serán miscibles las sustancias que posean polaridades semejantes • moléculas no polares se disuelven en los disolventes no polares CCl 4 en CH 4 • moléculas polares se disuelven en disolventes polares HBr (g) en H 2 O • los compuestos iónicos se disuelven mejor en los disolventes polares (por ejemplo en el agua) Na. Cl en H 2 O o NH 3 (l) 8. 4

2) Propiedades del soluto Solubilidad - es la máxima cantidad de soluto que se disolverá en una cantidad dada de disolvente a una temperatura determinada Cuando una sustancia sólida se disuelve en agua → el soluto es soluble Cuando una sustancia sólida NO se disuelve en agua → el soluto es insoluble Ejemplos: - la solubilidad de Na. Cl es 35, 7 g en 100 ml de agua a 00 C - la solubilidad de Pb. SO 4 es 4, 3 x 10 -3 g en 100 g de agua a 250 C Factores que modifican la velocidad de disolución • agitación • tamaño de los cristales • temperatura 8. 5

Reglas de solubilidad para compuestos iónicos comunes en agua a 250 C Compuestos solubles Excepciones Compuestos que contengan iones de metales alcalinos y NH 4+ NO 3 -, HCO 3 -, Cl. O 3 Cl-, Br-, I- Halogenuros de Ag+, Tl 1+, Pb 2+ SO 4 Sulfatos de Ag+, Ca 2+, Sr 2+, Ba 2+, Hg 2+, Pb 2+ 2 - Compuestos insolubles Excepciones CO 32 -, PO 43 -, Cr. O 42 -, S 2 - compuestos que contengan iones de metales alcalinos y NH 4+ OH- Compuestos que contengan iones de metales alcalinos, Ba 2+ y NH 4+ 8. 6

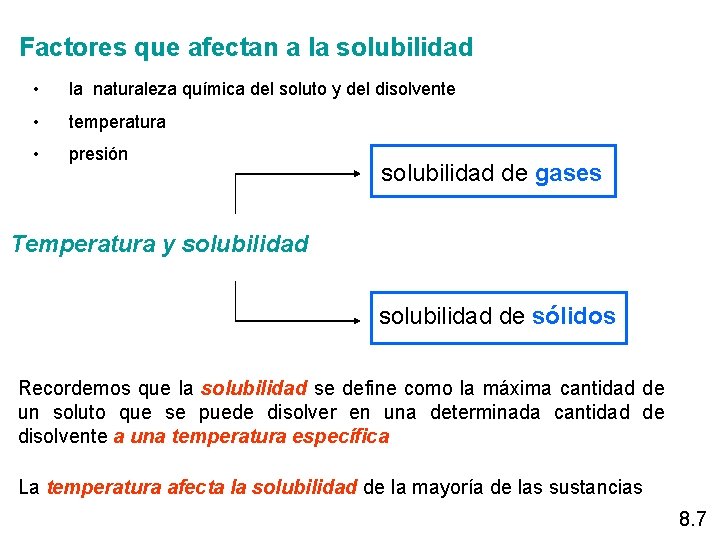
Factores que afectan a la solubilidad • la naturaleza química del soluto y del disolvente • temperatura • presión solubilidad de gases Temperatura y solubilidad de sólidos Recordemos que la solubilidad se define como la máxima cantidad de un soluto que se puede disolver en una determinada cantidad de disolvente a una temperatura específica La temperatura afecta la solubilidad de la mayoría de las sustancias 8. 7

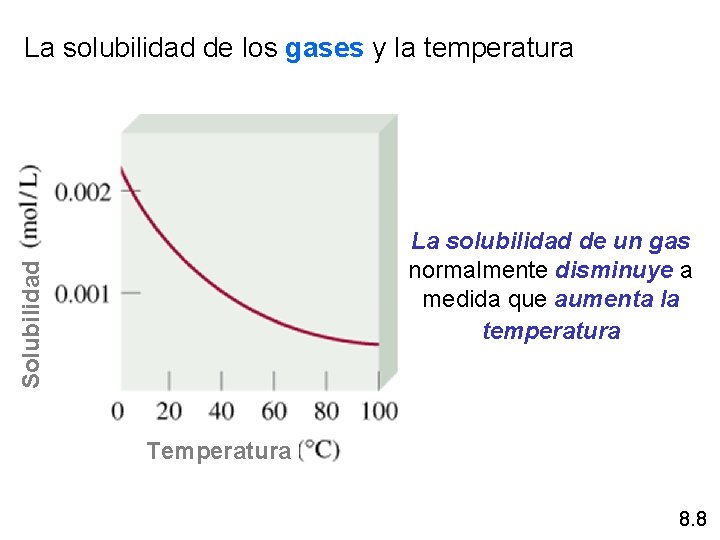
La solubilidad de los gases y la temperatura Solubilidad La solubilidad de un gas normalmente disminuye a medida que aumenta la temperatura Temperatura 8. 8

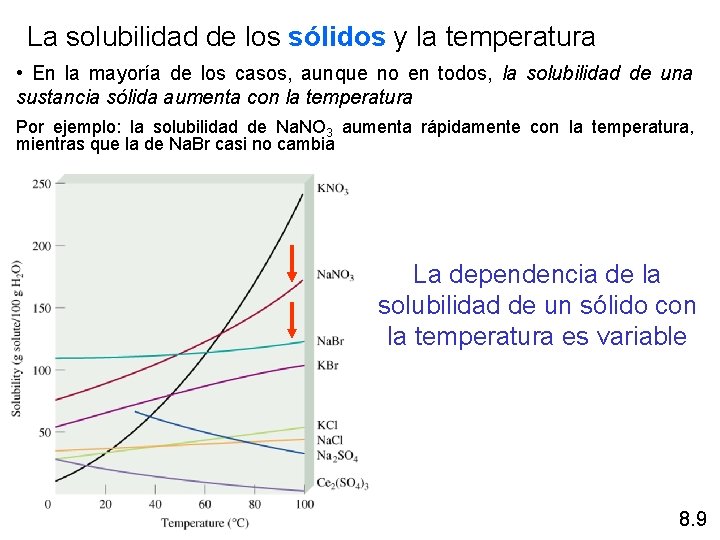
La solubilidad de los sólidos y la temperatura • En la mayoría de los casos, aunque no en todos, la solubilidad de una sustancia sólida aumenta con la temperatura Por ejemplo: la solubilidad de Na. NO 3 aumenta rápidamente con la temperatura, mientras que la de Na. Br casi no cambia La dependencia de la solubilidad de un sólido con la temperatura es variable 8. 9

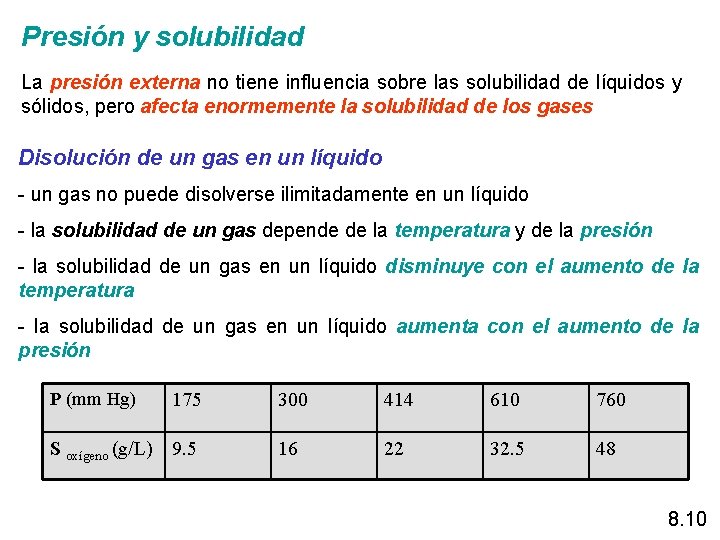
Presión y solubilidad La presión externa no tiene influencia sobre las solubilidad de líquidos y sólidos, pero afecta enormemente la solubilidad de los gases Disolución de un gas en un líquido - un gas no puede disolverse ilimitadamente en un líquido - la solubilidad de un gas depende de la temperatura y de la presión - la solubilidad de un gas en un líquido disminuye con el aumento de la temperatura - la solubilidad de un gas en un líquido aumenta con el aumento de la presión P (mm Hg) 175 S oxígeno (g/L) 9. 5 300 414 610 760 16 22 32. 5 48 8. 10

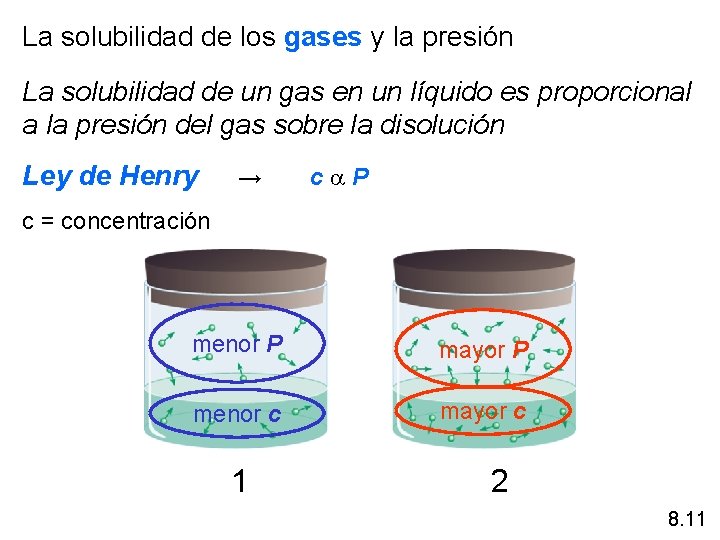
La solubilidad de los gases y la presión La solubilidad de un gas en un líquido es proporcional a la presión del gas sobre la disolución Ley de Henry → c P c = concentración menor P mayor P menor c mayor c 1 2 8. 11

3) Propiedades de la solución Concentración La concentración de una disolución indica la relación que existe entre la cantidad de soluto y disolvente Solución concentrada La relación soluto/disolvente es relativamente grande, se ha disuelto gran cantidad de soluto Solución diluida La relación soluto/disolvente es relativamente pequeña, se ha disuelto poca cantidad de soluto Otra clasificación: “En base a la capacidad de la solución para disolver a un soluto” Una solución saturada contiene la máxima cantidad de soluto que se disuelve en un disolvente en particular, a una temperatura determinada 8. 12

Una solución no saturada contiene menor cantidad de soluto que la que es capaz de disolver Una solución sobresaturada contiene más soluto que el que puede haber en una disolución saturada. No son muy estables En una solución sobresaturada de acetato de sodio al agregar un pequeño cristal como semilla, se forman rápidamente cristales de acetato de sodio que se separan de la disolución Solubilidad de un soluto en agua - es la cantidad de soluto necesaria para obtener una solución saturada en 100 gramos de agua a una temperatura determinada 8. 13

Unidades de concentración Para realizar el estudio cuantitativo de una solución se determina su concentración La concentración de una solución es la cantidad de soluto presente en una cantidad definida de solución (o contenido en una determinada cantidad de disolvente) solubilidad: cantidad necesaria de soluto para formar una solución saturada en 100 g de disolvente a una temperatura determinada Unidades físicas % P/P % P/V % V/V Unidades químicas M (molaridad) X (fracción molar) N (normalidad) m (molalidad) 8. 14

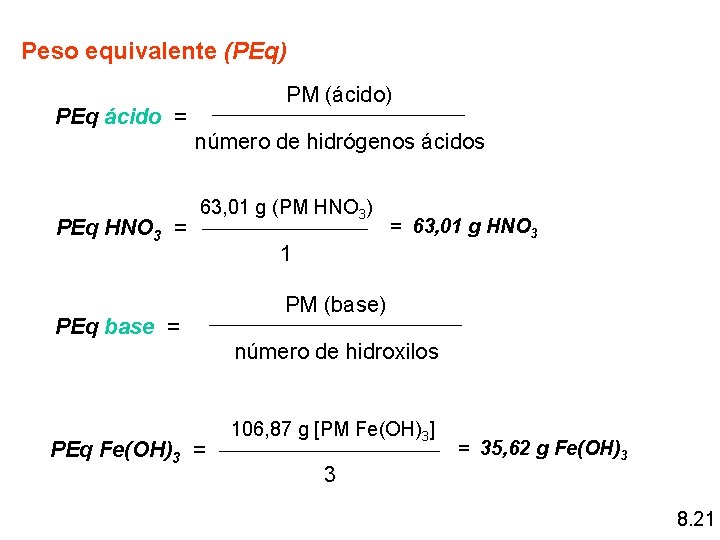
Concentración en unidades físicas gramos de solución 1 - Porcentaje peso en peso (% P/P) gramos de soluto - % P/P solución: son los gramos de soluto puro en 100 g de solución % P/P solución = masa de soluto x 100% masa de solución masasolución = masasoluto + masadisolvente 8. 15

Ejemplo Calcule la concentración expresada en % P/P de la solución resultante de mezclar 5, 5 g de Na. OH con 55, 5 g de agua masasolución = masasoluto + masadisolvente masasolución = 5, 5 g Na. OH + 55, 5 g H 2 O = 61 g de solución _______ 5, 5 g de soluto 100 g de solución _____ x = 9, 9 % P/P 9, 9 g de Na. OH (soluto) / 100 g de solución 8. 16

2 - Porcentaje peso en volumen (% P/V) - % P/V solución: son los gramos de soluto puro en 100 m. L de solución Ejemplo Se prepara una solución disolviendo 30 g de Na. Cl en 110 g de agua. El volumen final obtenido es 126 m. L. Calcular la concentración de la solución en % P/V 126 m. L de solución _______ 30 g de soluto (Na. Cl) 100 m. L de solución _____ x = 23, 81 % P/V 23, 81 g de Na. Cl (soluto) / 100 m. L de solución 8. 17

3 - Porcentaje volumen en volumen (% V/V) - % V/V solución: es la cantidad en mililitros de soluto puro en 100 m. L de solución Ejemplo Calcule la concentración de una solución que contiene 50 m. L de alcohol y cantidad suficiente de agua hasta un volumen final de 400 m. L de solución _______ 50 m. L de soluto (alcohol) 100 m. L de solución _____ x = 12, 5 % V/V 12, 5 m. L de alcohol (soluto) / 100 m. L de solución 8. 18

Concentración en unidades químicas Molaridad (M) Es el número de moles de soluto en un litro de solución M = no moles de soluto V solución (litros) Una solución 1, 46 M de glucosa contiene: 1, 46 moles de soluto (glucosa) en 1 L de solución 0, 73 moles de soluto (glucosa) en 500 m. L de solución 1, 46 mol M = 1 L 0, 73 mol = 1, 46 mol/L M = = 1, 46 mol/L 0. 5 L La concentración es una propiedad intensiva, su valor no depende de la cantidad de solución 8. 19

Ejemplo: Calcule la molaridad de una solución de HCl que contiene 30 g de ácido en 700 m. L de solución no de moles = masa (soluto) PM (soluto) 0, 82 mol M = = 30 g de HCl 36, 5 g/mol = 0, 82 moles = 1, 17 mol/L = 1, 17 M 0, 7 L Normalidad (N) Es el número de equivalentes químicos de un soluto en un litro de solución N= no de equivalentes de soluto equiv [=] litro V solución (litros) masa no de equivalentes (neq) = g [=] Peso equivalente g / equiv [ = ] equiv 8. 20

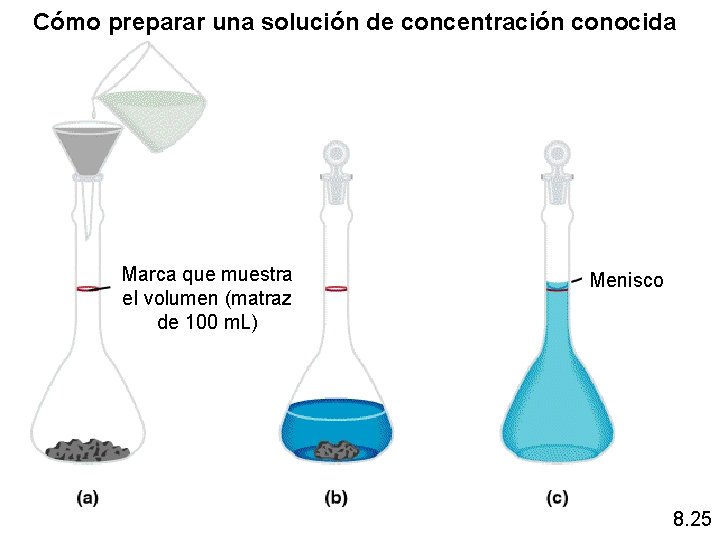
Peso equivalente (PEq) PM (ácido) PEq ácido = número de hidrógenos ácidos PEq HNO 3 = 63, 01 g (PM HNO 3) PEq base = = 63, 01 g HNO 3 1 PM (base) número de hidroxilos PEq Fe(OH)3 = 106, 87 g [PM Fe(OH)3] = 35, 62 g Fe(OH)3 3 8. 21

Ejemplo: Calcule la normalidad de una solución formada por 19, 6 g de H 3 PO 4 en suficiente cantidad de agua como para formar 300 m. L de solución N = no de equivalentes de soluto / V solución (litros) no de equivalentes = masa / Peso equivalente 1) PEq ácido = PM ácido / no de hidrógenos ácidos PEq H 3 PO 4 = 2) 3) neq = 98 g/mol 3 eq/mol = 32, 7 g/equiv 19, 6 g = 0, 599 equiv 32, 7 g/equiv N = 0, 599 equiv. de soluto / 0, 3 L = 2 N 8. 22
![Molaridad M y Normalidad N M molL N equivL para un ácido Molaridad (M) y Normalidad (N) M [=] mol/L N [=] equiv/L para un ácido](https://slidetodoc.com/presentation_image/0fb62d2d933b8e3f45d386f18059ed43/image-24.jpg)
Molaridad (M) y Normalidad (N) M [=] mol/L N [=] equiv/L para un ácido N = M H+ para una base N = M OH- H+ es la cantidad de protones cedidos por una molécula del ácido OH– es la cantidad de hidroxilos cedidos por una molécula de la base Ejemplos Una disolución 1 M de HCl cede 1 H+, es una disolución 1 N Una disolución 1 M de Ca (OH)2 cede 2 OH–, es una disolución 2 N

Fracción molar ( ) Es una cantidad adimensional que expresa la relación del número de moles (n) de un componente de una solución con el número de moles de todos los componentes presentes soluto = ns ns + n d nd ns + n d disolvente = La suma de las fracciones molares de una solución es igual a la unidad soluto + disolvente = 1 Ejemplo: Calcule la fracción molar de cada uno de los componentes de una solución formada por 15 g de agua y 15 g de acetona (CH 3 -CO-CH 3) masa o de moles (n) = n 1) PM 15 g n = = 0, 26 moles acetona n agua = = 0, 83 moles -1 58 g. mol 18 g. mol-1 ns + nd = 0, 83 moles + 0, 26 moles = 1, 09 moles 2) agua = 0. 83 / 1, 09 = 0, 76 acetona = 0, 26 / 1, 09 = 0, 24 8. 23

Molalidad (m) Es el número de moles de soluto en un kilo de disolvente m = no moles de soluto masa disolvente (kg) Ejemplo: calcule la molalidad de una solución acuosa de sulfato de sodio (Na 2 SO 4) que contiene 142 g de la sal en 1000 g de agua no de moles = masa / PM = 142 g / 142 g = 1 mol m = 1 mol / 1 kg = 1 mol/kg Para preparar una solución acuosa de sulfato de sodio 1 molal (1 m), hay que disolver 142 g (1 mol) de la sal en 1000 g (1 kg) de agua ¿Qué unidad de concentración elegir? 8. 24

Cómo preparar una solución de concentración conocida Marca que muestra el volumen (matraz de 100 m. L) Menisco 8. 25

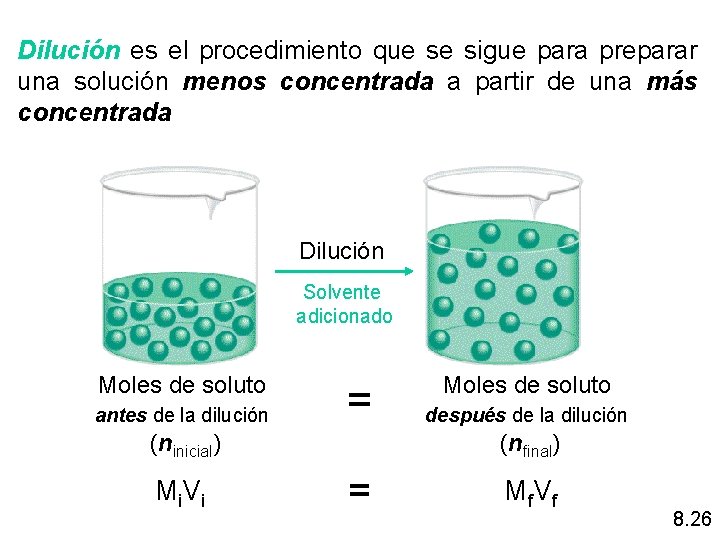
Dilución es el procedimiento que se sigue para preparar una solución menos concentrada a partir de una más concentrada Dilución Solvente adicionado Moles de soluto antes de la dilución = (ninicial) Mi V i Moles de soluto después de la dilución (nfinal) = Mf V f 8. 26

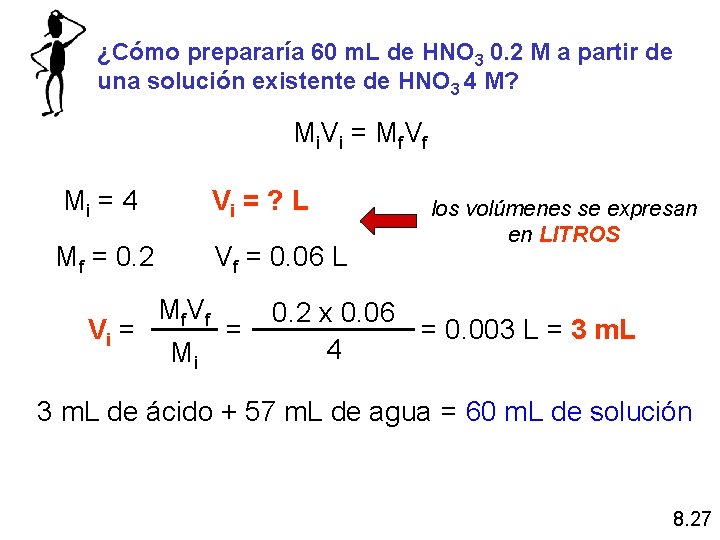
¿Cómo prepararía 60 m. L de HNO 3 0. 2 M a partir de una solución existente de HNO 3 4 M? Mi V i = M f V f Mi = 4 Vi = ? L Mf = 0. 2 Vf = 0. 06 L Vi = Mf V f Mi = los volúmenes se expresan en LITROS 0. 2 x 0. 06 = 0. 003 L = 3 m. L 4 3 m. L de ácido + 57 m. L de agua = 60 m. L de solución 8. 27

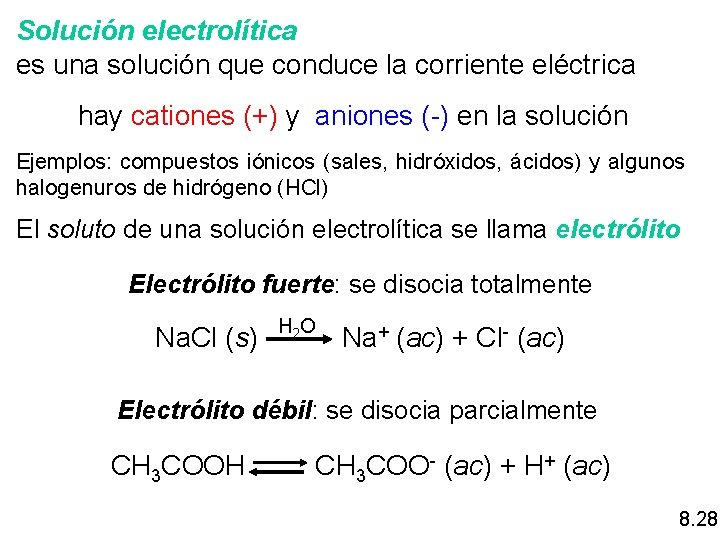
Solución electrolítica es una solución que conduce la corriente eléctrica hay cationes (+) y aniones (-) en la solución Ejemplos: compuestos iónicos (sales, hidróxidos, ácidos) y algunos halogenuros de hidrógeno (HCl) El soluto de una solución electrolítica se llama electrólito Electrólito fuerte: se disocia totalmente Na. Cl (s) H 2 O Na+ (ac) + Cl- (ac) Electrólito débil: se disocia parcialmente CH 3 COOH CH 3 COO- (ac) + H+ (ac) 8. 28

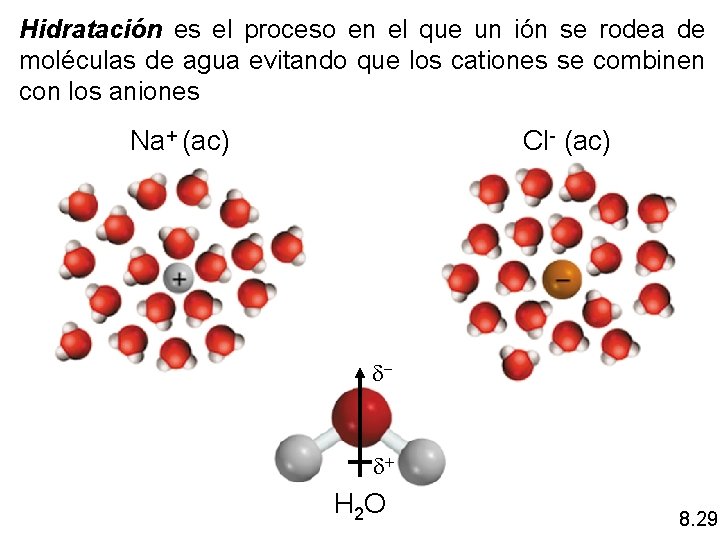
Hidratación es el proceso en el que un ión se rodea de moléculas de agua evitando que los cationes se combinen con los aniones Na+ (ac) Cl- (ac) d- d+ H 2 O 8. 29

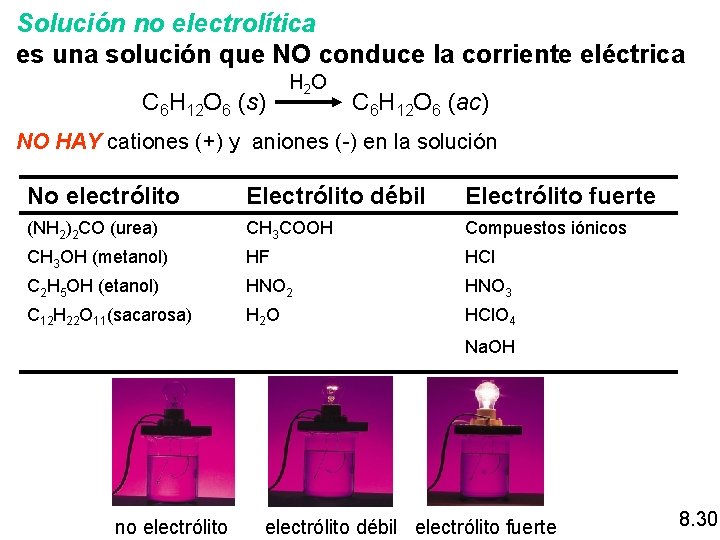
Solución no electrolítica es una solución que NO conduce la corriente eléctrica C 6 H 12 O 6 (s) H 2 O C 6 H 12 O 6 (ac) NO HAY cationes (+) y aniones (-) en la solución No electrólito Electrólito débil Electrólito fuerte (NH 2)2 CO (urea) CH 3 COOH Compuestos iónicos CH 3 OH (metanol) HF HCl C 2 H 5 OH (etanol) HNO 2 HNO 3 C 12 H 22 O 11(sacarosa) H 2 O HCl. O 4 Na. OH no electrólito débil electrólito fuerte 8. 30

Propiedades coligativas son propiedades que dependen del número de partículas de soluto en la solución y no de la naturaleza de las partículas del soluto MAS moléculas de soluto → MAYOR concentración → MAYOR efecto en las propiedades coligativas 1 - Disminución de la presión de vapor (DPv ) 2 - Disminución de la temperatura de congelación (DTc o DTf ) 3 - Aumento de la temperatura de ebullición (DTeb) 4 - Presión osmótica (p) 8. 31

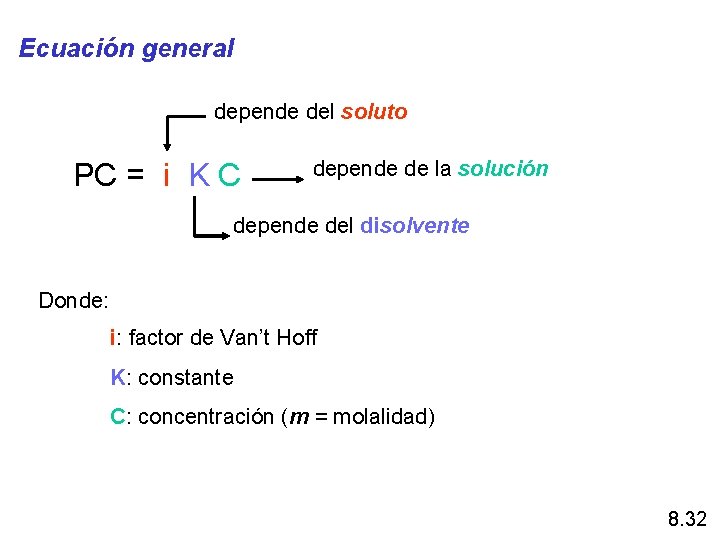
Ecuación general depende del soluto PC = i K C depende de la solución depende del disolvente Donde: i: factor de Van’t Hoff K: constante C: concentración (m = molalidad) 8. 32

Factor de Van’t Hoff (i) Cuando el soluto es un electrólito fuerte i representa el número de iones en que se disocia el soluto Ejemplos: Na. Cl → i = 2 → 1 Na+ y 1 Cl. Ba. Cl 2 → i =3 → 1 Ba 2+ y 2 Cl- Para solutos no electrólitos → i = 1 Ejemplos: etilenglicol, glicerina, glucosa, etc. 8. 33

Disminución de la presión de vapor (DPv ) El descenso de la presión de vapor de una solución con respecto a la presión de vapor del disolvente puro se calcula: DPv = i Kpv m Kpv constante molal de la disminución DPv = Pv 0 - Pv Pv 0 es la presión de vapor del disolvente puro Pv 0 > Pv Pv es la presión de vapor de la solución de la presión de vapor DPv > 0 ¿Porqué es menor la presión de vapor de la solución? 8. 34

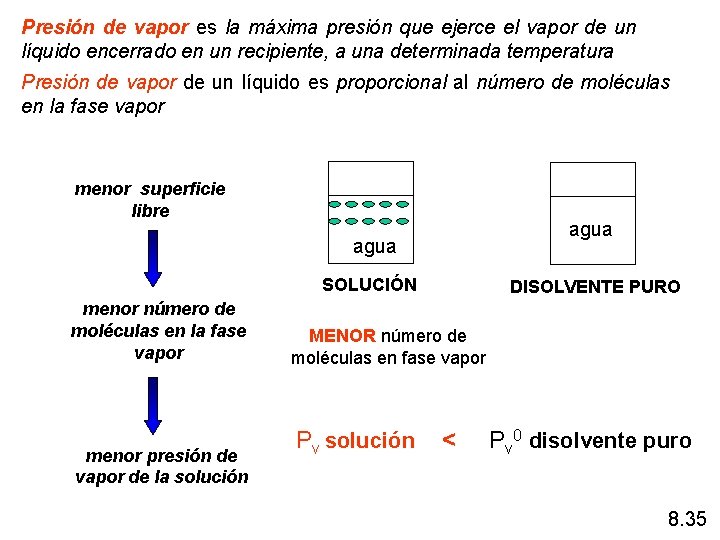
Presión de vapor es la máxima presión que ejerce el vapor de un líquido encerrado en un recipiente, a una determinada temperatura Presión de vapor de un líquido es proporcional al número de moléculas en la fase vapor menor superficie libre agua SOLUCIÓN menor número de moléculas en la fase vapor menor presión de vapor de la solución DISOLVENTE PURO MENOR número de moléculas en fase vapor Pv solución < Pv 0 disolvente puro 8. 35

Ejemplo Calcular la presión de vapor de una solución azucarada 0, 2 m, si la presión de vapor del disolvente puro a 280 C es de 28, 35 torr (Kpv = 0, 51 torr. kg. mol-1) DPv = i Kpv m solución azucarada es no electrólito → i = 1 DPv = 0. 51 torr. kg. mol-1 x 0. 2 mol. kg-1 = 0. 10 torr DPv = Pv 0 – Pv = 0. 10 torr Pv = Pv 0 – DPv = 28. 35 torr – 0. 10 torr = 28. 25 torr 8. 36

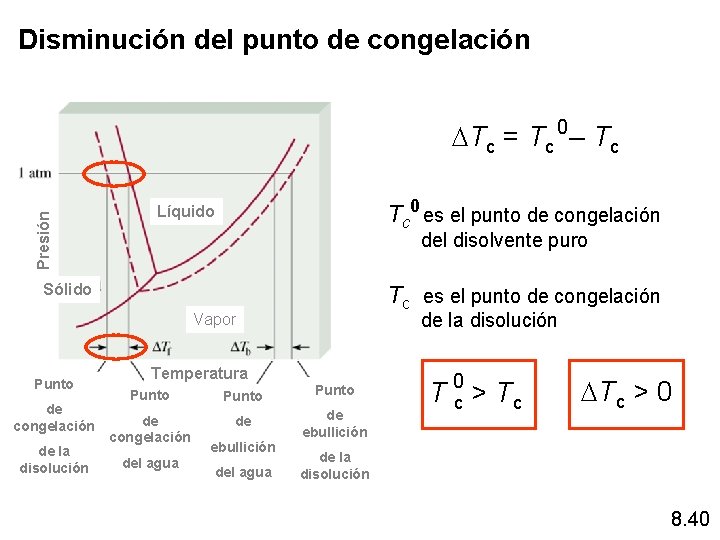
Disminución de la temperatura de congelación (DTc o DTf ) El descenso de la temperatura de congelación de una solución con respecto a la del disolvente puro se calcula: DTc = i Kc m Kc constante molal de la disminución del punto de congelación DTc = Tc Tc 0 es la temperatura de congelación del disolvente puro 0 - Tc Tc 0 > Tc Tc es la temperatura de congelación de la solución DTc > 0 ¿Porqué es menor la temperatura de congelación de la solución? 8. 37

Ejemplo 1 Para una solución acuosa 0. 01 molal de etilenglicol, ¿cuál será la temperatura de congelación de la misma? (KC agua = 1. 86 0 C. kg/mol) DTc = i Kc m etilenglicol es no electrólito → i = 1 DTc = 1. 86 0 C. kg/mol x 0. 01 mol/kg = 0. 0186 0 C DTc = Tc 0 - Tc 0. 0186 0 C = 0 0 C - Tc Tc = 0 0 C - 0. 0186 0 C → Tc = - 0. 0186 0 C El anticongelante etilenglicol disminuye el punto de congelación del agua del motor 8. 38

Ejemplo 2 En ciertos países el cloruro de sodio, el cloruro de calcio y la urea (NH 2 CONH 2 no-electrólito), se usan para fundir el hielo de calles y carreteras. Cuál es el efecto que producen? Todos disminuyen la temperatura de congelación del agua que permanecerá líquida a temperaturas menores a 00 C DTc = i Kc m El mayor descenso en la temperatura de congelación se conseguirá con el compuesto que tiene mayor valor de “i” (mayor número de partículas en la solución) Na. Cl y Ca. Cl 2 son sales → electrólitos urea → no electrólito Ca. Cl 2 Na. Cl i=3 i=2 urea i=1 8. 39

Disminución del punto de congelación Presión DTc = Tc 0 – Tc Tc 0 es el punto de congelación Líquido del disolvente puro Sólido Tc es el punto de congelación de la disolución Vapor Punto de congelación de la disolución Temperatura Punto de congelación de de ebullición del agua T 0 c > Tc DTc > 0 de la disolución 8. 40

Aumento de la temperatura de ebullición (DTeb) El ascenso de la temperatura de ebullición de una solución con respecto a la del disolvente puro se calcula: DTeb = i Keb m Keb constante molal de ascenso del punto de ebullición Las soluciones tienen temperaturas de ebullición más altas que los disolventes puros DTeb = Teb – Teb 0 Teb > Teb 0 DTeb > 0 Teb es la temperatura de ebullición de la solución Teb 0 es la temperatura de ebullición del disolvente puro ¿Porqué es mayor la temperatura de ebullición de la solución? 8. 41

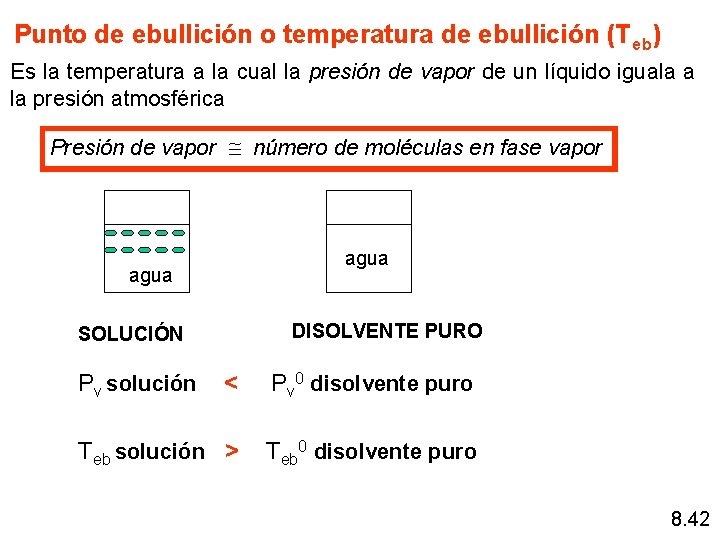
Punto de ebullición o temperatura de ebullición (Teb) Es la temperatura a la cual la presión de vapor de un líquido iguala a la presión atmosférica Presión de vapor número de moléculas en fase vapor agua DISOLVENTE PURO SOLUCIÓN Pv solución < Pv 0 disolvente puro Teb solución > Teb 0 disolvente puro 8. 42

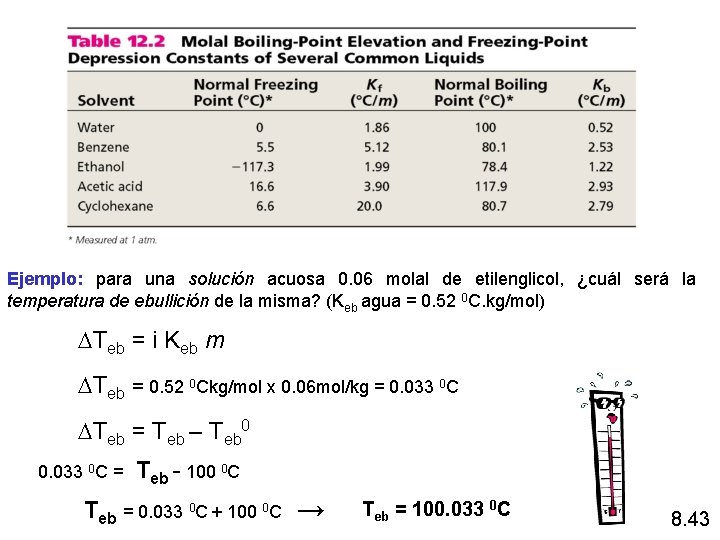
Ejemplo: para una solución acuosa 0. 06 molal de etilenglicol, ¿cuál será la temperatura de ebullición de la misma? (Keb agua = 0. 52 0 C. kg/mol) DTeb = i Keb m DTeb = 0. 52 0 Ckg/mol x 0. 06 mol/kg = 0. 033 0 C DTeb = Teb – Teb 0 0. 033 0 C = Teb - 100 0 C Teb = 0. 033 0 C + 100 0 C → Teb = 100. 033 0 C 8. 43

¿Cuál es el punto de ebullición de una solución acuosa 5 molal de etilenglicol? Keb agua = 0. 52 0 C. kg/mol DTeb = i Keb m DTeb = 0. 52 0 C. kg/mol x 5 mol/kg = 2. 6 0 C DTeb = Teb – Teb 0 2. 6 0 C = Teb - 100 0 C Teb = 2. 6 0 C + 100 0 C → Teb = 102. 6 0 C MAYOR concentración de la solución → MAYOR Temperatura de ebullición La concentración de la solución afecta a todas las propiedades coligativas!!! 8. 44

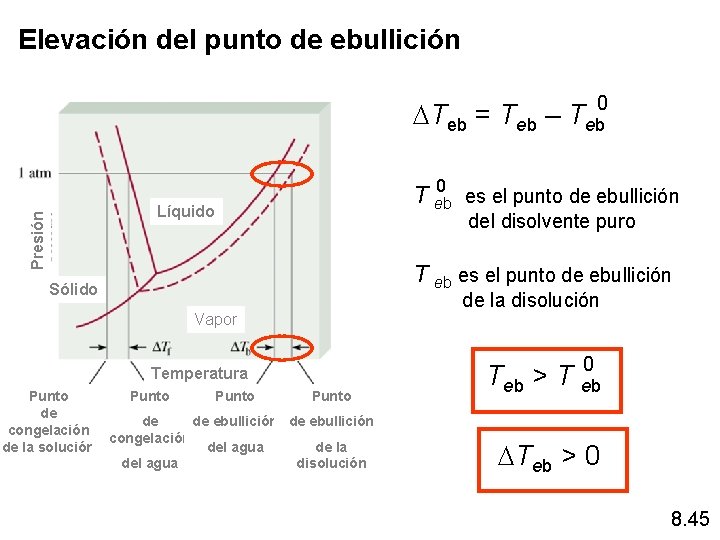
Elevación del punto de ebullición DTeb = Teb – Teb 0 Presión Líquido 0 T eb es el punto de ebullición del disolvente puro T eb es el punto de ebullición Sólido Vapor Temperatura Punto de de de ebullición congelación de la solución del agua de la del agua disolución de la disolución 0 T eb > T eb DTeb > 0 8. 45

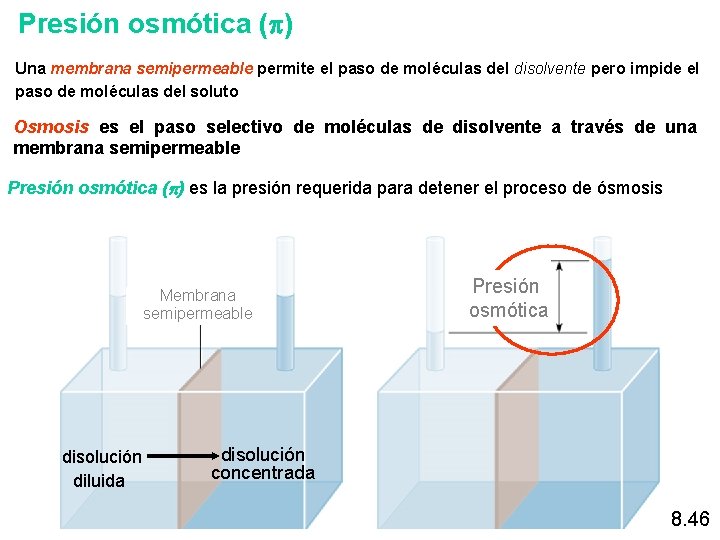
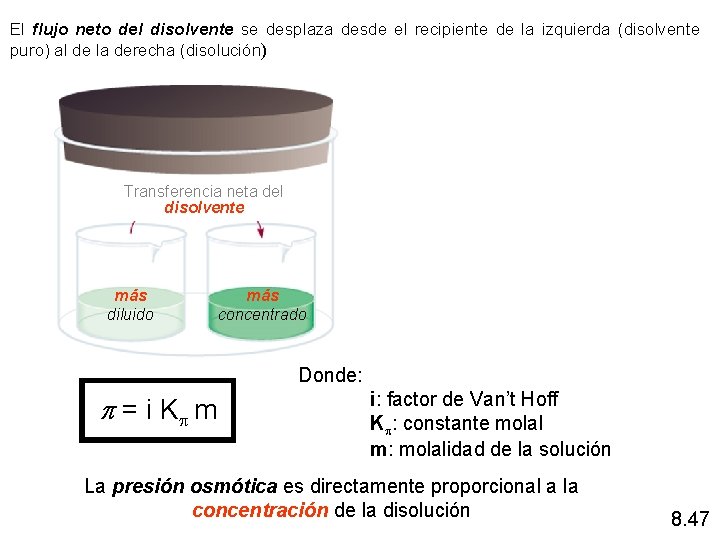
Presión osmótica (p) Una membrana semipermeable permite el paso de moléculas del disolvente pero impide el paso de moléculas del soluto Osmosis es el paso selectivo de moléculas de disolvente a través de una membrana semipermeable Presión osmótica (p) es la presión requerida para detener el proceso de ósmosis Membrana semipermeable disolución diluida Presión osmótica disolución concentrada 8. 46

El flujo neto del disolvente se desplaza desde el recipiente de la izquierda (disolvente puro) al de la derecha (disolución) Transferencia neta del disolvente más diluido más concentrado Donde: p = i Kp m i: factor de Van’t Hoff Kp: constante molal m: molalidad de la solución La presión osmótica es directamente proporcional a la concentración de la disolución 8. 47

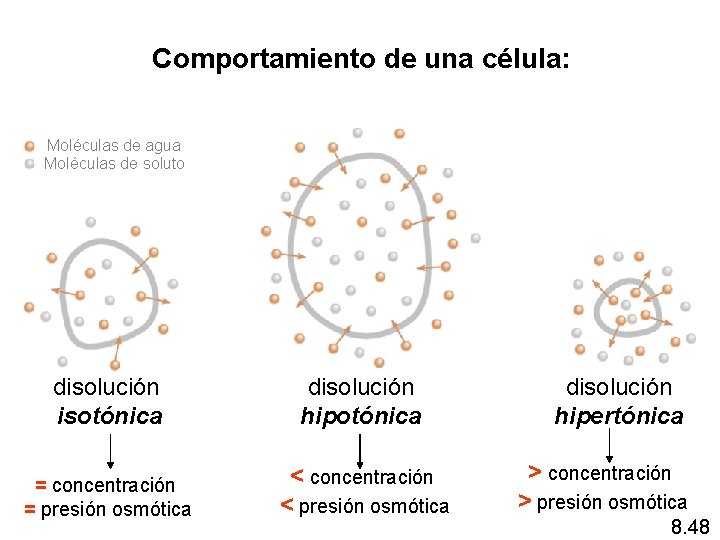
Comportamiento de una célula: Moléculas de agua Moléculas de soluto disolución isotónica disolución hipotónica = concentración = presión osmótica < concentración < presión osmótica disolución hipertónica > concentración > presión osmótica 8. 48

El oso POLAR, porqué se llama así?
