QUMICA ORGNICA Qu es la qumica orgnica En














- Slides: 18

QUÍMICA ORGÁNICA ¿Qué es la química orgánica? En los últimos años del siglo XVIII y a principios del XIX, muchos químicos centraron su atención en la separación, purificación e identificación de sustancias aisladas de animales o plantas. Pero se dieron cuenta de que los compuestos de este origen poseían en común ciertas propiedades que los distinguían de aquellos obtenidos de fuentes minerales. Por ejemplo; las sustancias extraídas de animales o plantas son por lo general combustibles, tienden a fundirse o descomponerse a temperaturas relativamente bajas (200 a 300ºC) y están constituídas por unos pocos elementos, principalmente carbono, hidrógeno, oxígeno y nitrógeno.

Debido a su procedencia de los organismos vivos, dichos compuestos fueron considerados como compuestos orgánicos y la rama de la química que se dedicaba a su estudio se denominó Química orgánica. Por muchos años se pensó que los compuestos orgánicos no podían ser sintetizados en el laboratorio porque tenían algo así como una fuerza vital que impedía su formación en fuentes distintas a las naturales. En 1. 828, el químico alemán Friedrich Wöhler 81. 800 -1. 882) logró obtener urea un compuesto presente en la orina. - a partir de cianato de amonio , lo que representó la conversión de una sustancia inorgánica en otra orgánica. Este y otros experimentos posteriores desacreditaron gradualmente la teoría de la fuerza vital(también conocida como teoria vitalista) y abrieron el campo para la síntesis de nuevos compuestos orgánicos.

En la actualidad el número de compuestos orgánicos preparados artificialmente es mucho mayor que el de obtenidos de fuentes naturales. Tanto los unos como los otros tienen como constituyente fundamental el carbono, por lo que se le conoce conjuntamente como compuestos del carbono.

La química orgánica: Es la rama de la química que se dedica al estudio de los compuestos del carbono. Importancia de la Química orgánica: La química orgánica se relaciona con nuestra vida cotidiana probablemente más que cualquier otra rama de la ciencia. Los alimentos que comemos, los vestidos que usamos, la madera y el papel de muebles y libros; las medicinas que ingerimos, los plásticos que utilizamos en las ´más variadas aplicaciones; la gasolina, aceites y lubricantes, el caucho de las llantas de los aviones y automóviles, y en fin una larga lista de productos, todos ellos innegable familiaridad, son compuestos orgánicos.

EL ÁTOMO DE CARBONO El carbono: Hoy en día se conocen más de tres millones de compuestos del carbono(o compuestos orgánicos) y su número aumenta constantemente, tanto por la síntesis de nuevos compuestos como por la identificación de otros extraídos de fuentes naturales. Es sorprendente el alto número de compuestos, si consideramos que en su gran mayoría están constituídos por no más de diez elementos.

La respuesta es la propiedad que poseen los átomos de carbono de formar cadenas unos con otros y formar compuestos distintos. Estructura tetraédrica del átomo de carbono: El carbono pertenece al grupo IV de la tabla periódica, lo que nos indica que tiene cuatro electrones de valencia y que puede completar su octeto cuando comparte dichos electrones, ya sea con otro átomo de carbono o con un átomo de un elemento distinto. El carbono forma cuatro enlaces covalentes.

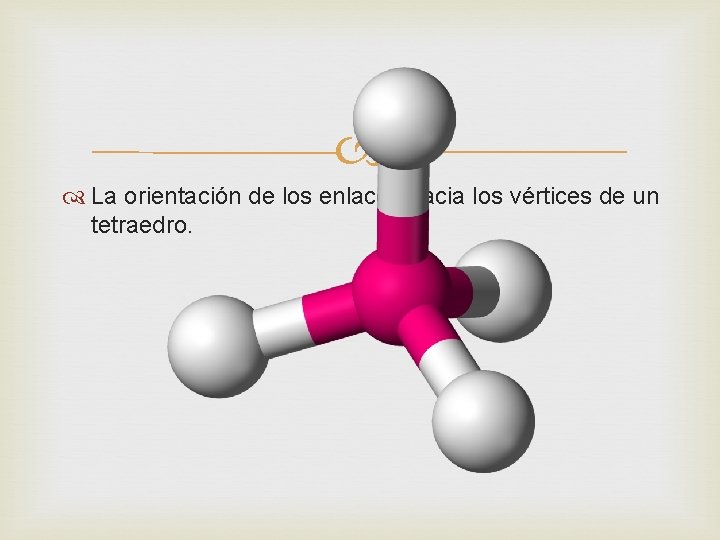
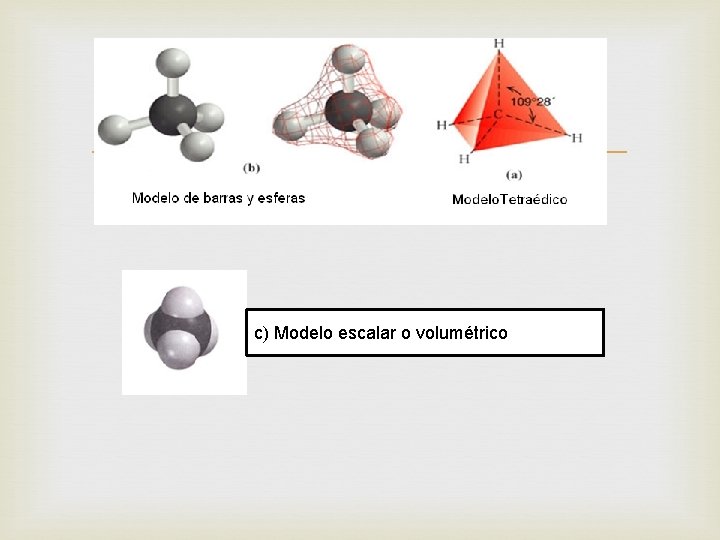
Diversos resultados experimentales indican que éstos cuatro enlaces están dirigidos hacia los vértices de un tetraedro(pirámide regular de base triangular) por ejemplo el caso más sencillo es el metano, compuesto de fórmula molecular Ch 4. que corresponde a las siguientes fórmulas electrónica y fórmula estructural.


La orientación de los enlaces hacia los vértices de un tetraedro.

c) Modelo escalar o volumétrico

El ángulo H-C-H(ángulo de enlace) no es recto como parece indicar las fórmulas planas, si no que es el correspondiente a un tetraedro es decir, 109º 28´ o aproximadamente 109, 50. El enlace simple carbono –carbono La cadena más corta se forma cuando dos átomos de carbono se unen entre sí. Este caso se presenta en la molécula de etano C 2 H 6. Sus fórmulas electrónicas y estructural son:


Los ángulos de enlace, tanto los H-C-H como las HC-C- son tetraédricos esto ocurre siempre que el carbono forma enlaces simples, por lo cual se conoce como carbono tetraedral. El enlace doble carbono-carbono: Dos átomos de carbono están unidos por medio de enlaces dobles o triples.

Cuando dos átomos de carbono forman un enlace doble, cada uno de ellos comparte con el otro dos de sus electrones de valencia. Por consiguiente, le quedan disponibles otros dos electrones para formar sendos enlaces simples con otros átomos. En otras palabras, cada átomo de carbono forma un total de cuatro enlaces: dos que conforman un enlace doble, y dos simples o sencillos. . C: +: C. ---. C: : C.

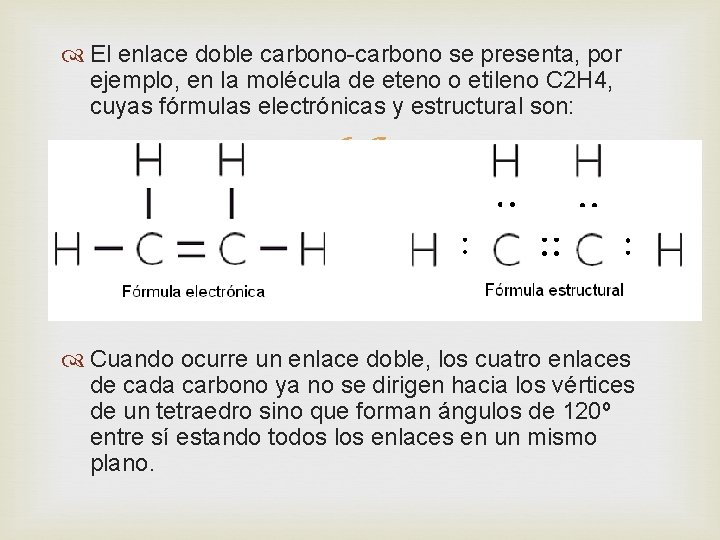
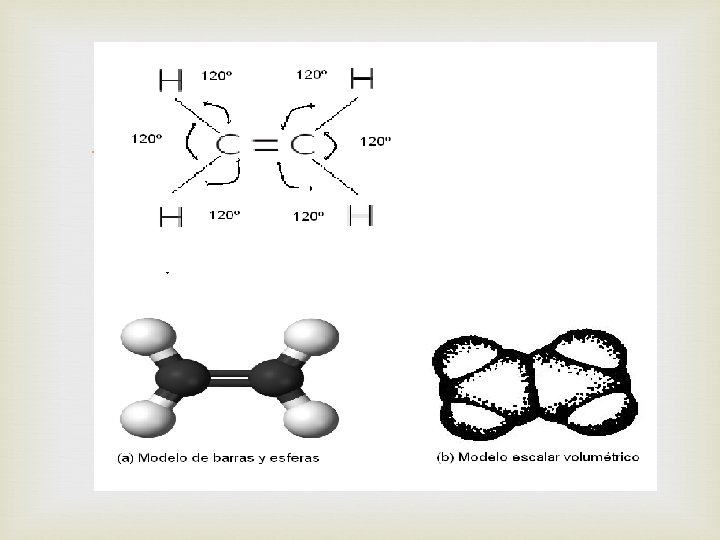
El enlace doble carbono-carbono se presenta, por ejemplo, en la molécula de eteno o etileno C 2 H 4, cuyas fórmulas electrónicas y estructural son: Cuando ocurre un enlace doble, los cuatro enlaces de cada carbono ya no se dirigen hacia los vértices de un tetraedro sino que forman ángulos de 120º entre sí estando todos los enlaces en un mismo plano.


El enlace triple carbono-carbono: En la formación del enlace triple carbono –carbono, tres de los electrones de valencia de cada átomo están comprometidos en el mismo, el cuarto electrón forma enlace simple con otros átomos tal ocurre por ejemplo, en la molécula de etino o acetileno C 2 H 2. H: C: : : C: H H-=C-H Los enlaces forman entre sí ángulos de 180º; lo que quiere decir, que la estructura es lineal. De los carbonos unidos por un enlace triple se dice que son digonales.

(a) Modelo de barras y esferas (b) Modelo escalar o volumétrico