SEMANA 15 INTRODUCCIN A LA QUMICA ORGNICA QUMICA






























- Slides: 46

SEMANA 15 INTRODUCCIÓN A LA QUÍMICA ORGÁNICA QUÍMICA 2016 1

INTRODUCCIÓN A LA QUÍMICA ORGÁNICA • Definición de Química orgánica. • Características generales del carbono • Hibridación del carbono: sp 3, sp 2, sp • Fórmulas: Global o molecular Estructural (desarrollada o expandida, condensada, escalonada o esqueleto) • Clasificación de átomos de carbono y sus hidrógenos. • Isomería y clasificación. • Diferencia entre las características de los compuestos orgánicos e inorgánicos. Laboratorio: Evaluación Practica de Laboratorios Semanas 1 a 13 (Viernes 20 de mayo) 2

¿Qué es QUIMICA ORGÁNICA? • La parte de la Química que estudia al CARBONO y los Compuestos del Carbono llamados COMPUESTOS ORGÁNICOS. • Los principales elementos que los forman son C, H, luego, O, N, S, P y en menor cantidad los halógenos Cl, Br, I, F. • El carbono forma parte de unos pocos compuestos inorgánicos por ej: Na 2 CO 3, Na. HCO 3, HCN. 3

Ejemplos de compuestos orgánicos • Comida : proteínas, grasas, carbohidratos. • Artículos de limpieza y tocador: jabón, shampoo, cremas, perfumes, tintes para el cabello, maquillajes. • Ropa y accesorios: algodón, seda, dacrón, nylón, poliéster, lana, cuero, cuerinas, plásticos. • Combustibles, : petróleo, gasolina, diesel, gas. • Medicamentos: antibióticos, analgésicos, antiinflamatorios, antialérgicos, antineoplásicos. • Materiales de construcción: madera, tubo plástico para drenajes, algunas pinturas. 4

El Carbono puede enlazarse y formar diferentes estructuras moleculares (formas alotrópicas). En la naturaleza se encuentra el grafito, diamante, fulereno o buckybola. 5

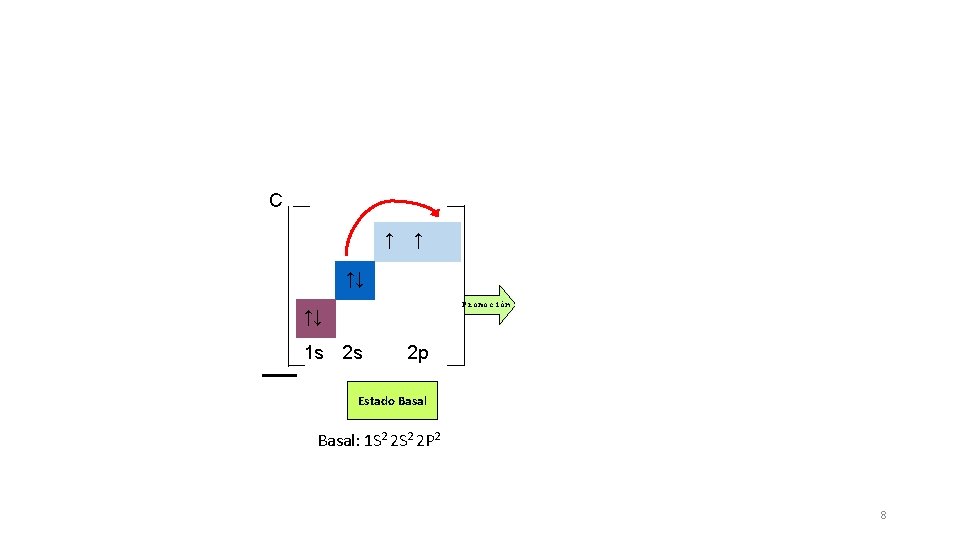
Características generales del carbono • No metal • Columna IV A 4 electrones de valencia • # atómico 6 6 protones y 6 electrones • Estructura electrónica del Carbono basal (no enlazado) Basal: 6 C = 1 s 2 2 p 2 Basal desarrollada: 1 s 2 2 px 1 2 py 1 2 pz (según esta configuración, el Carbono solo podría formar 2 enlaces, pero en la realidad tiene 4 electrones para enlazarse. ) 6

El CARBONO al formar compuestos siempre ES TETRAVALENTE (4 electrones para formar enlaces). ¿Cómo se explica esto? Con la hibridación del átomo de carbono: sp 3, sp 2 y sp • HIBRIDACIÓN: es la mezcla de orbitales de diferentes energías para poder formar orbitales equivalentes entre sí (orbitales híbridos). 7

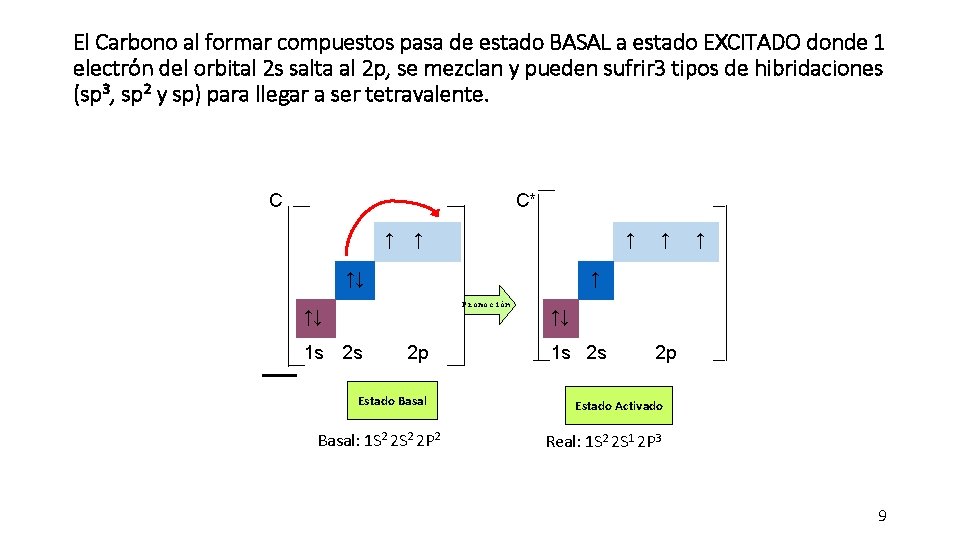
C C* ↑ ↑↓ ↑ ↑ Promoción ↑↓ 1 s 2 s ↑ 2 p Estado Basal: 1 S 2 2 P 2 ↑↓ 1 s 2 s 2 p Estado Activado Real: 1 S 2 2 S 1 2 P 3 8

El Carbono al formar compuestos pasa de estado BASAL a estado EXCITADO donde 1 electrón del orbital 2 s salta al 2 p, se mezclan y pueden sufrir 3 tipos de hibridaciones (sp 3, sp 2 y sp) para llegar a ser tetravalente. C C* ↑ ↑↓ ↑ ↑ Promoción ↑↓ 1 s 2 s ↑ 2 p Estado Basal: 1 S 2 2 P 2 ↑↓ 1 s 2 s 2 p Estado Activado Real: 1 S 2 2 S 1 2 P 3 9

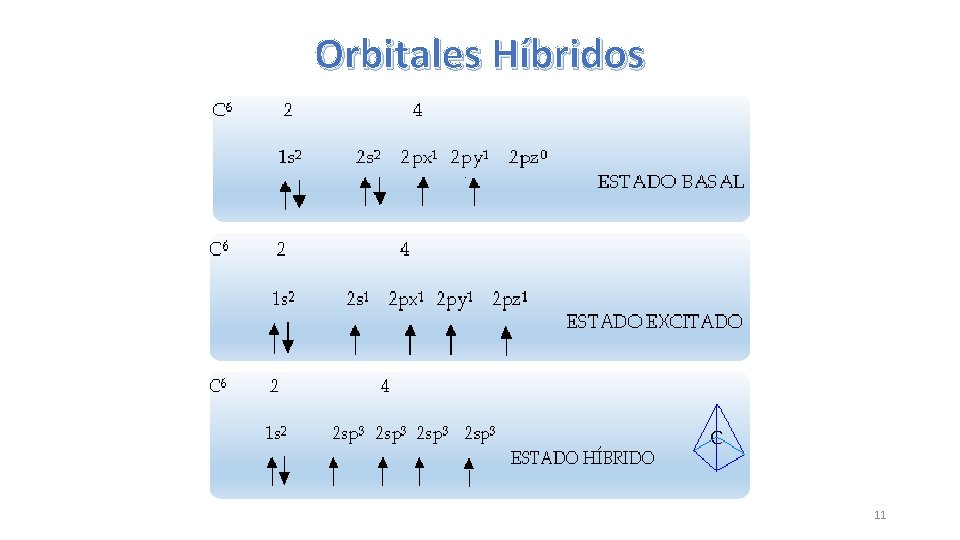
Hibridación sp 3 del Carbono • Se define como la combinación de 1 orbital 2 s con 3 orbitales 2 p • Formar 4 orbitales híbridos sp 3 • Se distribuyen en angulos de 109. 5º • Forman una molécula tetrahédrica • Forman los ALCANOS, familia de hidrocarburo saturados (presentan solo enlaces covalentes sencillos o simples) • Los enlaces simples se conocen como SIGMA ( ) CARBONO BASAL CARBONO EXCITADO CARBONO HIBRIDIZADO 10

Orbitales Híbridos 11

12

13

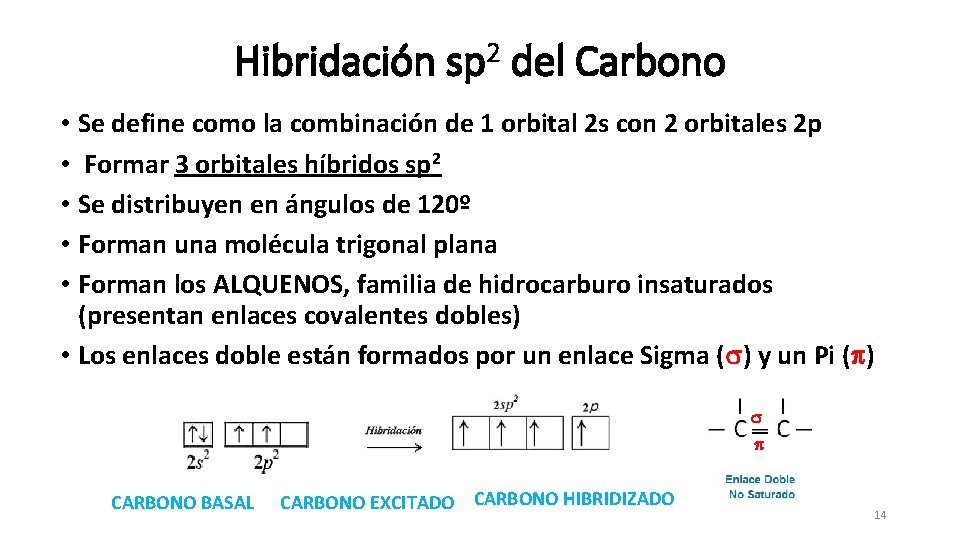
Hibridación sp 2 del Carbono • Se define como la combinación de 1 orbital 2 s con 2 orbitales 2 p • Formar 3 orbitales híbridos sp 2 • Se distribuyen en ángulos de 120º • Forman una molécula trigonal plana • Forman los ALQUENOS, familia de hidrocarburo insaturados (presentan enlaces covalentes dobles) • Los enlaces doble están formados por un enlace Sigma ( ) y un Pi ( ) CARBONO BASAL CARBONO EXCITADO CARBONO HIBRIDIZADO 14

Hibridación sp del Carbono • Se define como la combinación de 1 orbital 2 s con 1 orbitales 2 p • Formar 2 orbitales híbridos sp • Se distribuyen en angulos de 180º • Forman una molécula lineal • Forman los ALQUINOS, familia de hidrocarburo insaturados (presentan enlaces covalentes triples) • Los enlaces triples están formados por un enlace SIGMA y dos pi CARBONO BASAL CARBONO EXCITADO CARBONO HIBRIDIZADO 15

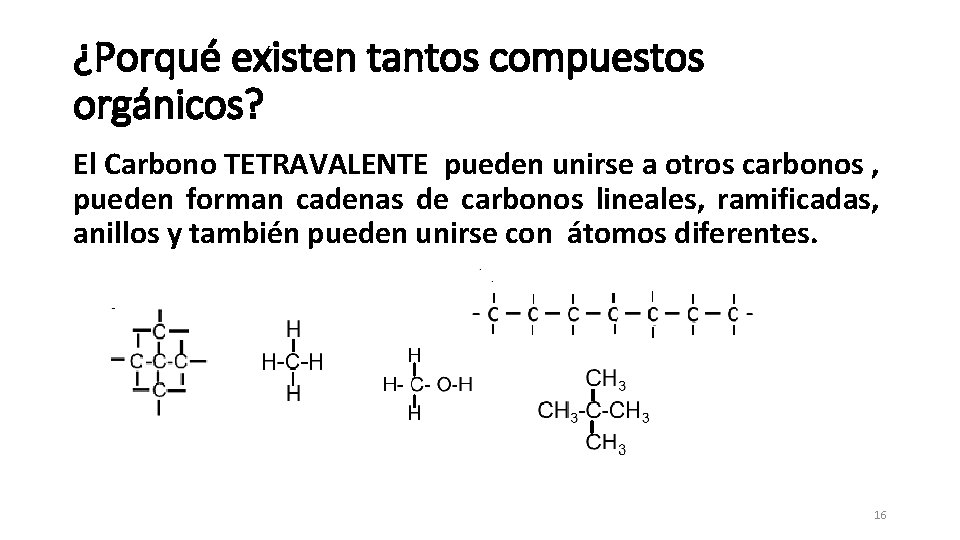
¿Porqué existen tantos compuestos orgánicos? El Carbono TETRAVALENTE pueden unirse a otros carbonos , pueden forman cadenas de carbonos lineales, ramificadas, anillos y también pueden unirse con átomos diferentes. 16

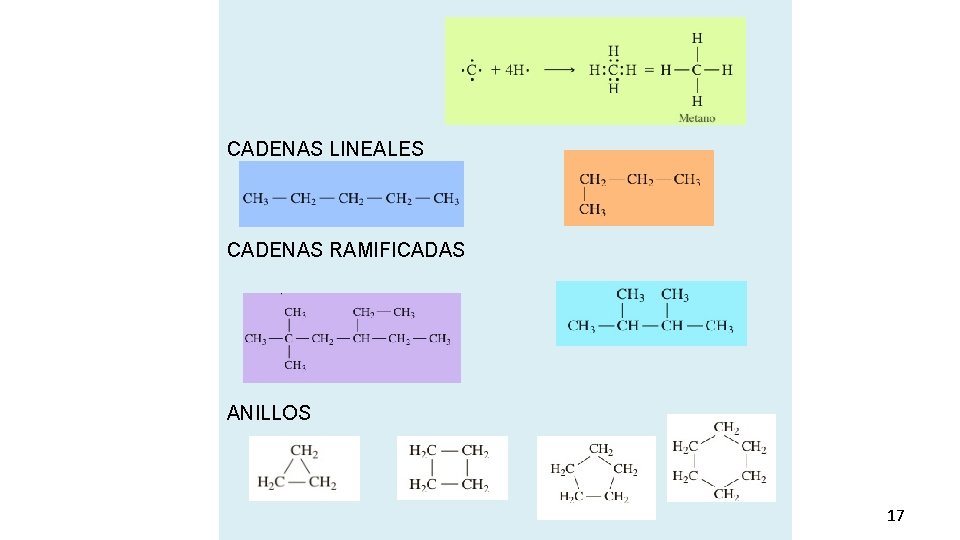
CADENAS LINEALES CADENAS RAMIFICADAS ANILLOS 17

Tipos de fórmulas para representar los compuestos orgánicos • Fórmula Global o Molecular • Fórmula Estructural A) Desarrollada o Expandida B) Condensada C) Escalonada o Esqueleto • Fórmula Global ó Molecular : representan el tipo y número de átomos que forman el compuesto, no representan sus enlaces. Ej: Pentano C 5 H 12 Sacarosa ( azúcar de mesa ) C 12 H 22 O 11 Glucosa C 6 H 12 O 6 Acido acético C 2 H 4 O 2 18

• Fórmula estructural Representa los símbolos de los elementos que forman la molécula, los enlaces se representan con líneas para mostrar los electrones involucrados en los enlaces, si se abrevia la fórmula, se usan subíndices para indicar el número de veces que aparece el elemento en la fórmula. Las fórmulas estructurales pueden ser : A) Estructural Desarrollada B) Estructural Condensada ó Expandida Ej: Hexano CH 3 -CH 2 -CH 3 ó más condensada CH 3(CH 2)4 CH 3 19

DESARROLLADA CONDENSADA CH 3(CH 2)2 CH 3

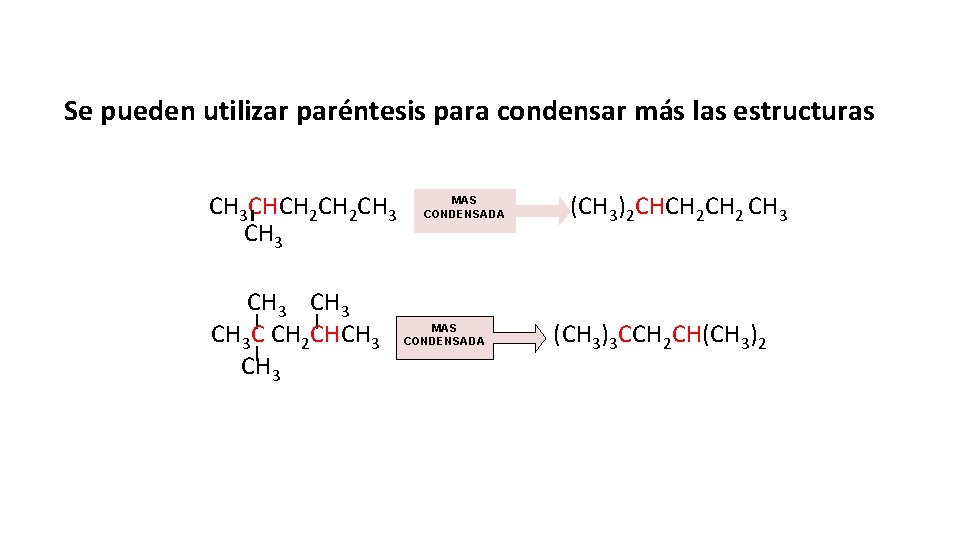
Se pueden utilizar paréntesis para condensar más las estructuras CH 3 CHCH 2 CH 3 | | CH 3 C CH 2 CHCH 3 | CH 3 MAS CONDENSADA (CH 3)2 CHCH 2 CH 3 (CH 3)3 CCH 2 CH(CH 3)2

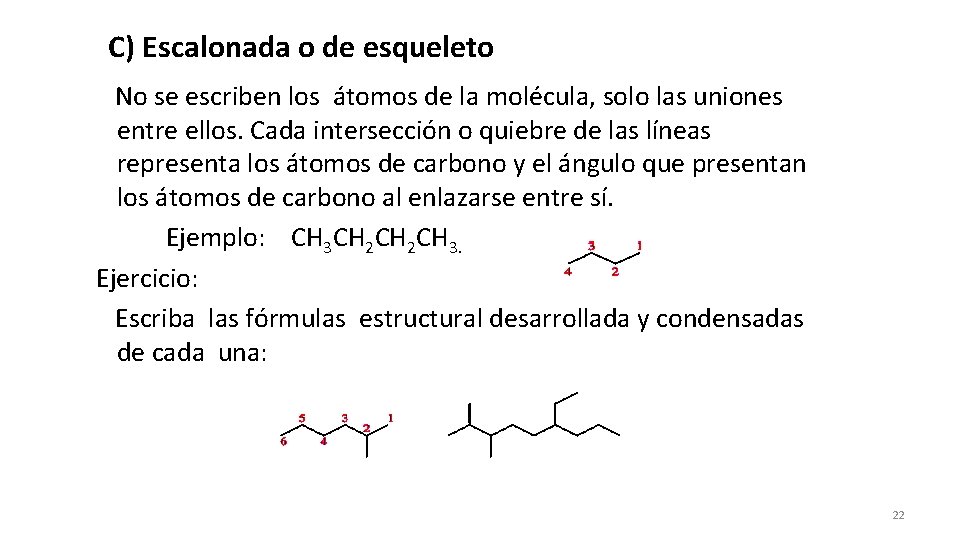
C) Escalonada o de esqueleto No se escriben los átomos de la molécula, solo las uniones entre ellos. Cada intersección o quiebre de las líneas representa los átomos de carbono y el ángulo que presentan los átomos de carbono al enlazarse entre sí. Ejemplo: CH 3 CH 2 CH 3. Ejercicio: Escriba las fórmulas estructural desarrollada y condensadas de cada una: 22

EJERCICIOS 1. Escriba la fórmula estructural desarrollada, condensada y escalonada de los siguientes compuestos a) C 3 H 8 b) C 5 H 12

EJERCICIOS 2. A partir de la siguiente fórmula: CH 3 CH 2 CH 2 CH 3, dibuje: a)Fórmula molecular : b)Fórmula estructural desarrollada: c)Formula de líneas ( esqueleto):

Clasificación de los átomos de Carbono e Hidrógeno 1) Carbono primario: se encuentra unido a un solo carbono, siempre esta en algún extremo de la molécula (izquierda, derecha, arriba, abajo). H 1º. Se une a un C 1º 2)Carbono secundario: se encuentra unido a dos carbonos. H 2º. Se une a un C 2º. 3) Carbono Terciario: se encuentra unido a tres carbonos. H 3º. Se une a un C 3º. 4) Carbono cuaternario: se encuentra unido a cuatro carbonos. No hay H 4º. 25

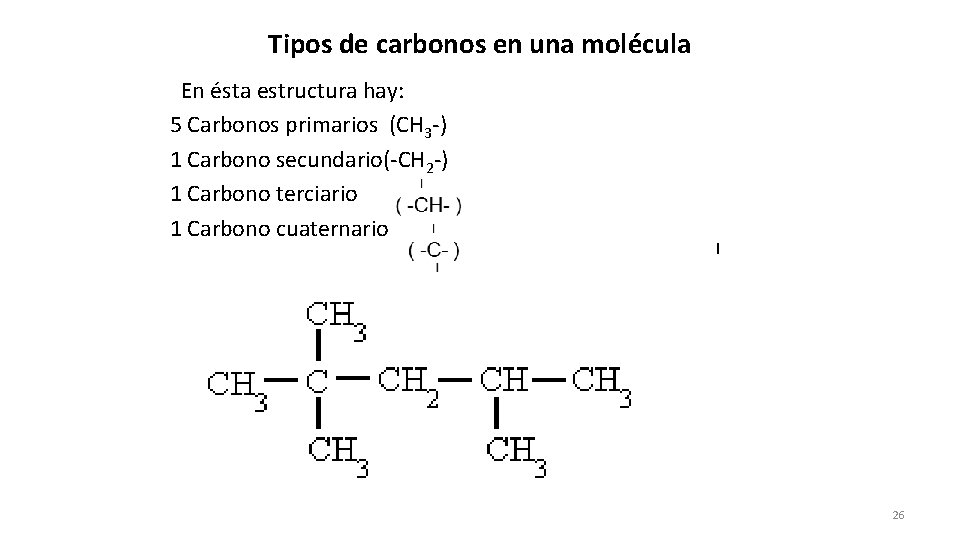
Tipos de carbonos en una molécula En ésta estructura hay: 5 Carbonos primarios (CH 3 -) 1 Carbono secundario(-CH 2 -) 1 Carbono terciario 1 Carbono cuaternario I 26

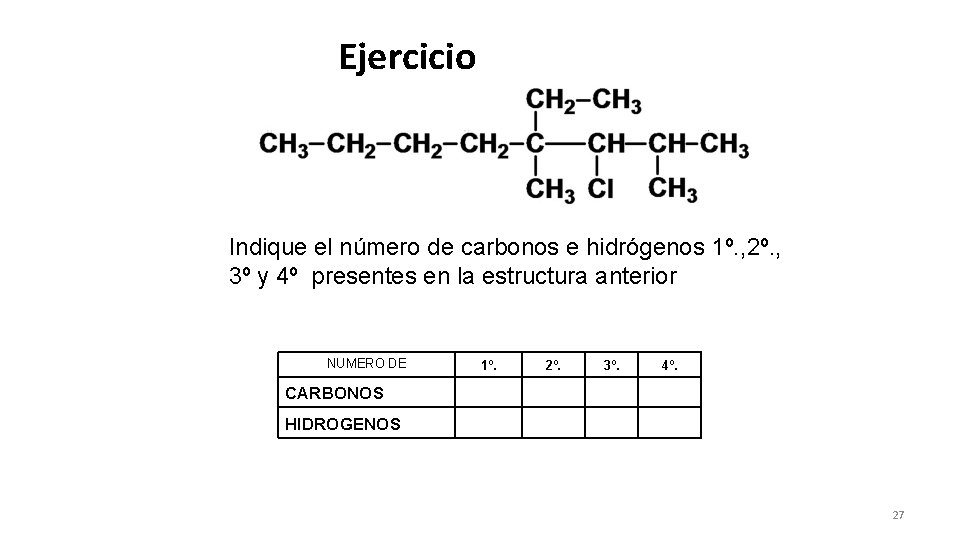
Ejercicio Indique el número de carbonos e hidrógenos 1º. , 2º. , 3º y 4º presentes en la estructura anterior NUMERO DE 1º. 2º. 3º. 4º. CARBONOS HIDROGENOS 27

ISOMERIA (iso=igual, mero=parte) • Característica que presentan algunos compuestos, que tienen la misma fórmula global ó molecular pero sus fórmulas estructurales son diferentes. • Debido a la isomería existen millones de compuestos orgánicos. En los compuestos inorgánicos la isomería es poco común. • Los isómeros pueden tener propiedades físicas y químicas diferentes. 28

29

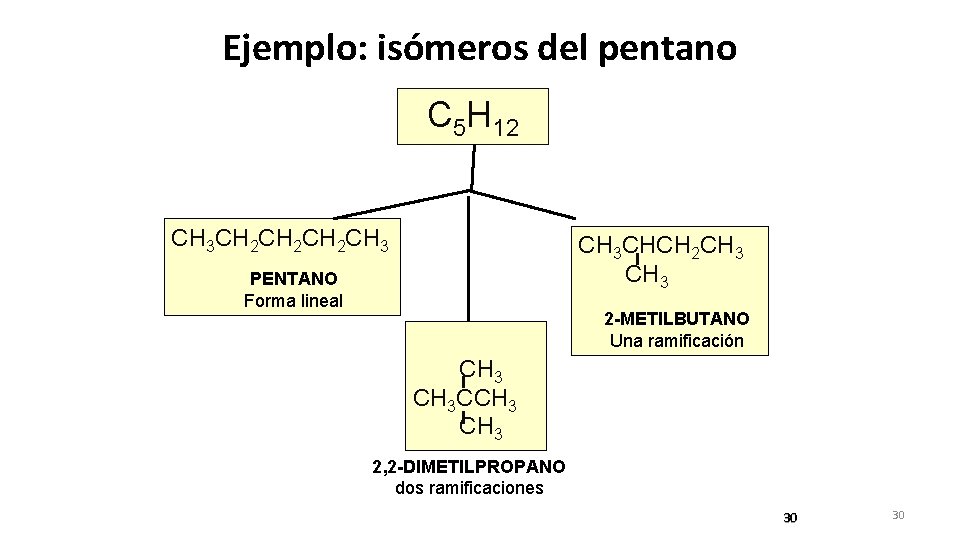
Ejemplo: isómeros del pentano C 5 H 12 CH 3 CH 2 CH 2 CH 3 CHCH 2 CH 3 PENTANO Forma lineal 2 -METILBUTANO Una ramificación CH 3 CCH 3 2, 2 -DIMETILPROPANO dos ramificaciones 30 30

Isómeros estructurales A) De esqueleto ó cadena • Estos isómeros se diferencian en que unos son lineales, otros ramificados, otros cíclicos. Ej: CH 3 -CH 2 -CH 2 -CH 3 lineal cíclico ramificado Los dos tienen la misma fórmula molecular C 6 H 14 pero sus fórmulas estructurales son diferentes. Ejercicio: escriba otro isómero de este compuesto pero que presente 4 carbonos primarios. 31

B) Isomería de posición • Estos isómero se diferencian en la posición que presenta un grupo ó sustituyente ó enlace en la cadena carbonada. Ej: Isómeros de posición con la fórmula molecular C 3 H 7 Cl 1) CH 3 CH 2 Cl 1 -Cloropropano (el cloro está en el carbono # 1) 2) CH 3 CHCH 3 2 -cloropropano (el cloro esta en el carbono #2) Cl Ej: Isómeros de posición con fórmula molecular C 4 H 8 1) CH 3 CH=CHCH 3 2 - Buteno (doble enlace entre C 2 y C 3 ) 2) CH 3 CH 2 CH=CH 2 1 -Buteno (doble enlace entre C 1 y C 2) 32

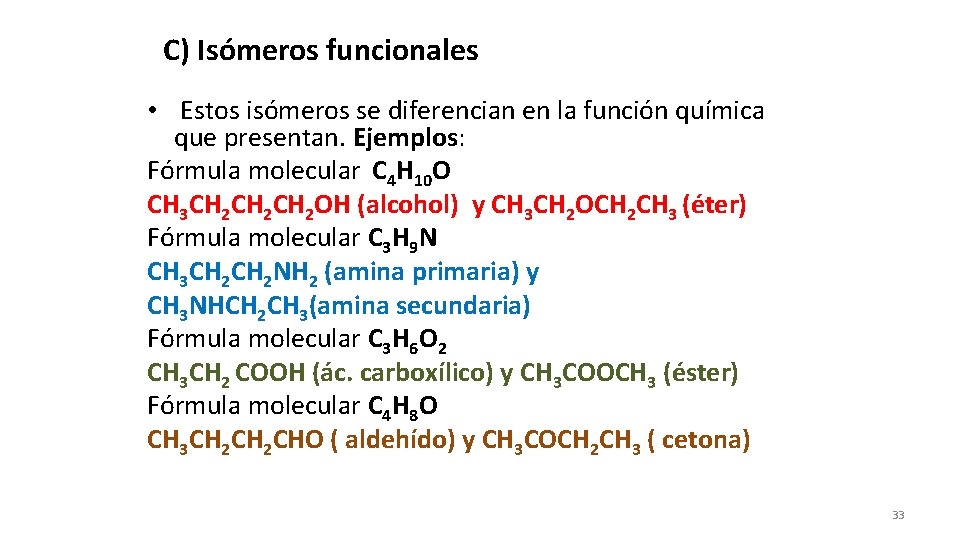
C) Isómeros funcionales • Estos isómeros se diferencian en la función química que presentan. Ejemplos: Fórmula molecular C 4 H 10 O CH 3 CH 2 CH 2 OH (alcohol) y CH 3 CH 2 OCH 2 CH 3 (éter) Fórmula molecular C 3 H 9 N CH 3 CH 2 NH 2 (amina primaria) y CH 3 NHCH 2 CH 3(amina secundaria) Fórmula molecular C 3 H 6 O 2 CH 3 CH 2 COOH (ác. carboxílico) y CH 3 COOCH 3 (éster) Fórmula molecular C 4 H 8 O CH 3 CH 2 CHO ( aldehído) y CH 3 COCH 2 CH 3 ( cetona) 33

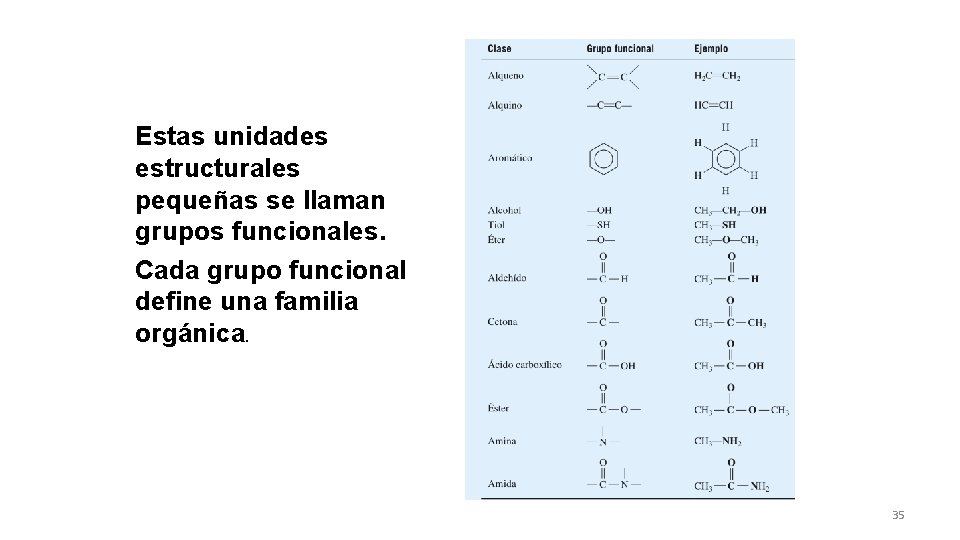
Grupos funcionales: • Son átomos, grupos de átomos o enlaces específicos, que al estar presentes en un compuesto orgánico, le dan características y propiedades propias que lo van a identificar y a distinguir de otros compuestos. 34

Estas unidades estructurales pequeñas se llaman grupos funcionales. Cada grupo funcional define una familia orgánica. 35

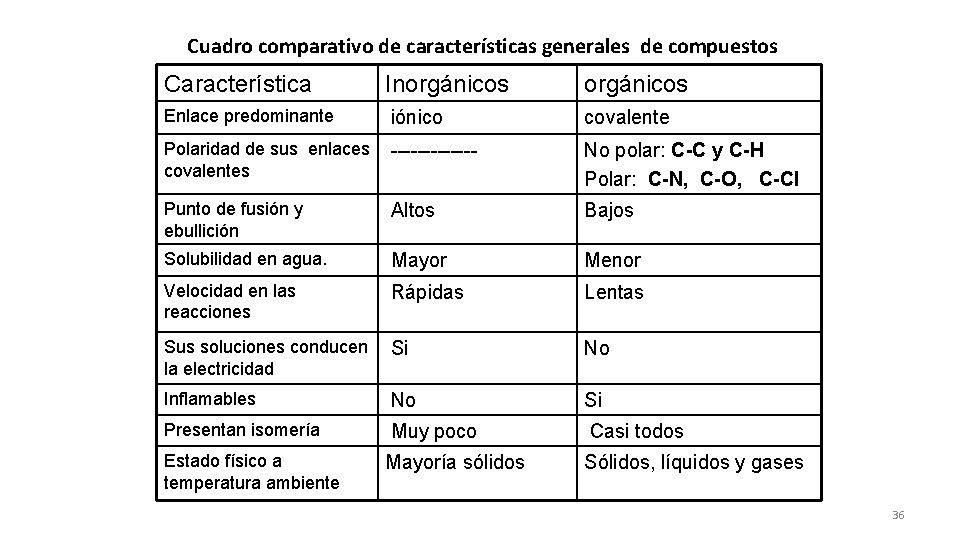
Cuadro comparativo de características generales de compuestos Característica Inorgánicos Enlace predominante iónico covalente Polaridad de sus enlaces covalentes ------- No polar: C-C y C-H Polar: C-N, C-O, C-Cl Punto de fusión y ebullición Altos Bajos Solubilidad en agua. Mayor Menor Velocidad en las reacciones Rápidas Lentas Sus soluciones conducen la electricidad Si No Inflamables No Si Presentan isomería Muy poco Casi todos Mayoría sólidos Sólidos, líquidos y gases Estado físico a temperatura ambiente 36

Hidrocarburos Son los compuestos orgánicos que contienen únicamente átomos de carbono e hidrógeno (C, H) HIDROCARBUROS ALIFATICOS SATURADOS ALCANOS AROMATICOS INSATURADOS ALQUENOS AROMATICOS POLINUCLEARES BENCENO ALQUINOS 37

ALIFÁTICOS (del griego aleiphar que significa grasa o aceite) Los Hidrocarburos alifáticos solo forman cadenas abiertas. Pueden ser saturados o insaturados. Y se subdividen en familias: alcanos, alquenos y alquinos. ALCANOS ALQUENOS ALQUINOS C-C C=C CΞC 38

HIDROCARBUROS SATURADOS Formados por átomos de carbono e hidrógeno. Saturado se refiere al tipo de enlaces de la molécula. Significa que cada átomo de carbono se encuentra unido en forma covalente a otros cuatro átomos mediante enlaces sencillos. 39

ALCANOS También llamados Parafinas del latín parum affinus que significa poca afinidad. FORMULA GENERAL ALCANOS Cn. H 2 n+2 40

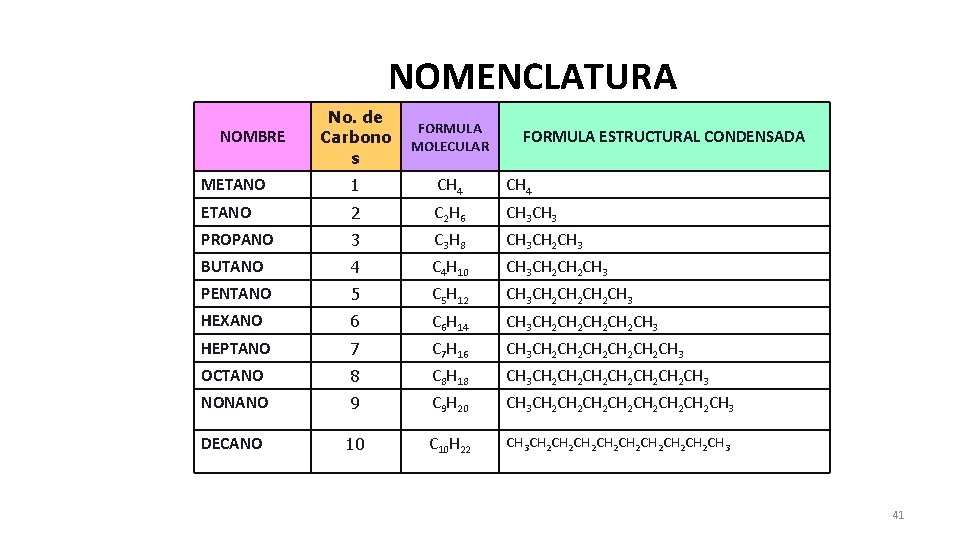
NOMENCLATURA No. de Carbono s FORMULA MOLECULAR METANO 1 CH 4 ETANO 2 C 2 H 6 CH 3 PROPANO 3 C 3 H 8 CH 3 CH 2 CH 3 BUTANO 4 C 4 H 10 CH 3 CH 2 CH 3 PENTANO 5 C 5 H 12 CH 3 CH 2 CH 2 CH 3 HEXANO 6 C 6 H 14 CH 3 CH 2 CH 2 CH 3 HEPTANO 7 C 7 H 16 CH 3 CH 2 CH 2 CH 2 CH 3 OCTANO 8 C 8 H 18 CH 3 CH 2 CH 2 CH 2 CH 3 NONANO 9 C 9 H 20 CH 3 CH 2 CH 2 CH 3 DECANO 10 C 10 H 22 CH 3 CH 2 CH 2 CH 3 NOMBRE FORMULA ESTRUCTURAL CONDENSADA 41

No. de carbonos FORMULA MOLECULAR FORMULA ESTRUCTURAL CONDENSADA UNDECANO 11 C 11 H 24 CH 3(CH 2)9 CH 3 DODECANO 12 C 12 H 26 CH 3(CH 2)10 CH 3 TRIDECANO 13 C 13 H 28 CH 3(CH 2)11 CH 3 TETRADECANO 14 C 14 H 30 CH 3(CH 2)12 CH 3 PENTADECANO 15 C 15 H 32 CH 3(CH 2)13 CH 3 HEXADECANO 16 C 16 H 34 CH 3(CH 2)14 CH 3 HEPTADECANO 17 C 17 H 36 CH 3(CH 2)15 CH 3 OCTADECANO 18 C 18 H 38 CH 3(CH 2)16 CH 3 NONADECANO 19 C 19 H 40 CH 3(CH 2)17 CH 3 EICOSANO 20 C 20 H 42 CH 3(CH 2)18 CH 3 NOMBRE 42

Serie homóloga • Son miembros de una misma familia de compuestos orgánicos que se diferencia uno del otro por un grupo -CH 2 - (metilén) de más o de menos en su estructura. Ej: CH 3 CH 2 CH 3 CH 2 CH 2 CH 3 43

Ejercicios: A partir de la fórmula CH 3(CH 2)6 CH 3 escriba: 1. Fórmula molecular 2. Fórmula escalonada ó de esqueleto 3. Fórmula estructural desarrollada 4. Carbonos 1º y 2º 5. Tres características de los compuestos orgánicos que presenta este compuesto 6. Una fórmula que representa a un isómero de cadena o esqueleto del compuesto. 44

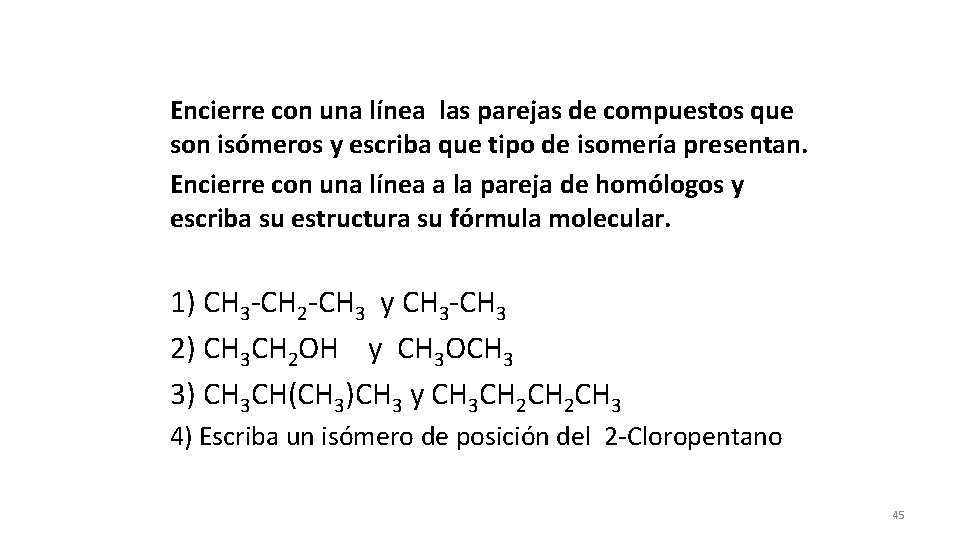
Encierre con una línea las parejas de compuestos que son isómeros y escriba que tipo de isomería presentan. Encierre con una línea a la pareja de homólogos y escriba su estructura su fórmula molecular. 1) CH 3 -CH 2 -CH 3 y CH 3 -CH 3 2) CH 3 CH 2 OH y CH 3 OCH 3 3) CH 3 CH(CH 3)CH 3 y CH 3 CH 2 CH 3 4) Escriba un isómero de posición del 2 -Cloropentano 45

Indique cuántos carbonos primarios, secundarios, terciarios y cuaternarios presenta la estructura y escriba su fórmula global ó molecular y condensada: 46
 Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Induccin
Induccin Introduccin
Introduccin Introducción de las enzimas
Introducción de las enzimas Qumica
Qumica Homogneo
Homogneo Gas carbônico
Gas carbônico Considere os íons
Considere os íons Notação de lewis
Notação de lewis Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Unip mecatronica
Unip mecatronica Qumica
Qumica Notação de lewis
Notação de lewis Qumica
Qumica Qumica
Qumica Feromonios
Feromonios Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Clasificacion de compuesto inorganico
Clasificacion de compuesto inorganico Qumica
Qumica Qumica
Qumica Fuerzas dipolo dipolo ejemplos
Fuerzas dipolo dipolo ejemplos Qumica
Qumica Moléculas polares e apolares exemplos
Moléculas polares e apolares exemplos Setas curvas
Setas curvas Teoria de thomson
Teoria de thomson Qumica
Qumica Qumica
Qumica Características del ácido clorhídrico
Características del ácido clorhídrico Celdas
Celdas Qumica
Qumica Qumica
Qumica Qumica
Qumica Atomos de carbono
Atomos de carbono Poluição das águas
Poluição das águas Qumica
Qumica Qumica
Qumica Qumica
Qumica Escriba la formula de los siguientes compuestos
Escriba la formula de los siguientes compuestos Cintica
Cintica



































































