Toma de muestra Dr Rolando Soloaga Director Carrera























































































































































- Slides: 179

Toma de muestra. Dr. Rolando Soloaga Director Carrera de Especialista en Microbiología Clínica, Univesidad Católica Argentina Profesor Asociado, Microbiología Medicina, Universidad del Salvador Profesor Adjunto. Especialidad en Enfermedades Infecciosas, UCA Asesor científico. Microbiología, Hospital Naval, Buenos Aires. Medical Approach Biomerieux, Argentina.

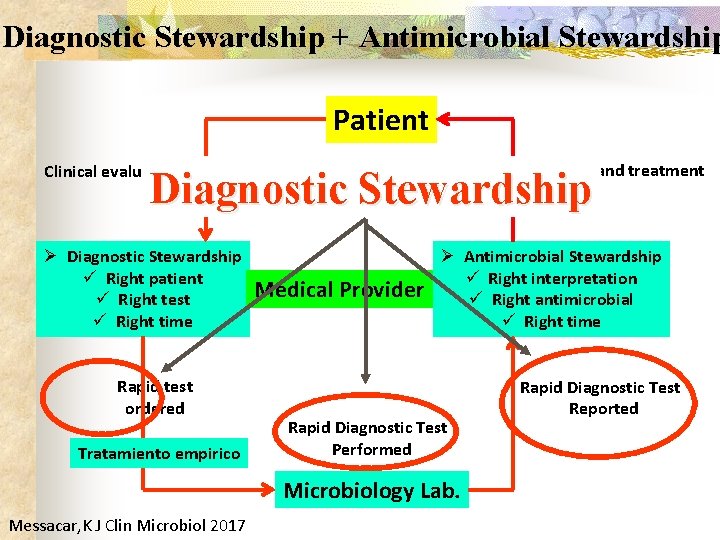
Diagnostic Stewardship + Antimicrobial Stewardship Patient Diagnosis and treatment Clinical evaluation Diagnostic Stewardship Ø Diagnostic Stewardship ü Right patient ü Right test ü Right time Rapid test ordered Tratamiento empirico Medical Provider Ø Antimicrobial Stewardship ü Right interpretation ü Right antimicrobial ü Right time Rapid Diagnostic Test Performed Microbiology Lab. Messacar, K J Clin Microbiol 2017 Rapid Diagnostic Test Reported

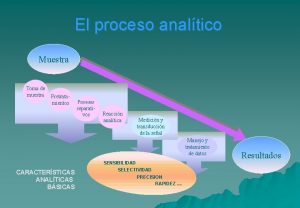
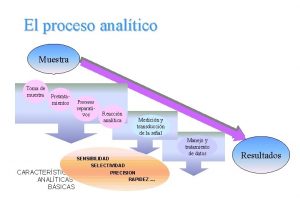
Correcta toma y transporte de muestras Estandarización y optimización Siembra Interpretación Identificación Sensibilidad Optimización de la comunicación del resultado

Etapa pre-analítica ü Aceptación de muestras erróneas ü Incorrecta obtención y/o transporte ü Recepción equivocada ü Pueden reducirse elaborando manuales de procedimientos ü ü muestras adecuadas y las inaceptables para cada infección criterios de rechazo de diferentes muestras transporte recepción de las mismas.

Datos mínimos del paciente. Optimización del procesamiento n n n Procedencia Edad y sexo Datos epidemiológicos de relevancia n n n Tratamiento ATB Enfermedad de base n n n Ocupación Viajes Contacto con enfermos, animales Consumo de alimentos o agua no seguros IC (neutropénicos, HIV, transplantados) Diabéticos Fibroquísticos Colagenopatías Factor de riesgo n Presencia de catéteres, sonda vesical, ARM, otros dispositivos médicos, herida quirúrgica, quemaduras, malformaciones, etc

Etapa pre-analítica ü Recepción de la muestra: muestra ü Falta de control de la orden médica y de lo que dice el envase de la muestra pueden ocasionar errores en ü ü trazabilidad que lleven a asignarle un espécimen a un paciente erróneo asignarle una muestra errónea a un paciente (por ejemplo líquido ascítico en lugar de orina)

Etapa pre-analítica ü Errores asociados a datos insuficientes ü Hemocultivos de pacientes con válvula cardíaca protésica, parches vasculares, marcapasos, o aislamientos de shunts, prótesis osteoarticulares y líquido pleural de pacientes con cirugía torácica previa. ü Subestimación de aislamientos de SCN, de difteroides, P. acnes como contaminantes.

Etapa pre-analítica ü Errores asociados a datos insuficientes ü Muestras de orina de pacientes con reflujo vesico-ureteral, sonda vesical o con catéteres doble J: ü Subestimación uropatógeno. de aislamientos con más de 1

Etapa pre-analítica ü Errores asociados a datos insuficientes ü Paciente pediátrico con otitis media persistente y aislamiento de un difteroide: ü Subestimación de aislamientos de Turicella otitidis.

Etapa pre-analítica ü Errores asociados a datos insuficientes ü Sepsis en un paciente VIH ü ü Métodos que optimizen la detección de H. capsulatum, C. neoformans y de micobacterias (lisis centrifugación o frascos especiales de Bactec o de Bact-Alert). Trabajo en un matadero, veterinaria, frigorífico y otras tareas rurales y cuadro toxémico y escara negra ü Ausencia del dato epidemiológico y/o del tipo de lesión lleva a subestimar como contaminante a Bacillus spp, que podría tratarse en realidad de B. anthracis

Etapa pre-analítica ü Errores asociados a datos insuficientes ü Edad adolescente + rash + faringitis ü Arcanobacterium haemolyticum y para visualizar mejor la beta hemolisis, se tendria que sembrar en medios especiales (con sangre de conejo o humana). ü Angina pseudomembranosa o de gingivitis necrotizante ü sub-diagnóstico de Angina de Vincent o de difteria ü Falta de agregado de Gram o de medio de Loeffler.

Toma de muestra. Bio. Seguridad n n Se deben obtener siempre con guantes, guardapolvo y eventualmente máscaras y anteojos. Los recipientes deben ser a prueba de filtraciones, dentro de una bolsa plástica con un compartimiento separado para la orden. Nunca enviar jeringas con agujas al laboratorio. Transferir a tubo estéril o sacar aguja y colocar tapa apropiada. Nunca transportar recipientes con fisuras.

Toma de muestra. Consideraciones generales n n Seleccionar correctamente el sitio para obtener la muestra y utilizar una técnica adecuada: S y E. Evitar contaminación con flora normal: E. Tomar volumen o cantidad suficiente de muestra para evitar falsos negativos: S. NUNCA refrigerar muestras en las que se busquen anaerobios, N. gonorrhoeae, N. meningitidis, Shigella, H. influenzae: S. n n n LCR Muestras genitales Oculares Oído medio. Hemocultivos

Toma de muestra. Consideraciones generales n Consecuencias de los factores que disminuyen la sensibilidad de una muestra. n n n Falta de cobertura ATB adecuada del germen causal. Mayor morbi-mortalidad Consecuencias de los factores que disminuyen la especificidad. n n Tratamiento ATB innecesario Cobertura ATB errónea Costos elevados Presión de selección de cepas resistentes

Etapa pre-analítica ü Errores en toma de muestra. Contaminación con microorganismos de piel n ningún antiséptico actúa en forma instantánea n n n Clorhexidina y alcohol iodado al 1 -2% actúan en 30 segundos iodo-povidona demora alrededor de 2 minutos Principal punto donde se contaminan las diversas muestras de líquidos estériles. Presencia de tejidos necróticos o de escara superficial n si la muestra (aún de tejidos vitales) se obtiene atravesando dicha zona n Contaminación con microorganismos colonizantes superficiales es casi segura.

Etapa pre-analítica ü Muestras de baja especificidad. Los hisopados nasales y los de oído para el diagnóstico de sinusitis y de otitis media Osteomielitis crónica ü Hisopado de fístulas no guarda correlación con biopsia ósea Pie diabético y úlceras por decúbito ü Hisopado no guarda correlación con muestras de punciön/biopsia de tejios vitales Neumonía nosocomial ü ü cultivo de esputo carece de especificidad colonización orofaríngea-traqueal con microorganismos nosocomiales (en las primeras 48 h de internación).

Toma de muestra. Fuentes de contaminación Sitio de Infección Fuente de contaminación Vejiga Uretra y perineo Sangre, LCR, Líquido articular, Líquido pleural, Líquido ascítico, Líquido pericárdico Sitio de punción y tapa del frasco de hemocultivo Endometrio Vagina Oído medio Canal externo del oído Senos nasales Nasofaringe, piel del pcte Infecciones de piel y partes blandas Piel Humor vítreo Conjuntiva

Muestras para búsqueda de anaerobios Muestra aceptable Muestra NO aceptable Muestras por punción/aspiración BAL no protegido, muestras no broncoscópicas Glándula de Bartholino Esputo y aspirado endotraqueal Bilis Lavado bronquial Sangre, líquido pleural, ascítico, articular, LCR Hisopado faríngeo y nasofaríngeo BAL protegido y cepillo protegido Loquia Material de culdocentesis Heces o hisopado rectal Trompas de Fallopio, utero, ovario Hisopado uretral Punción de senos nasales y de oído medio Orina por catéter o micción limpia Punción suprapúbica Heces para C. difficcile DIU para Actinomyces spp Material abdominal

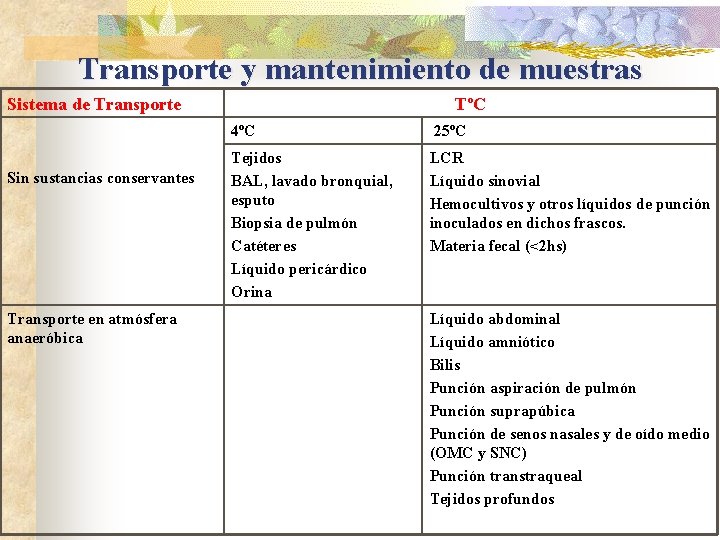
Transporte y mantenimiento de muestras Sistema de Transporte Sin sustancias conservantes Transporte en atmósfera anaeróbica TºC 4ºC 25ºC Tejidos BAL, lavado bronquial, esputo Biopsia de pulmón Catéteres Líquido pericárdico Orina LCR Líquido sinovial Hemocultivos y otros líquidos de punción inoculados en dichos frascos. Materia fecal (<2 hs) Líquido abdominal Líquido amniótico Bilis Punción aspiración de pulmón Punción suprapúbica Punción de senos nasales y de oído medio (OMC y SNC) Punción transtraqueal Tejidos profundos

Transporte y mantenimiento de muestras Sistema de Transporte TºC 4ºC Hemocultivos, medula ósea y otros líquidos de punción estériles (LCR, articular, ascítico, pleural, humor vítreo). Raspado de córnea Gonococos (JEMBEC) Bordetella (Regan Lowe, Bordet Gengou) Muestras inoculadas directamente en medios de cultivo En medios de Transporte Stuart Amies Cary Blair 25ºC Coprocultivos (24 HS) Hisopado cervical Hisopado conjuntival Cultivos genitales Hisopado nasofaríngeo Coprocultivo (48 hs)

Criterios de rechazo de Muestras Debe notificarse inmediatamente al médico responsable y el motivo del mismo. Muestras en botellas de hemocultivos rotas o con fisuras Recipientes con evidente contaminación externa Muestras no identificadas o que no correspondan con lo que dice la orden médica Esputos para gérmenes comunes con gran contenido de saliva macroscópica Muestras no representativas para el sitio de infección considerado

Muestras que NO deben ser procesadas n n n n n Punta de sonda vesical Bolsa colectora Tubo endotraqueal Punta de drenaje pleural Hisopados de escaras y otros tejidos necróticos. Gasas. Hisopados de fístulas Materia fecal forme (en el caso de sospecha de diarrea) Vómito y aspirado gástrico Loquia

n Hemocultivos

HEMOCULTIVOS? SIGNOS/SINTOMAS DE BACTERIEMIA (FIEBRE, ESCALOFRIOS, TAQUICARDIA) FIEBRE Y BAJO NIVEL SERICO DE ALBUMINA O INSUFICIENIA RENAL O POBRE ESTADO FUNCIONAL FIEBRE O HIPOTENSION NO EXPLICADAS POR CAUSAS NO INFECCIOSAS EN AUSENCIA DE FIEBRE: Infecciones focales (neumonía, meningitis, osteomielitis) Pacientes añosos con deterioro (confusión mental, caídas frecuentes) Insuficiencia renal y leucocitosis o alteración mental Inmunocomprometidos con insuficiencia respiratoria, renal o hepática TRATAMIENTO ANTIBIOTICO POR EPISODIO DE BACTERIEMIA (CONTROL) Seguimiento de fungemias y bacteriemias por S. aureus para descartar focos secundarios Inestabilidad hemodinamica, deterioro, falla a responder Chandrasekar, P; Brown, W. Arch intern Med, 154. 1994

HEMOCULTIVOS ENDOCARDITIS INFECCIONES RELACIONADAS A CATETERES, MARCAPASOS Y PROTESIS VASCULARES. SINDROME FEBRIL EN PACIENTES INMUNOCOMPROMETIDOS. FIEBRE DE ORIGEN DESCONOCIDO. PERITONITIS BACTERIANA ESPONTANEA. MENINGITIS. MEDIASTINITIS. INFECCIONES OSTEOARTICULARES AGUDAS NEUMONIA GRAVE QUE REQUIERE INTERNACION. ABSCESOS EN ORGANOS PROFUNDOS EPIGLOTITIS.

n n Desinfección del tapón del frasco Antisepsia de la piel n n n Alcohol de 70º Clorhexidina o alcohol iodado 1 -2% (30 s) o yodo povidona (1, 5 -2’) Alcohol de 70º

n n n No refrigerar los frascos!!!!!! Idealmente introducirlos lo más rapidamente en la estufa de cultivo. Caso contrario conservarlos a temperatura ambiente.

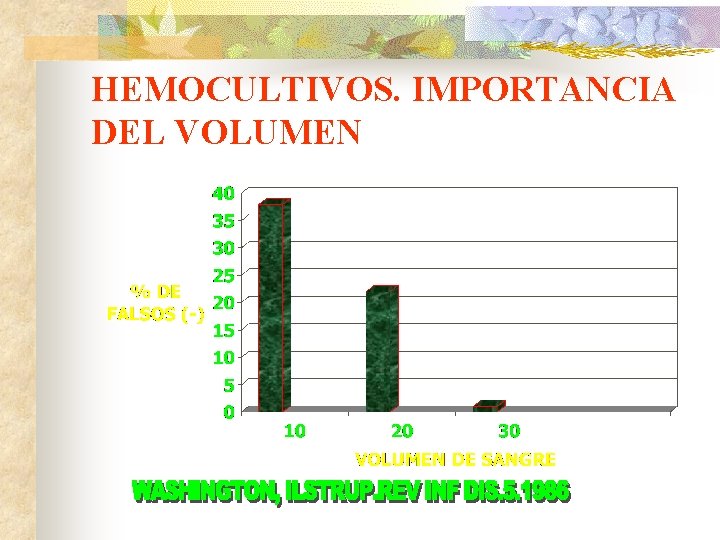
IMPORTANCIA DEL VOLUMEN DE SANGRE CULTIVADA

Independientemente de la edad del paciente y del método de hemocultivo, es la variable más importante en lo concerniente a la sensibilidad. Baron, E; Weinstein, M; Dunne, W; Yagupsky, P; Welch, D; Wilson, D. Cumitech Blood Cultures IV. 2005 Arpi, M, Eur Jclin Microbiol Infect Dis, 8, 1989. Cockerill, F. Clin Infect Dis, 38, 2004. Hall, M. J Clin Microbiol, 3. 1976 Ilstrupt, D; washington, J. Diagns Microbiol Infect Dis, 1. 1983 Li, J. J Clin Microbiol, 32. 1994. Mermel, L; Maki, D. Ann Intern med, 119. 1993. Plord, J. J Clin Microbiol, 22. 1985 Sandven, P. Acta pathol Microbiol Scand, 89. 1981 Tenney, J. J Clin Microbiol, 15. 1982 Washington, J. CRC Press, 1978.

HEMOCULTIVOS. IMPORTANCIA DEL VOLUMEN

Importancia del volumen en adultos Cockerill, F. J Clin Microbiol, 38. 2004 Bactec 9240 Dos muestras de 20 ml (siembra de 10 ml por frasco) separadas por 30’. En pacientes sin endocarditis: 20 ml vs 10 ml incrementaban el rendimiento en 30% 30 ml vs 10 ml incrementa en 47% 40 ml vs 30 ml incrementa solo 7%

El volumen en los países latinos Bouza, E. J Clin Microbiol, 45. 2007 Bactec 9240 Nº hemocultivos: 12. 643. Nº BAC: 581 Nº hemocultivos/pcte: 3 Volumen de sangre/pcte: 31. 52 ± 15. 15 Volumen por punción 10. 42 ± 6. 03 Por análisis multivariado, mayores V de sangre se asociaban con hemocultivos positivos Incremento en la detección de 3, 3% por cada ml adicional.

Importancia del volumen de sangre cultivada Incremento medio del 3, 5% por cada ml adicional (rango 0, 6 -4, 7%) Bouza, E. J Clin Microbiol. 2007. 45 Mermel, L; Maki, D. Ann Intern Med. 1993. 119 Mensa, J. Med Clin (Barcelona). 1997. 108 Brown, D. J Clin Pathol. 1990. 43 Hall, M. J Clin Microbiol. 1976. 17 Ilstrup, D; Washington, J. Diagn Microbiol Infect. 1983. 1. Plorde, J. J Clin Microbiol. 1985. 22 Sandven, P. Acta Pathol Microbiol Scand. 1981. 89 Tenney, J. J Clin Microbiol. 15

HEMOCULTIVOS. IMPORTANCIA DEL VOLUMEN EN PEDIATRIA KELLOGG, J. J CLIN MICROBIOL. 38, 2000. Media (años): 2, 2 Mediana (años): 0, 6 Rango (años): 0 -15 N DE EPISODIOS: 121 Nº DE MICROORGANISMOS: 147. RECUENTOS UFC/ML <1 1, 1 -10 >10 % DE AISLAMIENTOS 23 37 40

RAZONES DEL BAJO VOLUMEN DE SANGRE HEMOCULTIVADO EN NEONATOS è Argumentación frecuente Dificultades en tomar la muestra Preocupación acerca de la volemia en estos pacientes Evitar transfusiones después de repetidas punciones por diversos motivos Empezar antibiótico sin retraso 4 Kellog, J. J Clin Microbiol, 38. 2000.

VENTAJAS DE VOLUMEN DE SANGRE CORRECTO EN NEONATOS è El porqué de >1 ml hemocultivado y más de 1 muestra tomada Incremento en la detección de bacteriemia. Mejor discriminación de contaminantes. Discontinuar terapia innecesaria. Optimización de la terapia antibiótica. Reducción de costos y de presión de selección de cepas resistentes. 4 Kellog, J. J Clin Microbiol, 38. 2000.

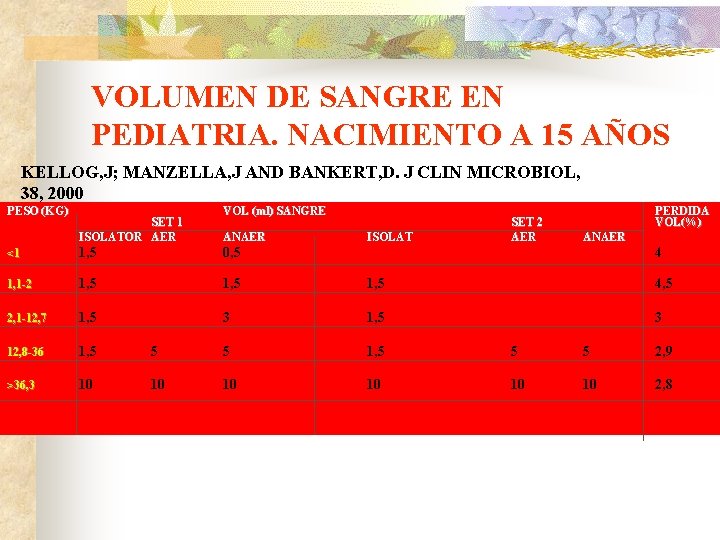
VOLUMEN DE SANGRE EN PEDIATRIA. NACIMIENTO A 15 AÑOS KELLOG, J; MANZELLA, J AND BANKERT, D. J CLIN MICROBIOL, 38, 2000 PESO (KG) SET 1 ISOLATOR AER VOL (ml) SANGRE ANAER ISOLAT SET 2 AER PERDIDA VOL(%) ANAER <1 1, 5 0, 5 4 1, 1 -2 1, 5 4, 5 2, 1 -12, 7 1, 5 3 12, 8 -36 1, 5 5 5 2, 9 >36, 3 10 10 10 2, 8

HEMOCULTIVOS CONTROL DE CALIDAD EN LA ETAPA PRE-ANALITICA n n Rodriguez, L; Carrara, C; Soloaga, R; Querejeta, M; Jaian, C. Sección Microbiología, Hospital General de Agudos “Dr Teodoro Alvarez” CONGRESO DE SADEBAC, 2006

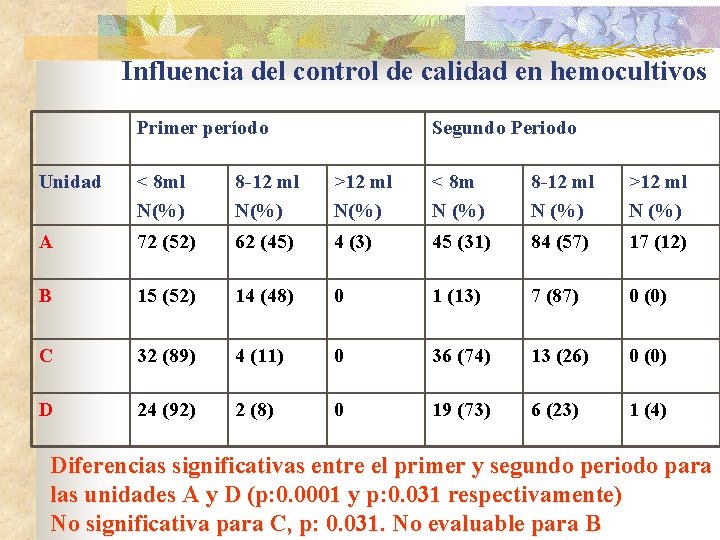
Influencia del control de calidad en hemocultivos Primer período Segundo Periodo Unidad < 8 ml N(%) 8 -12 ml N(%) >12 ml N(%) < 8 m N (%) 8 -12 ml N (%) >12 ml N (%) A 72 (52) 62 (45) 4 (3) 45 (31) 84 (57) 17 (12) B 15 (52) 14 (48) 0 1 (13) 7 (87) 0 (0) C 32 (89) 4 (11) 0 36 (74) 13 (26) 0 (0) D 24 (92) 2 (8) 0 19 (73) 6 (23) 1 (4) Diferencias significativas entre el primer y segundo periodo para las unidades A y D (p: 0. 0001 y p: 0. 031 respectivamente) No significativa para C, p: 0. 031. No evaluable para B

IMPORTANCIA DEL NUMERO DE HEMOCULTIVOS

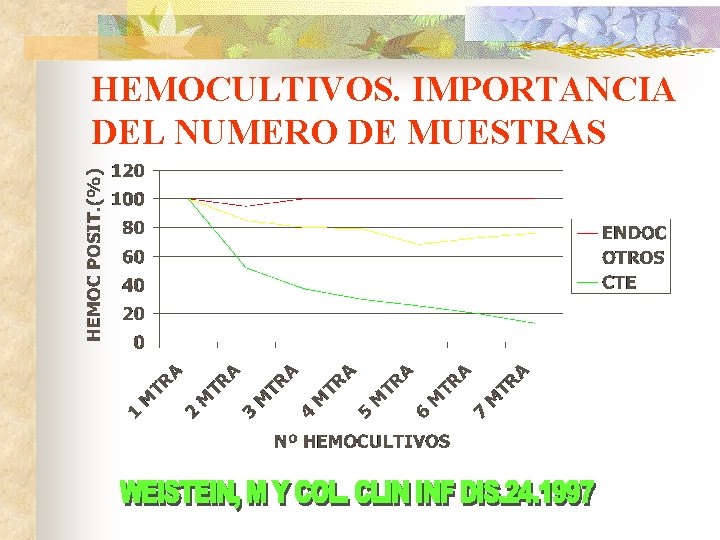
HEMOCULTIVOS. IMPORTANCIA DEL NUMERO DE MUESTRAS q WASHINGTON, J. MAYO CLIN PROC. 1975 Nº DE EPISODIOS= 80 3 MUESTRAS DE 10 ml CADA UNA 1º= 80% POSITIV. 2º= 88% POSITIV 3º= 99% POSITIV q WEINSTEIN, M. REV INF DIS, 1983 Nº DE EPISODIOS= 282 3 MUESTRAS DE 15 ml CADA UNA 1º= 91% POSITIV 2º= >99% POSITIV

HEMOCULTIVOS. IMPORTANCIA DEL NUMERO DE MUESTRAS n FOCO n ENDOCARDITIS è PROBABILIDAD DE TENER >1 HEMOCULTIVO + 95 -100% OTROS FOCOS è 75 -80% CONTAMINANTES è 10 -13%

HEMOCULTIVOS. IMPORTANCIA DEL NUMERO DE MUESTRAS

PORQUE TOMAR MAS DE UN HEMOCULTIVO? Lograr indirectamente un volumen correcto de sangre. Ayuda a discriminar bacteriemia de contaminación cuando se aíslan microorganismos de piel. Documenta bacteriemia continua y persistente Mejora la detección de bacteriemias intermitentes

PORQUE TOMAR MAS DE UN HEMOCULTIVO? Un hemocultivo casi nunca es suficiente para excluir o identificar bacteriemias. Dos hemocultivos son suficientes cuando La probabilidad de bacteriemia es baja/moderada (neumonía, infección urinaria e intra-abdominal) El microorganismo aislado NO es un contaminante frecuente (Ej enterobacterias, P. aeruginosa, S. aureus, C. albicans, etc) Tres hemocultivos DEBEN ser tomados cuando la probabilidad de bacteriemia es alta o se sospecha bacteriemia continua (endocarditis) Cuatro hemocultivos son necesarios cuando la probabilidad de bacteriemia es alta (>50%) y el germen es un contaminante frecuente (endocarditis protésica por SCN) o el paciente con sospecha de endocarditis ha recibido ATB previo Mylotte, J; Tayara, A. Eur J Clin Microbiol Infect Dis, 19. 2000

PORQUE TOMAR MAS DE UN HEMOCULTIVO? Cockerill, F y cols. Clin Infect Dis. 2004. 38: 1724 -1730 Mayo Clinic, Sistema BACTEC 9240 N: 181 BAC (18 endocarditis y 163 no endocarditis) Volumen por punción: 20 ml 2 hemocultivos detectaban solo 80% de BAC 3: 96% 4: 100% Mirrett, S y cols. J Clin Microb. 2007. 45: 3546 -3548 Robert Wood Johnson University Hospital y Duke Univesrsity Medical Center BACTEC 9240 y BACT ALERT Volumen por punción: 20 ml N: 687 BAC 1 hemocultivo: 73% 2: 90% 3: 98% 4: 100%

MOMENTO DE LA TOMA DE LA MUESTRA

El ingreso de bacterias ocurre 1 h despues del pico febril. Benett, I; Beeson, P. Yale J Biol Med, 26. 1954 Sin embargo no se ha demostrado que haya diferencias en tomar aleatoriamente 2 -3 muestras en un periodo de 24 hs vs intervalos espaciados o en relacion al pico febril. Li, J. J Clin Microbiol, 32. 1994. Desde un punto de vista practico se debe tomar lo mas inmediato al pico febril, separando las muestras por escasos min en pacientes graves y antes de iniciar tratamiento ATB. Cuando se quiere documentar bacteriemia continua se pueden separar las muestras por 1 h. Baron, E; Weisntein, M; Dunne, W; Yagupsky, P; Welch, D; Wilson, D. Cumitech Blood Cultures IV. 2005

SITIO DE LA MUESTRA

HEMOCULTIVOS. VENIPUNCION VS SANGRE A TRAVES DE CATETERES BUENA CORRELACION ENTRE AMBAS MUESTRAS EN GENERAL A TRAVES DE CATETERES HICKMAN/BROVIAC O DE PORTACAT FELICES Y COL TATURO Y COL ISAACMAN Y KARASIC (PEDIATRIA, CATETERES PERIF) POBRE CORRELACION WEISNTEIN Y COL BRYANT Y STRAND STRATTON TONNESEN Y COL ARONSON Y BOR RECOMENDACIÓN EVITAR TOMAR SANGRE A TRAVES DE CATETER A MENOS QUE EL PACIENTE YA NO TENGA VIAS O EN NEONATOS

Criterios de rechazo de hemocultivos Debe notificarse inmediatamente el médico responsable y el motivo del mismo. Botellas rotas o con fisuras Remisión en frascos inapropiados no validados para hemocultivos Botellas no identificadas o que no correspondan con lo que dice la orden médica

Notas adjuntas Sangre en el exterior del frasco. Hemocultivos en frascos vencidos. Incorrecto volumen cultivado. 1 solo hemocultivo. Mayor número de hemocultivos que el recomendado en 24 hs

Catéteres



n Segmento endovascular n Trayecto subcutáneo: sólo en caso de catéteres con largo trayecto y sospecha de tunelitis. n Ambos en tubo seco estéril o con 1 ml de SF. n Siempre con dos hemocultivos y al menos 1 de ellos periférico

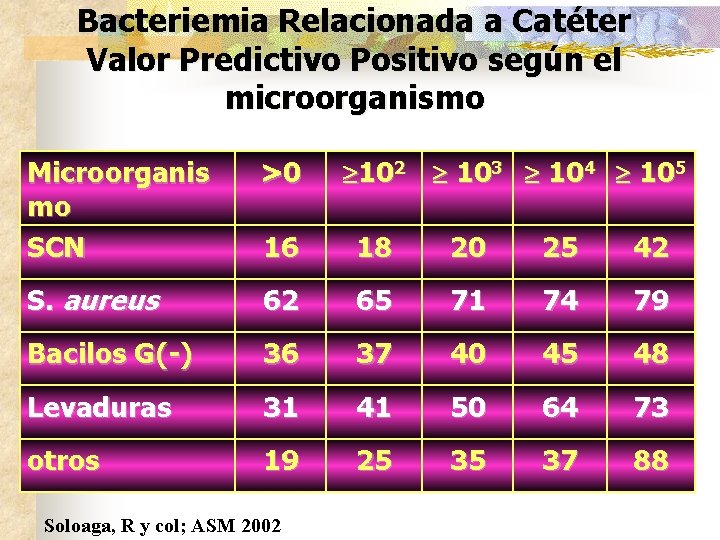
Bacteriemia Relacionada a Catéter Valor Predictivo Positivo según el microorganismo 102 103 104 105 Microorganis mo SCN >0 16 18 20 25 42 S. aureus 62 65 71 74 79 Bacilos G(-) 36 37 40 45 48 Levaduras 31 41 50 64 73 otros 19 25 35 37 88 Soloaga, R y col; ASM 2002

Qué hacer con los catéteres que no se pueden sembrar inmediatamente. Cómo conservarlos?

CONSERVACION DE CATETERES A 4º C EN SOLUCION FISIOLOGICA N: 746 CATETERES 117 POSITIVOS (24 ASOCIADOS CON BACTERIEMIA) SIEMBRA INICIAL: BRUN BUISSON CONSERVACION EN 1 ml DE SF A 4º C SE REPITIO BRUN BUISSON A 24 Y 48 HS p = 0, 56 Y 0, 62 RESPECTIVAMENTE SOLOAGA, R y col. ENF INF Y MICROBIOL CLIN, 18, 2000.

SOLOAGA, R Y COL. ENF INF Y MICROBIOL CLIN, 18, 2000.

n Catéteres de larga permanencia

Tiempo diferencial ü ü ü Util para catéteres de larga permanencia (>30 días). Descartar los primeros 10 ml. Tomar muestra de catéter y de vena con la menor separación de tiempo posible. Inocular exactamente el mismo V de sangre periférica y a través de catéter. Utilizar mismo tipo de frasco de hemocultivo. Ingresar ambas muestras al mismo tiempo al equipo.

Aspectos a resaltar Cultivo de segmento endovascular sólo frente a sospecha clínica de infección. Segmento subcutáneo: sólo frente a tunelitis Catéteres arteriales: sembrar también introductor (incrementa sensibilidad de 68 a 91%). Catéteres totalmente implantables: siembra de la punta y de la parte interna del reservorio (incrementa sensibilidad de 43 a 93%) 2 hemocultivos con al menos 1 periféricos tomados antes de la remoción del DIV Longuet, P. Clin Infect Dis, 32. 2001 Blot, F. J Hospt Inf, 48. 2001 Mermel, L. Infect Control Hosp, 22. 2001 O´Grady, N. Crit Care Med, 36. 2008

Piel y partes blandas



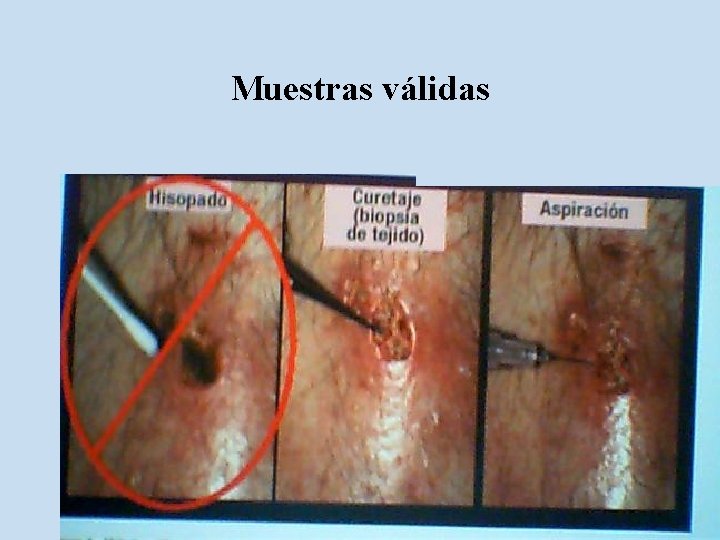
Muestras válidas Infecciones de piel y partes blandas

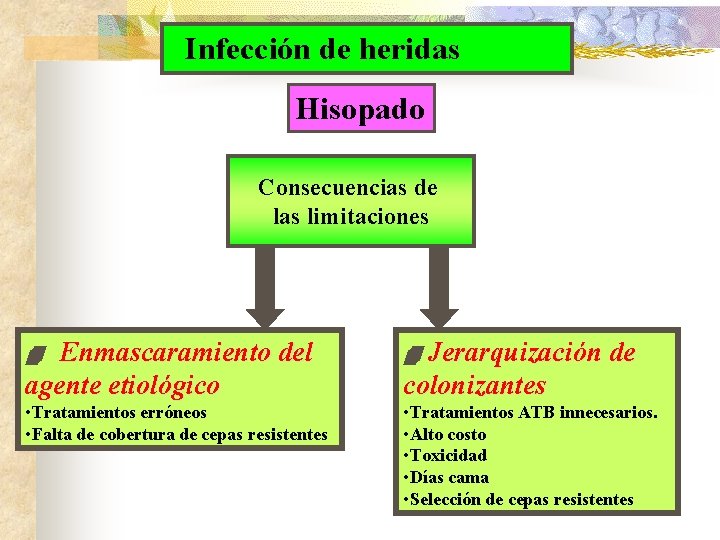
Heridas diversas. Hisopado u Desventajas u u u u Generalmente brinda cultivos polimicrobianos. Aislamiento e informe de colonizantes. No necesariamente refleja los microorganismos aislados en tejidos profundos. Puede enmascarar a los verdaderoas agentes etiológicos. Alto costo de seguimiento Puede orientar a tratamientos erróneos o innecesarios. Las pruebas de sensibilidad no indican necesariamente evolución clínica.

Infección de heridas Hisopado Consecuencias de las limitaciones Enmascaramiento del agente etiológico Jerarquización de colonizantes • Tratamientos erróneos • Falta de cobertura de cepas resistentes • Tratamientos ATB innecesarios. • Alto costo • Toxicidad • Días cama • Selección de cepas resistentes

Heridas diversas. Hisopado u Utilidad u u Como cultivo de vigilancia en la búsqueda de gérmenes resistentes. Algunos autores sugieren su utilidad en úlceras crónicas. u u u Siembra semicuantitativa Siembra cuantitativa Búsqueda solo de S. pyogenes, S. aureus, P. aeruginosa, enterobacterias, anaerobios, levaduras (IC) Eliminar tejido necrótico desvitalizado y tomar hisopado del fondo de la úlcera. Aún los defensores de los mismos indican esta muestra solo frente a heridas infectadas clínicamente o que no curan o que se deterioran progresivamente

Biopsia de tejidos vitales La muestra de mayor sensibilidad y especificidad en muestras de herida quirúrgica o traumáticas. Desventajas No siempre disponible Traumática para el paciente Costosa Laboriosa Diferencias en el recuento acorde a si son muestras periféricas o centrales

Biopsia de herida Bibliografía que sustenta su uso como gold standard y las limitaciones del hisopado: v. Robson, M. C. 1997. Surg. Clin. North Am. 77: 637– 650. v. Pruitt, B. A. , Jr. , A. T. Mc. Manus, S. H. Kim, and C. W. Goodwin. 1998. World J. Surg. 22: 135– 145. v. Breidenbach, W. C. , and S. Trager. 1995. Plast. Reconstr. Surg. 95: 860– 865. v. Fowler, E. 1998. Ostomy Wound Manage. 44: 44– 53. v. Neil, J. A. , and C. L. Munro. 1997. Ostomy Wound Manage. 43: 20– 30. v. Thomson, P. D. , and D. J. Smith. 1994. Am. J. Surg. v 167: 7 S– 11 S. v. Brown, D. L. , and D. J. Smith. 1999. Ostomy Wound Manage. 45: 119 S– 120 S. Gradon, J. , and C. Adamson. 1995. Infect. Dis. Clin. Pract. 1: 11– 16. v. Perry, C. R. , R. L. Pearson, and G. A. Miller. 1991. J. Bone Joint Surg. 73 A: 745– 749. v. Laing, P. 1994. Am. J. Surg. 167: 31 S– 36 S. Papasian, C. J. , and P. J. Kragel. 1997. Crit. Care Nurs. Q. 20: 44– 59.

Biopsia de herida Bibliografía que sustenta su uso como gold standard y las limitaciones del hisopado: v. Bharadwaj, R. , B. N. Joshi, and S. A. Phadke. 1983. Burns Incl. Therm. Inj. 10: 124– 126. v. Loebl, E. C. , J. A. Marvin, E. L. Heck, P. W. Curreri, and C. R. Baxter. 1974. J. Surg. Res. 16: 1– 5. v. Mc. Manus, A. T. , S. H. Kim, W. F. Mc. Manus, A. D. Mason, Jr. , and B. A. Pruitt, Jr. 1987. Arch. Surg. 122: 74– 76. v. Sjoberg, T. , S. Mzezewa, K. Jonsson, V. Robertson, and L. Salemark. 2003. J. Burn Care Rehabil. 24: 365– 370. v. Woolfrey, B. F. 1986. J. Clin. Microbiol. 24: 503. (Letter. ) v. Woolfrey, B. F. , J. M. Fox, and C. O. Quall. 1981. Am. J. Clin. Pathol. 75: 532– 537. v. Citron, D; Ellis, J. et. al J Clin Microbiol. 9, 2007

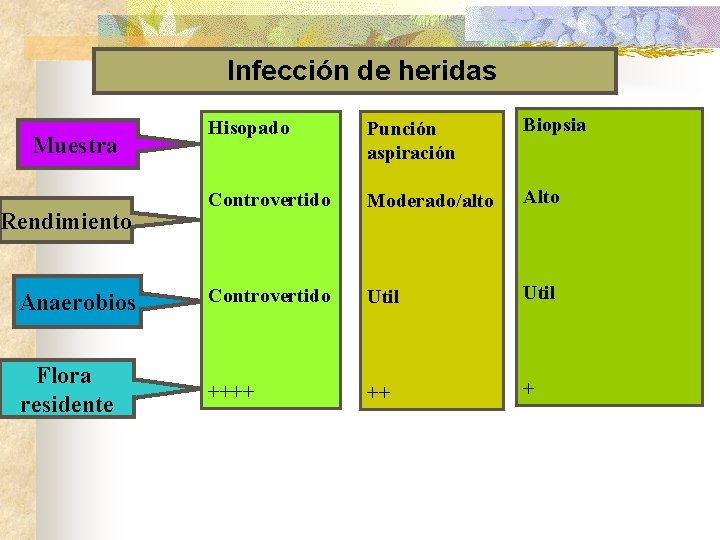
Infección de heridas Hisopado Punción aspiración Biopsia Controvertido Moderado/alto Anaerobios Controvertido Util Flora residente ++++ ++ + Muestra Rendimiento

Cultivo de heridas. Recomendación final Hisopado de infecciones superficiales de herida quirúrgica NO se recomienda debido a que el cultivo reflejará colonización superficial con gérmenes de piel u otros. En infecciones de organo/espacio o incisionales profundas se debe preferir tejido o aspiración alin critically hisopado. O´Grady, N; et. al. Guidelines for evaluation of new fever ill adult patients: 2008 update from the American College of Critical Care Medicine and the Infectious Diseases Society of America. Crit Care Med 2008, 36, Nº 4

Líquidos de punción “estériles”

Otros Líquidos de punción estériles n Consideraciones generales n n n Toma de muestra antes de iniciar ATB Utilizar técnica aséptica Sembrar dentro de los 15´y no más allá de las 2 hs. Temperatura ambiente. Siempre transportar en medios para anaerobios (pleural) Siempre sembrar en 1 frasco de hemocultivo (líquido articular vs Kingella kingae) Enviar muestra separada para citoquímico y eventualmente para micología, virología, micobacterias.

Líquidos de punción n n n n LCR Líquido articular Punción biopsia ósea Líquido pericárdico Empiema pleural Líquido ascítico Efluente de diálisis Punción suprapúbica Humor vítreo

Líquidos de punción n Consideraciones generales n n n n Toma de muestra antes de iniciar ATB Utilizar técnica aséptica Sembrar dentro de los 15´y no más allá de las 2 hs. Temperatura ambiente. Volumen mínimo de 10 ml para líquido ascítico y efluente de diálisis (ideal 20 ml separados en frasco aeróbico y anaeróbico) Siempre transportar en medios para anaerobios (pleural) Siempre sembrar en 1 frasco de hemocultivo (líquido articular vs Kingella kingae) Enviar muestra separada para citoquímico y eventualmente para micología, virología, micobacterias.

Líquidos de punción n Consideraciones generales n Si no hay guardia de laboratorio y el líquido no se pudiera procesar en el momento, se puede inocular en frasco de hemocultivo y realizar 2 -3 extendidos para posteriores coloraciones.

LCR

LCR. Datos importantes n n n n n Edad Tratamiento ATB previo Neurocirugía Presencia de shunt Traumatismo de cráneo abierto o cerrado Fístulas adquiridas o congénitas Focos infecciosos contiguos o a distancia Inmunocompromiso Datos epidemiológicos (viajes, contacto con enfermos o con aguas contaminadas, etc)

Insertar la aguja con un estilete en el espacio L 3 -L 4, L 4 -L 5 o L 5 -S 1. Cuando se alcanzó espacio subaracnoideo, retirar estilete Recoger 1 -2 ml en 3 tubos

Punción osteoarticular

Punción osteoarticular. Datos importantes n n n n Edad Tratamiento ATB previo Traumatismo abierto Mordedura animal o humana Cirugía Presencia de cuerpo extraño: clavos, prótesis Inmunocompromiso Datos epidemiológicos (sospecha de brucelosis o de TBC)

Punción osteoarticular. Datos importantes n Presencia de prótesis n n Obtener múltiples muestras (4 -5) Diferentes lugares Rotularlas correctamente No incluir fístulas

OSTEOMIELITIS MUESTRAS PARA CULTIVO PUNCION ASPIRACION OSEA BIOPSIA OSEA HISOPADO DE FISTULA? HEMOCULTIVOS

OSTEOMIELITIS MUESTRAS PARA CULTIVO PUNCION ASPIRACION OSEA BIOPSIA OSEA ESPECIALMENTE EN PACIENTES CON HEMOCULTIVOS NEGATIVOS E IMÁGENES Y CLINICA COMPATIBLE CON OSTEOMIELITIS

OSTEOMIELITIS MUESTRAS PARA CULTIVO HISOPADO DE FISTULAS BAJA ESPECIFICIDAD ESPECIALMENTE CON BACILOS GRAM NEGATIVOS MAYOR CORRELACION CON S. aureus

OSTEOMIELITIS MUESTRAS PARA CULTIVO MUESTRAS SUPERFICIALES DE ULCERAS POR DECUBITO O DE PIE DIABETICO POBRE CORRELACION CON MUESTRAS OBTENIDAS POR BIOPSIA O POR PUNCION ASPIRACION TIENEN VALOR SOLO COMO CULTIVO DE VIGILANCIA


DIAGNOSTICO BACTERIOLOGICO. PROCESAMIENTO DEL LIQUIDO ARTICULAR n n EL CULTIVO DE BIOPSIA SINOVIAL (94%) TIENE MAYOR RENDIMIENTO QUE EL LIQUIDO SINOVIAL (80 -90%) PARA n MICOBACTERIAS n HONGOS IMPORTANTE EL DATO DE LESION GRANULOMATOSA (PUEDEN NO ESTAR EN PACIENTES AÑOSOS) Smith, J; Piercy, E. Clin Inf Dis, 20, 1995

Líquido ascítico y PBE

Líquido ascítico. Datos importantes n n Edad Enfermedad de base n n n Cirrosis Síndrome nefrótico Tratamiento ATB previo


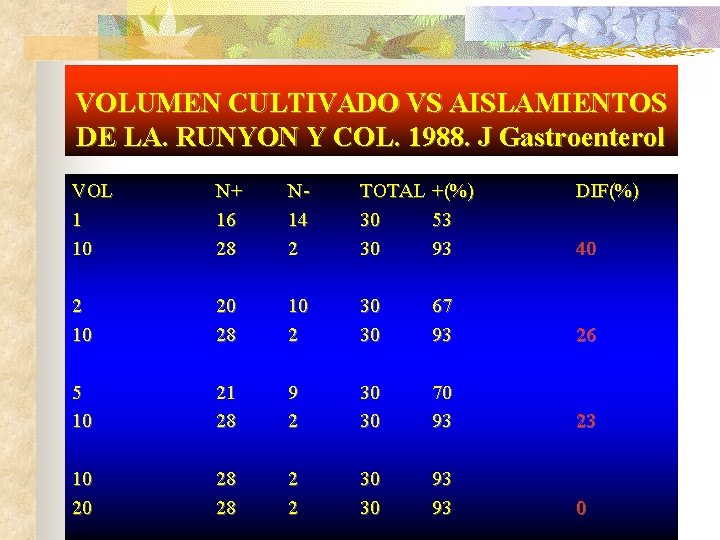
VOLUMEN CULTIVADO VS AISLAMIENTOS DE LA. RUNYON Y COL. 1988. J Gastroenterol VOL 1 10 N+ 16 28 N 14 2 TOTAL +(%) 30 53 30 93 DIF(%) 2 10 20 28 10 2 30 30 67 93 26 5 10 21 28 9 2 30 30 70 93 23 10 20 28 28 2 2 30 30 93 93 0 40

DIAGNOSTICO DE PBE. UTILIDAD DEL SISTEMA BACT-ALERT ORTIZ, J. J HEPATOL, 26, 1997. PBE: 23; BACTERIOASCITIS: 20 Y NEUTROASCITIS: 7 METODO +(%) T(HS) BACT-ALERT 67 13, 3+/-9, 2 FRASCO HEMO 73 43, 4+/-34, 2 CONVENCIONAL 33 VOLUMEN SEMBRADO EN BTA Y FRASCO DE HEMO CONVENCIONAL (HEMOLINE, BIOMERIEUX): 10 ml, DISTRIBUIDOS EN BOTELLA AEROBICA Y ANAEROBICA EN AMBOS CASOS CULTIVO CONVENC: 2 -3 GOTAS EN AS Y ACH Y 0, 5 -1 ml DE LIQUIDO NO CENTRIF EN TIOGLIC

VENTAJAS DE LA INOCULACION INMEDIATA DEL LA EN FRASCO DE HEMOCULTIVO DALAMAU, A Y COL. ARCH INTERN MED, 147, 1987. SAINZ, S Y COL. HEPATOLOGY, 9, 1989 BOBADILLA, M Y COL. J CLIN MICROBIOL, 27, 1989 RUNYON, B Y COL, J CLIN MICROBIOL, 28, 1988

Efluente de diálisis peritoneal


PERITONITIS EN PACIENTES DIALIZADOS COMPARACION DE METODOS METODO VOLUMEN Enriquecimiento en caldo vs. Filtración (millipore 0. 45 um) Males, B. J. Clin Microbiol 10 vs. 20 -400 23: 350 -353. 1986 Rubin, J. A. M. Kidney Dis 10 vs. 100 2: 602 -609. 1983 EQUIVALENTES Filtración vs. Centrifugación Doyle, P. J Clin Microbiol 100 vs. 5 -10 27: 1206 -1209. 1983 mejor la FILTRACION

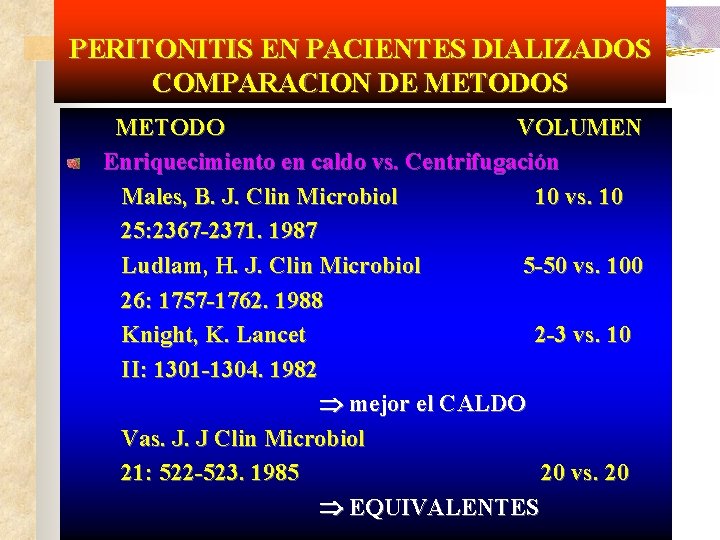
PERITONITIS EN PACIENTES DIALIZADOS COMPARACION DE METODOS METODO VOLUMEN Enriquecimiento en caldo vs. Centrifugación Males, B. J. Clin Microbiol 10 vs. 10 25: 2367 -2371. 1987 Ludlam, H. J. Clin Microbiol 5 -50 vs. 100 26: 1757 -1762. 1988 Knight, K. Lancet 2 -3 vs. 10 II: 1301 -1304. 1982 mejor el CALDO Vas. J. J Clin Microbiol 21: 522 -523. 1985 20 vs. 20 EQUIVALENTES

PERITONITIS EN PACIENTES DIALIZADOS COMPARACION DE VOLUMENES METODO Enriquecimiento en caldo Haechler, H. Infection 14: 102 -104. 1986 Ludlam, H. J. Clin Microbiol 26: 1757 -1762. 1988 VOLUMEN 1000 vs. 50 EQUIVALENTES 50 vs. 5

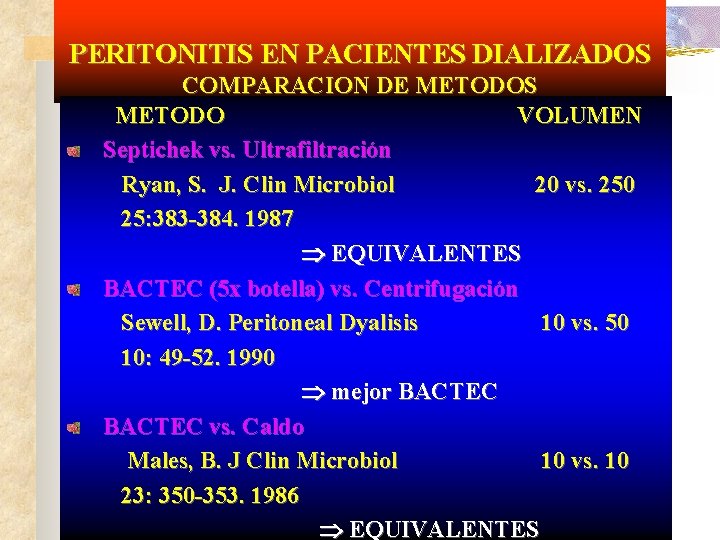
PERITONITIS EN PACIENTES DIALIZADOS COMPARACION DE METODOS METODO VOLUMEN Septichek vs. Ultrafiltración Ryan, S. J. Clin Microbiol 20 vs. 250 25: 383 -384. 1987 EQUIVALENTES BACTEC (5 x botella) vs. Centrifugación Sewell, D. Peritoneal Dyalisis 10 vs. 50 10: 49 -52. 1990 mejor BACTEC vs. Caldo Males, B. J Clin Microbiol 10 vs. 10 23: 350 -353. 1986 EQUIVALENTES

PERITONITIS EN PACIENTES DIALIZADOS COMPARACION DE METODOS METODO VOLUMEN BACTEC vs. Isolator Forbes, B. Kidney Dis 10 vs. 10 11: 176 -179. 1988 EQUIVALENTES BACTEC vs. Centrifugación Blondeau, J. ASM. 1995 10 vs. 10 mejor BACTEC Bact/Alert vs. Centrifugación 10 vs. 50 Khare, S. ICAAC. mejor Bact/Alert menor contaminación 1 vs. 9%

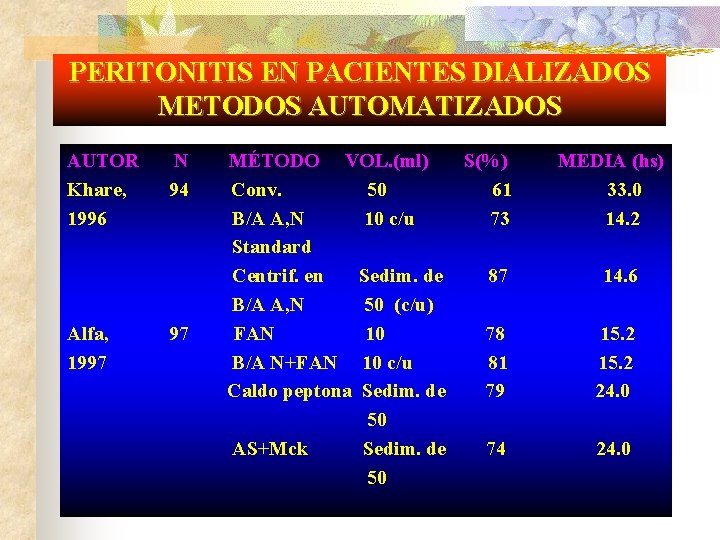
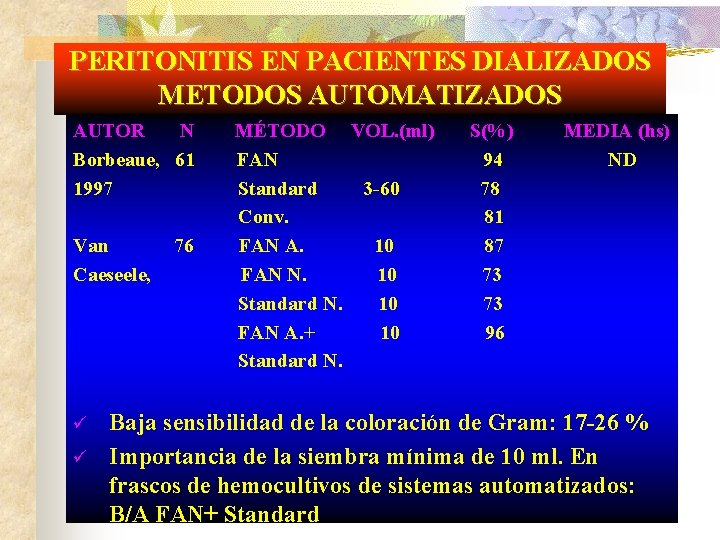
PERITONITIS EN PACIENTES DIALIZADOS METODOS AUTOMATIZADOS AUTOR Khare, 1996 Alfa, 1997 N 94 97 MÉTODO VOL. (ml) S(%) Conv. 50 61 B/A A, N 10 c/u 73 Standard Centrif. en Sedim. de 87 B/A A, N 50 (c/u) FAN 10 78 B/A N+FAN 10 c/u 81 Caldo peptona Sedim. de 79 50 AS+Mck Sedim. de 74 50 MEDIA (hs) 33. 0 14. 2 14. 6 15. 2 24. 0

PERITONITIS EN PACIENTES DIALIZADOS METODOS AUTOMATIZADOS AUTOR N Borbeaue, 61 1997 Van Caeseele, ü ü 76 MÉTODO VOL. (ml) FAN Standard 3 -60 Conv. FAN A. 10 FAN N. 10 Standard N. 10 FAN A. + 10 Standard N. S(%) 94 78 81 87 73 73 96 MEDIA (hs) ND Baja sensibilidad de la coloración de Gram: 17 -26 % Importancia de la siembra mínima de 10 ml. En frascos de hemocultivos de sistemas automatizados: B/A FAN+ Standard

Líquido pleural


Biopsias y prótesis varias


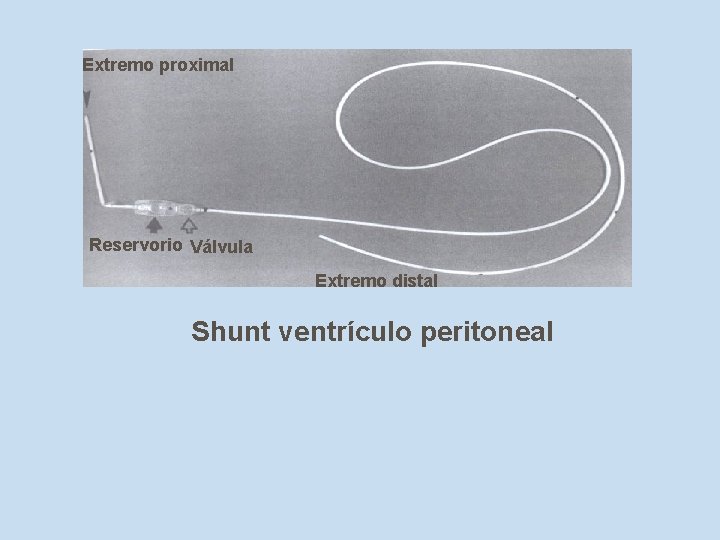
Extremo proximal Reservorio Válvula Extremo distal Shunt ventrículo peritoneal

n En pacientes con sistema de derivación ventrículo peritoneal, el cultivo del catéter ventricular debe ser analizado junto con el cultivo de la punción de reservorio.

No se deben secar (agregar al frasco un poco de SF) Transporte dentro de los 15´ a Tº ambiente

Vías respiratorias inferiores Neumonía nosocomial

Muestras para el diagnóstico Muestras broncoscópicas Cepillo protegido Lavado broncoalveolar protegido Biopsia transbronquial Secreciones traqueales para siembra cuantitativa Muestras no broncoscópicas Combicath BAL-Cath Swan-Ganz Hemocultivos y líquido pleural Biopsia de pulmón

Transporte de las muestras Idealmente dentro de los 30’ No más de 2 horas Sobrecrecimiento de colonizantes Disminución del recuento de S. pneumoniae, H. influenzae, anaerobios Cepillo protegido 1 ml de solución de Ringer Dentro de la doble cánula en una bolsa plástica estéril. BAL Frascos plásticos de boca ancha y tapa a rosca Fracciones separadas e identificadas



Lavado broncoalveolar Cuidadosa selección y colocación de la punta del broncoscopio en el lumen de la vía aérea. Aislamiento de esa vía de la vía aérea central. Infusión de al menos 120 ml de SF en 3 -6 porciones, aspiración. 1 Millón de alveólos (1% superficie pulmonar) El volumen de retorno varía ampliamente

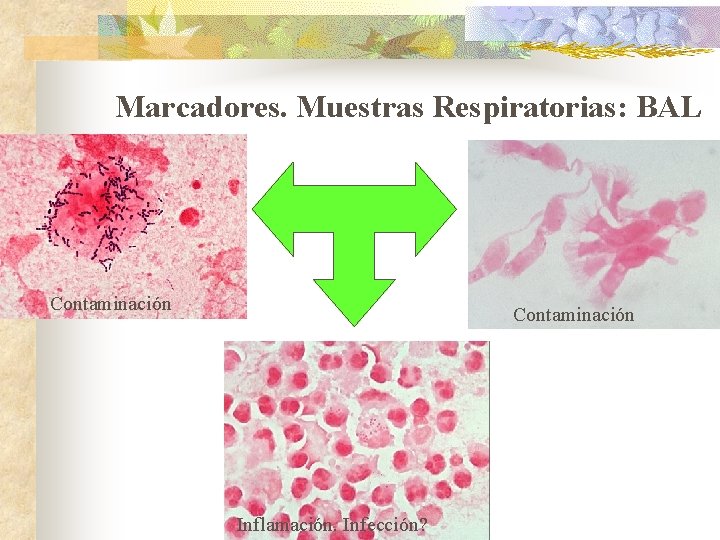
Indicadores en BAL CITOCENTRIFUGADO DE LA 2º PORCION. Marcadores de contaminación Cél. epiteliales escamosas (>1%) Células bronquiales Marcadores de infección PMN (idealmente>50%, no <10%) Ø Sensible pero poco especifico Bacterias intracelulares (2 -25%) Ø Especifico pero poco sensible Marcadores de presencia de muestra respiratoria Macrófagos alveolares

Marcadores. Muestras Respiratorias: BAL Contaminación Inflamación. Infección?

COMPARACION DE MUESTRAS BRONCOSCOPICAS BAL. MAYOR VOLUMEN DE MUESTRA Mayor dilución de ATB Mayor área testeada (1% de la superficie pulmonar) Sirve para micobacterias, hongos, P. jiroveci, Nocardia, gérmenes comunes. Permite realizar diversos exámenes directos y guiar inicialmente la terapéutica. Más fecuente compromiso de intercambio gaseoso CEPILLO PROTEGIDO En pacientes con pobre retorno (enfisema, vías aéreas colapsables) Sirve para anerobios, gérmenes comunes Más frecuente hemorragia y neumotórax

COMPARACION DE MUESTRAS BRONCOSCOPICAS Estudios que demuestran correlación entre BAL PSB Torres y col, Am Rev Respir Dis, 1989 Violan y col. Chest, 1993. Valles y col. Eur J Clin Microbiol Infect Dis, 1994 Johanson y col. Am Rev Respir Dis, 1988. Jourdain y col. Chest, 1997. Chastre y col. J Bronchology, 1997.

OPTIMIZACION DE MUESTRAS BRONCOSCOPICAS. Seleccionar los pacientes en base a un score clínico-radiológico. Experiencia del endoscopista. Evitar la succión de secreciones traqueales a medida que avanza el FOB. Realizar previa succión con un catéter distinto. No introducir lidocaína a través del canal de succión. Si se realizan ambas muestras, tomar primero el PSB. 1ºBAL y luego cepillo: 50% de falsos positivos del PSB; a la inversa solo 17%. (Meduri y cols, Am Rev Respir Dis, 143, 1991) No mezclar la primer fracción del BAL con el resto. 1º fracción equivalente a sec. traq. (Marquettte y cols, Am Rev Respir Dis, 147, 1993. ; Davis y col. Am Rev Respir Dis, 1982) Respetar los tiempos de transporte o conservar a 4ºC. Realizar cultivos cuantitativos.

Técnicas no broncoscópicas VENTAJAS Menor invasibidad Menor costo inicial que FOB Menor compromiso del intercambio gaseoso Disponibilidad para pctes con tubos endotraqueales de pequeño diámetro Toma por cualquier médico de terapia intensiva DESVENTAJAS Error en el muestreo debido a técnica a ciegas Imposibilidad de tomar muestra de pulmón izquierdo o de lóbulos superiores No se puede separar la fracción inicial del resto.

Criterios de rechazo para secreciones traqueales n Objetivos n n n >10 Células epiteliales escamosas o <25 PMN (poco frecuente) n n Disminuir costos Sobrecarga de trabajo innecesario Los cultivos son polimicrobianos Falta de visualización de bacterias en el Gram n Cultivo negativo o solo en el primer cuadrante de FPM. n Zaidi, A; Reller, L. J Clin Microbiol. 34, 1996 Morris, A; Tanner, D; Rller, L. J Clin Microbiol, 31, 1993. n


Vías respiratorias inferiores. Neumonía de la comunidad

Esputo espontáneo Recolectar en frasco esteril de boca ancha y tapa a rosca. Hacer realizar gargaras y cepillado de dientes previamente. Instruir para obtener un esputo profundo y sin saliva. Transporte <2 hs y mantenimiento a 4ºC < 24 hs

Esputo espontáneo En general solo 50% de estas muestras son representativas. No se explico claramente al paciente o a la enfermera Sólo 50% de las muestras representativas brindan un germen predominante

Vías respiratorias superiores

Toma de Muestra Transporte y Conservación Presentación Muestra Transporte y Conservación Faringitis Exudativa Hisopado enérgico de Hasta 12 hs: en faringe posterior y tubo seco estéril de ambas amígdalas > de 12 hs. en medio de transporte Membranas o pseudomembranas membrana tubo seco estéril Ulceraciones, nódulos o biopsia granulomas Frasco estéril con solución fisiológica Abcesos amigdalinos o periamigdalinos, OMA/OMC, Sinusitis Medio de transporte apto para anaerobios Punción aspiración

Faringitis. Causas de falsos negativos u u u Antibiótico previo o concomitante Hisopado de una sola amígdala: 20% de F(-), Brook, 1988 Tiempo de incubación insuficiente Inadecuada atmósfera o medio de cultivo Retraso excesivo en el transporte (>12 hs) Falla en la tipificación

Faringitis n Utilizar baja lenguas (evitar tocar lengua y paredes de la boca) n Hisopar ambas amígdalas y faringe posterior n Transportar en tubo seco (<12 hs) o con medio de transporte (>12 hs)


Faringitis pseudomembranosa Muestra ideal: pseudomembrana Tubo seco o con un poco de SF

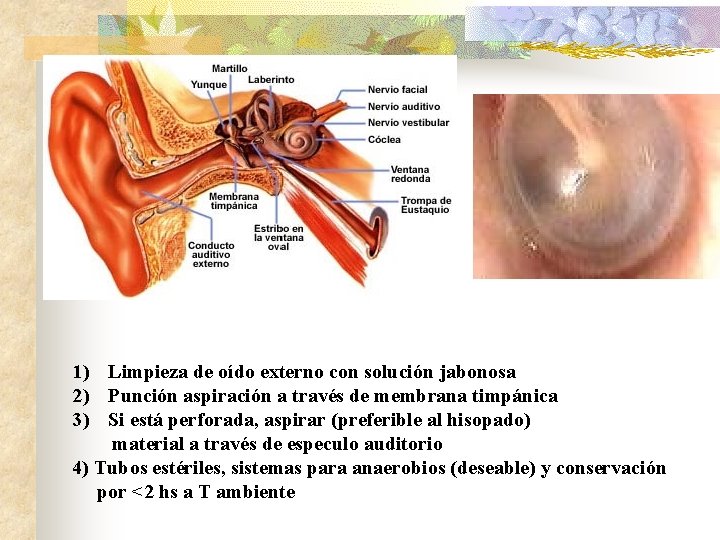
1) Limpieza de oído externo con solución jabonosa 2) Punción aspiración a través de membrana timpánica 3) Si está perforada, aspirar (preferible al hisopado) material a través de especulo auditorio 4) Tubos estériles, sistemas para anaerobios (deseable) y conservación por <2 hs a T ambiente

Otitis Media Indicaciones de la Timpanocentesis l l l Inmunosuprimidos Pacientes sépticos Neonatos Respuesta inadecuada al tratamiento antibiótico Complicaciones supuradas Áreas de alta prevalencia de cepas resistentes ?

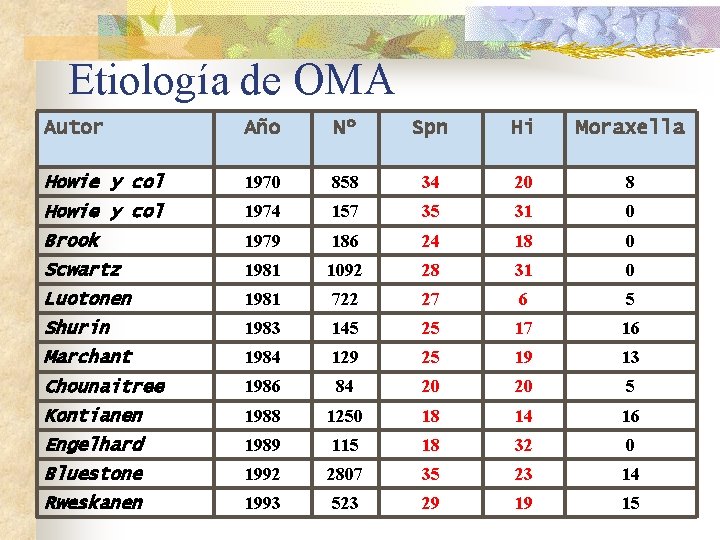
Etiología de OMA Autor Año Nº Spn Hi Moraxella Howie y col 1970 858 34 20 8 Howie y col 1974 157 35 31 0 Brook 1979 186 24 18 0 Scwartz 1981 1092 28 31 0 Luotonen 1981 722 27 6 5 Shurin 1983 145 25 17 16 Marchant 1984 129 25 19 13 Chounaitree 1986 84 20 20 5 Kontianen 1988 1250 18 14 16 Engelhard 1989 115 18 32 0 Bluestone 1992 2807 35 23 14 Rweskanen 1993 523 29 19 15

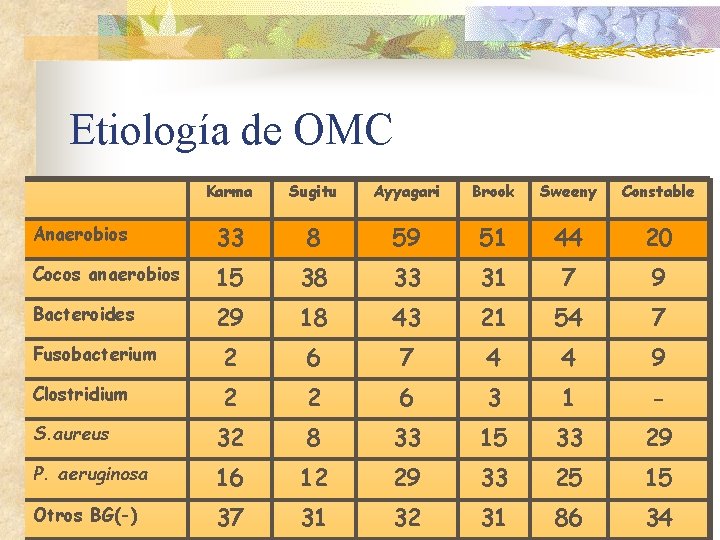
Etiología de OMC Karma Sugitu Ayyagari Brook Sweeny Constable Anaerobios 33 8 59 51 44 20 Cocos anaerobios 15 38 33 31 7 9 Bacteroides 29 18 43 21 54 7 Fusobacterium 2 6 7 4 4 9 Clostridium 2 2 6 3 1 - S. aureus 32 8 33 15 33 29 P. aeruginosa 16 12 29 33 25 15 Otros BG(-) 37 31 32 31 86 34

ETIOLOGIA DE LA SINUSITIS n n n n AGUDA S. pneumoniae H. influenzae M. catarrhalis S. pyogenes Anaerobios Desconocido % 25 -30 15 -20 2 -5 2 -11 2 -35 n CRONICA Estreptococos anaerobios Prevotella Bacteroides fragilis Bacteroides spp Veillonella S. pneumoniae Haemophilus spp S. aureus Streptococcus spp P. aeruginosa Enterobacterias % 51 -57 10 -40 4 -14 10 -15 6 -11 2 -7 9 -24 6 -16 9 -40 1 -53 1 -6

SINUSITIS Indicaciones para la punción de Senos Paranasales n n n Pacientes severamente enfermos Pacientes que no responden a la terapia con antibióticos Inmunosuprimidos Pacientes con complicaciones supurativas ¿Áreas de alta prevalencia de cepas resistentes?


Infecciones oculares

CONJUNTIVITIS DIAGNOSTICO MICROBIOLOGICO: GRUPOS DE RIESGO A CULTIVAR INMUNOCOMPROMETIDOS NIÑOS< 1 AÑO DEBILITAMIENTO GENERAL CIRUGIA OCULAR RECIENTE PRESENCIA DE VALVULA FILTRANTE USO DE CORTICOIDES TOPICOS USO DE ANTIBIOTICOS EN FORMA CRONICA LENTES DE CONTACTO O PROTESIS TRANSMISION INTRAHOSPITALARIA CONTACTO CON INFECTADOS POR N. gonorrhoeae, N. meningitidis, H. influenzae b CONJUNTIVITIS AGUDA MUCOPURULENTA RECURRENTE ENFERMEDAD DE CORNEA

CONJUNTIVITIS DIAGNOSTICO MICROBIOLOGICO: GRUPOS DE RIESGO A CULTIVAR CONJUNTIVITIS AGUDA MUCOPURULENTA QUE NO MEJORA LUEGO DE 7 -10 DIAS DE TRATAMIENTO CONJUNTIVITIS HIPERAGUDA CONJUNTIVITIS MEMBRANOSA Y PSEUDOMEMBRANOSA CONJUNTIVITIS NEONATAL CONJUNTIVITIS MUCOPURULENTA CRONICA ESTUDIO PREQUIRURGICO EN PACIENTES CON UN OJO O CON FACTORES DE RIESGO

CONJUNTIVITIS TOMAR MUESTRA ANTES DE TRATAMIENTO ATB O SUSPENDERLO 48 ANTES DEL ESTUDIO HISOPAR CONJUNTIVA SIN ANESTESIA CON HISOPO DE DACRON O ALGINATO DE CALCIO (HUMEDECIDO CON SF) NO UTILIZAR HISOPOS DE ALGODÓN (AC GRASOS INHIBITORIOS) SI LA MUESTRA ES ESCASA, PRIVILEGIAR LA SIEMBRA AL EXAMEN DIRECTO REALIZAR SIEMBRA DIRECTA O COLOCAR EN CARY-BLAIR O STUART



ENDOFTALMITIS. MUESTRAS è TOMA DE MUESTRA DE PUERTA DE ENTRADA è ABSCESO è SUTURA è AMPOLLA FILTRANTE è PUNCION DE CAMARA ANTERIOR è PUNCION VITREA è BIOPSIA VITREA è LENTE INTRA-OCULAR

Secreciones genitales

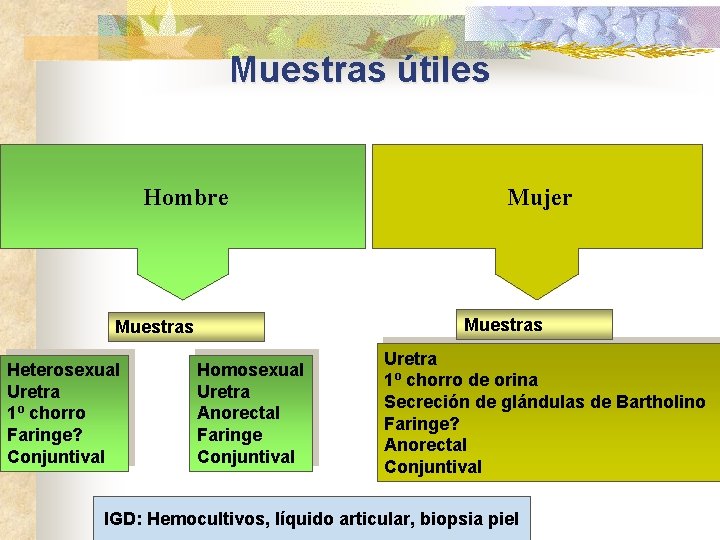
Muestras útiles Hombre Muestras Heterosexual Uretra 1º chorro Faringe? Conjuntival Mujer Homosexual Uretra Anorectal Faringe Conjuntival Uretra 1º chorro de orina Secreción de glándulas de Bartholino Faringe? Anorectal Conjuntival IGD: Hemocultivos, líquido articular, biopsia piel

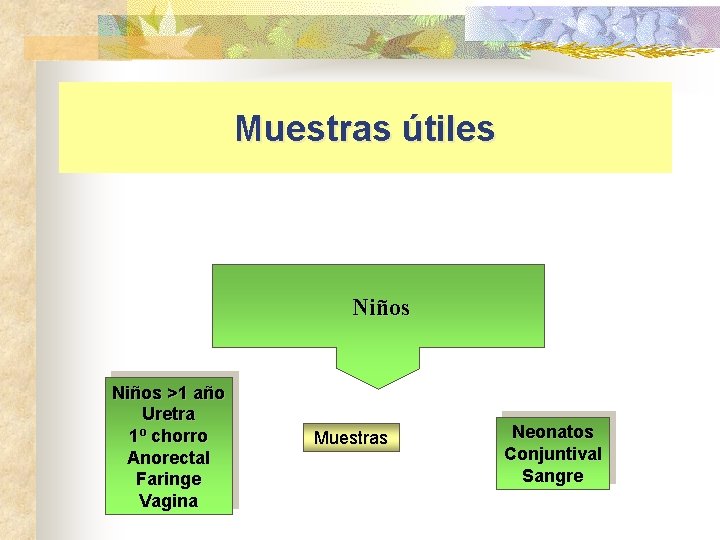
Muestras útiles Niños >1 año Uretra 1º chorro Anorectal Faringe Vagina Muestras Neonatos Conjuntival Sangre


TOMA DE MUESTRA. Procedimiento • > 2 hs de última micción • Introducir hisopo de alginato 2 – 3 cm dentro de la uretra • Girar 5 -10 seg.

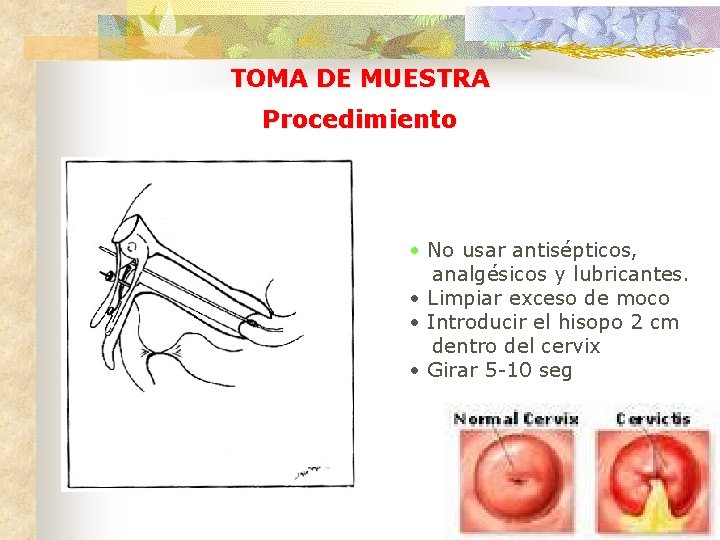
TOMA DE MUESTRA Procedimiento • No usar antisépticos, analgésicos y lubricantes. • Limpiar exceso de moco • Introducir el hisopo 2 cm dentro del cervix • Girar 5 -10 seg

TOMA DE MUESTRA Procedimiento • Introducir el hisopo 3 – 4 cm dentro del recto Para llegar a las criptas anales • Rotar 10 seg.

SIEMBRA DE LA MUESTRA • Frotis

INCUBACIÓN • • 5 % CO 2 Humedad 36 º C 24 – 48 hs

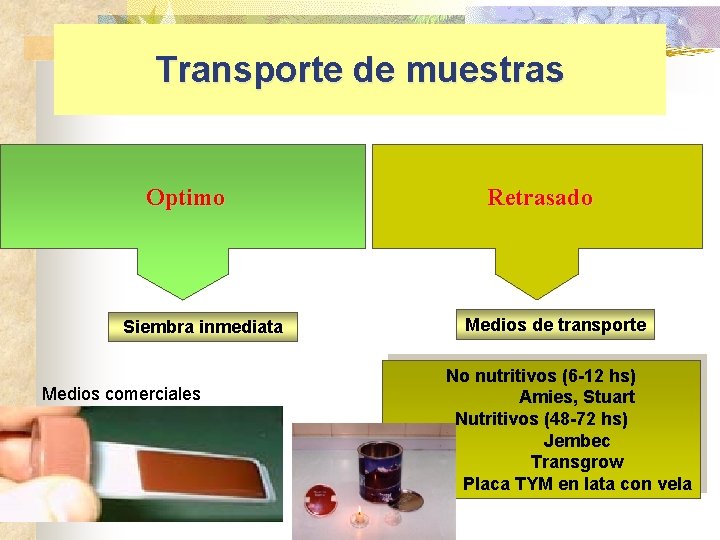
Transporte de muestras Optimo Siembra inmediata Medios comerciales Retrasado Medios de transporte No nutritivos (6 -12 hs) Amies, Stuart Nutritivos (48 -72 hs) Jembec Transgrow Placa TYM en lata con vela

Orinas

DATOS NECESARIOS PARA LA INTERPRETACION DEL UROCULTIVO n DEL PACIENTE n n EDAD SEXO SINTOMAS FACTOR PREDISPONENTE n n n n Vejiga neurogénica Reflujo vesicoureteral Presencia de sonda Cálculos o tumores Inmunosupresión ANTECEDENTS DE IU MEDICACION ACTUAL O PREVIA 2 DE LA MUESTRA 4 4 TIPO % CHORRO MEDIO (RETENCION) % PUNCION SUPRAPUBICA % SONDA(NUEVA O VIEJA, INTERMITENTE O PERMANENTE) CONSERVACION

Orinas tipo de muestras. n n n n Micción limpia (chorro medio) Primer chorro Sondaje intermitente Sondaje permanente Citoscopía Ostomías Punción suprapúbica Biopsia renal

Orinas tipo de muestras. n Micción limpia (chorro medio) n Mujeres n Idealmente 3 hs de retención y uso de tampón vaginal n Lavado de genitales externos con agua y jabón (nuevo) n Pcte sentada en inodoro con las rodillas separadas. n Separar labios mayores y menores n Limpiar meato uretral al menos 4 veces con jabón verde de adelante hacia atrás, secar. n No recolectar los primeros 15 -30 ml. n Recolectar en frasco estéril sin interrumpir la micción la fracción siguiente. Eisentadt, J; Washington, J. Urinary Tract Infections. 29 -66. 1996 ASM Press

Orinas tipo de muestras. n Micción limpia (chorro medio) n Hombres n Idealmente 3 hs de retención n Retraer prepucio. n Lavar con jabón el meato uretral, secar con gasa. n No recolectar los primeros 15 -30 ml n Sin interrumpir micción recolectar en frasco estéril la fracción siguiente. Eisentadt, J; Washington, J. Urinary Tract Infections. 29 -66. 1996 ASM Press

Orinas tipo de muestras. n Cateterización transitoria n No es equivalente a PSA. n Origina bacteriuria en 1 -5%. n No de rutina. n Util en obesos, vejiga neurogénica, mujeres con importante sangrado vaginal. n En presencia de obstrucción o anormalidades estructurales puede ser traumática Eisentadt, J; Washington, J. Urinary Tract Infections. 29 -66. 1996 ASM Press

Orinas tipo de muestras. n Cateterización transitoria n Limpiar la zona uretral con agua y jabón. n Secar con gasa. n Insertar asépticamente el catéter en la vejiga. n Dejar pasar los primeros 15 ml. Eisentadt, J; Washington, J. Urinary Tract Infections. 29 -66. 1996 ASM Press

Orinas tipo de muestras. n Cateterización permanente n Desinfectar “port” del catéter con alcohol de 70º. n Si no tiene port, punzar la zona de unión del catéter con el tubo de drenaje. n Aspirar 15 ml y colocar en recipiente estéril. Eisentadt, J; Washington, J. Urinary Tract Infections. 29 -66. 1996 ASM Press


Orinas tipo de muestras. n Punción suprapúbica n Gold estándar. n Procedimiento invasivo (usado poco frecuentemente). n Indicaciones n n n Diagnóstico de IU en neonatos/lactantes cuando no se ha podido recolectar por otros medios Confirmación de recuentos border line por micción limpia y cateterización contraindicada Diagnóstico de IU por anaerobios Eisentadt, J; Washington, J. Urinary Tract Infections. 29 -66. 1996 ASM Press

Diagnóstico bacteriológico de PBC. Método de Stamey-Meares. Invest Urol, 5, 1968 Muestras: Ø 1º chorro miccional Ø 2º chorro miccional ØMasaje prostático ØOrina post-masaje Interpretación= Si el rto del masaje prostático y de la orina post-masaje es 10 veces superior a las otras muestras= PBC Si se obtienen rtos altos en todas las muestras dar ATB que no lleguen a prostata (CTN, NIT) durante 48 -72 hs y luego repetir

Diagnóstico bacteriológico de PBC. Modificación de Nikel. Tech Urol 3, 1997 Muestras: ØOrina pre masaje prostático ØOrina post-masaje Sensiblidad y Especificidad del 91% comparado con método de Stamey Meares

Orinas. Transporte n n n Ideal, siembra dentro de 2 hs, temperatura ambiente. Mayor tiempo, conservar a 4º. Sistemas comerciales conservantes (ác. bórico ): T ambiente 24 hs

Materia Fecal

Datos que orientan la búsqueda Contacto del paciente con otra persona afectada Tiempo de incubación (brotes) Uso de antibióticos (C. difficile) Viajes (V. cholerae, V. parahaemolyticus, ETEC) Disentería (E. hystolítica, Shigella, EIEC) Diarrea con sangre Diarrea acuosa (agua de arroz) Diarrea y vómitos en niños pequeños Diarrea subaguda o crónica con flatulencia Síndromes apendiculares Períodos cortos de incubación con muchos vómitos

Toma de muestra Se deberán seleccionar las porciones de heces que presenten estrías de moco y/o sangre (aproximadamente 2 g si es semisólida o 2 ml si es líquida). Fase aguda y por lo menos tres muestras. El éxito en el hallazgo del agente causal bacteriano dependerá fundamentalmente de la toma de muestra.

Transporte y conservación a) sin medio de transporte b) con Cary blair Stuart Amies con Carbón procesar antes de la 1 er hora.

MUCHAS GRACIAS POR SU ATENCION!!!!
 Rolando soloaga
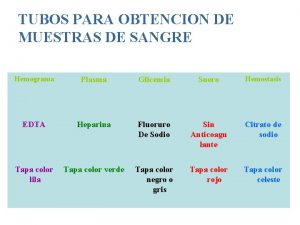
Rolando soloaga Color tubo hemograma
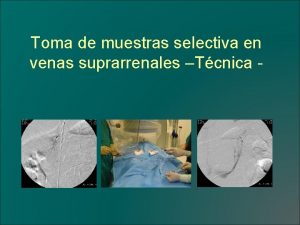
Color tubo hemograma Toma de muestra selectiva
Toma de muestra selectiva óscar rolando castro
óscar rolando castro Rolando chavez fiestas
Rolando chavez fiestas Dr. carlos rolando estrada flamenco
Dr. carlos rolando estrada flamenco Rolando hortaleza family
Rolando hortaleza family Plexus sacralisten çıkan sinir
Plexus sacralisten çıkan sinir Rolando menchaca garcia
Rolando menchaca garcia Fissure rolando
Fissure rolando Oase carpiene
Oase carpiene Surcos del lobulo frontal
Surcos del lobulo frontal Jorge rolando uyen napa
Jorge rolando uyen napa Escotadura preoccipital
Escotadura preoccipital Rolando roberto brizuela ramos
Rolando roberto brizuela ramos Rolando demanet
Rolando demanet Giesm
Giesm Instructivo informativo
Instructivo informativo Lo que el corazón quiere la mente se lo muestra
Lo que el corazón quiere la mente se lo muestra Muestreo estratificado y por conglomerados
Muestreo estratificado y por conglomerados Falacia ad hominem
Falacia ad hominem Que es muestra en estadística
Que es muestra en estadística La figura muestra dos cuadrados superpuestos
La figura muestra dos cuadrados superpuestos Muestra no probabilistica
Muestra no probabilistica Muestras diversas o de máxima variación ejemplos
Muestras diversas o de máxima variación ejemplos Tamaño de la muestra
Tamaño de la muestra Triangulo magico del 1 al 9 que de 20
Triangulo magico del 1 al 9 que de 20 Como se delimita una poblacion
Como se delimita una poblacion Formula poblacion infinita
Formula poblacion infinita Open epi calculo de muestra
Open epi calculo de muestra Muestreo
Muestreo Tabla de z alfa medios
Tabla de z alfa medios Que muestra
Que muestra Tamayo y tamayo 1997
Tamayo y tamayo 1997 Muestra no probabilistica
Muestra no probabilistica Propiedades físicas de la materia
Propiedades físicas de la materia Poblacion y muestra
Poblacion y muestra Absorcion fenomeno ondulatorio
Absorcion fenomeno ondulatorio Muestra med ipiales
Muestra med ipiales Muestra
Muestra Muestra liquida
Muestra liquida Universo y muestra
Universo y muestra Muestreo
Muestreo Ejemplos de texto espectacular
Ejemplos de texto espectacular Cruza de prueba ejemplo
Cruza de prueba ejemplo Muestra no probabilistica
Muestra no probabilistica Open epi tabla 2x2
Open epi tabla 2x2 Universo y muestra
Universo y muestra Interferencia de la luz
Interferencia de la luz Recuadro inferior
Recuadro inferior Distribuciones de probabilidad
Distribuciones de probabilidad Diferencia entre muestra y muestreo
Diferencia entre muestra y muestreo Ejemplo de tamaño de muestra
Ejemplo de tamaño de muestra Error de una muestra
Error de una muestra Lenguaje dramático
Lenguaje dramático Co2 estructura de lewis
Co2 estructura de lewis Planilla para calcular sueldo carrera docente
Planilla para calcular sueldo carrera docente Carrera profesional gva importes
Carrera profesional gva importes Esquemas de carrera
Esquemas de carrera Carrera de explorador
Carrera de explorador Seguridad y defensa carrera
Seguridad y defensa carrera Salidas profesionales farmacia
Salidas profesionales farmacia Duoc congelar
Duoc congelar En una carrera participan 6 personas
En una carrera participan 6 personas Colegio hermanos carrera rancagua
Colegio hermanos carrera rancagua Dibujos de mini atletismo
Dibujos de mini atletismo Orador motivacional carrera
Orador motivacional carrera José miguel carrera
José miguel carrera Colegio ignacio carrera pinto lo prado
Colegio ignacio carrera pinto lo prado Nerea carrera
Nerea carrera Carrera entre canoas
Carrera entre canoas Carrera profesional asturias
Carrera profesional asturias Carrera de teclado
Carrera de teclado Tesina completa
Tesina completa Conclusiones de terremotos
Conclusiones de terremotos Ana carrera poncela
Ana carrera poncela Tabla carrera profesional
Tabla carrera profesional Carrera magisterial
Carrera magisterial Carrera referencial lineal aps 2022
Carrera referencial lineal aps 2022 Correr la carrera legítimamente
Correr la carrera legítimamente José miguel carrera
José miguel carrera Valentina cisterna carrera
Valentina cisterna carrera Estas en una carrera y rebasas al segundo corredor
Estas en una carrera y rebasas al segundo corredor Biografia de zinedine zidane
Biografia de zinedine zidane Lineamientos de carrera magisterial
Lineamientos de carrera magisterial Ecologia marina carrera
Ecologia marina carrera Mentoring de carrera
Mentoring de carrera Colegio hermanos carrera rancagua
Colegio hermanos carrera rancagua Ingenieria ambiental carrera
Ingenieria ambiental carrera Qué son los riesgos antrópicos
Qué son los riesgos antrópicos Atletismo habilidades motrices
Atletismo habilidades motrices Tabla carrera profesional
Tabla carrera profesional Ciencias de la vida carrera
Ciencias de la vida carrera Que es el cuerpo morontial
Que es el cuerpo morontial Ejemplos de servidores públicos
Ejemplos de servidores públicos Seguridad y defensa carrera
Seguridad y defensa carrera Yo eligiendo mi carrera
Yo eligiendo mi carrera Carrera de bibliotecario escolar
Carrera de bibliotecario escolar L
L Plan de desarrollo individual pdf
Plan de desarrollo individual pdf Hebreos 12:12-13
Hebreos 12:12-13 Carrera de geografía salidas
Carrera de geografía salidas Carrera
Carrera Como se llama la carrera que estudia la biblia
Como se llama la carrera que estudia la biblia Fundamentacion de la carrera profesional
Fundamentacion de la carrera profesional Pulsos del cuerpo
Pulsos del cuerpo Toma blizanac
Toma blizanac Hurwics
Hurwics Toma de ramos utalca
Toma de ramos utalca Sistema de apoyo a la toma de decisiones ejemplos
Sistema de apoyo a la toma de decisiones ejemplos Toma y daca ejemplos
Toma y daca ejemplos Toma liliana
Toma liliana Sistema de apoyo a la toma de decisiones caracteristicas
Sistema de apoyo a la toma de decisiones caracteristicas Estilos de toma de decisiones
Estilos de toma de decisiones 10 ejemplos de problemas estructurados
10 ejemplos de problemas estructurados Lluvia de ideas de toma de decisiones
Lluvia de ideas de toma de decisiones Nadie toma para si esta honra
Nadie toma para si esta honra Toma teu leito e anda
Toma teu leito e anda Modelo oriental habilidades directivas
Modelo oriental habilidades directivas Conferintele interaliate
Conferintele interaliate Modelo racional de l taylee
Modelo racional de l taylee Kraljević i prosjak mišljenje o djelu
Kraljević i prosjak mišljenje o djelu Tomad señor y recibid toda mi libertad
Tomad señor y recibid toda mi libertad Toma directa
Toma directa Pulso femoral
Pulso femoral Murro em ponta de faca gif
Murro em ponta de faca gif Hematocrito en que tubo se toma
Hematocrito en que tubo se toma Donde se puede tomar el pulso
Donde se puede tomar el pulso Problemas de decision administrativa
Problemas de decision administrativa La toma de nota
La toma de nota Respiracion kussmaul
Respiracion kussmaul Herramientas del metodo cuantitativo
Herramientas del metodo cuantitativo Atomy probiotics
Atomy probiotics Toma de decisiones programadas ejemplos
Toma de decisiones programadas ejemplos Modelo del conjunto evocado
Modelo del conjunto evocado Proceso de toma de decisiones
Proceso de toma de decisiones Cómo se toma
Cómo se toma Adrian olteanu
Adrian olteanu Madalina toma
Madalina toma Gdss que es
Gdss que es Toma de presion
Toma de presion Pustolovine toma sawyera prezentacija
Pustolovine toma sawyera prezentacija Estilos en la toma de decisiones
Estilos en la toma de decisiones Toma de muestras indubitadas
Toma de muestras indubitadas Proceso militar para la toma de decisiones
Proceso militar para la toma de decisiones Josue toma el mando
Josue toma el mando Toma de apuntes características
Toma de apuntes características Conclusión de toma de decisión
Conclusión de toma de decisión Toma de la bastilla
Toma de la bastilla Escala de toma de decisiones
Escala de toma de decisiones Test del puerquito
Test del puerquito Le moigne toma de decisiones
Le moigne toma de decisiones Toma de decisiones y resolución de conflictos
Toma de decisiones y resolución de conflictos Si quieres ser mi discipulo toma tu cruz y sigueme
Si quieres ser mi discipulo toma tu cruz y sigueme John dewey pensamiento critico
John dewey pensamiento critico Modelos gerenciales
Modelos gerenciales Señor toma mi vida entera
Señor toma mi vida entera Discussion director
Discussion director Nec consultants
Nec consultants The newsroom director
The newsroom director Assistant director vicky
Assistant director vicky Director of technical education hp
Director of technical education hp Ethics acrostic poem
Ethics acrostic poem Sub director
Sub director Child development matrix
Child development matrix Wrap it up hand signal
Wrap it up hand signal Actor director musician
Actor director musician Director
Director Penitenciarul miercurea ciuc
Penitenciarul miercurea ciuc Director de el espectador
Director de el espectador Casa de sanatate bistrita
Casa de sanatate bistrita वेतनिका
वेतनिका English comic actor and film director
English comic actor and film director Paul king cisco
Paul king cisco Kill the director ukulele
Kill the director ukulele Ciclo de argos
Ciclo de argos Oliver stone
Oliver stone Macromedia director mx
Macromedia director mx Types of span of control in organization
Types of span of control in organization Supportive communication style
Supportive communication style