IKATAN KIMIA Juni Ekowati Departemen Kimia Farmasi Fakultas




















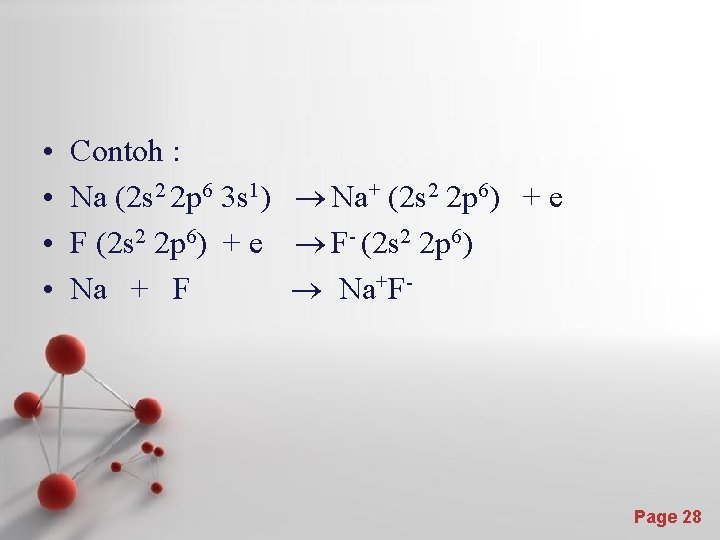
























































































































- Slides: 198

IKATAN KIMIA Juni Ekowati Departemen Kimia Farmasi Fakultas Farmasi Universitas Airlangga 2014 Page 1

Lingkup Pembahasan Kimia Dasar Sebagian Hukum-hukum Dasar Ilmu Kimia telah dipelajari di SMU, maka pada Semester I ini yang dibahas adalah pendalaman Hukum-hukum Dasar, pendalaman sifat-sifat dan struktur materi. Page 2

Peran Kimia Dasar berperan sebagai landasan (basis) bagi Ilmu-ilmu Kimia yang lain dan bersangkutan dengan cabang pengetahuan lanjutan. Kimia Fisik Kimia Organik Kimia Analitik Ilmu-ilmu lain Kimia Dasar Page 3

IKATAN KIMIA • Bila suatu atom berantaraksi dengan atom lain membentuk suatu bangun baru yang disebut molekul (dari bahasa Latin : molecula, artinya massa yang kecil), maka antaraksi yang terjadi membentuk ikatan kimia. • Pada proses pembentukan ikatan kimia, yang sangat berperan adalah elektron kulit terluar atau elektron valensi atom-atom yang berantaraksi itu. Page 4

Atom terdiri dari : § Elektron – terletak di luar nukleus; bermuatan negatif. § Proton – terletak di dalam nukleus; bermuatan positif, setara dengan muatan negatif elektron. § Neutron – terletak di dalam nukleus; tidak bermuatan. Page 5

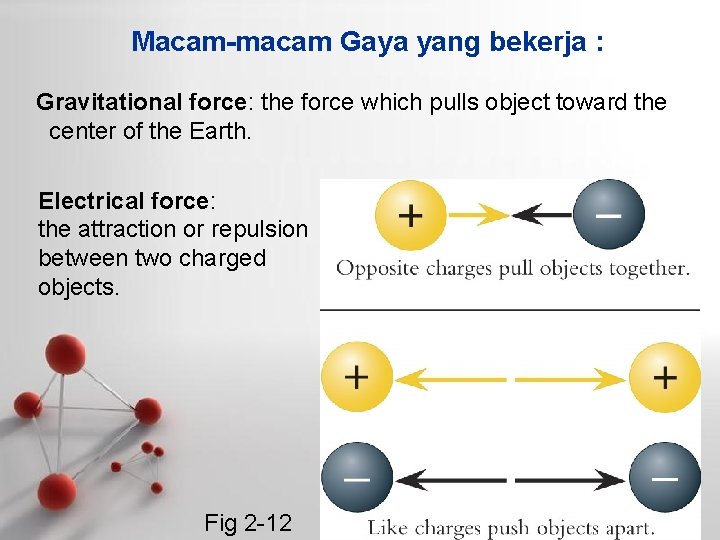
Macam-macam Gaya yang bekerja : Gravitational force: the force which pulls object toward the center of the Earth. Electrical force: the attraction or repulsion between two charged objects. Fig 2 -12 Page 6

Magnetic force: the force generated by charged objects in motion. Fig 2 -12 Page 7 Courtesy Patrick Watson

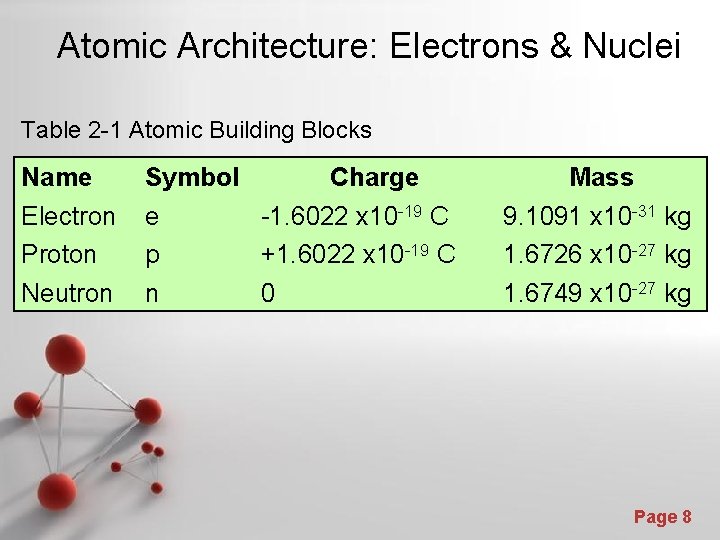
Atomic Architecture: Electrons & Nuclei Table 2 -1 Atomic Building Blocks Name Symbol Electron Proton Neutron e p n Charge -1. 6022 x 10 -19 C +1. 6022 x 10 -19 C 0 Mass 9. 1091 x 10 -31 kg 1. 6726 x 10 -27 kg 1. 6749 x 10 -27 kg Page 8

Atomic number, Z : nulcear charge, number of protons X = Atomic symbol of the element, or element symbol A = The Mass number; A = Z + N Z = The Atomic Number, the Number of Protons in the Nucleus N = The Number of Neutrons in the Nucleus Page 9

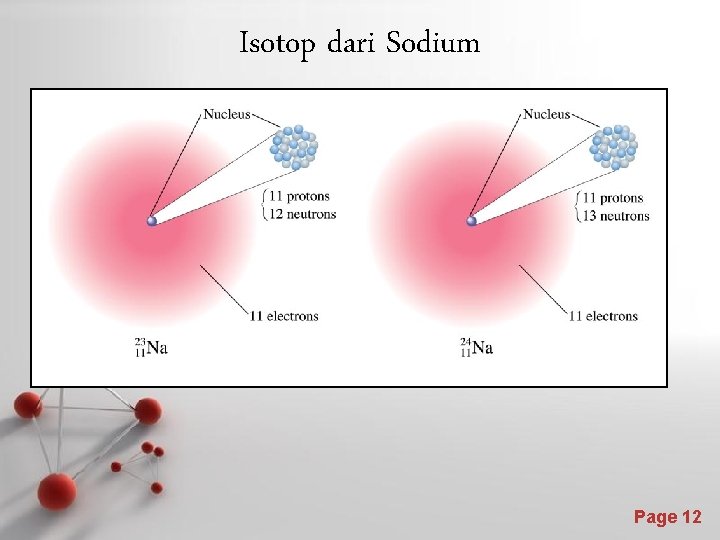
Isotop • • Atom yang memiliki jumlah proton sama, tetapi jumlah neutron yang berbeda. Isotop ini menunjukkan sifat kimia yang hampir sama. Sifat kimia atom ini disebabkan sifat elektronnya. Hampir semua senyawa yang ada di alam berada dalam campurannya dengan isotopnya. Page 10

Atomic Diversity Isotop : A ZX Contoh : 16 O 8 12 6 C 14 6 C 8 proton, 8 neutron, 8 elektron 6 proton, 6 neutron, 6 elektron 6 proton, 8 neutron, 6 elektron Page 11

Isotop dari Sodium Page 12

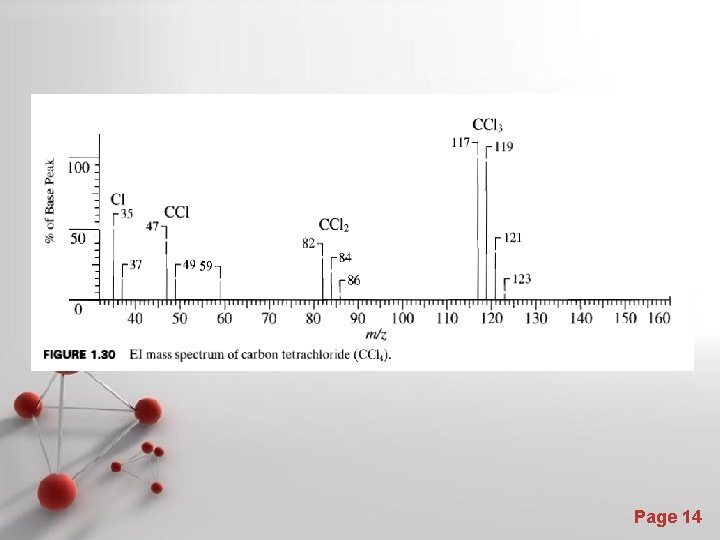
Isotop Kelimpahan isotop Cl di alam Page 13

Page 14

Elektron valensi - Elektron valensi (valence electrons) adalah Elektron yang terlibat dalam suatu ikatan - Elektron valensi merupakan faktor penting dalam ikatan kimia, letaknya di kulit terluar orbital atom. - Elektron tersebut ditulis sebagai titik (dots) disebelah simbol dari elemen. - Bentuk seperti itu dinamakan Lewis Structures atau Lewis Dot Structures. Page 15

Struktur Lewis dan Aturan Oktet Page 16

JENIS-JENIS IKATAN KIMIA • Pada proses pembentukan ikatan terjadilah penataan ulang susunan elektron terluar kedua atom itu sehingga menjadi susunan elektron yang baru. • Menurut sifat-sifat dan susunan elektron valensi yang baru setelah dua atom berantaraksi, terdapat tiga jenis ikatan kimia, yaitu : 1. Ikatan elektrovalen (ikatan ion) 2. Ikatan kovalen 3. Ikatan logam Page 17

Ikatan ion Page 18

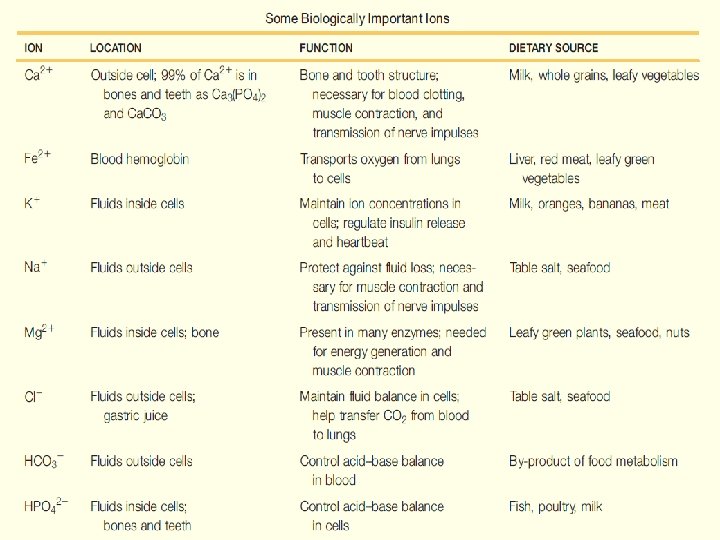
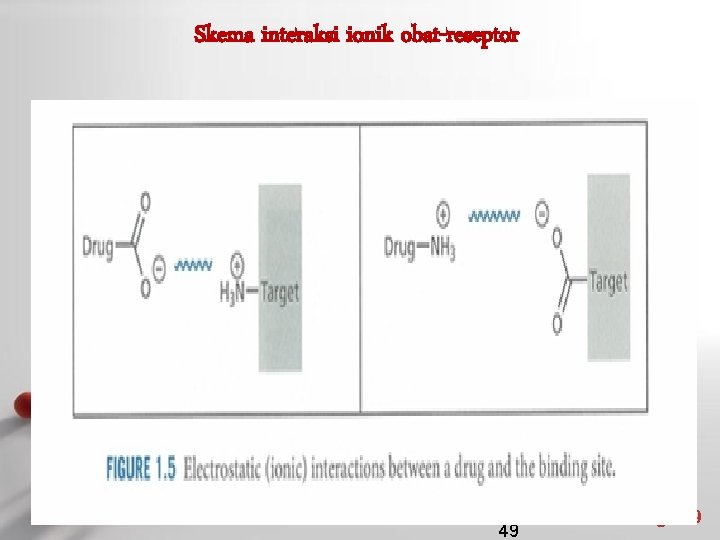
Ikatan ion • • • Ikatan ion adalah ikatan yang dihasilkan oleh daya tarik menarik elektrostatik antara ion-ion yang berlawanan muatan. Kekuatan ikatan (20 -40 k. J mol-1) Kekuatan tarik menarik akan semakin berkurang bila jarak antar ion semakin jauh dan pengurangan tersebut berbanding terbalik dengan jaraknya. Beberapa obat mengandung gugus fungsi asam maupun amina yang terionisasi pada p. H fisiologis, memungkinkan terbentuknya ikatan ion antara senyawa obat dan reseptor. Page 19

IKATAN ION) -Pada pembentukan ikatan ion, atom-atom akan berusaha mencapai konfigurasi oktet dalam membentuk ion positif atau ion negatif. Kaidah Oktet Atas dasar konfigurasi elektron gas mulia tersebut, Kossel mengajukan Kaidah (Aturan) Oktet, yaitu bahwa susunan (konfigurasi) elektron dengan jumlah delapan elektron merupakan susunan elektron yang stabil. Page 20

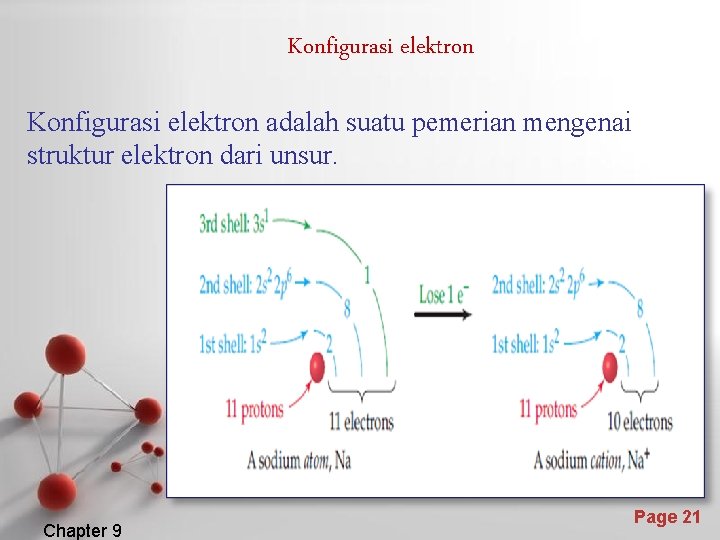
Konfigurasi elektron adalah suatu pemerian mengenai struktur elektron dari unsur. Chapter 9 Page 21

Pembentukan ion positif • • Ion positif terbentuk dengan pengeluaran elektron valensi. Contoh : Na Na+ + e Atom Na Ion Na+ • • Konfigurasi : Atom Na : 1 s 2 2 p 6 3 s 1 Ion Na+ : 1 s 2 2 p 6 Terlihatlah bahwa konfigurasi ion Na+ sama dengan konfigurasi atom Ne. Page 22

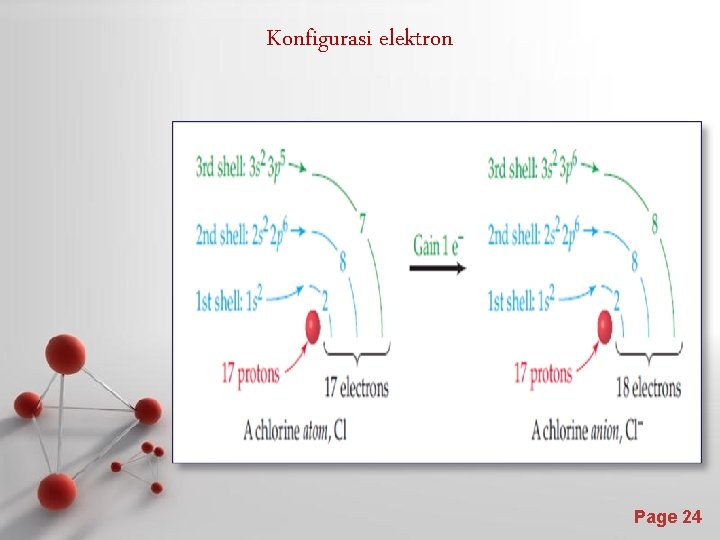
Pembentukan ion negatif Ion negatif terbentuk dengan penarikan elektron dari luar ke dalam kulit elektron valensi. Contoh : F + e F– Atom F Ion F-Konfigurasi : Atom F : 1 s 2 2 p 5 Ion F : 1 s 2 2 p 6 Ternyata konfigurasi elektron ion F – sama dengan konfigurasi elektron atom Ne. Jadi terlihatlah bahwa konfigurasi elektron yang stabil adalah konfigurasi dengan jumlah elektron terluar delapan. Page 23

Konfigurasi elektron Page 24

Konfigurasi elektron Page 25


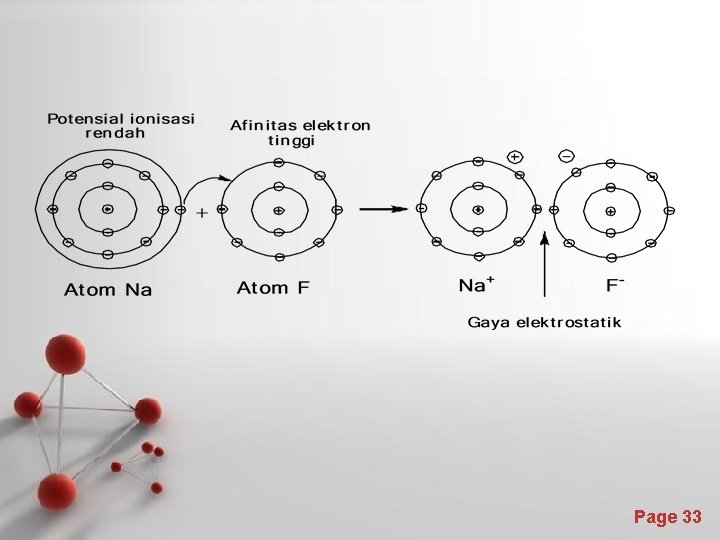
Pembentukan ikatan ionik (ikatan elektrovalen) Ikatan ionik akan terbentuk bila : • Terdapat atom unsur dengan potensial ionisasi rendah (yang akan menjadi ion positif) dan atom unsur dengan afinitas elektron tinggi (yang akan menjadi ion negatif) • Terjadi tarik menarik antara ion-ion tersebut melalui gaya elektrostatik (gaya Coulomb) Q 1, Q 2 = charge on ions k = 8. 99 x 109 J-m/c 2 d = distance between ions Page 27
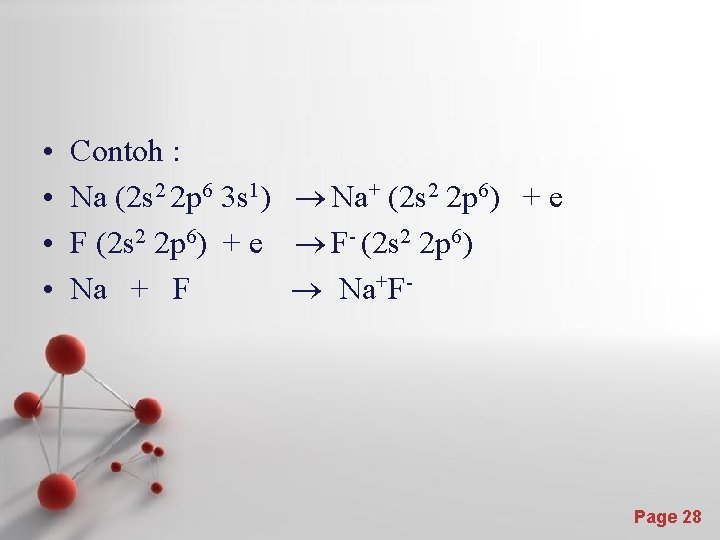
• • Contoh : Na (2 s 2 2 p 6 3 s 1) Na+ (2 s 2 2 p 6) + e F (2 s 2 2 p 6) + e F- (2 s 2 2 p 6) Na + F Na+F- Page 28

Chapter 9 29 Page 29

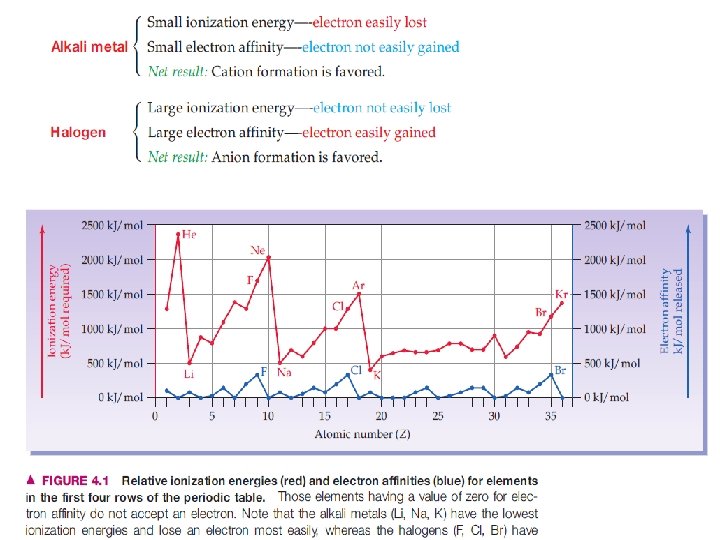
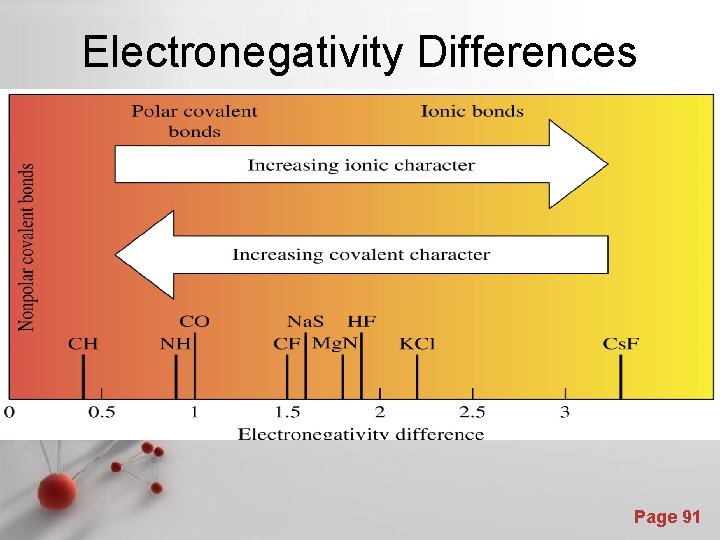
Keelektronegatifan : Ukuran kemampuan atom untuk menarik elektron luarnya, atau elektron valensi • Karena elektron luar dari atom yang digunakan untuk ikatan, maka keelektronegatifan berguna untuk meramalkan dan menerangkan kereaktifan kimia. • Keelektronegatifan dipengaruhi oleh jumlah proton dalam inti dan jumlah kulit yang mengandung elektron Page 30

Skala Pauling : Skala numerik dari keelektronegatifan. Page 31

• Ikatan ion terbentuk bila perbedaan keelektronegatifan antara dua atom adalah besar (> 1, 7) • Misalnya : atom Na (keelektronegatifan : 0, 9), atom Cl (keelektronegatifan : 3, 0). Page 32

Page 33

Dalam pembentukan ikatan ionik berlaku aturan : jumlah elektron yang dilepas oleh suatu atom sama dengan jumlah elektron yang diterima oleh atom yang lain. Page 34

Ikatan ionik Na(s) + ½Cl 2(g) Na. Cl(s) H°f = -410. 9 k. J - Reaksi ini bersifat sangat eksotermik - Sodium kehilangan satu elektron menjadi ion Na+ - Klorin menerima sebuah elektron menjadi ion Cl- Na+ memiliki konfigurasi elektron dari atom Ne dan Cl- memiliki konfigurasi elektron dari atom Ar Page 35

Unsur-unsur yang dapat membentuk ikatan ionik Unsur-unsur yang mempunyai sifat-sifat sebagai berikut : • Unsur-unsur dengan potensial ionisasi rendah : • Golongan IA (golongan logam alkali) • Golongan IIA (golongan logam alkali tanah) • Unsur-unsur dengan afinitas elektron tinggi : • Golongan VIIA (golongan halogen) • Golongan VIA (golongan kalkogen) Page 36

Page 37

Dengan demikian ikatan ionik dapat terjadi pada unsur golongan : IA dengan VIIA (jadi senyawa AY) IA dengan VIA (jadi senyawa A 2 X) IIA dengan VIIA (jadi senyawa BY 2) IIA dengan VIA (jadi senyawa BX) Page 38

Ciri-ciri senyawa ionik : - Kebanyakan senyawa ionik menyerupai Na. Cl yaitu berwarna putih - Mudah larut dalam air - Leleh pada suhu tinggi - Lelehan senyawa ionik dapat menghantarkan arus listrik - Bentuk padat juga terdiri atas ion-ion, yang tersusun dalam suatu kristal. Page 39

Jari-jari ion • Ion positif : jari-jari ion positif lebih kecil daripada jari -jari atomnya. Hal ini disebabkan kation kehilangan elektron pada kulit terluarnya • Ion negatif : jari-jari ion negatif lebih besar daripada jari-jari atomnya Hal ini disebabkan pada anion kulit terluar bertambah elektronnya Jari-jari ion berpengaruh terhadap sifat fisik senyawanya Page 40

Jari-jari ion • Makin kecil jari-jari kation, makin tinggi titik lelehnya. • Hal ini disebabkan makin kecil jarak antara kation dan anion sehingga gaya tarik keduanya makin besar dan sukar dipisahkan dengan pemanasan Page 41

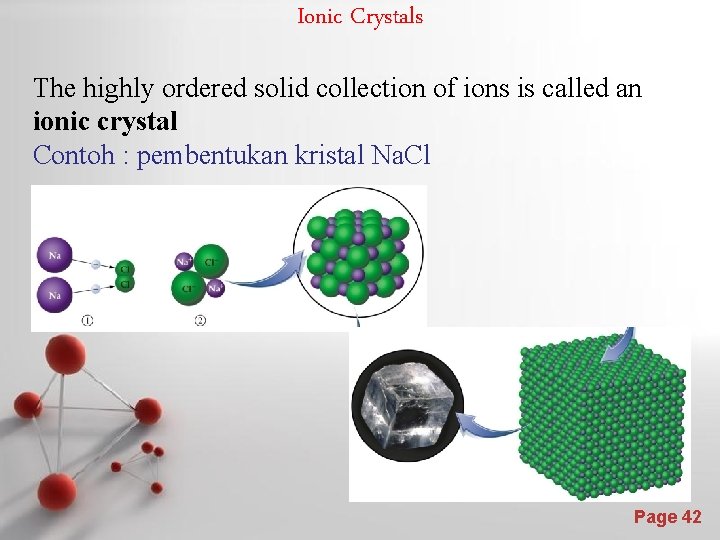
Ionic Crystals The highly ordered solid collection of ions is called an ionic crystal Contoh : pembentukan kristal Na. Cl EOS Page 42

Sifat kristal senyawa ion Isomorfi Polimorfi Bila ada dua zat yang mempunyai bangun kristal yang sama, maka dikatakan bahwa kedua zat itu isomorf. Contohnya campuran Na. Cl dan KCl yang sama bangun kristalnya dan perbedaannya hanya pada besar ion Na+ dan K+. Di alam banyak terdapat zat atau senyawa yang berada dalam berbagai bentuk kristal, mis. Ca. CO 3 yang dapat berbentuk heksagonal dalam mineral kalsit atau ortorombik dalam mineral aragonit. Kedaan demikian disebut polimorfi. Senyawa-senyawa yang mempunyai sifat polimorfi menunjukkan sifat-sifat yang khas pada masing-masing bentuk kristalnya, sehingga manfaatnya pun berlainan. Misalnya batu pualam dan gragal yang merupakan bentuk polimorfi Ca. CO 3. Page 43

Alotropi : - Bangun kristal berlainan yang dimiliki oleh suatu unsur. - Unsur-unsur yang mempunyai sifat alotropi adalah karbon (intan, arang dan grafit), fosfor (merah dan kuning), belerang (rombik dan monoklinik) dan oksigen (O 2 dan O 3). - Suatu alotrop dapat berubah menjadi alotrop yang lain dengan perlakuan fisika atau kimia. Contoh perlakuan fisika adalah pemanasan pada suhu tertentu yang disebut suhu transisi. Amorfi : - Ada juga zat-zat yang tidak dapat membentuk kristal. Biasanya hal ini terjadi pada senyawa-senyawa dengan massa rumus (berat molekul) tinggi, dan umumnya terdapat sebagai polimer. - Contoh-contoh polimer adalah karet (alam atau buatan), karbohidrat (amilum dan selulosa), protein dan kaca. - Zat yang amorf tidak mempunyai titik lebur yang tajam, melainkan suatu trayek lebur. Page 44

Air kristal • Senyawa anorganik padat sering dinyatakan sebagai kristal hidrat, yaitu suatu senyawa yang mengandung molekul-molekul air dan yang turut menyusun kisi kristal, misalnya Cu. SO 4. 5 H 2 O; Na 2 SO 4. 10 H 2 O; Ca. SO 4. 2 H 2 O dan lain-lain. • Sebagian atau semua air kristal dapat lepas dari ikatannya karena pengaruh suhu atau tekanan uap, sehingga kristalnya menjadi kering. Contoh reaksinya ialah : Mg. SO 4. 7 H 2 O Mg. SO 4. H 2 O + 6 H 2 O • Sebaliknya, kristal dapat pula mencair bila banyak molekul air masuk dan terikat oleh kristal. Sifat ini dinamakan higroskopik. Page 45

Chapter 9 46 Page 46

Page 47

48 Page 48

Skema interaksi ionik obat-reseptor 49 Page 49

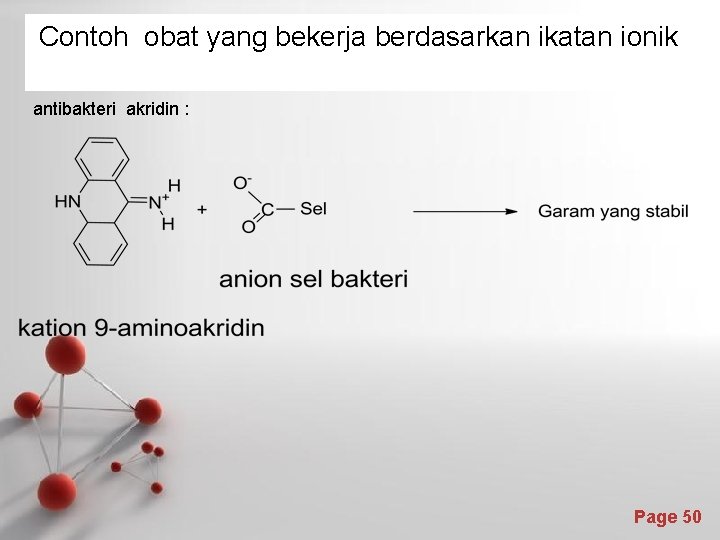
Contoh obat yang bekerja berdasarkan ikatan ionik antibakteri akridin : Page 50

IKATAN KOVALEN Page 51

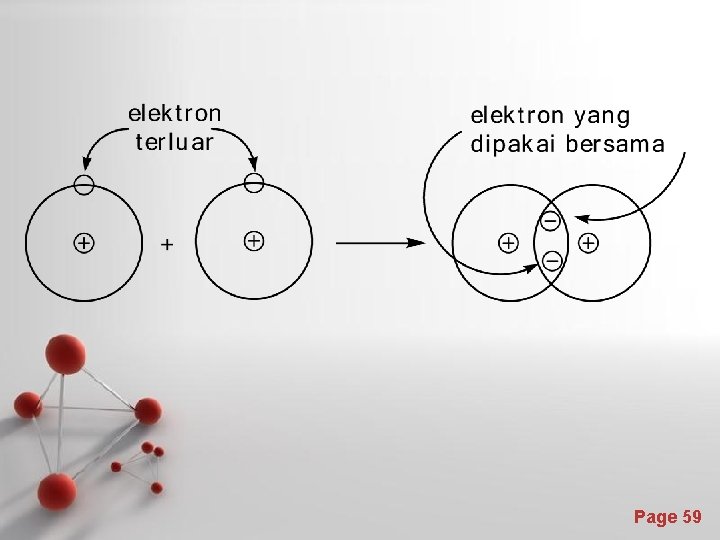
IKATAN KOVALEN PEMBENTUKAN IKATAN KOVALEN • Ikatan kovalen, yang juga disebut ikatan atom, terbentuk dari pemakaian bersama pasangan-pasangan elektron yang berasal dari atom-atom yang berikatan. • Bila suatu atom berdiri sendiri, maka elektron-elektronnya hanya dipengaruhi oleh inti atomnya sendiri. • Bila dua buah atom saling mendekati, maka elektron dan inti atom keduanya saling mempengaruhi, sehingga tercapai keadaan yang lebih stabil (tingkat energi lebih rendah) sewaktu terjadi ikatan kimia. • Ikatan kovalen sangat kuat (40 -140 kkal/mol) dan secara prakstis bersifat irreversible. Page 52

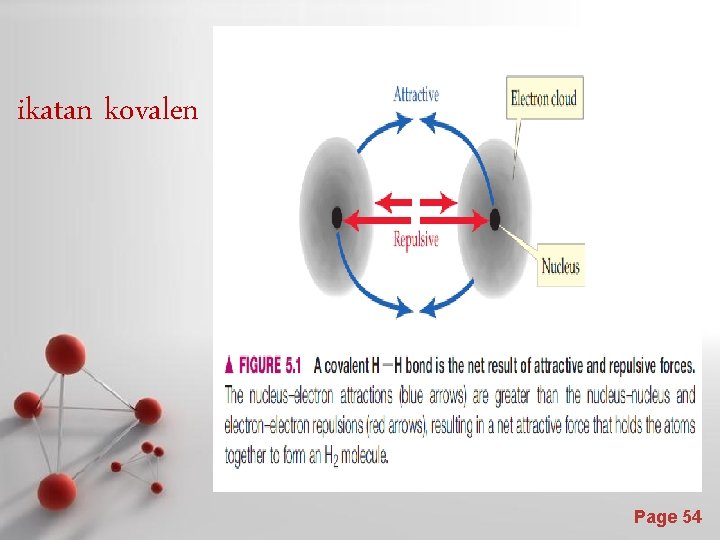
• Contoh pada molekul H 2, terdiri dari nukleus bermuatan positif dan satu elektron valensi 1 s yang bermuatan negatif. • Jika dua atom hidrogen berdekatan, akan terjadi gaya tarik elektrik, yaitu “repulsive” dan “attractive ”. • Gaya elektrik “repulsive” terjadi antara dua muatan positif dan dua muatan negatif. • Gaya elektrik “attractive ” terjadi antara muatan positif masing-masing nukleus dengan muatan negatif masing elektron. • Karena gaya tarik (“attractive ” ) lebih kuat daripada tolakan (“repulsive”), maka ikatan kovalen terbentuk dan atom hidrogen dapat berikatan bersama sebagai H 2. Page 53

ikatan kovalen Page 54

ikatan kovalen Page 55

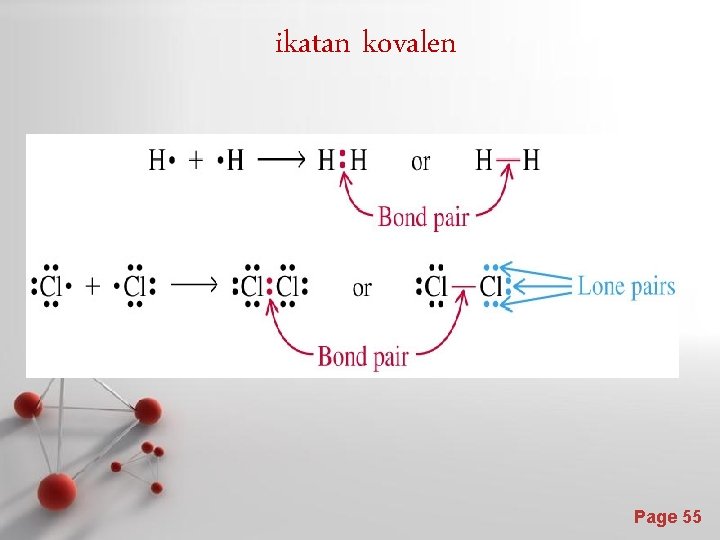
Contoh pada pembentukan ikatan kovalen molekul klorin (Cl 2) - Atom Cl memiliki 7 elektron valensi dan konfigurasi elektron kulit terluarnya adalah - Jika digunakan simbol elektron dot , maka masing-masing atom Cl dinyatakan sebagai - Apabila dua atom Cl saling mendekat, elektron 3 p yang tidak berpasangan akan digunakan bersama-sama oleh kedua atom sebagai ikatan kovalen. - Masing-masing atom Cl pada molekul Cl 2 memiliki 6 elektron pada kulit terluar dan membentuk elektron valensi oktet seperti Ar. Page 56

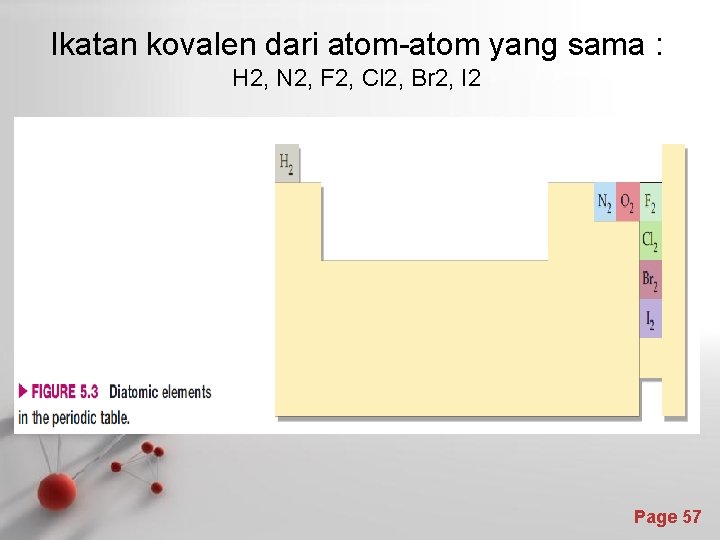
Ikatan kovalen dari atom-atom yang sama : H 2, N 2, F 2, Cl 2, Br 2, I 2 Page 57

PENGGAMBARAN BANGUN IKATAN KOVALEN Ada dua cara (metode) dalam menggambarkan ikatan kovalen, yaitu : 1. Cara Ikatan Valensi (Valence Bond Method) 2. Cara Orbital Molekul (Molecular Orbital Method) Cara Ikatan Valensi disebut juga cara Heitler-London-Slater-Pauling (cara HLSP), dg anggapan bahwa molekul terdiri atas atom-atom yang Berdiri sendiri-sendiri, kecuali satu atau beberapa elektron kulit terluar suatu atom digunakan oleh atom lain dalam kulit terluarnya. Page 58

Page 59

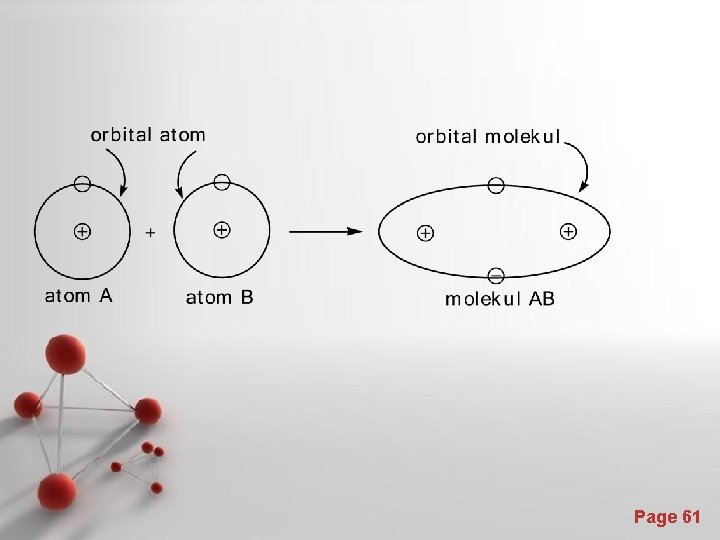
Cara Orbital Molekul • disebut juga cara Hund-Mulliken-Hückel (cara HMH), dengan anggapan bahwa seluruh molekul beserta elektron-elektronnya sebagai satu kesatuan. • Elektron bergerak karena pengaruh semua inti dan elektron-elektron lain dalam orbital baru, yang disebut orbital molekul. Page 60

Page 61

PENGGAMBARAN RUMUS BANGUN SENYAWA KOVALEN • Pembentukan ikatan s (sigma) dari tumpang tindih orbital s • G. N. Lewis mengajukan gambaran senyawa kovalen dengan titik dan garis, yaitu : 1. Dua titik menggambarkan satu pasang elektron 2. Satu garis sama dengan dua titik 3. Dua titik atau satu garis menggambarkan satu ikatan tunggal Page 62

Lewis Simbol Elektron valensi ditunjukkan dengan titik (dots) disekitar elemen EOS Page 63

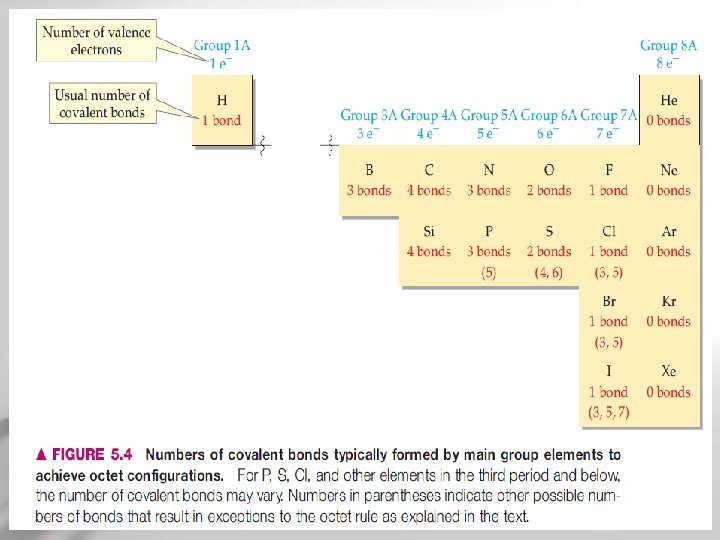
• Banyaknya ikatan kovalen yang dibentuk oleh sebuah atom tergantung pada banyaknya elektron tambahan yang diperlukan agar atom itu mencapai konfigurasi gas mulia Page 64

Page 65

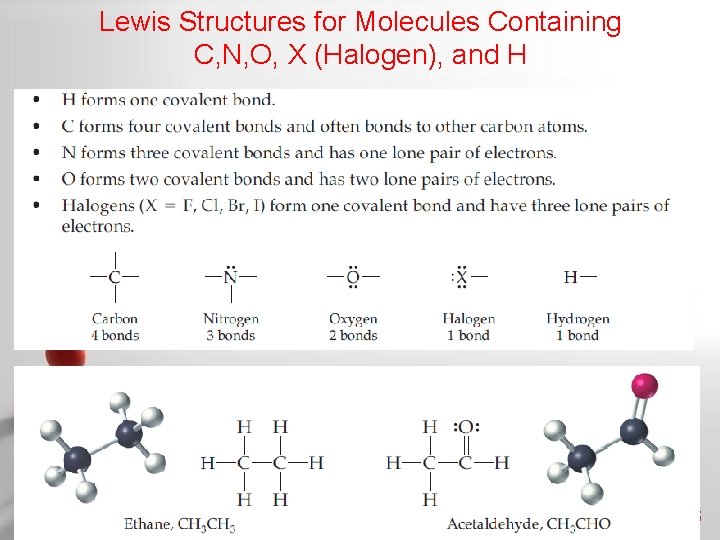
Lewis Structures for Molecules Containing C, N, O, X (Halogen), and H Page 66

Contoh : metana (CH 4) Gambar 7. 9. Rumus bangun senyawa kovalen CH 4 dengan titik dan garis Satu atom H dikelilingi oleh 2 elektron (konfigurasi elektron helium) dan satu atom C dikelilingi oleh 8 elektron (oktet). Page 67

Struktur Kerangka • Atom hidrogen selalu berada di ujung. • Atom pusat umumnya atom yang memiliki sifat keelektronegatifan paling rendah. • Atom karbon hampir selalu menjadi atom pusat. • Umumnya struktur merupakan senyawa yang kompak dan simetris. Page 68

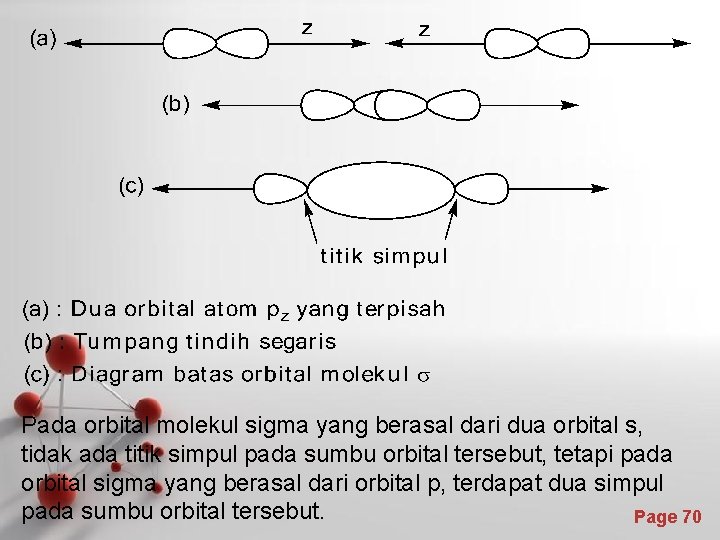
Pembentukan ikatan sigma dari tumpang tindih orbital p Pada molekul H 2, ikatan sigma dapat terbentuk dari tumpang tindih (overlap) orbital-orbital s. Ikatan sigma dapat juga terbentuk dari tumpang tindih orbital p Kekuatan ikatan sigma : • Ikatan sigma merupakan ikatan kovalen yang paling kuat, dengan energi ikatan yang paling besar. Page 69

Pada orbital molekul sigma yang berasal dari dua orbital s, tidak ada titik simpul pada sumbu orbital tersebut, tetapi pada orbital sigma yang berasal dari orbital p, terdapat dua simpul pada sumbu orbital tersebut. Page 70

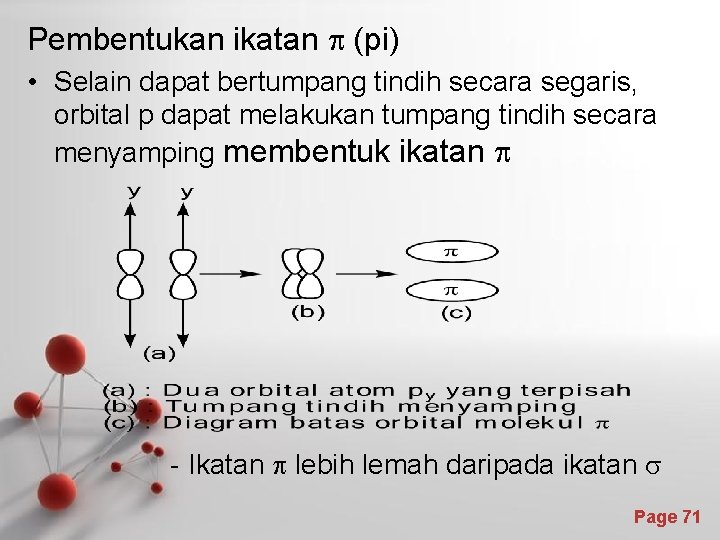
Pembentukan ikatan p (pi) • Selain dapat bertumpang tindih secara segaris, orbital p dapat melakukan tumpang tindih secara menyamping membentuk ikatan p - Ikatan p lebih lemah daripada ikatan s Page 71

• Pembentukan orbital molekul dari orbital atom s dan p • Kemungkinan pembentukan orbital molekul dari berbagai orbital atom adalah : 1. Dari orbital atom s hanya dapat terbentuk orbital molekul sigma (s) 2. Dari orbital atom p dapat terbentul orbital molekul sigma (s) dan pi (p) Page 72

Gambarkan Rumus Struktur : a. b. c. d. e. HCN CO 2 N 2 C 2 H 3 Cl Page 73


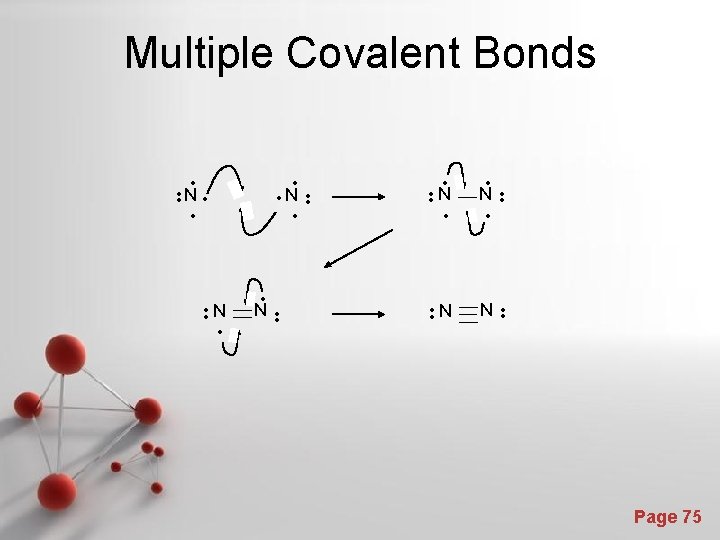
Multiple Covalent Bonds N N • • • N • • N • • • • N • • Page 75

Page 76

Page 77

SIFAT KEPOLARAN, MUATAN DAN RESONANSI SENYAWA KOVALEN KONSEP KEPOLARAN Kepolaran (dari bahasa Latin polus, tiang atau sumbu langit) berarti sifat mengutub atau dimilikinya kutub, dalam pengertian elektrostatik, oleh suatu senyawa. Kepolaran dalam molekul diatomik Dua atom yang berikatan membentuk suatu molekul belum tentu masing-masing mempunyai keelektronegatifan yang sama. Sebagai akibatnya, penyebaran elektron dalam molekul belum tentu merata dalam seluruh molekul tersebut. Page 78

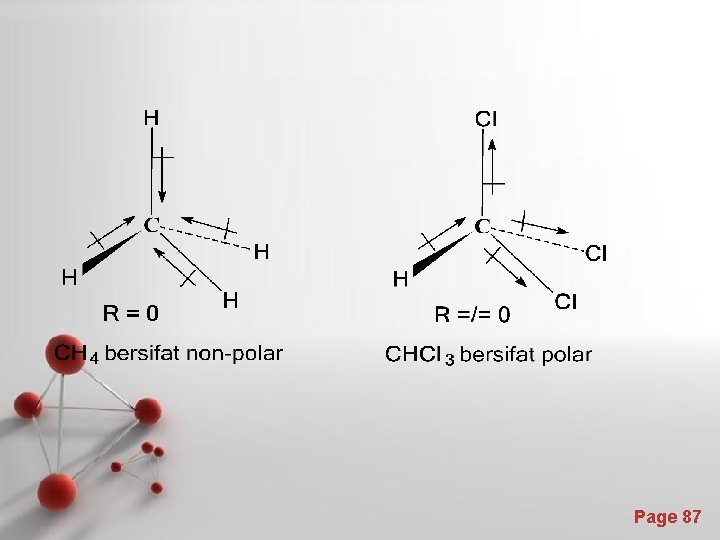
1. Ikatan Kovalen Non-polar - Yaitu ikatan kovalen yang elektron-elektronnya tersebar merata dan titik pusat muatan negatif (awan elektron) terletak ditengah-tengah molekul dan berimpit dengan titik pusat muatan positif (inti atom). - Contoh : molekul H 2. - Page 79

• Senyawa dengan ikatan kovalen non-polar disebut senyawa non-polar • Pada senyawa diatomik, keelektronegatifan kedua atom sama Contoh : H 2, N 2, O 2, F 2, Cl 2, Br 2, I 2 Page 80

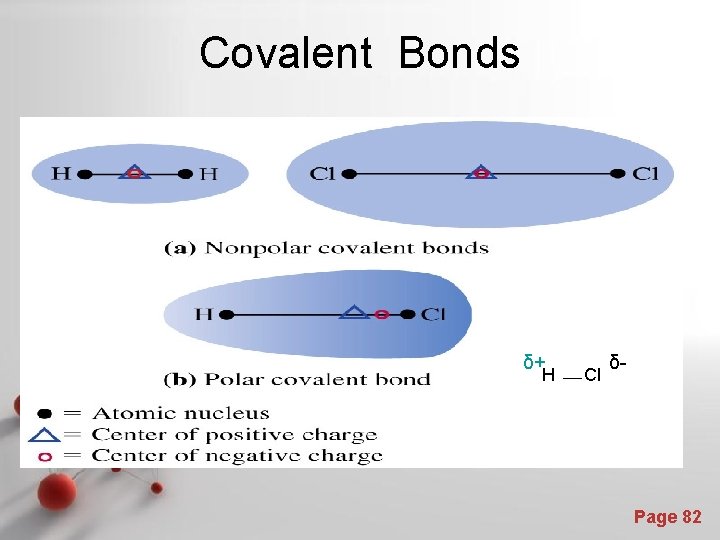
2. Ikatan polar -Yaitu ikatan kovalen yang elektron-elektronnya tersebar tidak merata dan titik pusat muatan negatif (awan elektron) tidak terletak ditengah-tengah molekul dan tidak berimpit dengan titik pusat muatan positif (inti atom). -Contoh : molekul HCl. -Senyawa dengan ikatan kovalen polar disebut senyawa polar -Pada senyawa diatomik, keelektronegatifan kedua atom tidak Page 81 sama.

Covalent Bonds δ+ H Cl δ- Page 82

Dwikutub (dipole) dan momen dwikutub (dipole moment) Molekul polar mempunyai pusat muatan positif dan negatif yang tidak berimpit, maka seolah-olah molekul tersebut mempunyai dua kutub, yaitu kutub positif dan kutub negatif. - Keadaan demikian merupakan dwikutub (dipole). - Suatu dwikutub dilambangkan sebagai anak panah dengan ujung anak panah mengarah ke kutub negatif. - Gb. 9. 3. Gambaran dan Lambang dwikutub Page 83

Momen dwikutub (dipole moment) • Kemampuan suatu dwikutub untuk berorientasi dalam medan listrik dikenal sebagai momen dwikutub (dipole moment), yang besarnya dapat dirumuskan sebagai berikut : = zxd • (mu) =momen dwikutub, dengan satuan Debye. • z = muatan dalam satuan elektrostatik (Statcoulomb) • d =jarak dalam cm Page 84

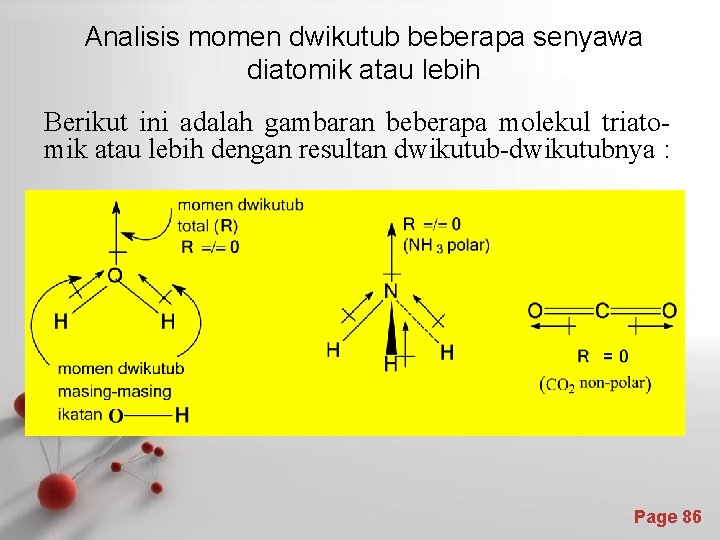
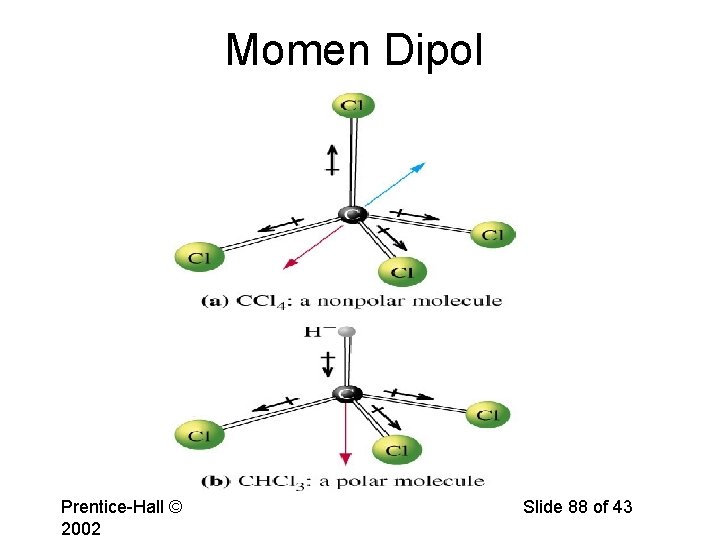
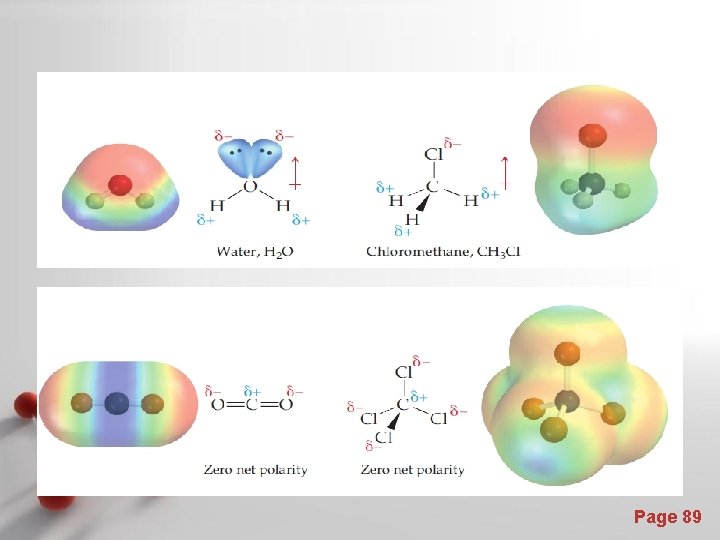
Momen dwikutub dan kepolaran : • Molekul-molekul diatomik dengan kedua atom sama, maka momen dwikutubnya = nol, karena d (jarak antara kutub negatif dan kutub positif) adalah nol (berimpit) dan molekul bersifat non-polar. • Molekul diatomik dengan atom-atom yang berbeda, maka 0, jadi molekul tersebut polar. • Momen dwikutub merupakan besaran vektor, jadi untuk molekul triatomik atau lebih, momen dwikutub total merupakan resultan dwikutub-dwikutub yang berasal dari tiap-tiap ikatan yang ada. • Bila resultan momen-momen dwikutub tersebut = 0, maka molekul tersebut bersifat non-polar, dan bila resultannya 0, maka molekul tersebut bersifat polar. Page 85

Analisis momen dwikutub beberapa senyawa diatomik atau lebih Berikut ini adalah gambaran beberapa molekul triatomik atau lebih dengan resultan dwikutub-dwikutubnya : Page 86

Page 87

Momen Dipol Prentice-Hall © 2002 Slide 88 of 43

Page 89

Kepolaran Page 90

Electronegativity Differences Page 91

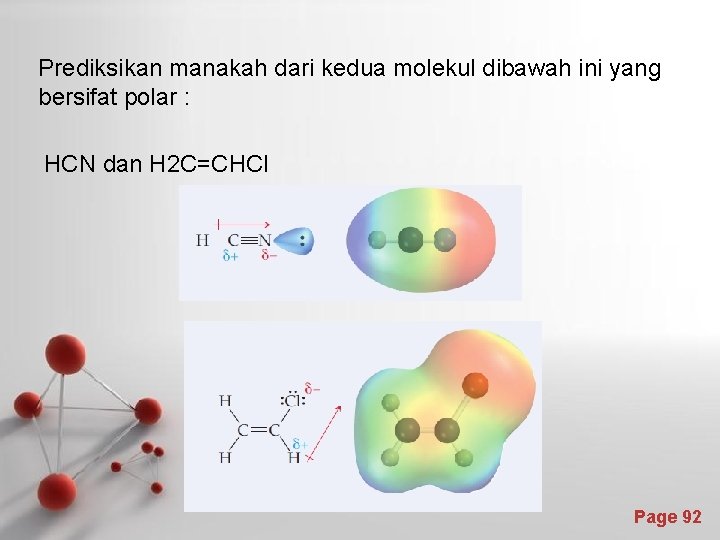
Prediksikan manakah dari kedua molekul dibawah ini yang bersifat polar : HCN dan H 2 C=CHCl Page 92

ENERGI PADA IKATAN KOVALEN Energi Ikatan adalah energi yang diperlukan untuk memecah atau membentuk suatu ikatan kovalen • Struktur Lewis tidak menggambarkan kekuatan relatif dari ikatan kovalen. • Contoh: ikatan H 2 dan Cl 2 digambarkan garis tunggal identik, tetapi dalam eksperimen ternyata diperlukan energi yang lebih besar untuk memecah ikatan H 2 daripada Cl 2. • Maka Ikatan H 2 > Cl 2 Page 93

Suatu besaran kuantitatif yang mengukur kestabilan suatu molekul disebut Energi disosiasi (pemecahan) Ikatan. Energi disosiasi (pemecahan) ikatan yaitu: Perubahan entalpi yang diperlukan untuk memecah suatu ikatan tertentu dalam 1 mol senyawa diatomik yang berwujud gas. Satuannya: k. J/mol Contoh: untuk molekul hidrogen H 2 (g) H (g) + H (g) AHo= + 436, 4 k. J Page 94

• Artinya : untuk memecah ikatan kovalen dalam 1 mol gas H 2 diperlukan 436, 4 k. J energi. • Sebaliknya : • H(g) + H(g) H 2(g) AH 0= - 436, 4 k. J • Artinya : dalam pembentukan ikatan kovalen 1 mol gas H 2 dari 2 atom H(g) diperoleh 436, 4 k. J energi. • Energi yang diperoleh ini disebut energi pembentukan ikatan. Page 95

Kekuatan ikatan kovalen Entalpi Ikatan (Energy) – Energi yang dibutuhkan untuk memecah ikatan kovalen pada substansi gas. Cl 2(g) 2 Cl(g) H = DCl-Cl - Jika lebih dari satu ikatan pecah, entalpi ikatan adalah fraksi dari H pada reaksi atomisasi : CH 4(g) C(g) + 4 H(g) H = 1660 k. J DC-H = ¼(1660 k. J) = 415 k. J. - Entalpi ikatan dapat bernilai positif atau negatif. Page 96

Kekuatan Ikatan Kovalen Page 97

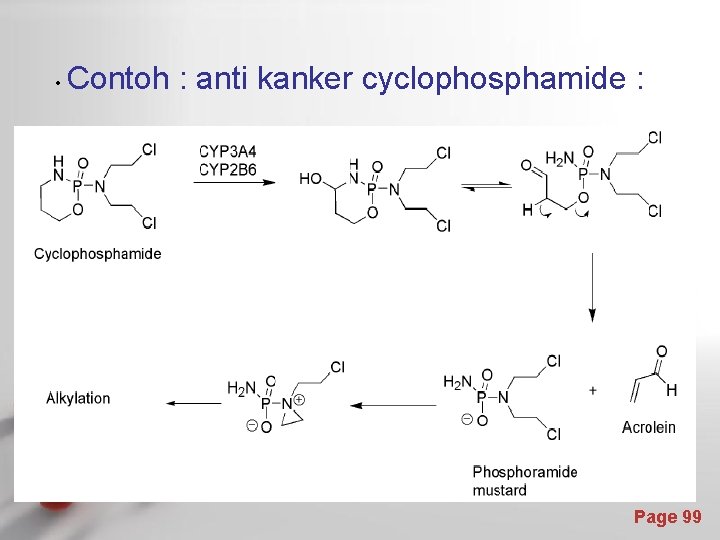
Interaksi obat-reseptor dengan pembentukan ikatan kovalen diperlukan pada kondisi tertentu, misalnya untuk tujuan antikanker Gugus fungsi yang sangat reaktif seperti alkil halida membentuk ikatan kovalen yang bersifat irreversibel dengan reseptor target. Contoh : cycloposphamide Page 98

• Contoh : anti kanker cyclophosphamide : Page 99

Kestabilan suatu senyawa/molekul dipengaruhi oleh beberapa faktor a. l. : • • • 1. Suhu 2. Cahaya 3. Adanya oksigen di udara 4. Kelembaban 5. Tekanan 6. Keasaman/Kebasaan Page 100

Contoh : 1. Pengaruh suhu / pemanasan dan tekanan misalnya Pelepasan air kristal pada Mg. SO 4. 7 H 2 O jadi Mg. SO 4 2. Cahaya dan Oksidasi udara misalnya Vit C putih jadi coklat 3. Kelembaban mis. Amoksisilin, Aspirin 4. Keasaman / kebasaan : Aspirin Page 101

IKATAN KOVALEN KOORDINASI (IKATAN DATIF) Page 102

IKATAN KOVALEN KOORDINASI (IKATAN DATIF) DEFINISI Ikatan kovalen koordinasi atau ikatan datif adalah ikatan kovalen yang pasangan elektronnya yang dipakai bersama berasal dari satu atom saja. Contoh 1 : Ion amonium (NH 4+) Page 103

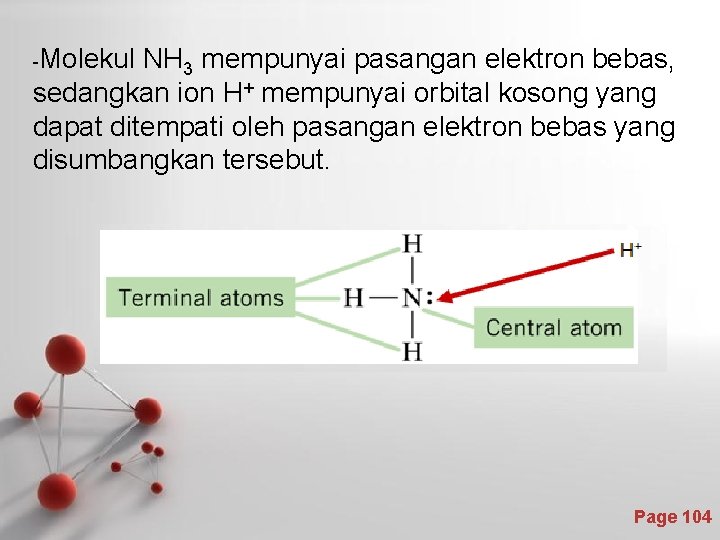
-Molekul NH 3 mempunyai pasangan elektron bebas, sedangkan ion H+ mempunyai orbital kosong yang dapat ditempati oleh pasangan elektron bebas yang disumbangkan tersebut. Page 104

TERBENTUKNYA IKATAN KOVALEN KOORDINASI • Ikatan kovalen koordinasi (datif) terbentuk jika : 1. Salah satu atom mempunyai pasangan elektron bebas 2. Atom yang lain mempunyai orbital kosong atau setengah penuh. Page 105

SENYAWA KOMPLEKS (SENYAWA KOORDINASI) Senyawa koordinasi adalah suatu senyawa netral yang mengandung satu atau lebih ion kompleks. Ion kompleks adalah ion yang terdiri atas satu ion pusat (kation logam) yang terikat dengan satu atau lebih molekul atau ion. Ligan adalah molekul atau ion yang mengikat ion pusat itu. Secara ringkas dapat dikatakan di sini bahwa senyawa kompleks dapat terdiri atas : [Kation kompleks] + Anion - (bukan kompleks) atau Kation+(bukan kompleks) [Anion kompleks]- atau [Kation kompleks]+[Anion kompleks]Page 106

Terbentuknya ion kompleks • Antaraksi antara ion logam dengan ligan dapat dianggap sebagai reaksi asam-basa Lewis. • Basa Lewis adalah suatu substansi yang dapat menyumbangkan satu atau lebih pasangan elektron. • Setiap ligan mempunyai paling sedikit satu pasangan elektron bebas, misalnya : Jadi ligan berperan sebagai basa Lewis. Page 107

- Sebaliknya, suatu atom logam dari golongan unsur transisi, baik dalam keadaan netral atau bermuatan positif, berperan sebagai asam Lewis, yang menerima dan memakai bersama pasangan elektron bebas dari basa Lewis. - Dengan demikian, ikatan logam-ligan biasanya berupa ikatan kovalen koordinasi. Page 108

Bilangan Koordinasi • Bilangan koordinasi dalam senyawa koordinasi adalah jumlah atom donor yang mengelilingi atom atau ion pusat dalam suatu senyawa kompleks. • • Contoh bilangan koordinasi : Ion Ag+ dalam [Ag(NH 3)2]+ adalah 2 Ion Cu 2+ dalam [Cu(NH 3)4]2+ adalah 4 Ion Fe 3+ dalam [Fe(CN)6]3+ adalah 6. Page 109

Bilangan Koordinasi Atom donor • Atom dalam ligan yang terikat langsung dengan ion atau atom pusat disebut atom donor. • Contoh : nitrogen adalah atom donor dalam ion kompleks [Cu(NH 3)4]2+. Page 110

Penggolongan ligan Ditinjau dari jumlah atom dalam molekul atau ion ligan, maka ligan dapat digolongkan menjadi ligan monodentat, ligan bidentat dan Ligan polidentat. • Ligan semisal H 2 O dan NH 3 adalah ligan monodentat, karena hanya mempunyai satu atom donor tiap ligan. Page 111

Ligan bidentat yang umum adalah etilendiamina • Kedua atom nitrogen dapat mengadakan ikatan kovalen koordinasi dengan suatu atom logam Page 112

Pembentukan kelat • Ion etilendiaminatetraasetat (EDTA) adalah suatu ligan polidentat yang mengandung enam atom donor, yaitu dua atom nitrogen dan empat atom oksigen. Keempat atom oksigen tersebut berada dalam empat gugus COO- yang berikatan tunggal dengan atom karbon. • Ligan-ligan bidentat dan polidentat juga disebut pembentuk kelat, karena kemampuannya mengikat atom logam bagaikan cakar (dari bahasa Yunani : chele yang berarti cakar). Page 113

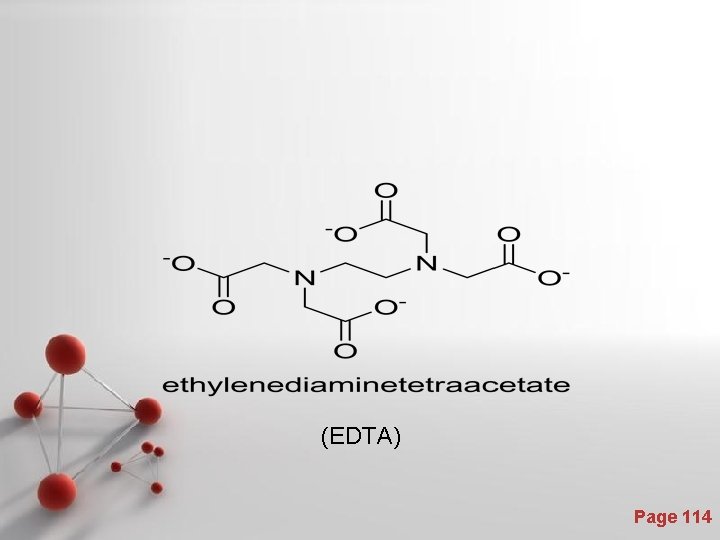
(EDTA) Page 114

Kegunaan senyawa kompleks Beberapa peranan dan kegunaan senyawa kompleks : • Hemoglobin dan klorofil merupakan senyawa kompleks dengan atom pusat besi dan magnesium dengan ligan berbagai protein. • Dalam kimia analitik dikenal kompleksometri, yaitu penentuan kadar logam dengan EDTA, juga kolorimetri dengan menggunakan kompleks yang berwarna. • EDTA dan BAL (dimerkaptopropanol) yang digunakan untuk penawar keracunan logam berat, juga senyawa kompleks platina yang digunakan untuk anti kanker. Page 115

GAYA ANTAR MOLEKUL • Molekul-molekul dalam wujud gas, cair dan padat saling berantaraksi satu dengan yang lainnya. • Antaraksi ini berpengaruh terhadap sifat-sifat fisika senyawa tersebut, misalnya titik leleh, titik didih, kelenturan, kekerasan dll. • Secara garis besar, antaraksi antar molekul dapat digolongkan menjadi : 1. Gaya Van der Waals 2. Ikatan hidrogen 3. Ikatan kimia antar molekul 4. Gaya antar ion. Page 116

GAYA VAN DER WAALS Gaya Dispersi (gaya London) • • Gaya ini terjadi di antara molekul-molekul non-polar. Pada senyawa non-polar, pada saat-saat tertentu, secara kebetulan, elektron-elektron terkonsentrasi pada suatu tempat tertentu dalam molekul. Perpindahan elektron ini menyebabkan molekul yang normalnya non-polar menjadi polar. Maka terbentuklah dwikutub sesaat, kemudian elektron-elektron molekul tetangganya bergeser sehingga menjadi dwikutub pula. Proses ini disebut induksi dan dwikutub yang baru saja terbentuk disebut dwikutub terinduksi. Sebagai akibatnya, terjadilah gaya tarik antar molekul, yaitu gaya tarik antara dwikutub sesaat dengan dwikutub terinduksi yang dikenal sebagai gaya dispersi atau gaya London (penafsiran secara mekanika kuantum oleh Fritz London (1930). Page 117

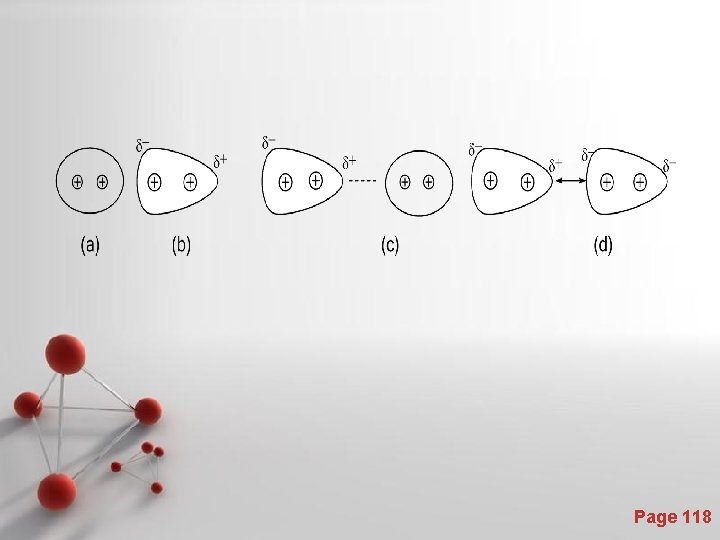
Page 118

Terjadinya gaya dispersi (gaya London) • 1. Sebuah molekul non-polar 2. Molekul non-polar itu menjadi dwikutub sesaat 3. Dwikutub sesaat menginduksi molekul tetangganya 4. Molekul tetangga menjadi dwikutub terinduksi dan terjadilah gaya tarik. Page 119

Antaraksi dwikutub-dwikutub • Pada senyawa polar, molekul-molekul cenderung menyusun diri dengan cara ujung positif suatu molekul mengarah kepada ujung negatif molekul yang lain, gambar berikut ini : Page 120

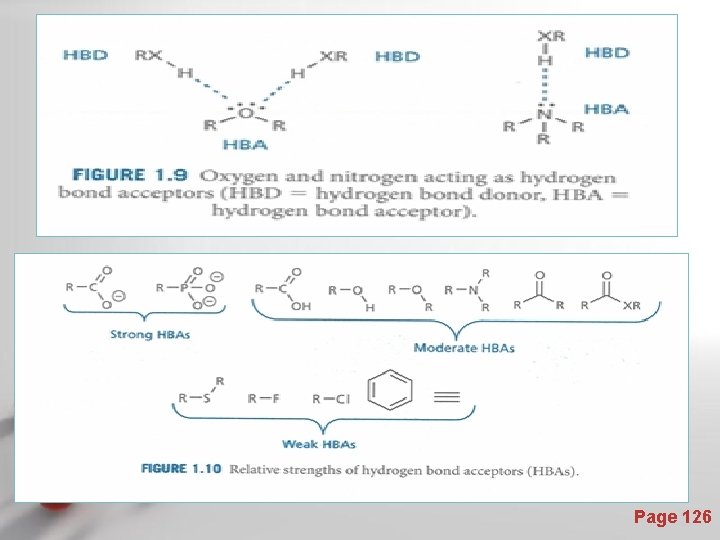
Ikatan hidrogen • • • Kekuatan ikatan bervariasi Lebih lemah daripada interaksi elektrostatik, tetapi lebih kuat daripada Van der Waals interaksi Ikatan hidrogen terbentuk antara suatu atom hidrogen yang terikat pada heteroatom yang kaya elektron dengan heteroatom yang kaya elektron (N atau O) Atom hidrogen yang terikat pada heteroatom yang kaya elektron disebut a hydrogen bond donor Heteroatom yang kaya elektron (N atau O) disebut a hydrogen bond acceptor Page 121

IKATAN HIDROGEN • Ikatan hidrogen terbentuk jika satu atom H yang terikat kepada salah satu dari atom yang sangat elektronegatif (F, O atau N). • Ikatan hidrogen adalah gaya tarik antar molekul yang cukup kuat, dengan energi ikatan berkisar antara 15 - 40 k. J/mol. • Pada pembentukan ikatan hidrogen, atom yang sangat elekronegatif yang mengikat atom H secara kovalen, menarik elektron atom H tersebut menjauhi inti atomnya yang berupa suatu proton. Hal ini menyebabkan proton tersebut terpapar (terbuka) sehingga tertarik oleh suatu pasangan elektron bebas atom tetangganya yang sangat elektronegatif pula.

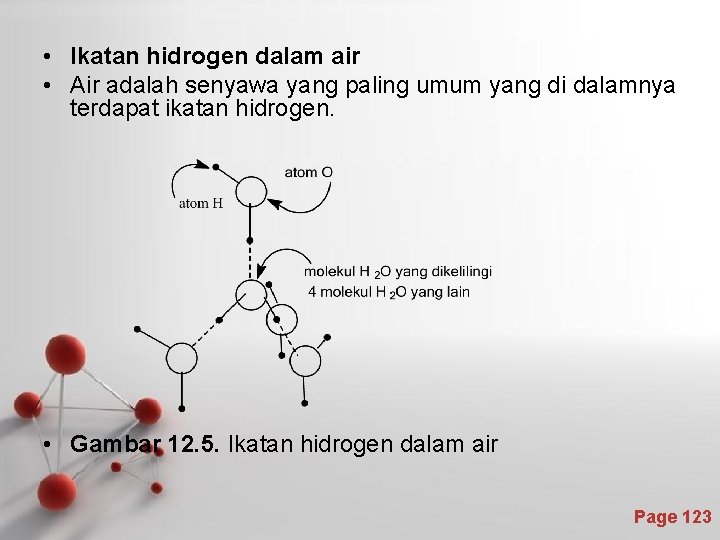
• Ikatan hidrogen dalam air • Air adalah senyawa yang paling umum yang di dalamnya terdapat ikatan hidrogen. • Gambar 12. 5. Ikatan hidrogen dalam air Page 123

Ikatan hidrogen pada senyawa-senyawa lain. • Ikatan hidrogen dapat menyebabkan terjadinya dimerisasi (penggabungan dua molekul menjadi satu molekul yang lebih besar) asam asetat. • Gambar 12. 6. Dimer asam asetat

• Ikatan hidrogen juga dapat menerangkan terjadinya kenaikan kekentalan pada senyawa 2 tertentu, mis. Alkohol dan sorbitol. • sorbitol lebih kental karena kemampuan senyawa sorbitol (polihidroksi) dalam membentuk ikatan hidrogen lebih banyak. • Walaupun sebagian besar ikatan hidrogen melibatkan senyawa-senyawa N, O dan F yang mengikat hidrogen, tetapi ikatan hidrogen yang lemah juga terdapat pada senyawa-senyawa Cl dan S yang mengikat hidrogen. Page 125

Page 126

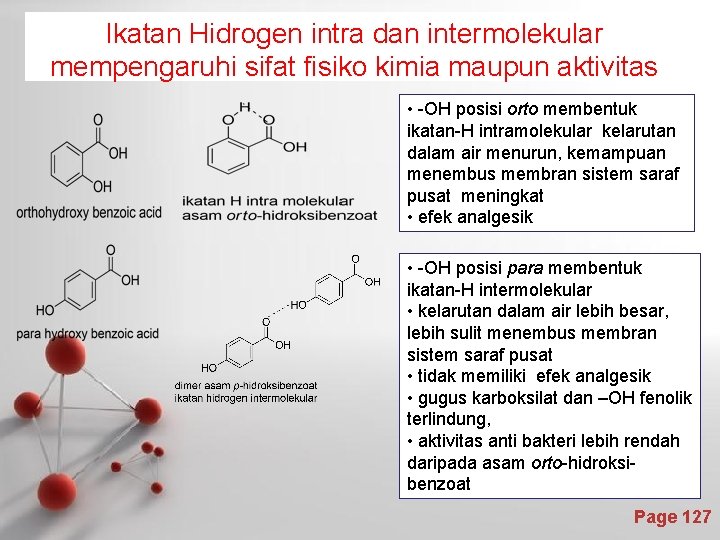
Ikatan Hidrogen intra dan intermolekular mempengaruhi sifat fisiko kimia maupun aktivitas • -OH posisi orto membentuk ikatan-H intramolekular kelarutan dalam air menurun, kemampuan menembus membran sistem saraf pusat meningkat • efek analgesik • -OH posisi para membentuk ikatan-H intermolekular • kelarutan dalam air lebih besar, lebih sulit menembus membran sistem saraf pusat • tidak memiliki efek analgesik • gugus karboksilat dan –OH fenolik terlindung, • aktivitas anti bakteri lebih rendah daripada asam orto-hidroksi- 127 benzoat Page 127

Ikatan Logam Page 128

• Dalam bentuk padat, tiap atom Cu terikat dengan 12 atom tetangganya. Hal ini karena pada Cu bangun kristal logam berbentuk kubus berpusat muka, dengan bilangan koordinasi 12. • Bilangan koordinasi ini menunjukkan jumlah atom yang mengelilingi atom tertentu • Ikatan antara 2 atom Cu terjadi seperti hibrida resonansi, yaitu elektron valensi tiap atom Cu dapat berpindah ke atom yang lain sehingga atom-atom Cu dapat berganti-ganti menjadi ion positif dan negatif, dan terjadilah ikatan antara atom-atom Cu tersebut. Page 129

SIFAT LOGAM Model Lautan Elektron : • Teori sederhana yang dapat menerangkan sifat logam adalah logam padat sebagai jaringan ion-ion positif yang tercelup dalam lautan elektron. • Misalnya pada Li, ion positipnya adalah Li+ dan satu elektronnya disumbangkan untuk lautan elektron tsb. Elektron-elektron tersebut bebas dan mudah bergerak. Page 130

Ciri khas logam : 1. Penghantaran listrik : jika elektron dari sumber luar masuk kawat logam dari satu ujung, maka elektron yang bebas melewati kawat dan menuju ujung yang lain sehingga aliran elektron (aliran listrik) dapat lancar melalui kawat/logam. Page 131

Beberapa ciri khas logam: 2. Sifat mengkilap : Elektron-elektron bebas pada permukaan logam mampu menyerap foton dan memancarkan kembali cahaya yang jatuh pada permukaan tersebut dengan frekuensi yang sama, sehingga permukaan logam tampak mengkilap. 3. Kemampuan untuk diubah bentuknya (deformasi) : bila satu lapisan logam mendapat beban melewati lapisan lain, tidak ada ikatan yang putus dan struktur bagian dalam logam tidak mengalami perubahan dan lautan elektron segera menyesuaikan diri dengan keadaan yang baru. Page 132

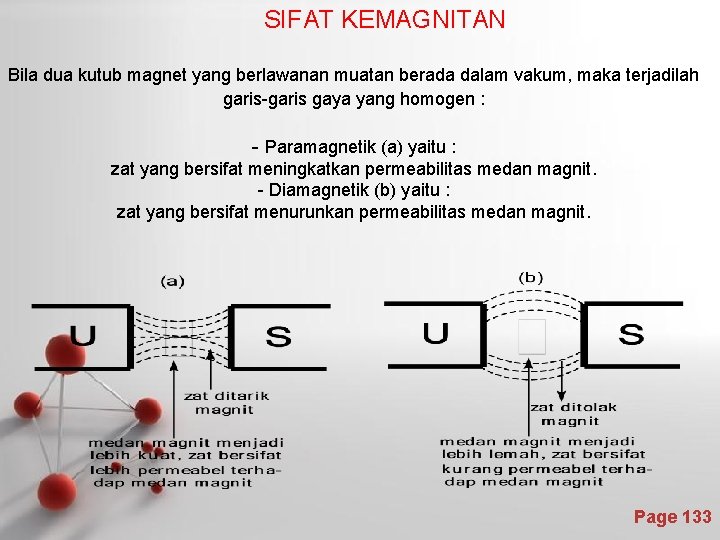
SIFAT KEMAGNITAN Bila dua kutub magnet yang berlawanan muatan berada dalam vakum, maka terjadilah garis-garis gaya yang homogen : - Paramagnetik (a) yaitu : zat yang bersifat meningkatkan permeabilitas medan magnit. - Diamagnetik (b) yaitu : zat yang bersifat menurunkan permeabilitas medan magnit. Page 133

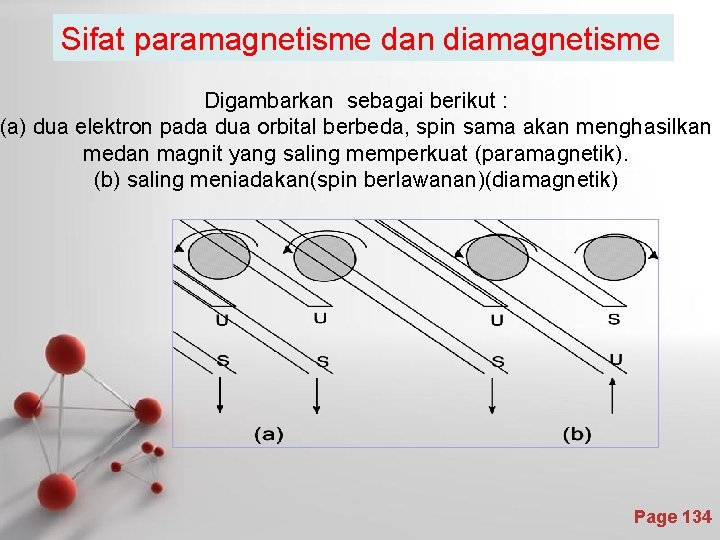
Sifat paramagnetisme dan diamagnetisme Digambarkan sebagai berikut : (a) dua elektron pada dua orbital berbeda, spin sama akan menghasilkan medan magnit yang saling memperkuat (paramagnetik). (b) saling meniadakan(spin berlawanan)(diamagnetik) Page 134

Paramagnetik : Unsur yang punya jumlah elektron gasal. Diamagnetik : Unsur yang mempunyai jumlah elektron genap, tetapi tidak semua unsur yang mempunyai jumlah elektron genap akan bersifat diamagnetik. Beberapa contoh :

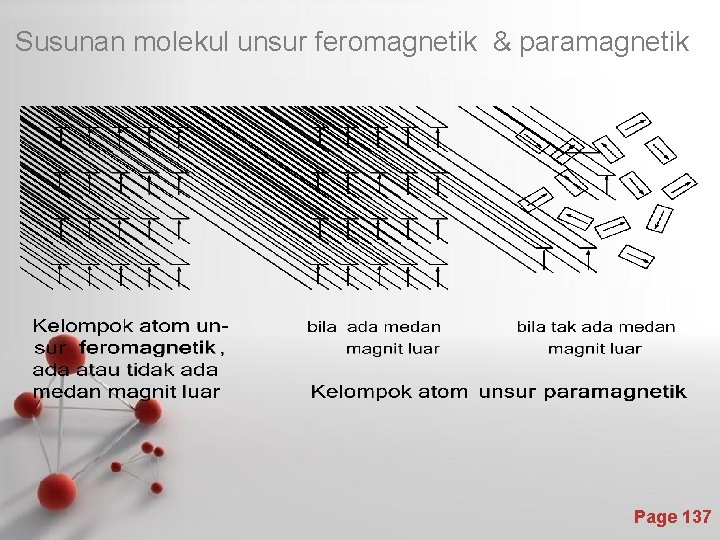
Sifat Feromagnetisme • Unsur-unsur besi, kobalt, nikel dan gadolinium (Gd) mempunyai sifat-sifat kemagnitan yang sangat tinggi. • Besi merupakan unsur yang paling penting, maka sifat ini dinamakan feromagnetisme dan kelompok unsur di atas disebut bersifat feromagnetik. • Ciri utama unsur feromagnetik adalah kelompok-kelompok atom, yang ukurannya di sekitar 0, 001 mm sehingga dapat diamati dengan mikroskop, sifat kemagnitannya maksimum, karena atom-atomnya tersusun sehingga momen magnetiknya sejajar dan jarak antar atomnya tertentu. • Sifat kemagnitan ini kira-kira seribu kali kekuatan unsur paramagnetik. Page 136

Susunan molekul unsur feromagnetik & paramagnetik Page 137

BANGUN MOLEKUL Page 138

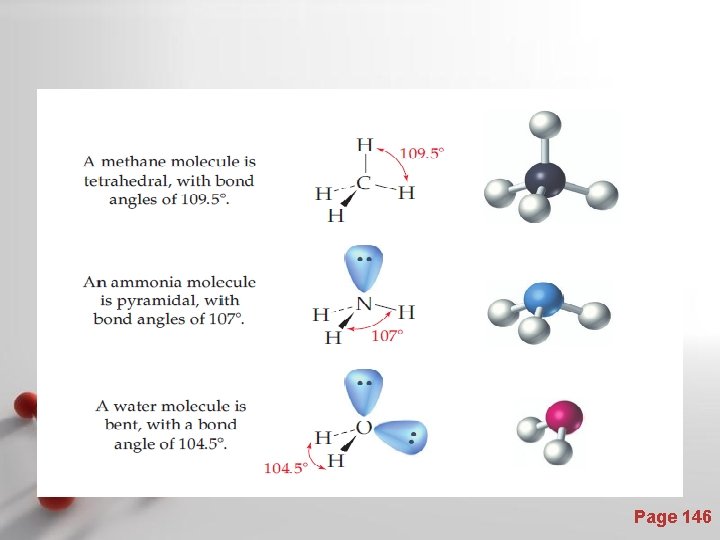
BANGUN MOLEKUL Bangun molekul adalah gambaran geometrik yang diperoleh dengan cara menghubungkan inti-inti atom yang berikatan, dengan garis lurus. Contoh : Bangun molekul air yang triatomik (terdiri atas tiga atom) : d 1 = d 2, a =104, 45 - panjang ikatan (d) : jarak antara inti-inti atom yang berikatan - sudut ikatan (a) : sudut antara dua garis yang menggambarkan ikatan Page 139

• Semua molekul Diatomik mempunyai bangun linier • Molekul Triatomik dapat mempunyai bangun linier (sudut =180 o), dan bersudut/bentuk V (sudut<180 o). • Molekul Poliatomik, beberapa ada yang punya bangun linier, tetapi umumnya melukiskan gambaran bangun geometrik tiga dimensi. Page 140

Bangun molekul dalam hubungannya dengan jenis hibridisasi orbital molekul : • Bangun molekul senyawa kovalen yang dihasilkan dari hibridisasi orbital-orbital atom pusatnya ditentukan oleh jenis hibridisasinya. Page 141

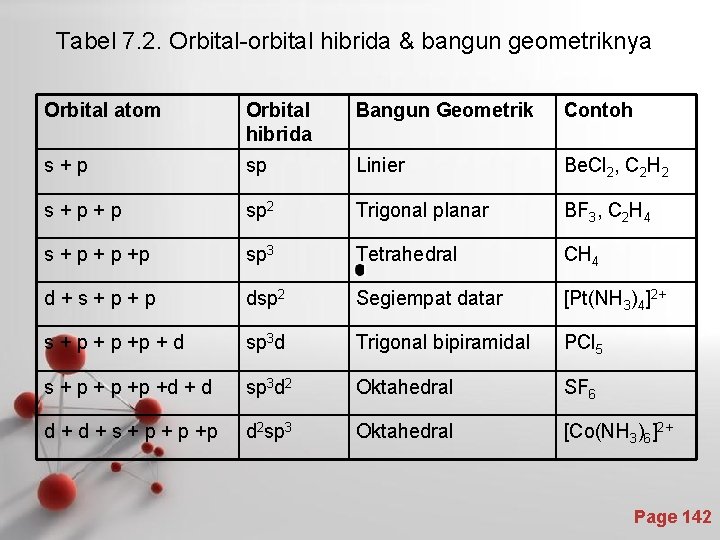
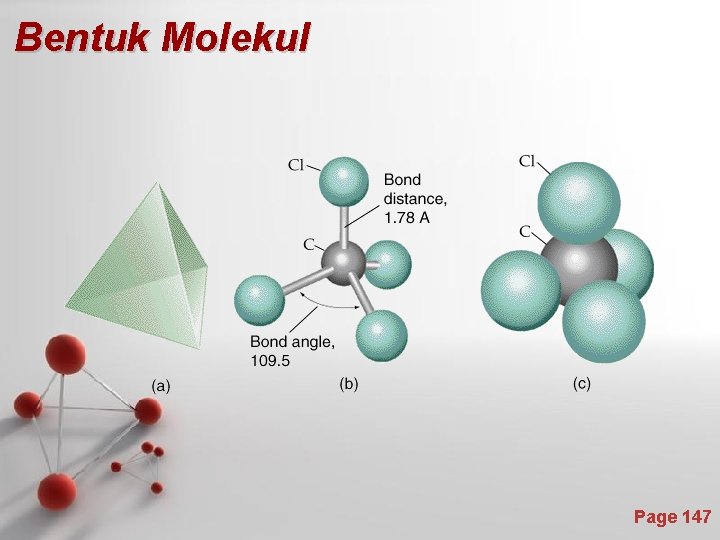
Tabel 7. 2. Orbital-orbital hibrida & bangun geometriknya Orbital atom Orbital hibrida Bangun Geometrik Contoh s+p sp Linier Be. Cl 2, C 2 H 2 s+p+p sp 2 Trigonal planar BF 3, C 2 H 4 s + p +p sp 3 Tetrahedral CH 4 d+s+p+p dsp 2 Segiempat datar [Pt(NH 3)4]2+ s + p +p + d sp 3 d Trigonal bipiramidal PCl 5 s + p +p +d + d sp 3 d 2 Oktahedral SF 6 d + s + p +p d 2 sp 3 Oktahedral [Co(NH 3)6]2+ Page 142

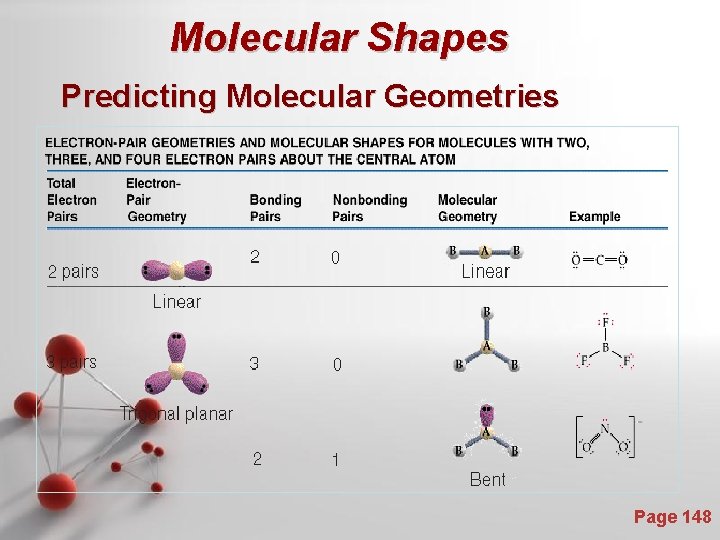
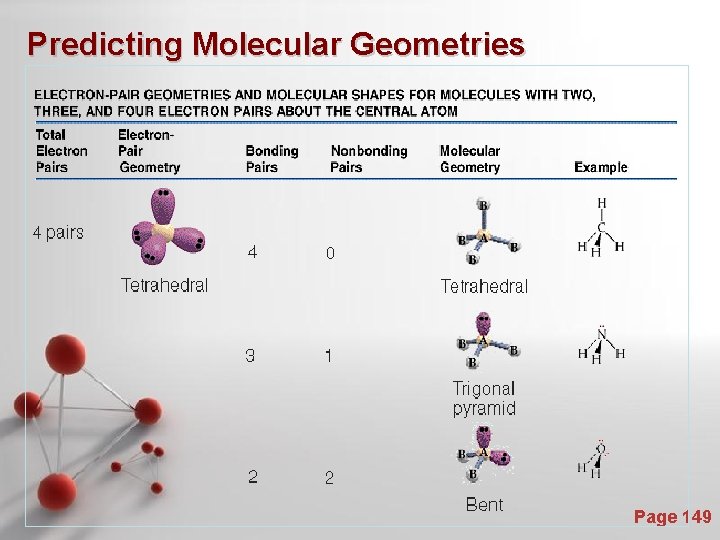
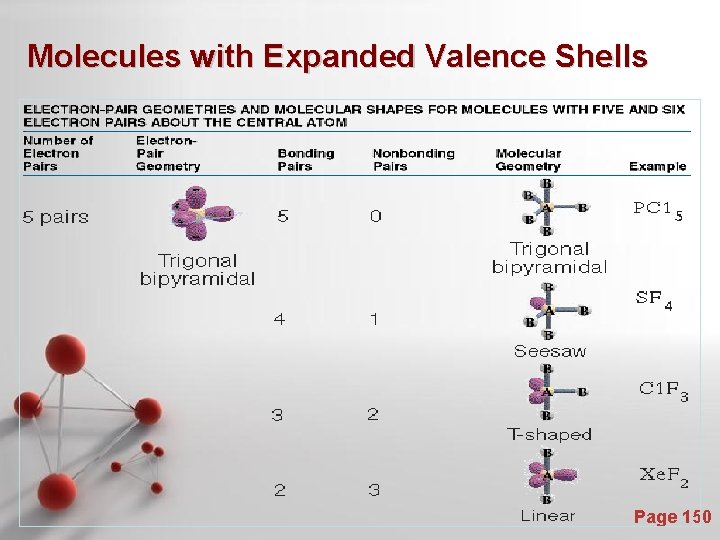
Bangun Molekul : Valence Shell Electron Pair Repulsion Theory (VSEPR) - Teori VSEPR didasarkan adanya ide yang berdasarkan gaya tolakan elektrostatik dari elektron diturunkan sampai minimum jika beberapa daerah yang memiliki densitas elektron yang cukup tinggi diletakkan sejauh mungkin. - Daerah yang memiliki densitas elektron tinggi antara lain : - Pasangan elektron bebas - Ikatan kovalen bonds (tunggal, rangkap dua, rangkap tiga) Page 143

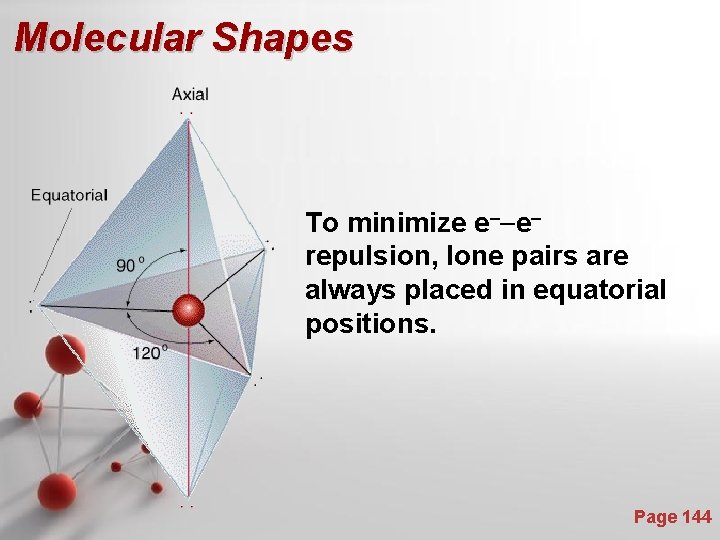
Molecular Shapes To minimize e--erepulsion, lone pairs are always placed in equatorial positions. Page 144

Balloon Analogy Prentice-Hall © 2002 Page 145

Page 146

Bentuk Molekul Page 147

Molecular Shapes Predicting Molecular Geometries Page 148

Predicting Molecular Geometries Page 149

Molecules with Expanded Valence Shells Page 150

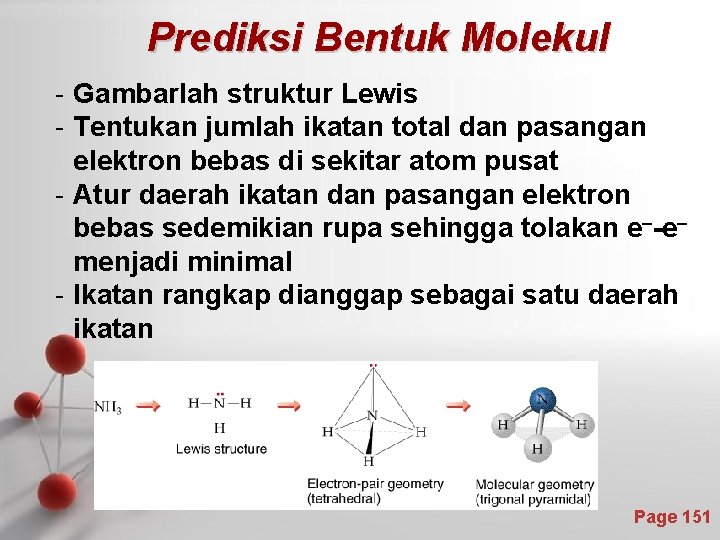
Prediksi Bentuk Molekul - Gambarlah struktur Lewis - Tentukan jumlah ikatan total dan pasangan elektron bebas di sekitar atom pusat - Atur daerah ikatan dan pasangan elektron bebas sedemikian rupa sehingga tolakan e--emenjadi minimal - Ikatan rangkap dianggap sebagai satu daerah ikatan Page 151

larutan Page 152

Larutan adalah materi homogen yang tidak mempunyai susunan (komposisi) kimia tertentu. Suatu larutan terdiri dari : 1. Pelarut (= solven) Pelarut dapat berupa zat tunggal atau campuran 2. Zat terlarut (= solut = linarut) Zat terlarut juga dapat terdiri dari zat tunggal atau campuran Page 153

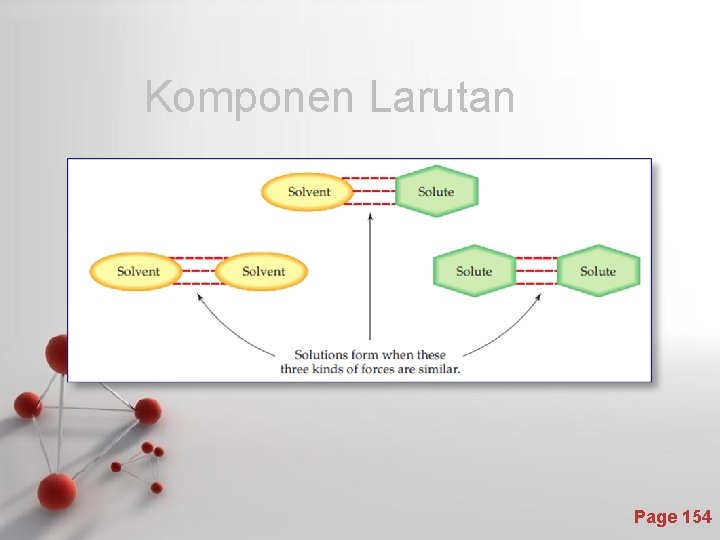
Komponen Larutan Page 154

Penggolongan larutan Menurut wujud akhirnya, larutan dapat dibagi menjadi : 1. Larutan Gas Larutan gas : baik pelarut maupun linarut (solven dan solut) berupa gas. Contoh : Uap air dalam udara Larutan gas disebut juga campuran gas. 2. Larutan cair : pelarutnya berwujud cair, sedangkan menurut wujud linarutnya, larutan cair dibagi menjadi : 2. a. Larutan gas dalam cair Contoh : Larutan oksigen (O 2) dalam air 2. b. Larutan cair dalam cair Contoh : Larutan etanol dalam air 2. c. Larutan padat dalam cair Contoh : Larutan Gula dalam air Page 155

Page 156

Contoh berbagai macam Larutan Page 157

3. Larutan padat : pelarutnya berwujud padat, sedangkan menurut wujud linarutnya, larutan padat dapat dibagi menjadi : 3. a. Larutan gas dalam padat Linarut berupa gas, misalnya gas hidrogen (H 2) yang larut dalam paladium (Pd) 3. b. Larutan cair dalam padat Linarut berupa cairan, misalnya amalgam (larutan logam dalam raksa). Contoh : amalgam perak, yaitu Ag dalam Hg 3. c. Larutan padat dalam padat Linarut berupa padatan, umumnya berupa larutan logam atau paduan logam (aliasi = alliage), misalnya kuningan (Cu dalam Zn). Page 158

Peristiwa melarut Terjadinya larutan dapat melalui salah satu dari tiga proses berikut : 1. Zat terlarut bereaksi secara kimia dengan pelarut dan membentuk zat baru. Keadaan ini terjadi bila ada antaraksi antara pelarut dengan linarut, yaitu dengan pemecahan satu atau lebih ikatan kimia. Contoh : P 2 O 5 + 3 H 2 O 2 H 3 PO 4 NH 3 + H 2 O NH 4 OH Page 159

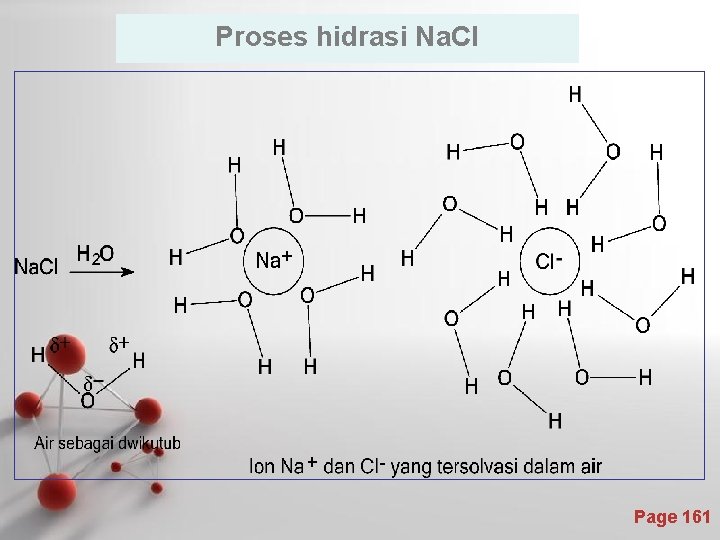
2. Zat terlarut berantaraksi dengan pelarut tanpa perubahan sifat zat terlarutnya. • Peristiwa ini dikenal sebagai solvasi dan khusus untuk pelarut air disebut hidrasi. • Contoh : pelarutan Na. Cl dalam air • Solvasi terjadi antara pelarut polar dengan linarut polar atau ionik. • Contoh lain adalah larutan etanol (polar) dengan air (polar). Page 160

Proses hidrasi Na. Cl Page 161

162 Page 162

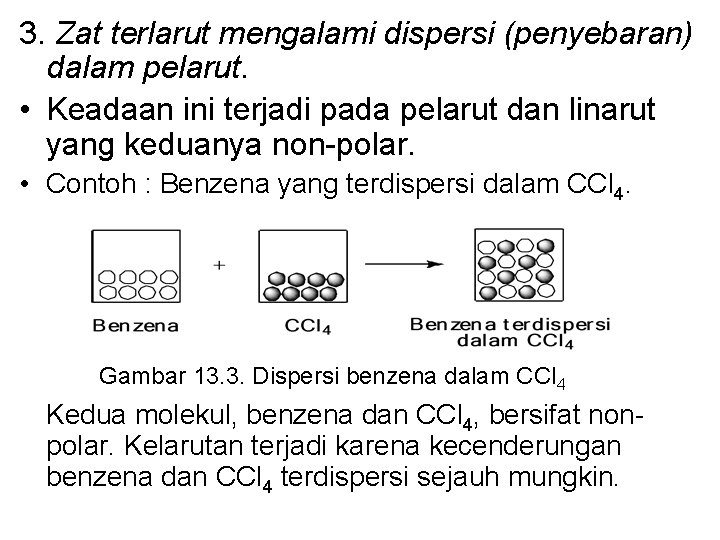
3. Zat terlarut mengalami dispersi (penyebaran) dalam pelarut. • Keadaan ini terjadi pada pelarut dan linarut yang keduanya non-polar. • Contoh : Benzena yang terdispersi dalam CCl 4. Gambar 13. 3. Dispersi benzena dalam CCl 4 Kedua molekul, benzena dan CCl 4, bersifat nonpolar. Kelarutan terjadi karena kecenderungan benzena dan CCl 4 terdispersi sejauh mungkin.

164 Page 164

SIFAT-SIFAT KOLIGATIF LARUTAN Sifat koligatif adalah sifat yang ditentukan oleh banyaknya zat (materi) yang ada dan bukan ditentukan oleh macamnya zat. Sifat-sifat koligatif larutan adalah : 1. Penurunan Tekanan Uap 2. Penurunan Titik Beku 3. Kenaikan Titik Didih 4. Tekanan Osmotik Page 165

Titik Beku • Adalah temperatur dimana terjadi keseimbangan antara wujud padat dan wujud cair. • Pada keadaan ini kedua wujud tersebut tidak mengalami perubahan. • Contoh : titik beku air pada 1 atm. adalah 0 o. C. Tekanan Uap • Molekul-molekul suatu zat yang berada dalam fasa cair mempunyai kecenderungan lolos keluar dari wujud cair menjadi wujud gas. • Bila cairan tersebut berada dalam ruang tertutup, maka molekul-molekul yang lolos ini menimbulkan tekanan yang besarnya tergantung kepada temperatur waktu itu. • Tekanan ini disebut tekanan uap zat tersebut pada Page 166 temperatur itu.

Titik Didih • Titik didih suatu cairan adalah temperatur yang menunjukkan tekanan uap cairan sama dengan tekanan udara luar. • Bila tekanan tersebut = 1 atm. , maka titik didih itu disebut titik didih standar cairan tersebut. • Pada titik didihnya, terjadi gelembung uap pada cairan yang naik ke permukaan cairan. Peristiwa ini disebut pendidihan cairan. Page 167

Penentuan Titik Didih Cairan • Titik didih cairan pada tekanan udara normal dapat diukur dengan cara penyulingan (destilasi) cairan tersebut pada tekanan udara normal (fasa cair berhubungan dengan udara terbuka). • Temperatur diukur sewaktu cairan mulai menetes. Page 168

Penurunan Tekanan Uap Larutan Bila suatu cairan berisi zat terlarut yang tidak mudah menguap, maka kecenderungan lolos molekul cairan tersebut berkurang. Gambar 13. 9. Berkurangnya kecenderungan lolos Page 169

Hukum Raoult • F. M. Raoult (1887) secara eksperimental menemukan : Tekanan parsial uap pelarut yang berkeseimbangan dalam larutan encer berbanding lurus dengan fraksi mol pelarut dalam larutan. • Dapat dirumuskan sbb. : P = P 0. X • P : tekanan parsial pelarut dalam larutan • P 0 : tekanan uap pelarut murni • X : fraksi mol pelarut dalam larutan Page 170

Page 171

Penurunan Titik Beku larutan • Pada diagram fasa air dan larutan dalam air, maka titik beku larutan selalu lebih rendah daripada titik beku pelarut murninya. • Penurunan titik beku larutan encer berbanding lurus dengan konsentrasi zat terlarut, yang dapat dirumuskan sebagai berikut (Raoult, 1883) : Tf = Kf. m • Tf : Penurunan titik beku larutan • Kf : Tetapan penurunan molal pelarut (tetapan krioskopik) • m : Konsentrasi linarut dalam molal, yang dapat dirumuskan sbb : W 1: Berat pelarut W 2 : Berat linarut M 2 : massa molekul linarut

Kenaikan titik didih larutan • Besarnya kenaikan titik didih larutan juga berbanding lurus dengan konsentrasi zat terlarut, yang dapat dirumuskan sebagai berikut • • • Tb : kenaikan titik didih larutan Kb : tetapan kenaikan molal pelarut (tetapan ebulioskopik) m : molalitas linarut W 1 : berat pelarut W 2 : berat linarut M 2 : massa molekul linarut

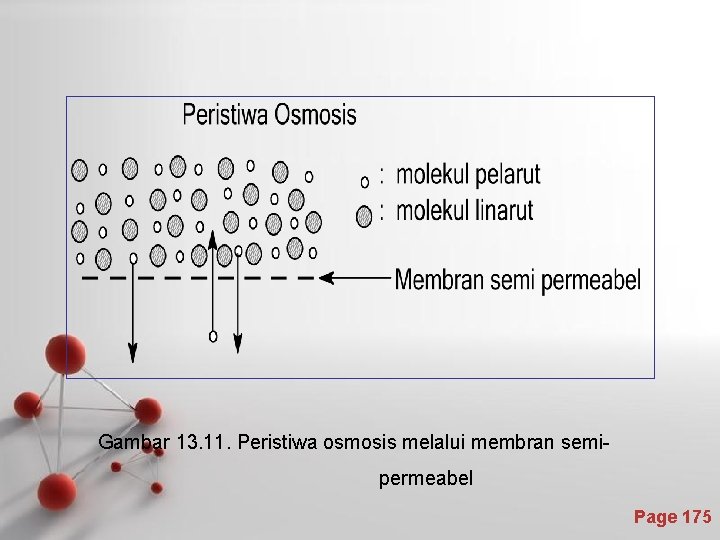
Tekanan Osmotik Larutan Tekanan osmotik adalah tekanan hidrostatik yang terjadi akibat peristiwa osmosis. • Peristiwa osmosis adalah peristiwa perpindahan molekul-molekul melalui membran semi-permeabel. • Membran semi-permeabel (selaput setengah tembus) adalah suatu lapisan yang dapat dilewati oleh molekul-molekul yang kecil tetapi tidak dapat dilewati oleh molekul-molekul yang besar. Page 174

Gambar 13. 11. Peristiwa osmosis melalui membran semipermeabel Page 175

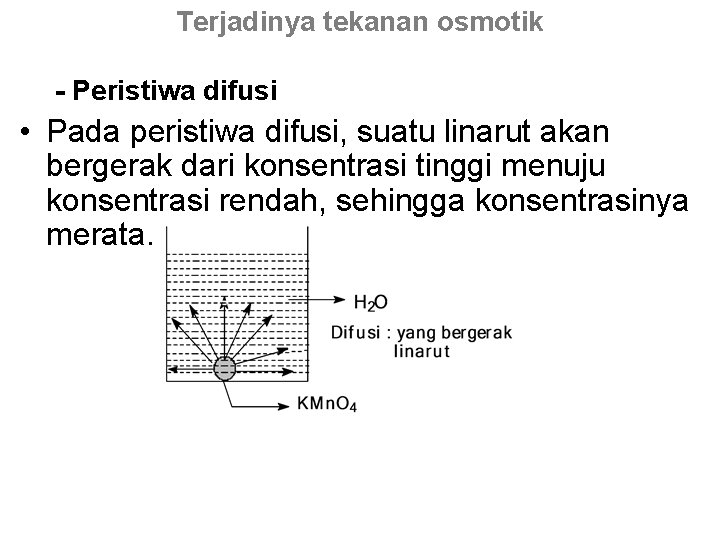
Terjadinya tekanan osmotik - Peristiwa difusi • Pada peristiwa difusi, suatu linarut akan bergerak dari konsentrasi tinggi menuju konsentrasi rendah, sehingga konsentrasinya merata.

Pengukuran dan perhitungan tekanan osmotik Rumus gas yang umum : P x V = n x R x T (Boyle-Gay Lussac-Avogadro) • dengan : • P : tekanan gas (atm. ) • V : volume gas (liter) • n : jumlah mol gas • R : tetapan gas (0, 082 L. atm. mol-1. o. K-1) • T : temperatur mutlak (o. K) untuk larutan berlaku : x V = n x R x T • dengan : • : tekanan osmotik (atm) • V : volume larutan (liter) • n : jumlah mol linarut (Boyle-Gay Lussac- van ‘t Hoff) Page 177

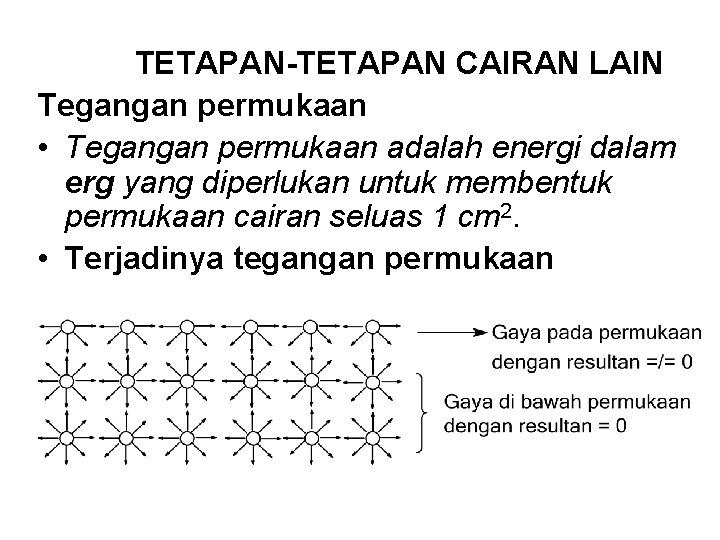
TETAPAN-TETAPAN CAIRAN LAIN Tegangan permukaan • Tegangan permukaan adalah energi dalam erg yang diperlukan untuk membentuk permukaan cairan seluas 1 cm 2. • Terjadinya tegangan permukaan

• Pada molekul cairan, terjadi gaya tarik jarak pendek (gaya van der Waals). Sebagian besar molekul cairan tersebut, gaya van der Waals saling meniadakan sehingga hasil akhir = 0. • Pada molekul yang berada di permukaan, gaya dari atas tidak ada, sehingga resultan gaya tersebut adalah ke arah bawah, dan molekul-mole -kul menekan ke bawah seolah-olah cairan tersebut mem-punyai kulit. Inilah yang disebut tegangan permukaan. • Adanya tegangan permukaan, memungkinkan cairan berusaha untuk mempunyai permukaan sesempit mungkin (bentuk bola). Page 179

Pengaruh temperatur terhadap tegangan permukaan : • Bila temperatur suatu cairan meningkat, maka gerakan molekulnya makin cepat. • Akibatnya, gerakan ini akan melawan gaya tarik antar molekul cairan tersebut, sehingga tegangan permukaan cairan akan menurun. • Pada temperatur kritisnya, cairan akan kehi-langan tegangan permukaannya. Page 180

KEKENTALAN (VISKOSITAS) Kekentalan adalah besaran yang menyatakan hambatan suatu sistem untuk mengalir, bila terhadap sistem itu dikenakan suatu tekanan. • Satuan kekentalan adalah poise, yaitu gaya geser yang diperlukan untuk memperoleh kecepatan 1 cm/detik antara dua bidang sejajar suatu cairan yang masing-masing luasnya 1 cm 2 dan dipisahkan dengan jarak 1 cm. • 1 poise = 1 dyne. det. cm-2 = 1 dyne. det/cm 2 = gram x cm/det 2 = gram cm 2 cm. det Page 181

- Fluiditas ( = phi) adalah kebalikan dari viskositas Pentingnya pengukuran viskositas • Pengetahuan dan pengukuran viskositas sangat penting dalam pembuatan preparat-preparat cair dan setengah cair, misalnya pada pembuatan obat semprot hidung, krim salep dan obat gosok. • Viskositas juga penting dalam kedokteran, misalnya dalam pengukuran tekanan darah. Bila viskositas darah naik, maka tekanan darah naik pula, yang dapat membebani kerja jantung. Page 182

Indeks bias suatu zat adalah perbandingan antara kerapatan optik zat itu dengan kerapatan optik ruang hampa. Pengukuran Indeks bias • Indeks bias suatu zat diukur dengan alat yang disebut refraktometer. Salah satu contoh refraktometer adalah refraktometer Abbe. • Prinsip kerja • Refraktometer Abbe membandingkan indeks bias zat yang akan diukur dengan indeks bias prisma yang telah diketahui. • Lambang : n. D 20 Page 183

KEJENUHAN LARUTAN Hubungan antara keadaan larutan dengan jumlah relatif linarut dan pelarut ada 3 macam, yaitu : 1. Larutan jenuh 2. Larutan tak jenuh 3. Larutan lewat jenuh Page 184

Larutan jenuh • Larutan jenuh adalah suatu larutan yang di dalamnya zat terlarut (solut/linarut) yang berada dalam larutan, berkesetimbangan dengan zat terlarut murni yang berada dalam wadah tempat larutan itu berada tetapi di luar sistem larutan itu. • Larutan tak jenuh adalah suatu larutan yang di dalamnya konsentrasi zat terlarut lebih kecil daripada kelarutan zat terlarut dalam pelarutnya pada temperatur tertentu. Page 185

Gambar 13. 21. Gambaran larutan jenuh Page 186

Larutan lewat jenuh • Larutan lewat jenuh adalah suatu larutan yang mengandung linarut dengan konsentrasi lebih besar daripada kelarutan linarut tersebut pada temperatur tertentu. • Contoh : Larutan Na 2 S 2 O 3 (natrium tiosulfat) dan CH 3 COONa (natrium asetat) • Sejumlah Na 2 S 2 O 3 atau CH 3 COONa yang melebihi kelarutannya dapat dilarutkan dalam air dengan pemanasan. Bila dibiarkan dingin, linarut tersebut tidak mengkristal walaupun konsentrasinya melebihi kelarutannya. • Larutan semacam ini disebut larutan lewat jenuh dan bersifat metastabil. Page 187

Larutan jenuh metastabil dapat dijadikan larutan jenuh yang stabil dengan cara : 1. Mengkristalkan linarut dengan memancingnya dengan menambahkan kristal linarut dari luar. 2. Mengocok wadah dengan keras. 3. Menggores dinding wadah dengan pengaduk. Page 188

189 Page 189

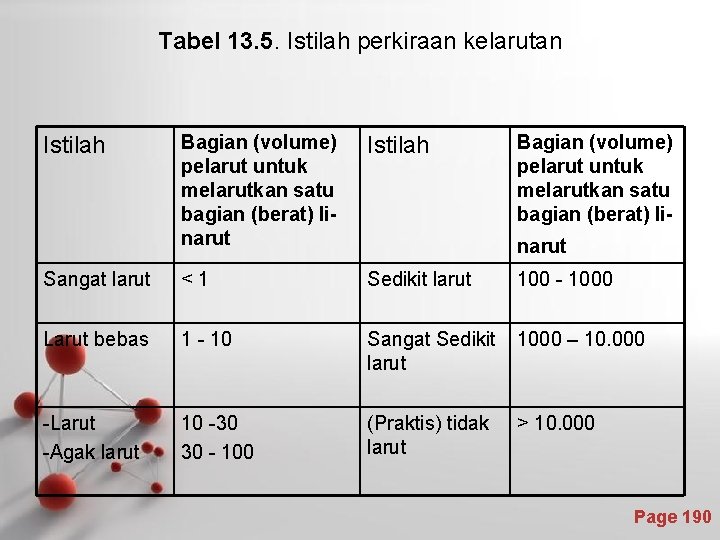
Tabel 13. 5. Istilah perkiraan kelarutan Bagian (volume) pelarut untuk melarutkan satu bagian (berat) linarut Istilah Sangat larut <1 Sedikit larut 100 - 1000 Larut bebas 1 - 10 Sangat Sedikit larut 1000 – 10. 000 -Larut -Agak larut 10 -30 30 - 100 (Praktis) tidak larut > 10. 000 Istilah Bagian (volume) pelarut untuk melarutkan satu bagian (berat) linarut Page 190

Larutan elektrolit dan bukan elektrolit Bila ke dalam air dilarutkan : Gula atau Alkohol atau Urea • maka berlaku rumus-rumus penurunan tekanan uap, penurunan titik beku dan kenaikan titik didih sebagai berikut : P = Po. X; Tf = Kf x m dan Tb = Kb x m • Larutan-larutan tersebut mengikuti Hukum Raoult dan tidak menghantarkan arus listrik. • Oleh karena itu disebut larutan non-elektrolit (larutan bukan elektrolit). • Tetapi bila ke dalam air dilarutkan : – Asam atau Basa atau Garam • maka terjadi penyimpangan dari Hukum Raoult, yaitu bahwa hasilnya lebih besar daripada rumus-rumus di atas. • Larutan ini disebut Larutan elektrolit (penghantar listrik cair) Page 191

192 Page 192

SISTEM HETEROGEN ADALAH SISTEM YANG MEMPUNYAI BAGIAN 2 YANG TIDAK SAMA DALAM KESELURUHAN SISTEM PENGGOLONGAN: 1. SUSPENSI adalah sistem heterogen dengan ukuran partikel terdispersi > 0, 1 (1 = 10 -4) 2. KOLOID (DISPERSI KOLOID) adalah sistem heterogen dengan ukuran partikel terdispersi antara 0, 001 - 0, 1 (1, 0 - 100 m ) EMULSI merupakan jenis koloid yang medium pendispersi maupun fasa terdispersinya berupa cairan yang tidak saling campur. -Kedua fase terdiri dari fase minyak dan air atau sebaliknya. -Emulgator = zat penstabil emulsi Contoh emulsi : susu, santan, minyak ikan, minyak rambut (cream) Page 193

Perbedaan antara larutan, koloid dan suspensi Karakteristik Larutan Koloid Suspensi -Tidak tampak -Tampak -Tampak -Kertas saring -Membran semipermiabel -Lolos -Tertahan -Sifat difusi -Fasa -Kejernihan -Bila dibiarkan -Cepat -Satu fasa -Jernih -Tidakmengendap -Sangat lambat -Dua fasa -Baur -Tidakmengendap -Tak mendifusi -Dua fasa -Tdk tmbs chy -Mengendap Penampakan -Mikroskop biasa -Mikroskop elektronik Penyaringan Page 194

SIFAT-SIFAT KOLOID 1. SIFAT OPTIK Efek Faraday-Tyndall berupa kerucut cahaya bila sistem koloid disinari dari samping. Efek ini disebkan oleh penghamburan sinar oleh partikel-partikel terdispersi. 2. SIFAT KINETIK a. Gerak Brown : gerakan acak partikel terdispersi dalam medium terdispersi. b. Difusi : partikel terdispersi scr spontan bergerak (berdifusi) dari konsentrasi tinggi ke konsentrasi rendah. Akibat langsung dari gerak Brown. Page 195

3. SIFAT ELEKTRIK a. Elektroforesis adalah pergerakan partikel terdispersi dengan adanya pengaruh listrik. b. Elektro-osmosis adalah pergerakan medium pendispersi dengan adanya pengaruh listrik, sedangkan fasa terdispersi diam. (kebalikan elektroforesis) Page 196

CARA PENGENDAPAN KOLOID 1. Penambahan sejumlah besar elektrolit 2. Pemanasan 3. Dengan muatan listrik Page 197

Selamat Belajar 198 Page 198
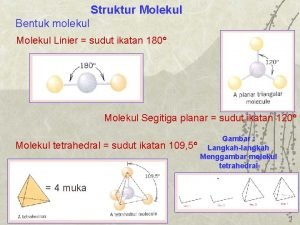
 Sudut ikatan molekul
Sudut ikatan molekul Contoh material yang memiliki ikatan ion
Contoh material yang memiliki ikatan ion Aturan oktet dan duplet
Aturan oktet dan duplet Ftp gunadarma
Ftp gunadarma Fakultas psikologi unisba
Fakultas psikologi unisba Fakultas teknik industri gunadarma
Fakultas teknik industri gunadarma Fakultas teknik industri gunadarma
Fakultas teknik industri gunadarma Fakultas perikanan dan ilmu kelautan ub
Fakultas perikanan dan ilmu kelautan ub Fakultas teknik umm
Fakultas teknik umm Fakultas ekonomi dan bisnis universitas brawijaya
Fakultas ekonomi dan bisnis universitas brawijaya Fakultas teknik industri gunadarma
Fakultas teknik industri gunadarma Psikolog gunadarma
Psikolog gunadarma Visi misi ketua angkatan fakultas ekonomi
Visi misi ketua angkatan fakultas ekonomi Dr muhartono meninggal
Dr muhartono meninggal Mata kuliah teknik industri
Mata kuliah teknik industri Mohammedaansch recht
Mohammedaansch recht Visi misi fakultas peternakan unpad
Visi misi fakultas peternakan unpad Alamat kampus unm parangtambung
Alamat kampus unm parangtambung Bescheidungsurteil vornahmeurteil
Bescheidungsurteil vornahmeurteil Fakturierungssoftware
Fakturierungssoftware Dreißig tage hat september
Dreißig tage hat september 24 juni 1969
24 juni 1969 24 juni 1998
24 juni 1998 Wetter paris april
Wetter paris april Midsommar 23 juni
Midsommar 23 juni Midsommarafton 24 juni
Midsommarafton 24 juni 27 juni 2008
27 juni 2008 Rini juni astuti
Rini juni astuti Primo juni
Primo juni Menghitung biaya konversi
Menghitung biaya konversi Materi metode harga pokok proses 2 departemen
Materi metode harga pokok proses 2 departemen Anggaran biaya overhead pabrik
Anggaran biaya overhead pabrik Departemen
Departemen Karakteristik data mart
Karakteristik data mart Banyak atribut pada departemen
Banyak atribut pada departemen Contoh soal kalkulasi biaya proses
Contoh soal kalkulasi biaya proses Peminatan manajemen
Peminatan manajemen Contoh soal process costing metode fifo
Contoh soal process costing metode fifo Pengertian departementalisasi
Pengertian departementalisasi Proker penalaran dan keilmuan
Proker penalaran dan keilmuan Peran imunologi dalam bidang farmasi
Peran imunologi dalam bidang farmasi Apa itu pio dalam farmasi
Apa itu pio dalam farmasi Pelayanan kefarmasian di rumah sakit
Pelayanan kefarmasian di rumah sakit Kenaikan pangkat secara fleksi jpa
Kenaikan pangkat secara fleksi jpa Siklus logistik farmasi
Siklus logistik farmasi Misce fac lege artis
Misce fac lege artis Edumanage usb login
Edumanage usb login Etiket obat luar
Etiket obat luar Teledyne caris support
Teledyne caris support Farmasi sosial
Farmasi sosial Hubungan ilmu farmasi dengan ilmu fisika
Hubungan ilmu farmasi dengan ilmu fisika Master i farmasi
Master i farmasi Bioteknologi farmasi
Bioteknologi farmasi Eso dalam farmasi
Eso dalam farmasi Patofisiologi farmasi
Patofisiologi farmasi Pkpo akreditasi rs
Pkpo akreditasi rs Kriteria pemilihan pbf
Kriteria pemilihan pbf Tugas pft
Tugas pft Nama latin resep
Nama latin resep Materi farmasi rumah sakit
Materi farmasi rumah sakit Farmasi forensik
Farmasi forensik Kriteria pemilihan pbf
Kriteria pemilihan pbf Hemoglobin c
Hemoglobin c Komite farmasi dan terapi
Komite farmasi dan terapi Sistem unit dosis adalah
Sistem unit dosis adalah Pengertian pelayanan kefarmasian
Pengertian pelayanan kefarmasian Struktur organisasi instalasi farmasi rumah sakit
Struktur organisasi instalasi farmasi rumah sakit Mata kuliah farmasi ugm
Mata kuliah farmasi ugm Pulv adsp adalah
Pulv adsp adalah Tujuan penambahan emulgator pada emulsi adalah
Tujuan penambahan emulgator pada emulsi adalah Smk farmasi madiun
Smk farmasi madiun Validasi proses terhadap produk yang sudah berjalan adalah
Validasi proses terhadap produk yang sudah berjalan adalah Meso farmasi
Meso farmasi Sifat atom
Sifat atom Ikatan juru masak profesional indonesia
Ikatan juru masak profesional indonesia Struktur termampatkan
Struktur termampatkan D
D Ikatan
Ikatan Pola kegiatan ismkmi
Pola kegiatan ismkmi Ikatan dokter indonesia merupakan organisasi
Ikatan dokter indonesia merupakan organisasi Gaya london terjadi antar
Gaya london terjadi antar Patah serong
Patah serong Ikatan rangkap
Ikatan rangkap Ikatan apa
Ikatan apa Ikatan
Ikatan Gizi unnes
Gizi unnes Rerangka kode etik iai
Rerangka kode etik iai Ikatan monosakarida
Ikatan monosakarida Eginia penulis ikatan cinta
Eginia penulis ikatan cinta Ikatan hidrogen
Ikatan hidrogen Ikatan elektrovalen
Ikatan elektrovalen Jurnal makanan dalam konteks budaya
Jurnal makanan dalam konteks budaya Hibridisasi atom c pada molekul hcoh adalah
Hibridisasi atom c pada molekul hcoh adalah Termokimia adalah
Termokimia adalah Perubahan entalpi
Perubahan entalpi Arah pengaliran arus elektrik
Arah pengaliran arus elektrik Bagaimana pencapaian kompetensi seorang akuntan profesional
Bagaimana pencapaian kompetensi seorang akuntan profesional Lencana perkhidmatan pengakap kelana
Lencana perkhidmatan pengakap kelana Definisi ikatan datif
Definisi ikatan datif Ikatan kovalen
Ikatan kovalen What is the function of dna
What is the function of dna Cara ikatan buku sila
Cara ikatan buku sila Struktur resonansi nco-
Struktur resonansi nco- Jenis ikatan dan kegunaannya
Jenis ikatan dan kegunaannya Orde ikatan
Orde ikatan Entalpi adalah
Entalpi adalah Tujuan balutan cincin
Tujuan balutan cincin Contoh ion kompleks
Contoh ion kompleks Kedudukan pintu khemah
Kedudukan pintu khemah Papan acuan agar kokoh harus diberi ikatan menggunakan
Papan acuan agar kokoh harus diberi ikatan menggunakan Ikatan peptida
Ikatan peptida Energi ikatan rata-rata
Energi ikatan rata-rata Dewan kehormatan notaris
Dewan kehormatan notaris Susunan oktet
Susunan oktet Kronologi kasus kimia farma 2001
Kronologi kasus kimia farma 2001 Ada 6 jenis zat kimia yang perlu disimpan di gudang
Ada 6 jenis zat kimia yang perlu disimpan di gudang Peta konsep zat dan karakteristiknya
Peta konsep zat dan karakteristiknya Arya kimia
Arya kimia Perkembangan teknologi kimia
Perkembangan teknologi kimia Sifat fisika paracetamol
Sifat fisika paracetamol Lavoisier mereaksikan cairan merkuri
Lavoisier mereaksikan cairan merkuri Sifat fisik laut
Sifat fisik laut Sifat fisika dan kimia gas mulia
Sifat fisika dan kimia gas mulia Errors in analytical chemistry
Errors in analytical chemistry Pengurusan bahan kimia
Pengurusan bahan kimia Gambar kimia korosif
Gambar kimia korosif Sifat fisik telur
Sifat fisik telur Ciri ciri penagih dadah
Ciri ciri penagih dadah Ppt kimia erlangga
Ppt kimia erlangga Gambar kimia korosif
Gambar kimia korosif Bab 3 kimia unsur
Bab 3 kimia unsur Materi korosi kimia kelas 12
Materi korosi kimia kelas 12 Hukum laju terintegrasi
Hukum laju terintegrasi Suatu tim lomba pesona kimia
Suatu tim lomba pesona kimia Balai besar kimia dan kemasan
Balai besar kimia dan kemasan Perubahan materi yang merupakan perubahan kimia adalah
Perubahan materi yang merupakan perubahan kimia adalah Resonance effect
Resonance effect Kimia adalah
Kimia adalah Struktur kimia bht
Struktur kimia bht Sifat kimia air laut
Sifat kimia air laut Reaksi kimia dalam larutan air
Reaksi kimia dalam larutan air Kimia
Kimia Analytical chemistry statistics
Analytical chemistry statistics Alkali asid dan neutral
Alkali asid dan neutral Hakikat kimia dan metode ilmiah
Hakikat kimia dan metode ilmiah Nomenklatur adalah
Nomenklatur adalah Penataan alat laboratorium kimia
Penataan alat laboratorium kimia Jelaskan apa yang dimaksud dengan rumus molekul
Jelaskan apa yang dimaksud dengan rumus molekul Materi kimia kelas 12 semester 1 sifat koligatif larutan
Materi kimia kelas 12 semester 1 sifat koligatif larutan Saraf kranium
Saraf kranium Reaksi kimia dibedakan menjadi
Reaksi kimia dibedakan menjadi Jenis reaksi
Jenis reaksi Tabel pergeseran kimia h nmr
Tabel pergeseran kimia h nmr Senyawa turunan alkana kelas 12
Senyawa turunan alkana kelas 12 Ppt kimia erlangga
Ppt kimia erlangga Peta konsep hakikat biologi
Peta konsep hakikat biologi Tabel pergeseran kimia h nmr
Tabel pergeseran kimia h nmr Kimia
Kimia Peta konsep hukum dasar kimia
Peta konsep hukum dasar kimia Kinematika kimia
Kinematika kimia Unsur kimia kayu
Unsur kimia kayu Silikon aluminium kimia
Silikon aluminium kimia Reaksi kimia anabolisme
Reaksi kimia anabolisme Sifat kimia kalium
Sifat kimia kalium Materi adalah segala sesuatu yang
Materi adalah segala sesuatu yang Reaksi kompleks
Reaksi kompleks Persamaan kimia
Persamaan kimia Nama kelompok untuk tugas
Nama kelompok untuk tugas Kimia
Kimia Quotion reaksi
Quotion reaksi Campuran homogen adalah
Campuran homogen adalah Gambar kimia
Gambar kimia Berapakah titik beku 0 010 m k2so4
Berapakah titik beku 0 010 m k2so4 Asam oksalat rumus kimia
Asam oksalat rumus kimia Reaksi biokimia
Reaksi biokimia Ester rcoor
Ester rcoor Contoh soal neraca massa tanpa reaksi kimia
Contoh soal neraca massa tanpa reaksi kimia Sifat golongan alkali
Sifat golongan alkali Kimia inti
Kimia inti Bhs inggris
Bhs inggris Peta konsep katabolisme karbohidrat
Peta konsep katabolisme karbohidrat Sifat kimia air tawar
Sifat kimia air tawar Karya ilmiah kimia
Karya ilmiah kimia Bab 1 pengenalan ilmu kimia
Bab 1 pengenalan ilmu kimia Agen kimia adalah
Agen kimia adalah Www.psb-psma.org kimia
Www.psb-psma.org kimia Desain laboratorium kimia
Desain laboratorium kimia Kimia 2
Kimia 2 Faktor faktor yang mempengaruhi kesetimbangan kimia
Faktor faktor yang mempengaruhi kesetimbangan kimia Ammonium klorida dan natrium hidroksida
Ammonium klorida dan natrium hidroksida Contoh agen kimia
Contoh agen kimia 9 kelas bahan kimia berbahaya
9 kelas bahan kimia berbahaya Rumus kadar
Rumus kadar Soal dan jawaban matematika teknik kimia
Soal dan jawaban matematika teknik kimia Ilmu kimia yang mempelajari tentang panas atau suhu disebut
Ilmu kimia yang mempelajari tentang panas atau suhu disebut Gugus amina
Gugus amina Ruang lingkup kajian ilmu kimia adalah
Ruang lingkup kajian ilmu kimia adalah Kobalt (i) sulfida mempunyai rumus
Kobalt (i) sulfida mempunyai rumus Aluminium amfoter
Aluminium amfoter