Hukumhukum Dasar Kimia Tata Nama Senyawa dan Persamaan



















- Slides: 19

Hukum-hukum Dasar Kimia Tata Nama Senyawa dan Persamaan Reaksi Bahan Ajar Mata Pelajaran Kimia SMA Kelas X Semester 1 Didin Haerudin S. Pd. SMA Negeri 1 Cianjur

Menu SK, KD dan Indikator Tata Nama Senyawa Menentukan Rumus Kimia dari Nama Senyawa Persamaan Reaksi Selesai

Standar Kompetensi 2. Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia (stoikiometri)

Kompetensi Dasar 2. 1 Mendeskripsikan tata nama senyawa anorganik dan organik sederhana serta persamaan reaksinya.

Indikator 2. 1. 1 Menuliskan nama senyawa dari rumusnya 2. 1. 2 Menuliskan rumus senyawa dari namanya 2. 1. 3 Menuliskan persamaan reaksi 2. 1. 4 Menyetarakan persamaan reaksi sederhana

Tata Nama Senyawa (1) Senyawa Ion Sebutkan nama ion positif (kation) diikuti nama ion negatif (anion) Contoh Na. Cl Na+ +Cl. Na+ = Ion Natrium Cl- = Ion Klorida Nama = Natrium Klorida

Tata Nama Senyawa (2) Senyawa kovalen biner (tersusun dari dua unsur) Sebutkan nama unsur yang didepan diberi awalan jumlah dalam bahasa sansekerta dan diikuti nama unsur yang kedua diberi akhiran ida dan awalan jumlah dalam bahasa sansakerta (catatan : mono di depan tidak lazim disebut)

Tata Nama Senyawa (3) Contoh : CO 2 = mono carbon dioksida CCl 4 = carbon tetraclorida N 2 O 5 = dinitrogen pentaoksida

Tata Nama Senyawa (4) Beberapa senyawa mempunyai tata nama khusus terutama senyawa karbon. Contoh: NH 3 = amonia BH 3 = Borin H 2 O = Air CH 4 = metana C 2 H 4 = etana

Latihan Soal Tuliskan nama senyawaan berikut 1. 2. 3. 4. 5. 6. 7. 8. Fe. Cl 3 Cu. O Mg. I 2 Ca. SO 4 KNO 3 Al 2 CO 3 (NH 4)2 CO 3 Mg 3 N 2 9. 10. 11. 12. 13. 14. 15. 16. Al 2 O 3 P 2 O 5 CS 2 N 2 O 3 OF 2 NH 3 CH 4 H 2 O

Menentukan Rumus Kimia dari Nama Senyawa Tuliskan rumus masing-masing ion, lalu gabungkan. Perhatikan bahwa muatan rumus kimia senyawa harus netral (nol) Contoh : Tembaga(II)Klorida Tembaga(II) = Cu 2+ Klorida = Cl. Cu 2+ + 2 Cl- Cu. Cl 2 Jadi rumus senyawanya = Cu. Cl 2

Latihan Soal Tuliskan rumus senyawa untuk nama-nama berikut 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. Alumunium klorida Besi (III) sulfida Emas (III) nitrat (V) Tembaga(I) Sulfat(IV) Kalium Hidroksida Amonium karbonat Perak Nitrat Magnesium Posfat(V) Kalsium karbida Barium Oksida

Persamaan Reaksi Persamaan yang menyatakan zat-zat yang terlibat dalam reaksi dan hasil reaksinya dipisahkan oleh tanda panah Zat yang bereaksi disebut pereaksi atau reaktan diletakkan di ruas kiri Zat yang dihasilkan disebut produk atau hasil reaksi diletakkan di ruas kanan Berlaku Hukum Ketetapan Massa : Massa zat sebelum dan sesudah reaksi tetap.

Persamaan Reaksi Hukum ketetapan Massa terpenuhi bila jumlah masing-masing atom dalam reaksi di kedua ruas sama. Persamaan reaksi setara adalah persamaan dimana jumlah masing -masing atom di kedua ruas sama. Contoh persamaan reaksi setara: Gas Hidrogen bereaksi dengan Gas Oksigen menghasilkan air. 2 H 2 + O 2 2 H 2 O

Menyetarakan Persamaan Reaksi Dari persamaan reaksi tak setara, samakan jumlah masing-masing atom dikedua ruas dengan memberikan koefisien di depan rumus senyawanya. Contoh: 2 H 2 + O 2 2 H 2 O PERHATIAN Tidak boleh mengubah rumus senyawa

Penyetaraan cara matematika (1) Untuk persamaan reaksi yang lebih rumit kita gunakan cara matematika, yaitu dengan memberikan koefisien variable lalu buat persamaan matematika untuk masing -masing unsur di kedua ruas. Contoh : a. Cu + b. HNO 3 c. Cu(NO 3)2 + d. NO + e. H 2 O Cu a = c H b = 2 e N b = 2 c + d O 3 b = 6 c + d + e

Penyetaraan cara matematika (2) Misal b = 2 Maka b = 2 e e = 1 - 6 c + 3 d = 6 c + d + e 2 d = e d = ½ - b = 2 c + d 2 = 2 c + ½ c=¾ - a = ¾ a= ¾ , b= 2, c= ¾, d= ½ , e= 1 Sehingga a = 3, b = 8, c = 3, d = 2, e = 4 Maka reaksi setaranya adalah 3 Cu + 8 HNO 3 3 Cu(NO 3)2 + 2 NO + 4 H 2 O

Latihan Soal Setarakan persamaan reaksi berikut: 1. N 2 + H 2 NH 3 2. SO 2 + O 2 SO 3 3. KCl. O 3 KCl + KCl. O 4 + O 2 4. Na. OH + HCl Na. Cl + H 2 O 5. Ca. CO 3 + H 2 O Ca. OH + H 2 O + CO 2

Selamat belajar Selesai
 Nama senyawa
Nama senyawa Nama senyawa ch3 - ch(ch3) - o - ch2 - ch3.
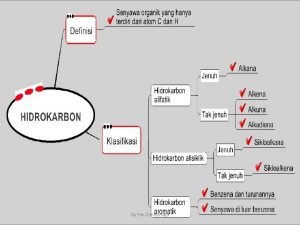
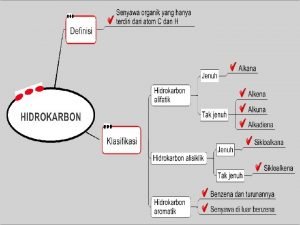
Nama senyawa ch3 - ch(ch3) - o - ch2 - ch3. Perbedaan senyawa karbon dan hidrokarbon
Perbedaan senyawa karbon dan hidrokarbon Senyawa turunan alkana kelas 12
Senyawa turunan alkana kelas 12 Persamaan kimia asid sulfurik dan natrium hidroksida
Persamaan kimia asid sulfurik dan natrium hidroksida Peta konsep perhitungan kimia
Peta konsep perhitungan kimia Ikatan rangkap
Ikatan rangkap Nama senyawa organik
Nama senyawa organik Urutan mono di tri
Urutan mono di tri Senyawa nu
Senyawa nu Seimbangkan persamaan ini n2 + h2 → nh3
Seimbangkan persamaan ini n2 + h2 → nh3 Latihan frasa tingkatan 3
Latihan frasa tingkatan 3 Kata nama am majmuk
Kata nama am majmuk Frasa nama + frasa kerja contoh ayat
Frasa nama + frasa kerja contoh ayat Beriman kepada hari akhir
Beriman kepada hari akhir Nama
Nama Kata ganti nama
Kata ganti nama 7 tingkat iman
7 tingkat iman Nama kelompok untuk tugas
Nama kelompok untuk tugas Nama kelompok kimia
Nama kelompok kimia