RUMUS KIMIA DAN TATA NAMA RUMUS KIMIA Rumus





















- Slides: 22

RUMUS KIMIA DAN TATA NAMA

RUMUS KIMIA Rumus Kimia suatu zat menyatakan komposisi dari partikel penyusun zat tersebut, yang dinyatakan dengan lambang unsur penyusun serta perbandingan jumlah atom penyusun zat tersebut. Rumus kimia merupakan kumpulan lambang atom dengan komposisi tertentu. Rumus kimia terdiri dari rumus molekul dan rumus empiris.

Rumus Molekul Rumus molekul menyatakan jenis dan jumlah atom dalam tiap molekul zat. Hanya unsur dan senyawa yang mempunyai rumus molekul. Contoh: - Rumus molekul air adalah H 2 O Artinya tiap molekul air terdiri dari 2 atom hidrogen (H) dan 1 atom oksigen (O). - Rumus molekul gas hidrogen adalah H 2. Artinya tiap molekul gas hidrogen terdiri dari 2 atom hidrogen (H).

Rumus Empiris Rumus empiris menyatakan jenis dan perbandingan paling sederhana dari atom dalam senyawa yang bersangkutan. Nama Zat Rumus. Molekul Rumus Empiris Propuna C 3 H 4 Etuna C 2 H 2 CH Air H 2 O Benzena C 6 H 6 CH Butana C 4 H 10 C 2 H 5


Bilangan Oksidasi 1. Atom atau unsur bebas, bilangan oksidasinya = 0 2. Dalam suatu molekul senyawa atau satuan rumus kimia, jumlah bilangan oksidasi semua atom adalah = 0, sedangkan dalam sebuah ion, jumlah bilangan oksidasinya = muatan ion. 3. Dalam senyawanya : - logam alkali (IA) bilangan oksidasinya = + 1, - logam alkali tanah (IIA) bilangan oksidasinya = + 2. 4. Dalam senyawanya, bilangan oksidasi H = + 1, dan bilangan oksidasi F = − 1. 5. Dalam senyawanya, bilangan oksidasi O = − 2. 6. Dalam senyawa biner dengan logam - golongan VIIA bilangan oksidasinya = − 1 - golongan VIA bilangan oksidasinya = − 2 - golongan VA bilangan oksidasinya = − 3.

TATA NAMA







Beri nama senyawa berikut: 1. Mg. S 2. PCl 3 3. NH 4 OH 4. N 2 O 5 5. SO 2 6. Cr 2 O 3 7. Na 2 SO 4 8. Si. O 2 9. Cl 2 O 10. Mg 3 N 2 11. Fe. Cl 3 12. Cu. SO 4 13. Ca. CO 3 14. Zn. Cl 2 : : : :

Tuliskan rumus kimia senyawa berikut: 1. Silikon tetrafluorida 2. Timbal (II) oksida 3. Aluminium oksida 4. Kobalt (III) nitrat 5. Karbon disulfide 6. Besi (II) fosfat 7. Perak klorida 8. Timbal (IV) sulfida 9. Aluminium klorida 10. Kalium nitrat 11. Difosforus pentoksida 12. Kalium dikromat : : :

PERSAMAAN KIMIA Penulisan Persamaan Reaksi Kimia Persamaan reaksi menyatakan kesetaraan jumlah zat-zat yang bereaksi dengan jumlah zat-zat hasil reaksi. Untuk menyatakannya digunakan rumus kimia zat-zat, koefisien reaksi, dan wujud zat. Contoh : 2 Na (s) + Cl 2 (g) 2 Na. Cl (s)

PENYETARAAN REAKSI KIMIA • Diperlukan agar persamaan reaksi sesuai dengan Hukum Kekekalan Massa dari Lavoisier, yang menyatakan bahwa: “ Massa zat sebelum dan sesudah reaksi adalah sama” • Jumlah partikel pereaksi sama dengan produk reaksi • Dengan memperhatikan KOEFISIEN REAKSI.

Contoh : 1. Setarakan reaksi berikut: Fe + O 2 Fe 2 O 3 (Atom Fe di kiri ada 1 dan di kanan ada 2, maka yang di kiri dikalikan 2), menjadi: 2 Fe + O 2 Fe 2 O 3 (Atom O di kiri ada 2 dan di kanan ada 3, maka yang di kiri dikalikan 3/2), menjadi: 2 Fe + 3/2 O 2 Fe 2 O 3 (Agar tidak ada pecahan, maka semua ruas dikalikan 2): 4 Fe + 3 O 2 2 Fe 2 O 3 (setara)

2. Setarakan reaksi berikut: C 3 H 8 + O 2 CO 2 + H 2 O (Atom C di kiri ada 3 dan di kanan ada 1, maka yang di kanan dikalikan 3), menjadi: C 3 H 8 + O 2 3 CO 2 + H 2 O (Atom H di kiri ada 8 dan di kanan ada 2, maka yang di kanan dikalikan 4), menjadi: C 3 H 8 + O 2 3 CO 2 + 4 H 2 O (Atom O di kiri ada 2 dan di kanan ada 10 (6 dari CO 2 dan 4 dari H 2 O), maka yang di kiri dikalikan 5: C 3 H 8 + 5 O 2 3 CO 2 + 4 H 2 O (setara)

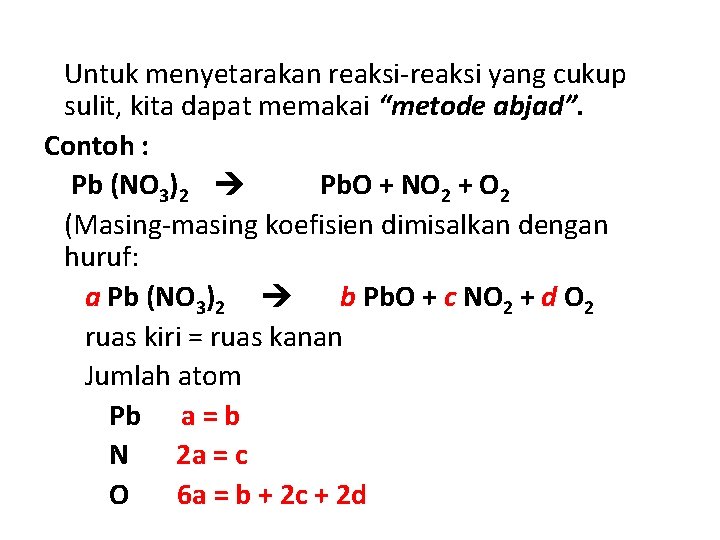
Untuk menyetarakan reaksi-reaksi yang cukup sulit, kita dapat memakai “metode abjad”. Contoh : Pb (NO 3)2 Pb. O + NO 2 + O 2 (Masing-masing koefisien dimisalkan dengan huruf: a Pb (NO 3)2 b Pb. O + c NO 2 + d O 2 ruas kiri = ruas kanan Jumlah atom Pb a = b N 2 a = c O 6 a = b + 2 c + 2 d

Salah satu huruf dimisalkan dengan angka. Misalnya, a =1: Maka, b = a maka b = 1 c = 2 a = 2 × 1 = 2 Untuk mencari d, maka harga a, b, c dimasukkan ke persamaan terakhir: 6 a = b + 2 c + 2 d (6 × 1) = 1 + (2 x 2) + 2 d 6 = 5 + 2 d maka d=½ Diperoleh harga koefisien a = 1, b = 1, c = 2, dan d = ½, Maka, 1 Pb (NO 3)2 1 Pb. O + 2 NO 2 + ½ O 2 (Supaya tidak ada pecahan, masing-masing ruas dikalikan 2: 2 Pb (NO 3)2 2 Pb. O + 4 NO 2 + O 2 (setara)

Latihan : Setarakan reaksi di bawah ini. a. Fe 2 O 3 + CO Fe + CO 2 b. Cu. Cl 2 + Na. OH Cu(OH)2 + Na. Cl c. Na. OH + H 2 SO 4 Na 2 SO 4 + H 2 O d. I 2 + Na. OH Na. I + Na. IO 3 + H 2 O e. Cu + HNO 3 Cu(NO 3)2 + NO + H 2 O f. Ag 2 O + NH 3 Ag + N 2 + H 2 O g. KMn. O 4 + Fe. SO 4 + H 2 SO 4 K 2 SO 4 + Fe 2 (SO 4)3 + Mn. SO 4 + H 2 O h. K 2 Cr 2 O 7 + HCl KCl + Cr. Cl 3 + H 2 O + Cl 2
 Nama senyawa
Nama senyawa Contoh kata penguat
Contoh kata penguat Maksud kata am
Maksud kata am Ayat pelengkap
Ayat pelengkap Peta konsep iman kepada rasul
Peta konsep iman kepada rasul Definisi kata sendi nama
Definisi kata sendi nama Kata terbitan awalan
Kata terbitan awalan Pengertian yaumul fashl
Pengertian yaumul fashl Jenang sela wader kalen sesonderan, maksude sing tembung?
Jenang sela wader kalen sesonderan, maksude sing tembung? Tata tata puno puno ja te volim
Tata tata puno puno ja te volim Tuliskan manfaat tata krama
Tuliskan manfaat tata krama Nama kelompok kimia
Nama kelompok kimia Sifat golongan alkali
Sifat golongan alkali N-etil propilamina
N-etil propilamina Manfaat alkil halida
Manfaat alkil halida Struktur aldehid
Struktur aldehid Tata nama enzim
Tata nama enzim Nama simplisia
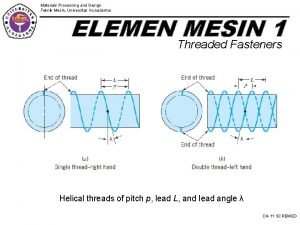
Nama simplisia Gunadarma teknik mesin
Gunadarma teknik mesin Tata nama ester
Tata nama ester Tata nama neoplasma
Tata nama neoplasma Denyutan nadi normal
Denyutan nadi normal Nama nama otot manusia
Nama nama otot manusia