Pengenalan Kimia Organik Unsurunsur umum dalam senyawa organik






- Slides: 37

Pengenalan Kimia Organik

Unsur-unsur umum dalam senyawa organik 11. 1

Kimia Organik berfokus pada kimia karbon. Apa yang telah diingat mengenai ikatan karbon dari pelajaran sebelumnya? • Karbon adalah unsur bukan logam • Karbon memiliki elektronegatifitas sebesar 2, 5 (berkisar antara 0, 7 – 4, 0) • Karbon merupakan unsur golongan 4 A • memiliki 4 elektron valensi • Karbon dibutuhkan oleh elektron untuk menyelesaikan oktetnya • membutuhkan 4 ikatan • Karbon dapat membentuk ikatan yang panjang C C 11. 1

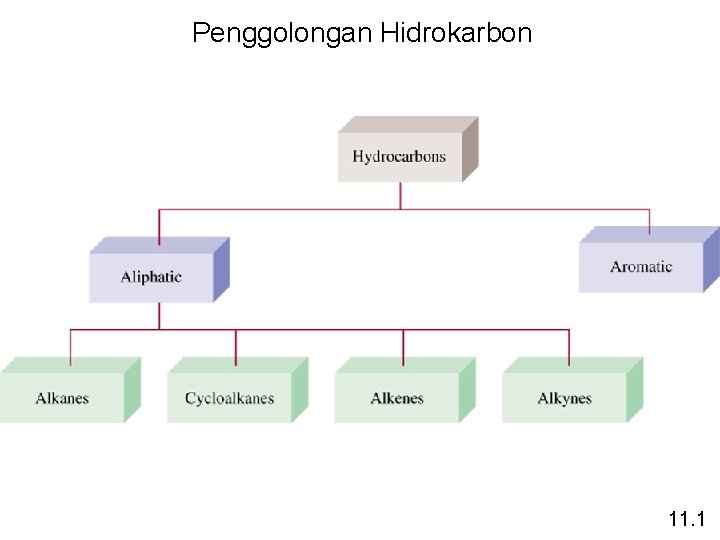
Penggolongan Hidrokarbon 11. 1

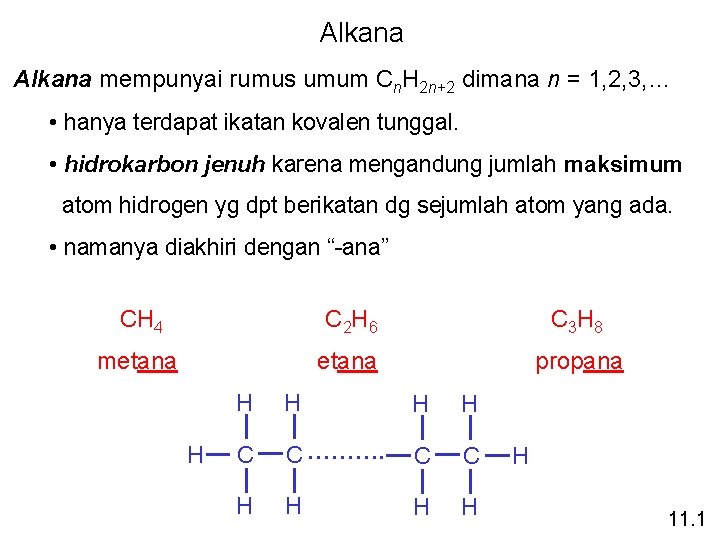
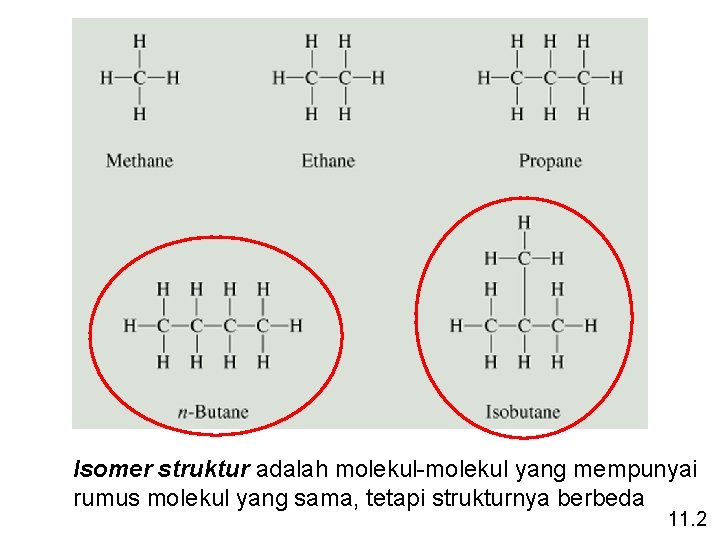
Alkana mempunyai rumus umum Cn. H 2 n+2 dimana n = 1, 2, 3, … • hanya terdapat ikatan kovalen tunggal. • hidrokarbon jenuh karena mengandung jumlah maksimum atom hidrogen yg dpt berikatan dg sejumlah atom yang ada. • namanya diakhiri dengan “-ana” CH 4 C 2 H 6 C 3 H 8 metana propana H H H C C ………. C C H H H 11. 1

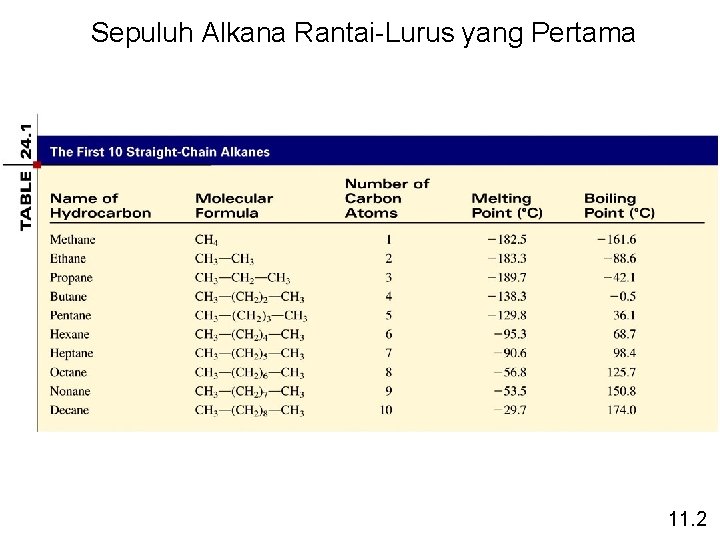
Sepuluh Alkana Rantai-Lurus yang Pertama 11. 2

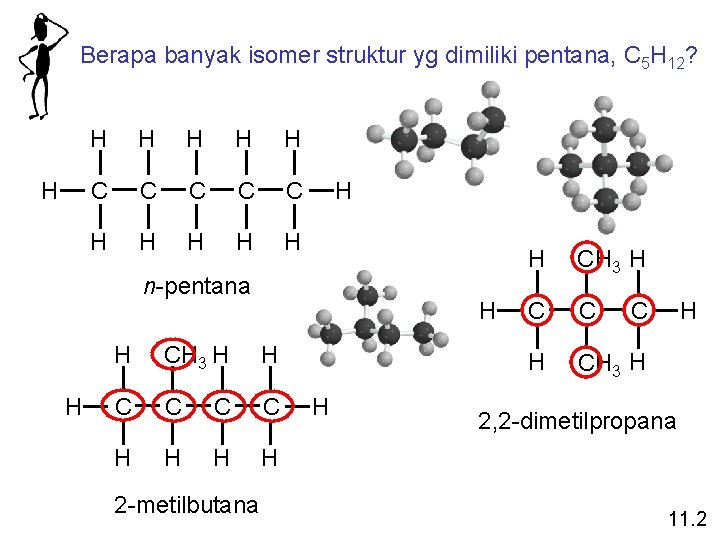
Isomer struktur adalah molekul-molekul yang mempunyai rumus molekul yang sama, tetapi strukturnya berbeda 11. 2

Bagaimana menentukan apakah dua molekul adalah isomer struktur? • Hitung jumlah atom dari tiap ikatan untuk melihat apakah struktur memiliki rumus yang sama. (Jika jumlah atom tidak sama, mereka bukanlah isomer !) • Perhatikan variasi struktur: • Jika ditemukan perbedaan antara jumlah dan jenis ikatan pada masing 2 molekul, dua struktur tsb adalah isomer untuk yang lainnya. • Jika tidak ditemukan perbedaan jumlah dan jenis ikatan dari masing 2 dua molekul tsb. , dua struktur menyatakan molekul yang sama, dan bukan isomer untuk yang lainnya. • Pastikan perbedaan bukan hanya karena penggambaran strukturnya. 11. 2

Berapa banyak isomer struktur yg dimiliki pentana, C 5 H 12? H H H C C C H H H n-pentana H H H CH 3 H H C C H H 2 -metilbutana H H CH 3 H C C H CH 3 H C H 2, 2 -dimetilpropana 11. 2

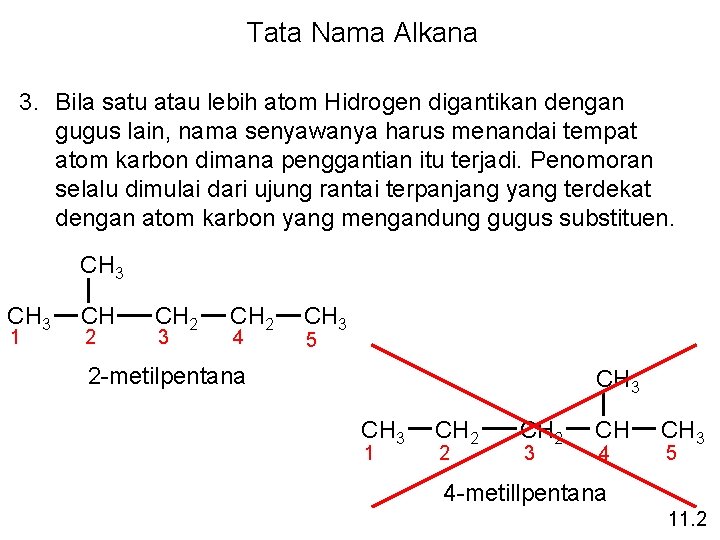
Tata Nama Alkana 1. Nama induk senyawa hidrokarbon ditentukan oleh rantai karbon terpanjang atom-atom dalam molekul. CH 3 1 CH 2 2 CH 2 3 CH 4 CH 2 5 2. Suatu alkana yg memiliki atom hidrogen lebih sedikit termasuk dalam gugus alkil. metana CH 4 CH 3 11. 2 metil CH 2 6 CH 3 4 -metilheptana 7

Tata Nama Alkana 3. Bila satu atau lebih atom Hidrogen digantikan dengan gugus lain, nama senyawanya harus menandai tempat atom karbon dimana penggantian itu terjadi. Penomoran selalu dimulai dari ujung rantai terpanjang yang terdekat dengan atom karbon yang mengandung gugus substituen. CH 3 1 CH 2 3 CH 2 4 CH 3 5 2 -metilpentana CH 3 1 CH 2 2 CH 2 3 CH 4 CH 3 5 4 -metillpentana 11. 2

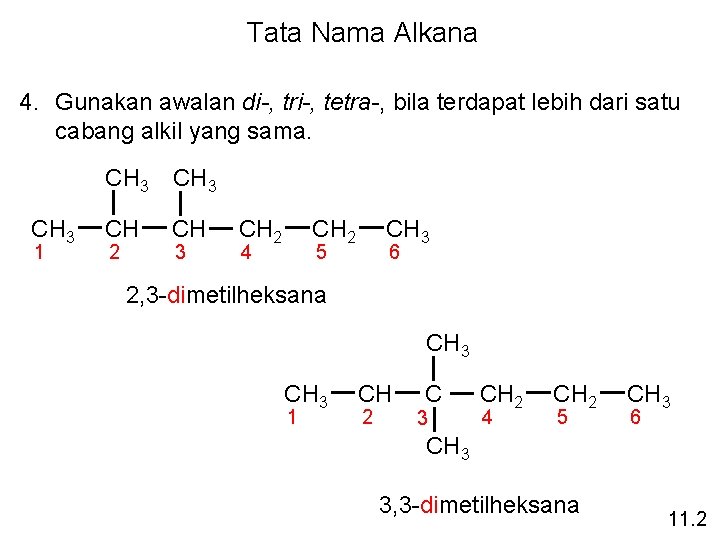
Tata Nama Alkana 4. Gunakan awalan di-, tri-, tetra-, bila terdapat lebih dari satu cabang alkil yang sama. CH 3 1 CH 3 CH CH 2 3 CH 2 4 CH 3 5 6 2, 3 -dimetilheksana CH 3 1 CH 2 C 3 CH 2 4 CH 2 5 CH 3 6 CH 3 3, 3 -dimetilheksana 11. 2

Tata Nama Alkana 5. Gunakan aturan terdahulu untuk gugus substituen lainnya. CH 3 1 Br NO 2 CH CH 2 3 CH 3 4 2 -bromo-3 -nitrobutana Br CH 2 1 NO 2 CH 2 2 CH 3 4 1 -bromo-3 -nitrobutana 11. 2

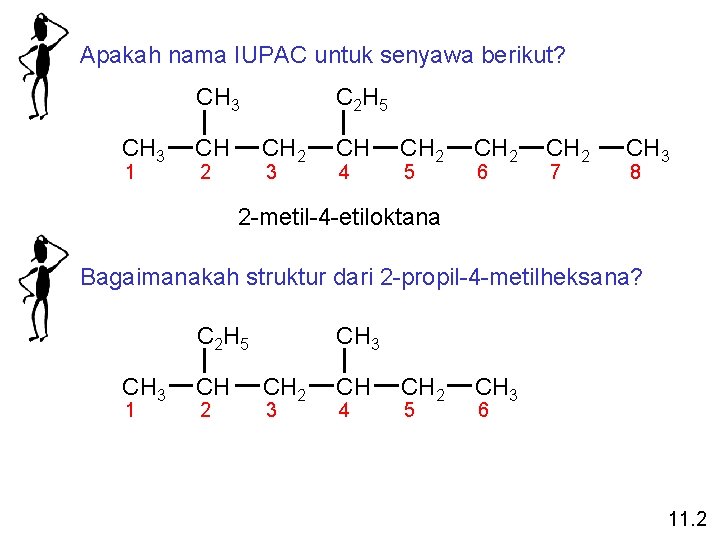
Apakah nama IUPAC untuk senyawa berikut? CH 3 1 CH C 2 H 5 CH 2 2 3 CH 4 CH 2 5 CH 2 6 CH 2 7 CH 3 8 2 -metil-4 -etiloktana Bagaimanakah struktur dari 2 -propil-4 -metilheksana? C 2 H 5 CH 3 1 CH 2 CH 3 CH 2 3 CH 4 CH 2 5 CH 3 6 11. 2

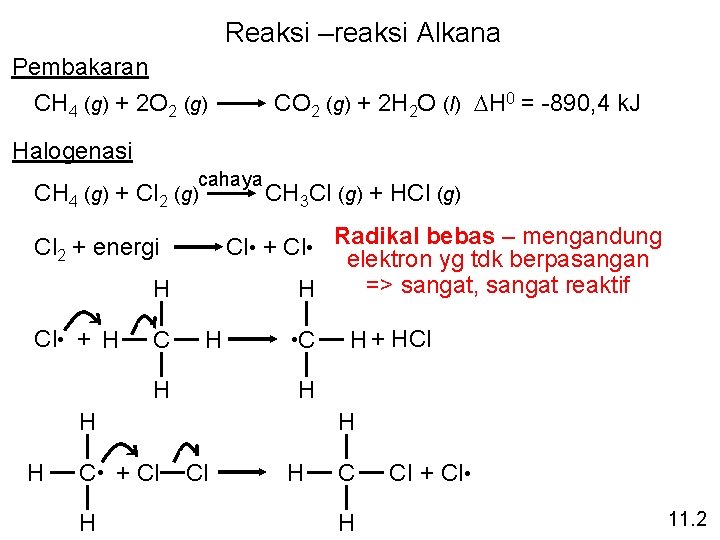
Reaksi –reaksi Alkana Pembakaran CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (l) DH 0 = -890, 4 k. J Halogenasi CH 4 (g) + Cl 2 cahaya (g) CH 3 Cl (g) Cl • + Cl • Radikal bebas – mengandung elektron yg tdk berpasangan => sangat, sangat reaktif H Cl 2 + energi H Cl • + H C H H • C C • + Cl H H + HCl H H H + HCl (g) H Cl + Cl • 11. 2

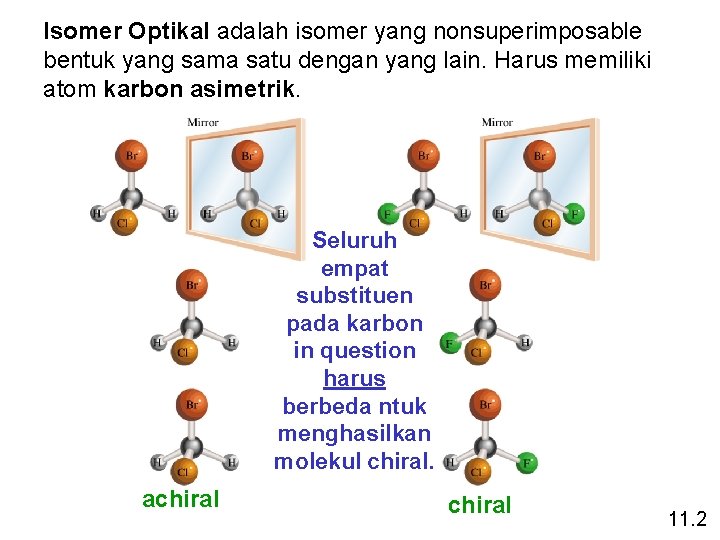
Isomer Optikal adalah isomer yang nonsuperimposable bentuk yang sama satu dengan yang lain. Harus memiliki atom karbon asimetrik. Seluruh empat substituen pada karbon in question harus berbeda ntuk menghasilkan molekul chiral. achiral 11. 2

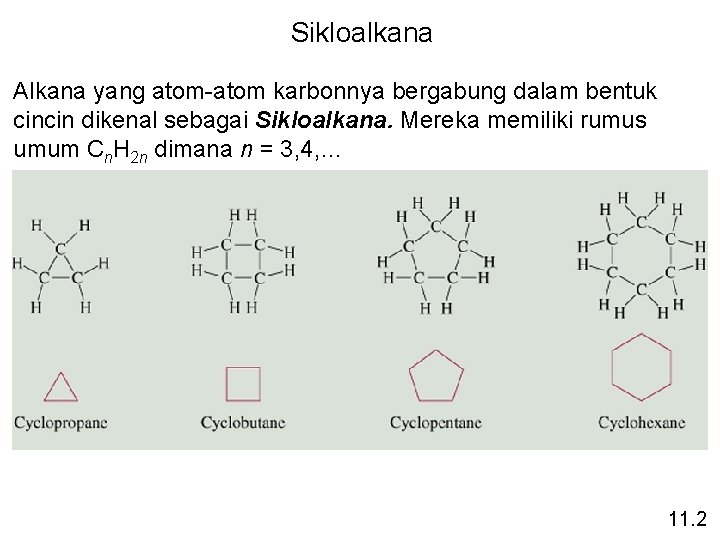
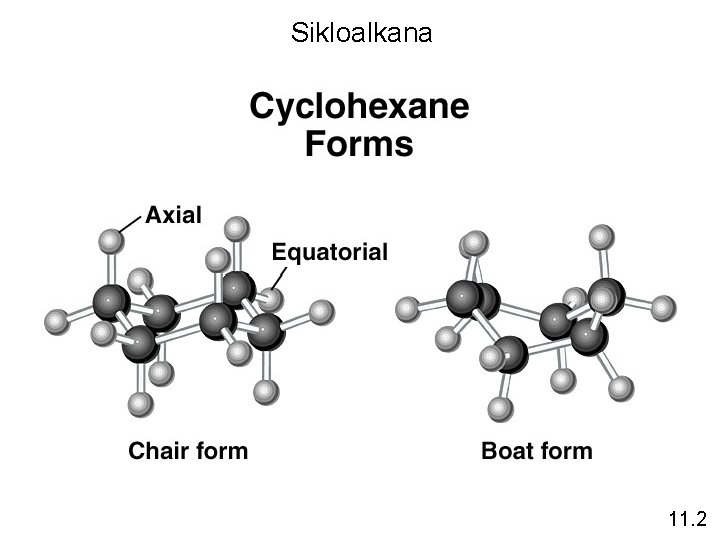
Sikloalkana Alkana yang atom-atom karbonnya bergabung dalam bentuk cincin dikenal sebagai Sikloalkana. Mereka memiliki rumus umum Cn. H 2 n dimana n = 3, 4, … 11. 2

Sikloalkana 11. 2

Alkena memiliki rumus umum Cn. H 2 n dimana n = 2, 3, … • memiliki setidaknya satu ikatan rangkap karbon-karbon • sering disebut olefin & merupakan hidrokarbon tak jenuh • penamaan diakhiri dengan “-ena” CH 2 CH CH 2 1 -butena CH 3 CH CH CH 3 2 -butena Tata Nama: • Nama induk senyawa hidrokarbon ditentukan oleh rantai karbon terpanjang aton-aton dalam molekul. • Penomoran ditentukan oleh nomor terkecil dari lokasi dimana terdapat ikatan rangkap. • Ikuti aturan untuk cabang dan gugus fungsional. 11. 3

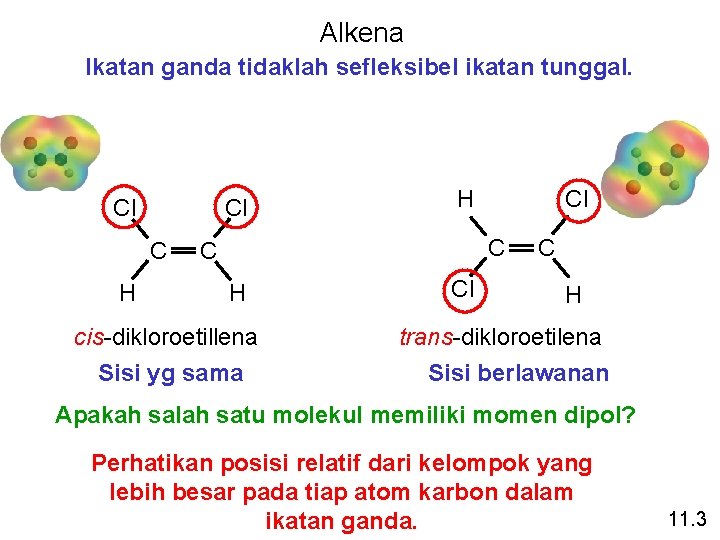
Alkena Ikatan ganda tidaklah sefleksibel ikatan tunggal. Cl Cl C H H Cl C C H cis-dikloroetillena Sisi yg sama Cl C H trans-dikloroetilena Sisi berlawanan Apakah salah satu molekul memiliki momen dipol? Perhatikan posisi relatif dari kelompok yang lebih besar pada tiap atom karbon dalam ikatan ganda. 11. 3

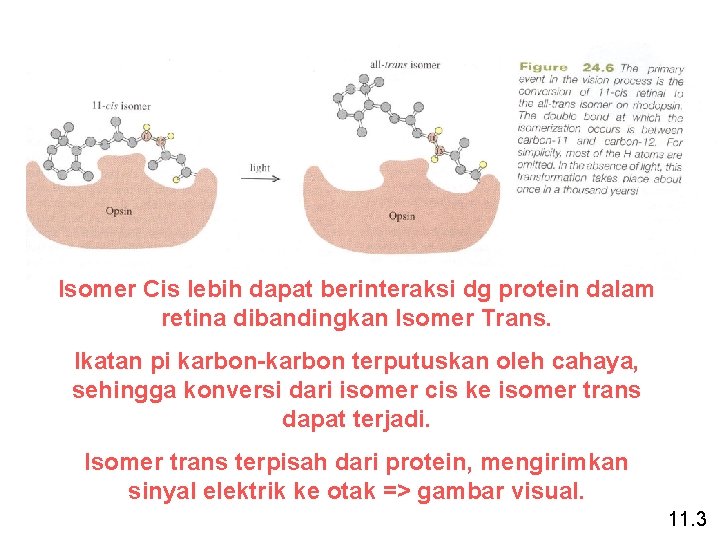
Isomer Cis lebih dapat berinteraksi dg protein dalam retina dibandingkan Isomer Trans. Ikatan pi karbon-karbon terputuskan oleh cahaya, sehingga konversi dari isomer cis ke isomer trans dapat terjadi. Isomer trans terpisah dari protein, mengirimkan sinyal elektrik ke otak => gambar visual. 11. 3

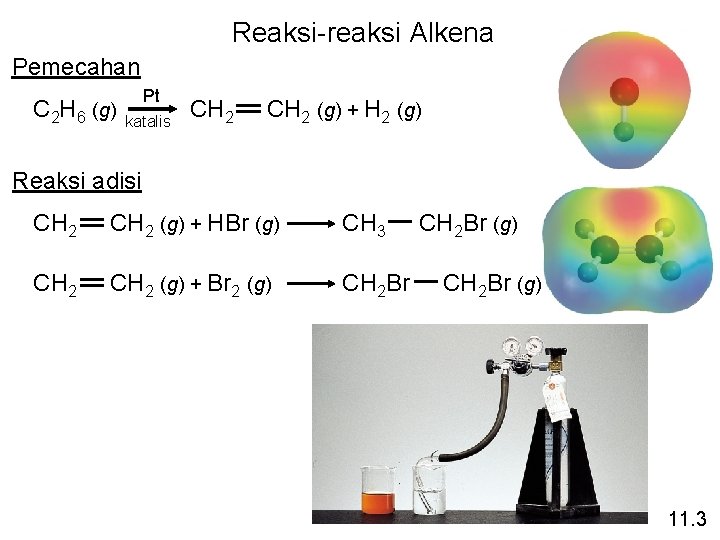
Reaksi-reaksi Alkena Pemecahan C 2 H 6 (g) Pt katalis CH 2 (g) + H 2 (g) Reaksi adisi CH 2 (g) + HBr (g) CH 3 CH 2 (g) + Br 2 (g) CH 2 Br (g) 11. 3

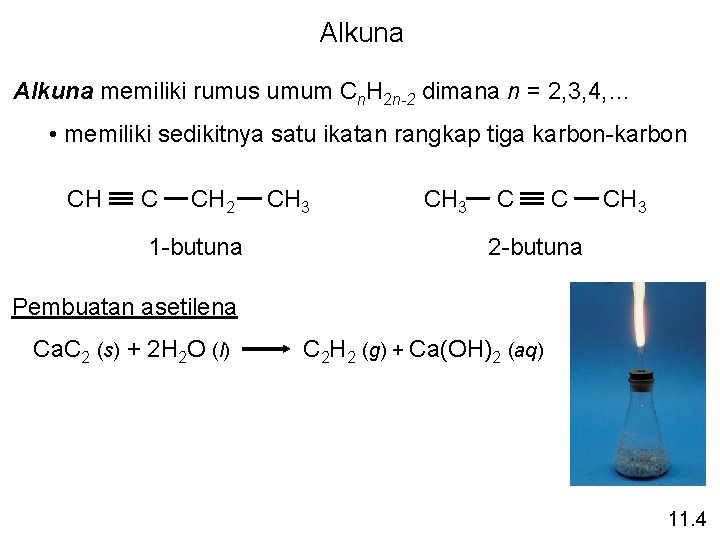
Alkuna memiliki rumus umum Cn. H 2 n-2 dimana n = 2, 3, 4, … • memiliki sedikitnya satu ikatan rangkap tiga karbon-karbon CH C CH 2 1 -butuna CH 3 C C CH 3 2 -butuna Pembuatan asetilena Ca. C 2 (s) + 2 H 2 O (l) C 2 H 2 (g) + Ca(OH)2 (aq) 11. 4

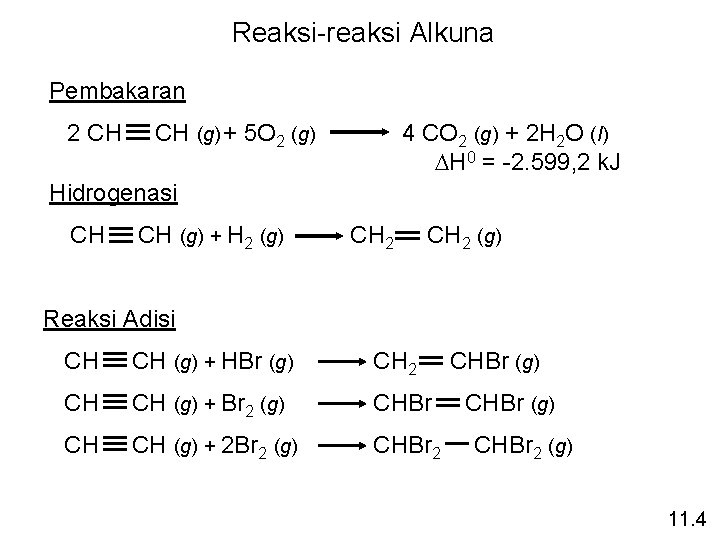
Reaksi-reaksi Alkuna Pembakaran 2 CH CH (g) + 5 O 2 (g) 4 CO 2 (g) + 2 H 2 O (l) DH 0 = -2. 599, 2 k. J Hidrogenasi CH CH (g) + H 2 (g) CH 2 (g) Reaksi Adisi CH CH (g) + HBr (g) CH 2 CH CH (g) + Br 2 (g) CHBr CH CH (g) + 2 Br 2 (g) CHBr 2 CHBr (g) CHBr 2 (g) 11. 4

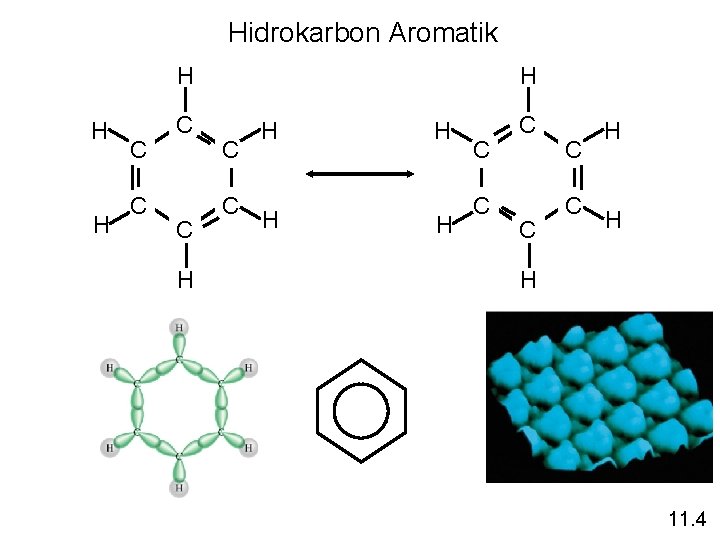
Hidrokarbon Aromatik H H C C H H C C C H H H 11. 4

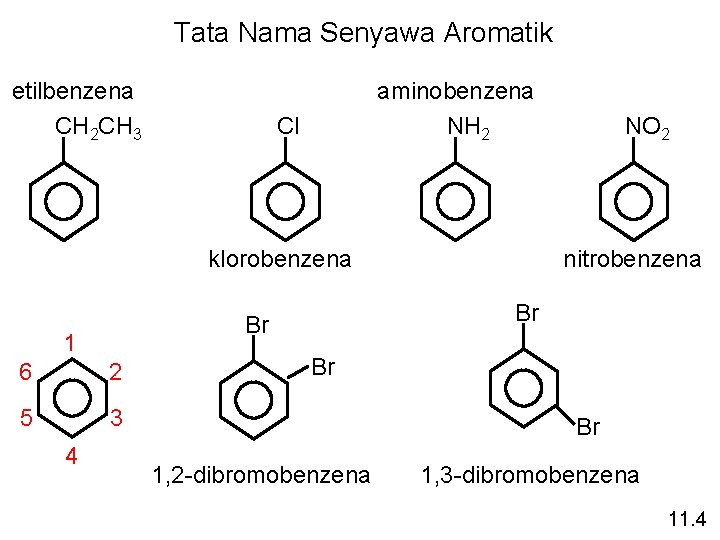
Tata Nama Senyawa Aromatik etilbenzena CH 2 CH 3 aminobenzena NH 2 Cl klorobenzena 6 2 5 3 4 nitrobenzena Br Br 1 NO 2 Br Br 1, 2 -dibromobenzena 1, 3 -dibromobenzena 11. 4

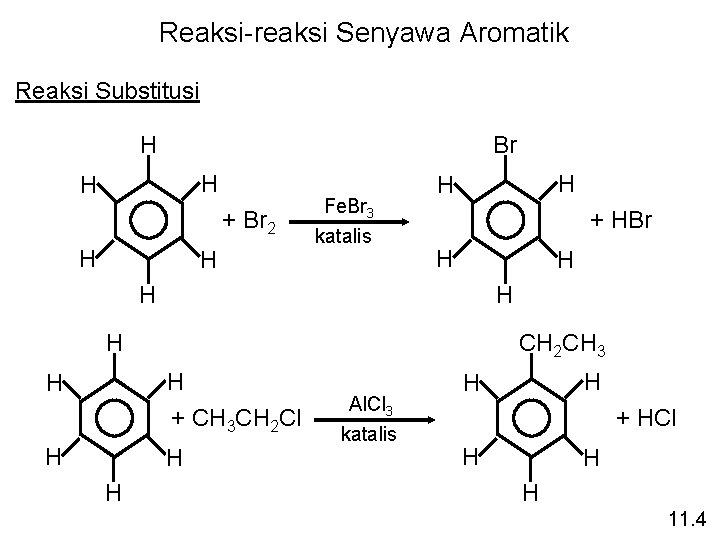
Reaksi-reaksi Senyawa Aromatik Reaksi Substitusi H Br H H + Br 2 H H Fe. Br 3 katalis H H + HBr H H H CH 2 CH 3 H + CH 3 CH 2 Cl H H Al. Cl 3 katalis H H + HCl H H H 11. 4

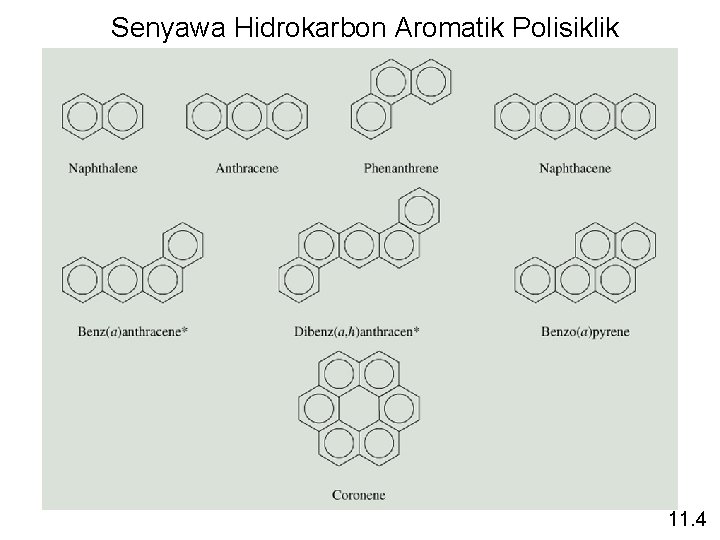
Senyawa Hidrokarbon Aromatik Polisiklik 11. 4

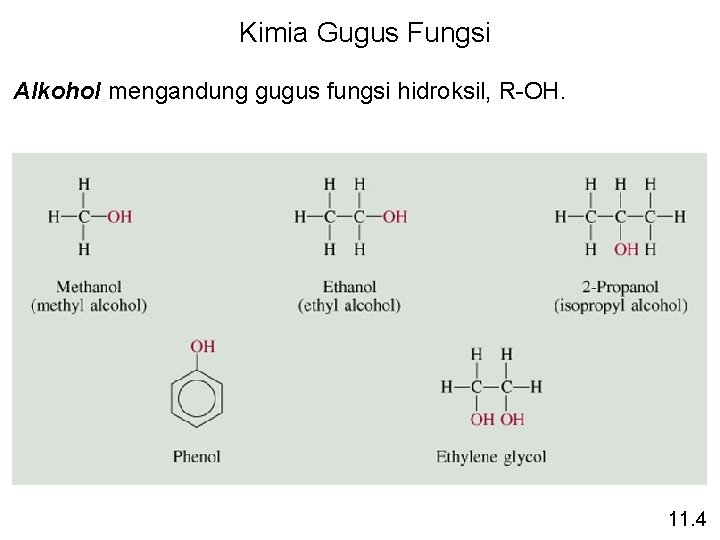
Kimia Gugus Fungsi Alkohol mengandung gugus fungsi hidroksil, R-OH. 11. 4

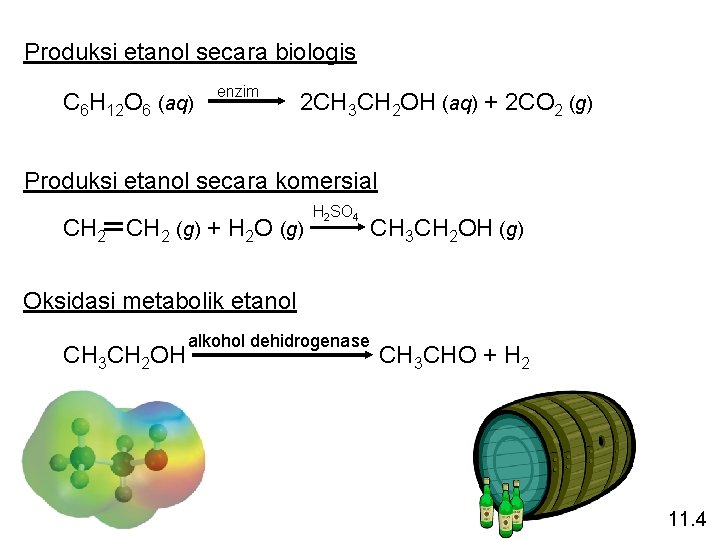
Produksi etanol secara biologis C 6 H 12 O 6 (aq) enzim 2 CH 3 CH 2 OH (aq) + 2 CO 2 (g) Produksi etanol secara komersial CH 2 (g) + H 2 O (g) H 2 SO 4 CH 3 CH 2 OH (g) Oksidasi metabolik etanol CH 3 CH 2 OH alkohol dehidrogenase CH 3 CHO + H 2 11. 4

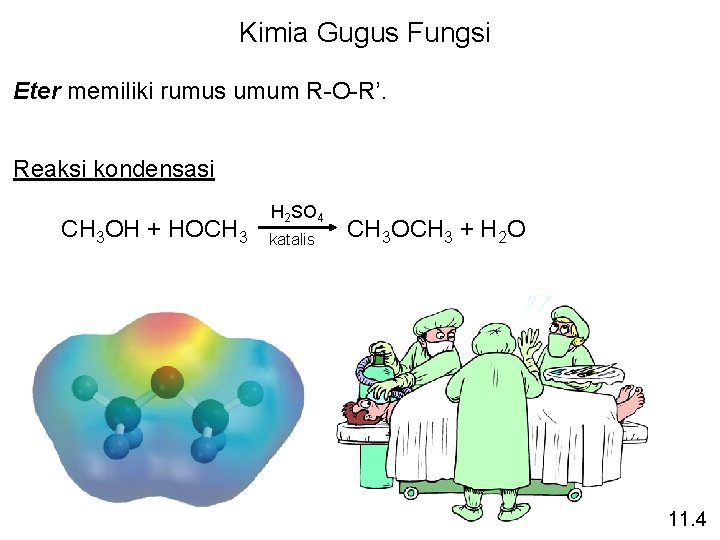
Kimia Gugus Fungsi Eter memiliki rumus umum R-O-R’. Reaksi kondensasi CH 3 OH + HOCH 3 H 2 SO 4 katalis CH 3 OCH 3 + H 2 O 11. 4

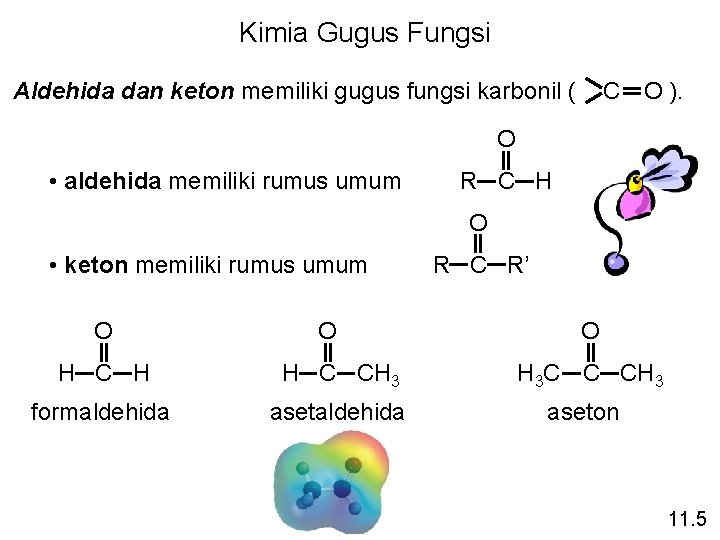
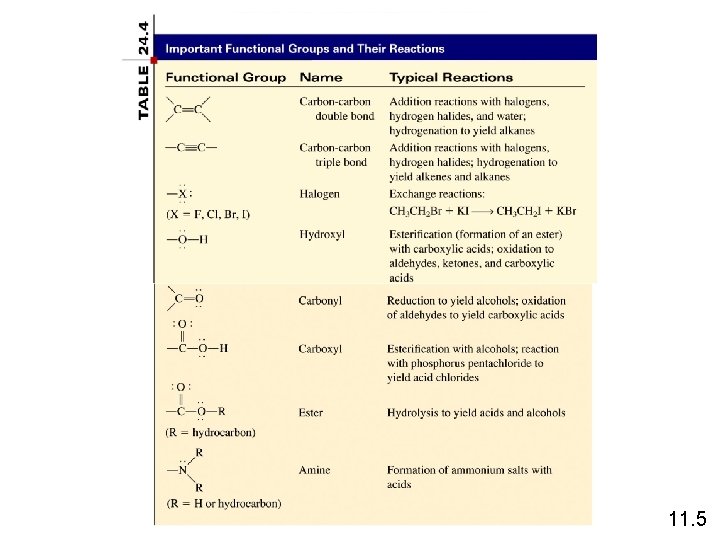
Kimia Gugus Fungsi O C Aldehida dan keton memiliki gugus fungsi karbonil ( ). O • aldehida memiliki rumus umum R C H O • keton memiliki rumus umum O O R C R’ O H C H H C CH 3 H 3 C C CH 3 formaldehida aseton 11. 5

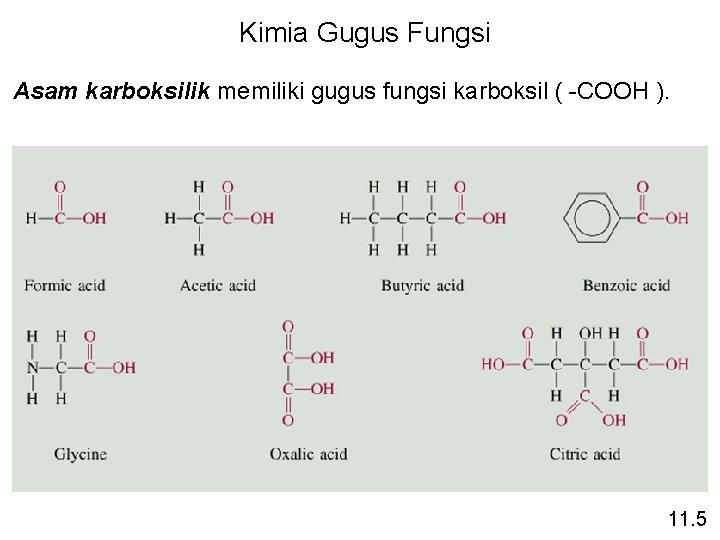
Kimia Gugus Fungsi Asam karboksilik memiliki gugus fungsi karboksil ( -COOH ). 11. 5

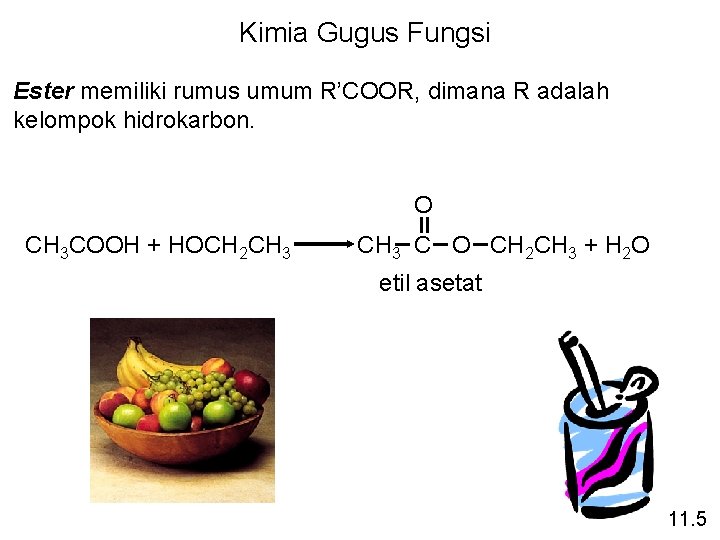
Kimia Gugus Fungsi Ester memiliki rumus umum R’COOR, dimana R adalah kelompok hidrokarbon. O CH 3 COOH + HOCH 2 CH 3 C O CH 2 CH 3 + H 2 O etil asetat 11. 5

Kimia Gugus Fungsi Amina adalah basa organik dengan rumus umum R 3 N. CH 3 NH 2 + H 2 O CH 3 CH 2 NH 2 + HCl RNH 3+ + OH- CH 3 CH 2 NH 3+Cl- 11. 5

11. 5

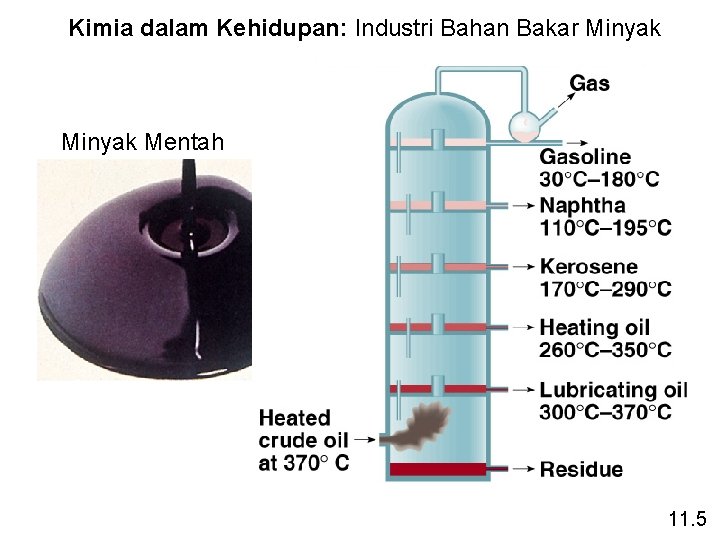
Kimia dalam Kehidupan: Industri Bahan Bakar Minyak Mentah 11. 5
 Oksidasi senyawa organik
Oksidasi senyawa organik Enzim merupakan senyawa organik
Enzim merupakan senyawa organik Oksidasi senyawa organik
Oksidasi senyawa organik Jumlah isomer dari senyawa nh2oh adalah
Jumlah isomer dari senyawa nh2oh adalah Nama senyawa hidrokarbon
Nama senyawa hidrokarbon Senyawa karbon organik dan anorganik
Senyawa karbon organik dan anorganik Enzim
Enzim Perbedaan senyawa karbon dan hidrokarbon
Perbedaan senyawa karbon dan hidrokarbon Efek resonansi
Efek resonansi Kuosien reaksi
Kuosien reaksi Kimia
Kimia Turunan alkana kelas 12
Turunan alkana kelas 12 Tata nama senyawa kimia
Tata nama senyawa kimia Pengenalan ilmu kimia
Pengenalan ilmu kimia Pengenalan komputer secara umum
Pengenalan komputer secara umum Pengenalan tentang gambaran umum
Pengenalan tentang gambaran umum Model umum sistem informasi
Model umum sistem informasi Pengenalan instrumen dalam praktik kebidanan
Pengenalan instrumen dalam praktik kebidanan Contoh ayat tema pendahuluan
Contoh ayat tema pendahuluan Maksud kenaikan pangkat secara fleksi
Maksud kenaikan pangkat secara fleksi Pengenalan pola dapat muncul dalam bentuk.... *
Pengenalan pola dapat muncul dalam bentuk.... * Chemical error
Chemical error Statistics in analytical chemistry
Statistics in analytical chemistry Reaksi kimia dalam larutan air
Reaksi kimia dalam larutan air Dadah merupakan bahan kimia
Dadah merupakan bahan kimia Jirim kelabu dan jirim putih
Jirim kelabu dan jirim putih Laporan perubahan modal
Laporan perubahan modal Mekanisme debit dan kredit
Mekanisme debit dan kredit Jenis tarif dalam angkutan umum
Jenis tarif dalam angkutan umum Sita umum dalam kepailitan adalah
Sita umum dalam kepailitan adalah Pengertian bertelepon
Pengertian bertelepon Texture
Texture Struktur rekaan
Struktur rekaan Suspending agent dari alam
Suspending agent dari alam Sni 7763:2018
Sni 7763:2018 Pelarut protonik
Pelarut protonik Cis trans izomeri
Cis trans izomeri Alkanlarda izomeri
Alkanlarda izomeri