100 UNSUR KIMIA JUTAAN SENYAWA KIMIA GAYA YANG

- Slides: 22


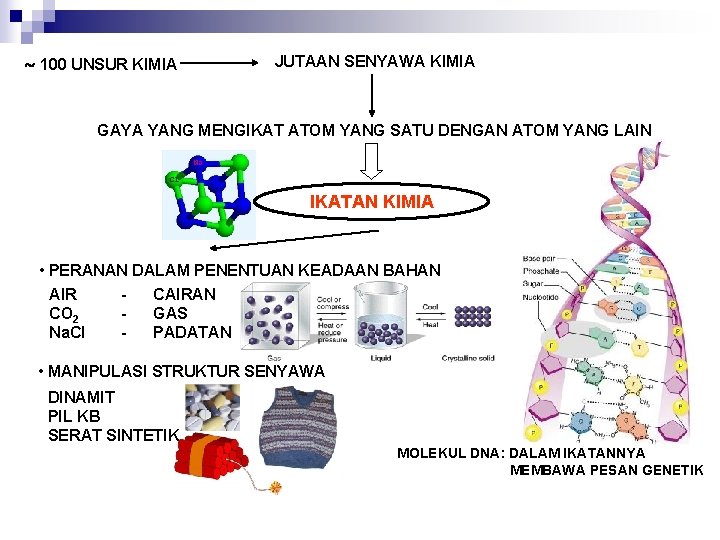
100 UNSUR KIMIA JUTAAN SENYAWA KIMIA GAYA YANG MENGIKAT ATOM YANG SATU DENGAN ATOM YANG LAIN IKATAN KIMIA • PERANAN DALAM PENENTUAN KEADAAN BAHAN AIR CAIRAN CO 2 GAS Na. Cl PADATAN • MANIPULASI STRUKTUR SENYAWA DINAMIT PIL KB SERAT SINTETIK MOLEKUL DNA: DALAM IKATANNYA MEMBAWA PESAN GENETIK

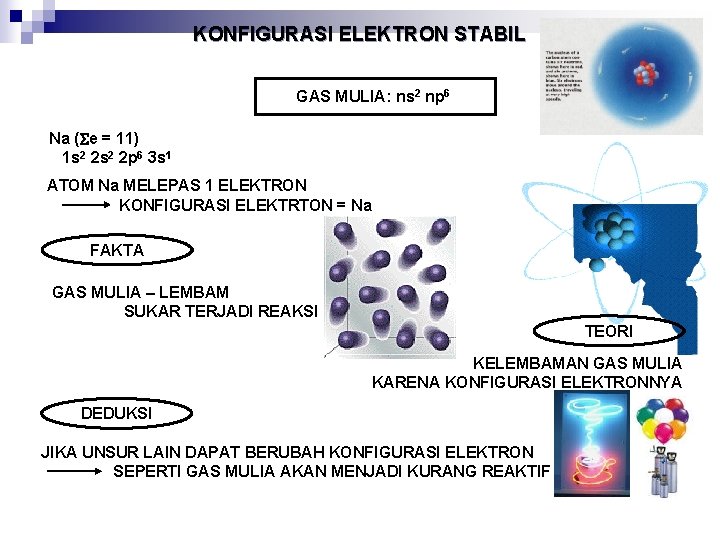
KONFIGURASI ELEKTRON STABIL GAS MULIA: ns 2 np 6 Na ( e = 11) 1 s 2 2 p 6 3 s 1 ATOM Na MELEPAS 1 ELEKTRON KONFIGURASI ELEKTRTON = Na FAKTA GAS MULIA – LEMBAM SUKAR TERJADI REAKSI TEORI KELEMBAMAN GAS MULIA KARENA KONFIGURASI ELEKTRONNYA DEDUKSI JIKA UNSUR LAIN DAPAT BERUBAH KONFIGURASI ELEKTRON SEPERTI GAS MULIA AKAN MENJADI KURANG REAKTIF

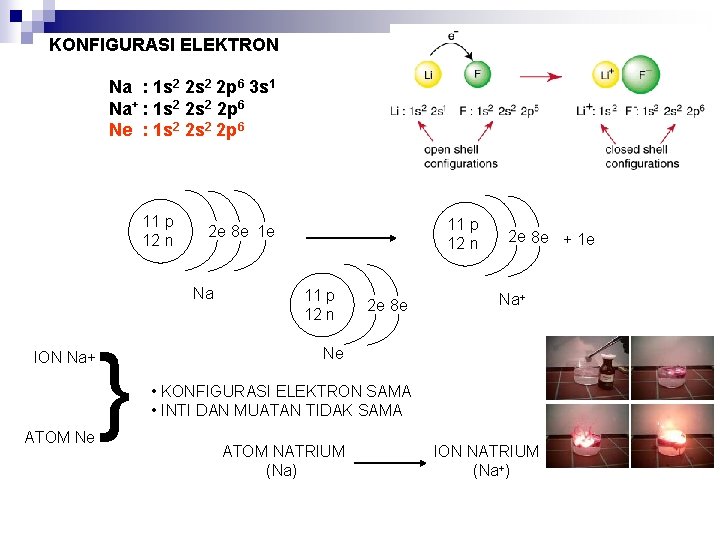
KONFIGURASI ELEKTRON Na : 1 s 2 2 p 6 3 s 1 Na+ : 1 s 2 2 p 6 Ne : 1 s 2 2 p 6 11 p 12 n Na ION Na+ ATOM Ne } 11 p 12 n 2 e 8 e 1 e 11 p 12 n 2 e 8 e + 1 e Na+ Ne • KONFIGURASI ELEKTRON SAMA • INTI DAN MUATAN TIDAK SAMA ATOM NATRIUM (Na) ION NATRIUM (Na+)

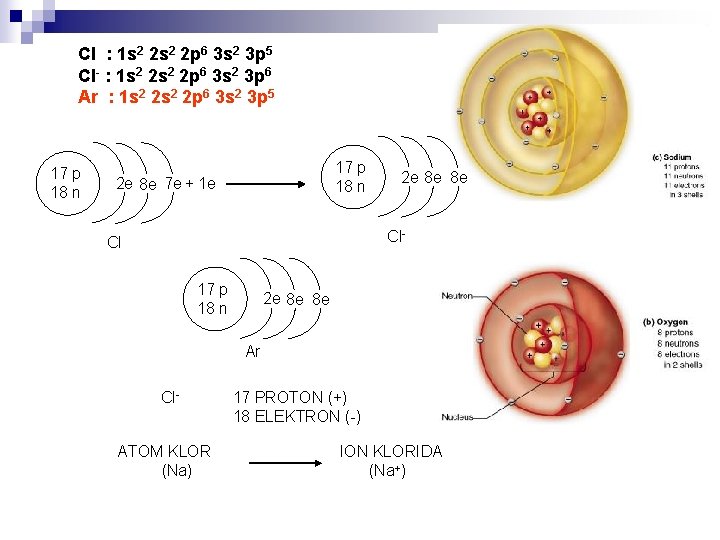
Cl : 1 s 2 2 p 6 3 s 2 3 p 5 Cl- : 1 s 2 2 p 6 3 s 2 3 p 6 Ar : 1 s 2 2 p 6 3 s 2 3 p 5 17 p 18 n 2 e 8 e 7 e + 1 e 2 e 8 e 8 e Cl- Cl 17 p 18 n 2 e 8 e 8 e Ar Cl. ATOM KLOR (Na) 17 PROTON (+) 18 ELEKTRON (-) ION KLORIDA (Na+)

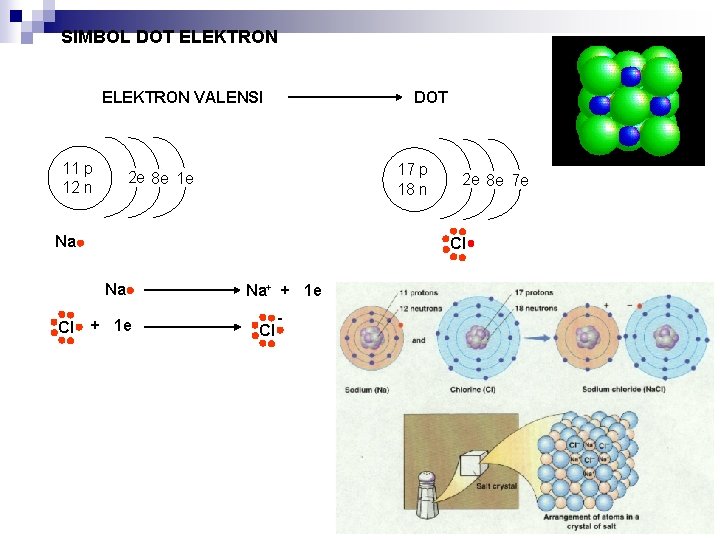
SIMBOL DOT ELEKTRON VALENSI 11 p 12 n DOT 17 p 18 n 2 e 8 e 1 e Na Cl 2 e 8 e 7 e + 1 e Na+ + 1 e Cl -

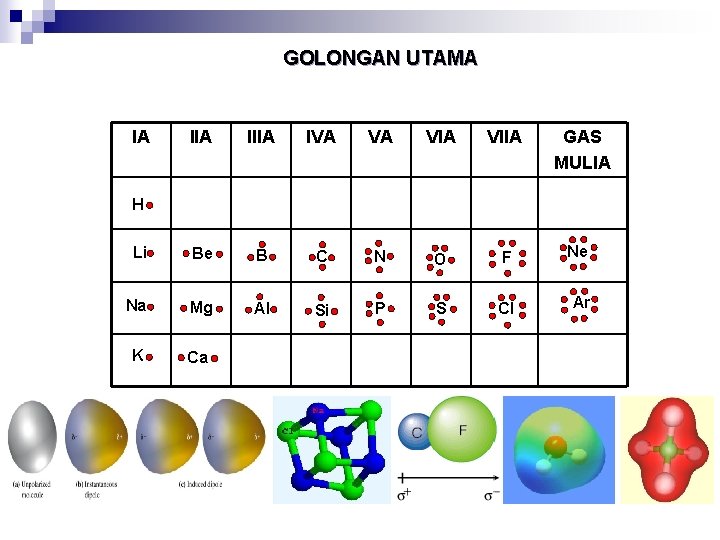
GOLONGAN UTAMA IA IIIA IVA VA VIIA GAS MULIA Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca H

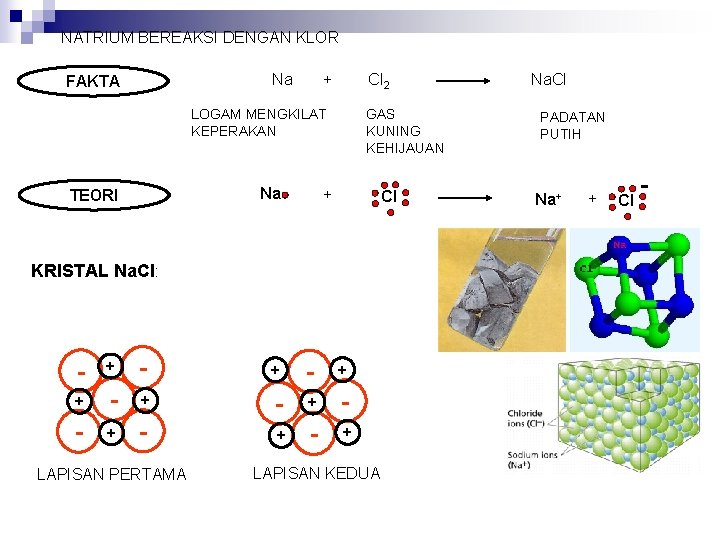
NATRIUM BEREAKSI DENGAN KLOR Na FAKTA + Cl 2 LOGAM MENGKILAT KEPERAKAN Na TEORI GAS KUNING KEHIJAUAN + Cl KRISTAL Na. Cl: - + - + - - + - + LAPISAN PERTAMA LAPISAN KEDUA Na. Cl PADATAN PUTIH Na+ + Cl -

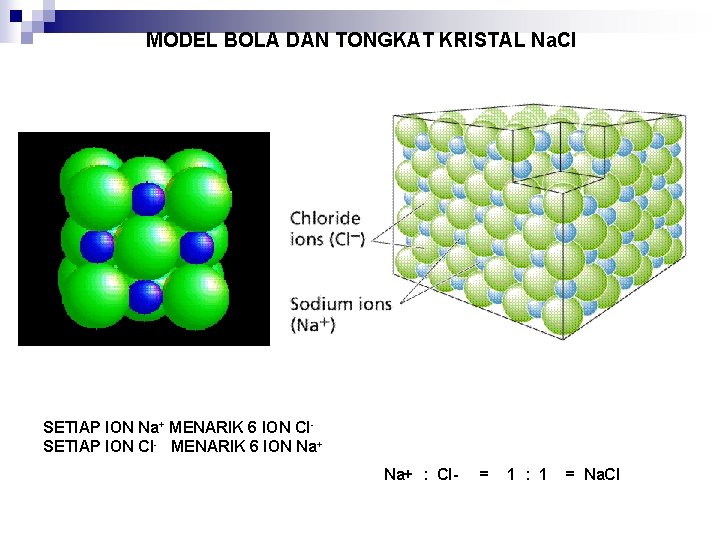
MODEL BOLA DAN TONGKAT KRISTAL Na. Cl SETIAP ION Na+ MENARIK 6 ION Cl. SETIAP ION Cl- MENARIK 6 ION Na+ : Cl- = 1 : 1 = Na. Cl

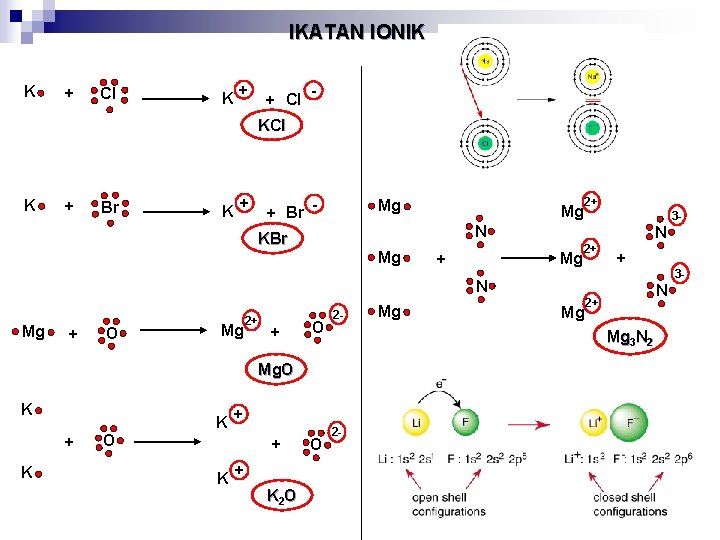
IKATAN IONIK K + Cl + K + Cl - KCl K + Br K + + Br - Mg Mg 2+ 3 - N KBr Mg N Mg + 2+ + N Mg + O Mg 2+ + O 2 - + K O K + + K 2 O O Mg N 2+ Mg 3 N 2 Mg. O K Mg 2 - 3 -

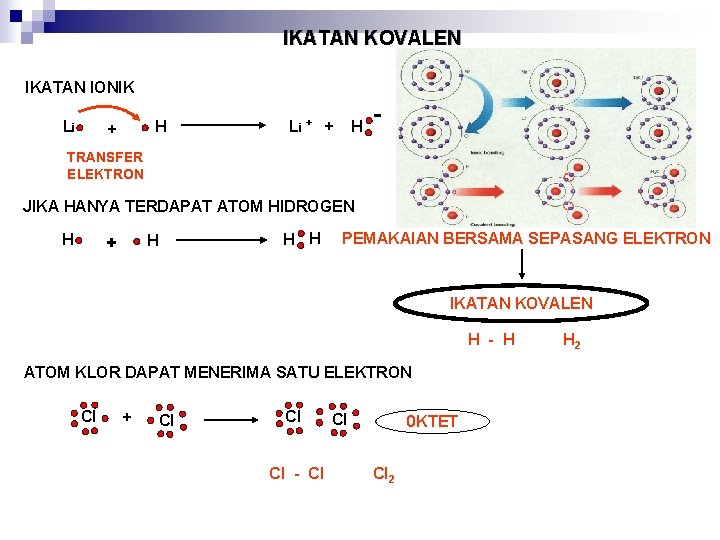
IKATAN KOVALEN IKATAN IONIK Li H + Li + + H - TRANSFER ELEKTRON JIKA HANYA TERDAPAT ATOM HIDROGEN H H + H H PEMAKAIAN BERSAMA SEPASANG ELEKTRON IKATAN KOVALEN H - H ATOM KLOR DAPAT MENERIMA SATU ELEKTRON Cl + Cl Cl Cl - Cl Cl 0 KTET Cl 2 H 2

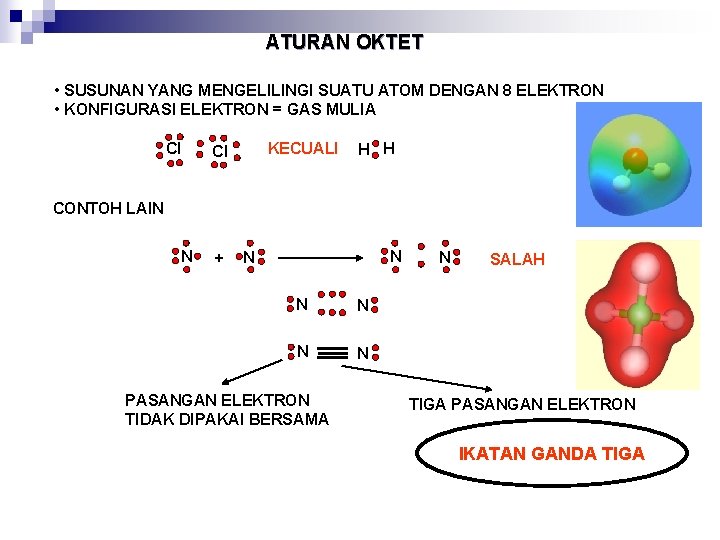
ATURAN OKTET • SUSUNAN YANG MENGELILINGI SUATU ATOM DENGAN 8 ELEKTRON • KONFIGURASI ELEKTRON = GAS MULIA Cl KECUALI Cl H H CONTOH LAIN N N N + PASANGAN ELEKTRON TIDAK DIPAKAI BERSAMA N N SALAH TIGA PASANGAN ELEKTRON IKATAN GANDA TIGA

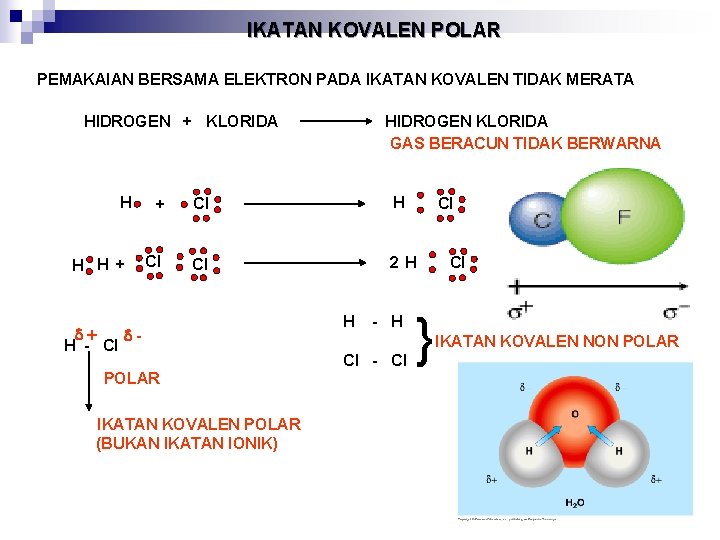
IKATAN KOVALEN POLAR PEMAKAIAN BERSAMA ELEKTRON PADA IKATAN KOVALEN TIDAK MERATA HIDROGEN + KLORIDA H H H + HIDROGEN KLORIDA GAS BERACUN TIDAK BERWARNA + Cl H Cl Cl 2 H H - Cl POLAR IKATAN KOVALEN POLAR (BUKAN IKATAN IONIK) H - H Cl - Cl Cl } Cl IKATAN KOVALEN NON POLAR

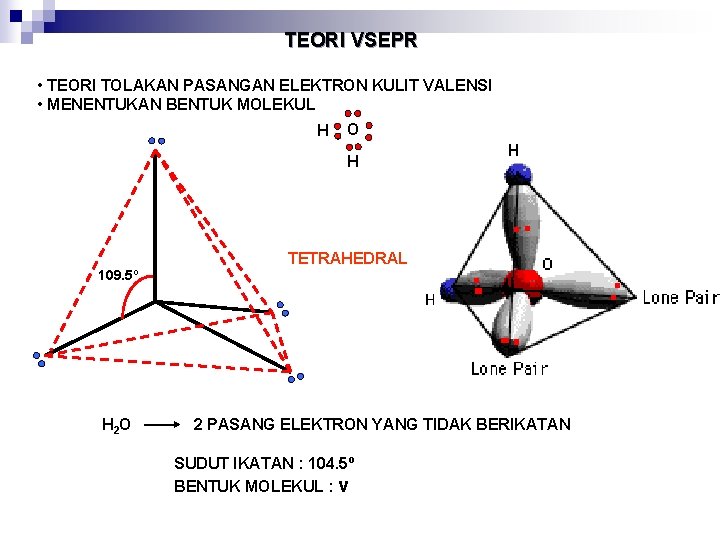
TEORI VSEPR • TEORI TOLAKAN PASANGAN ELEKTRON KULIT VALENSI • MENENTUKAN BENTUK MOLEKUL H O H TETRAHEDRAL 109. 5º H 2 O 2 PASANG ELEKTRON YANG TIDAK BERIKATAN SUDUT IKATAN : 104. 5º BENTUK MOLEKUL : v

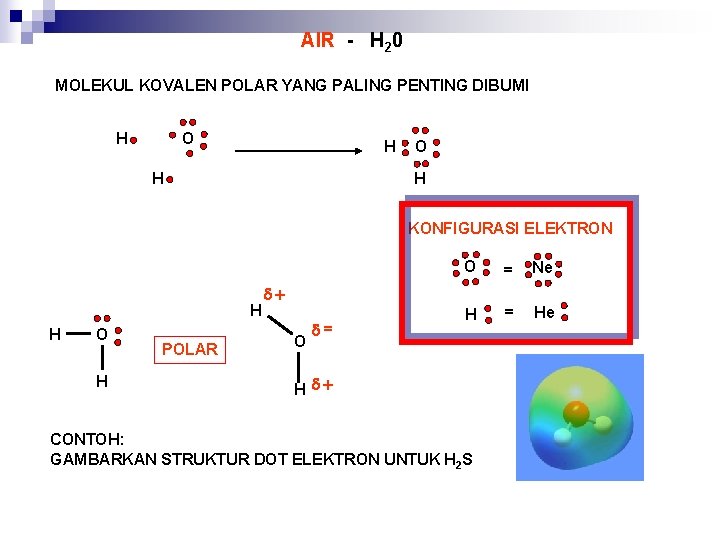
AIR - H 20 MOLEKUL KOVALEN POLAR YANG PALING PENTING DIBUMI O H H KONFIGURASI ELEKTRON H H O H POLAR O = Ne H = He O = H CONTOH: GAMBARKAN STRUKTUR DOT ELEKTRON UNTUK H 2 S

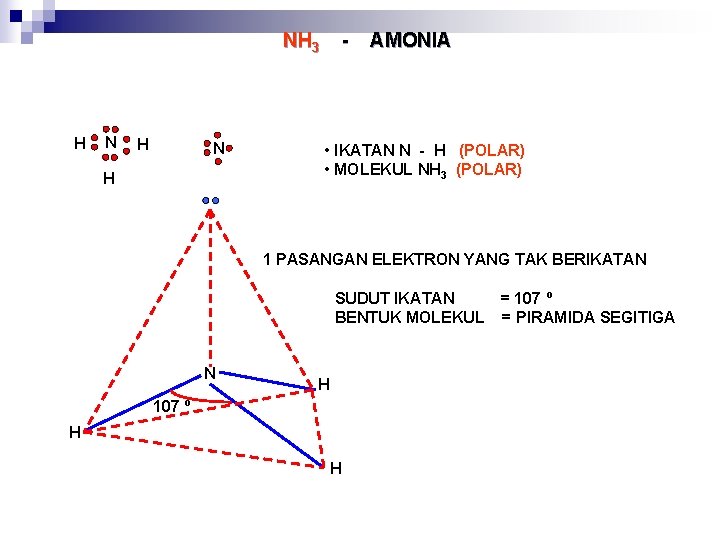
NH 3 H N H - AMONIA • IKATAN N - H (POLAR) • MOLEKUL NH 3 (POLAR) 1 PASANGAN ELEKTRON YANG TAK BERIKATAN SUDUT IKATAN BENTUK MOLEKUL N H 107 º H H = 107 º = PIRAMIDA SEGITIGA

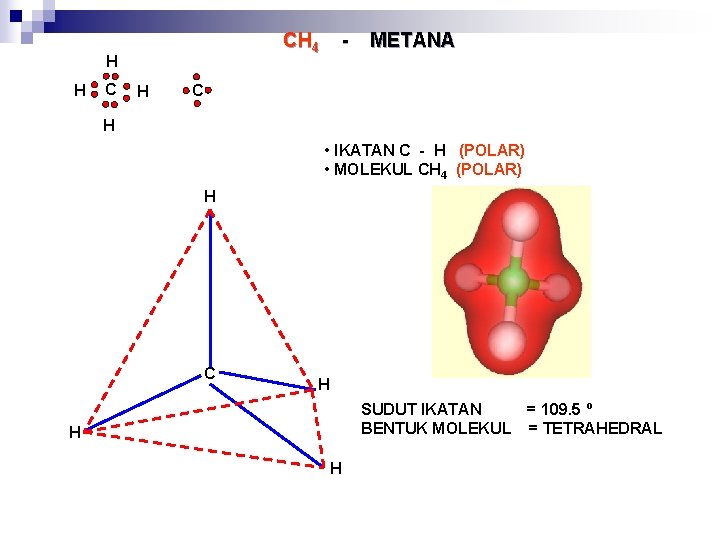
CH 4 H H C H - METANA C H • IKATAN C - H (POLAR) • MOLEKUL CH 4 (POLAR) H C H SUDUT IKATAN BENTUK MOLEKUL H H = 109. 5 º = TETRAHEDRAL

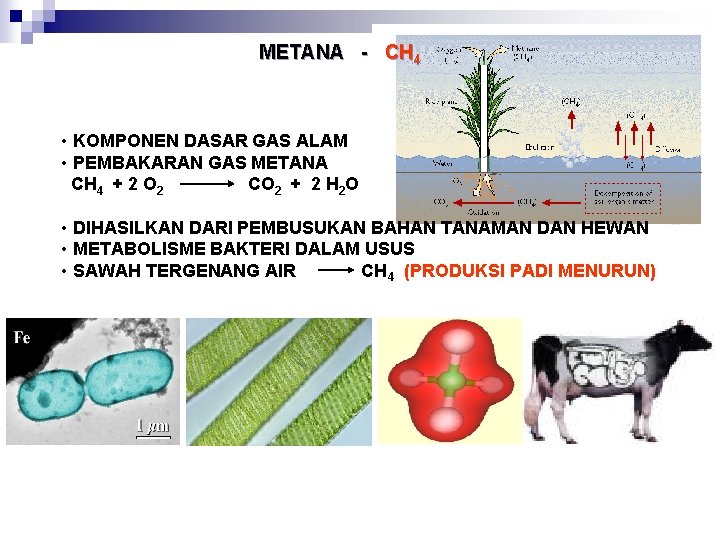
METANA - CH 4 • KOMPONEN DASAR GAS ALAM • PEMBAKARAN GAS METANA CH 4 + 2 O 2 CO 2 + 2 H 2 O • DIHASILKAN DARI PEMBUSUKAN BAHAN TANAMAN DAN HEWAN • METABOLISME BAKTERI DALAM USUS • SAWAH TERGENANG AIR CH 4 (PRODUKSI PADI MENURUN)

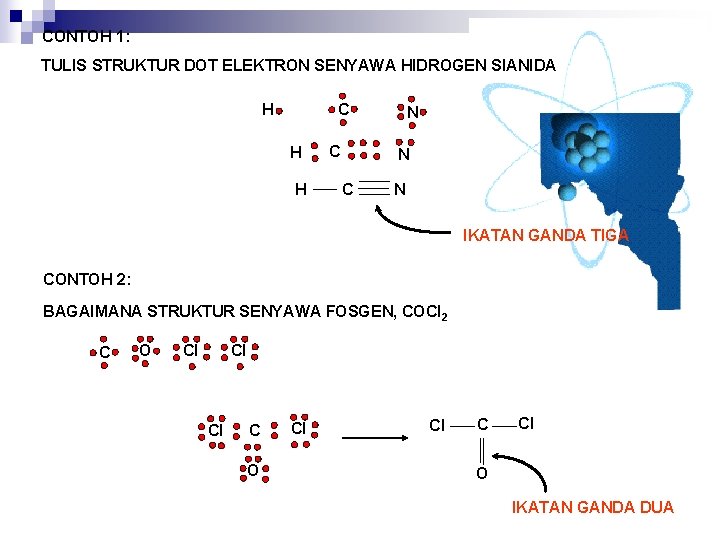
CONTOH 1: TULIS STRUKTUR DOT ELEKTRON SENYAWA HIDROGEN SIANIDA C H H H C N N C N IKATAN GANDA TIGA CONTOH 2: BAGAIMANA STRUKTUR SENYAWA FOSGEN, COCl 2 C O Cl Cl Cl C O Cl Cl C Cl O IKATAN GANDA DUA

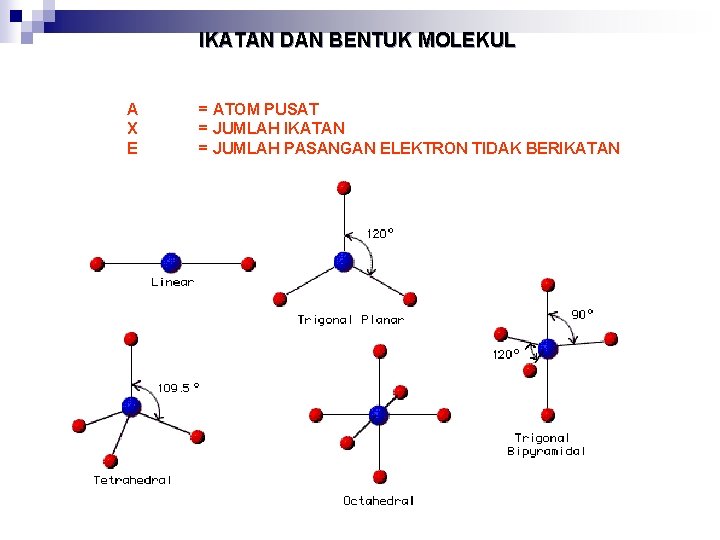
IKATAN DAN BENTUK MOLEKUL A X E = ATOM PUSAT = JUMLAH IKATAN = JUMLAH PASANGAN ELEKTRON TIDAK BERIKATAN

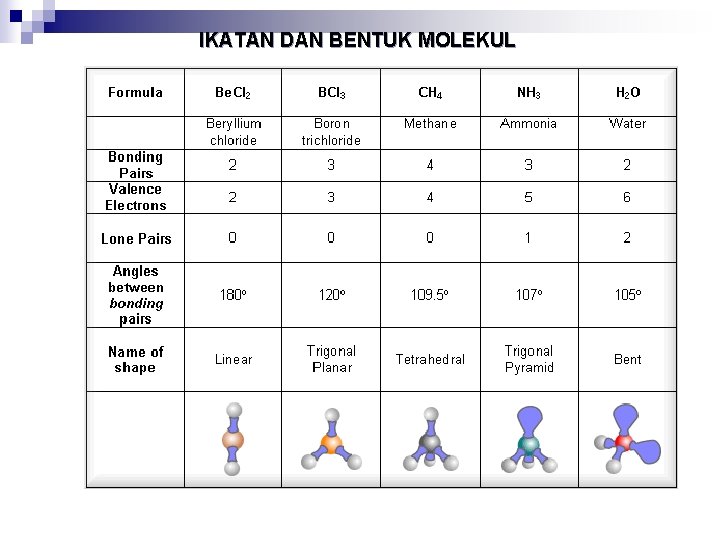
IKATAN DAN BENTUK MOLEKUL

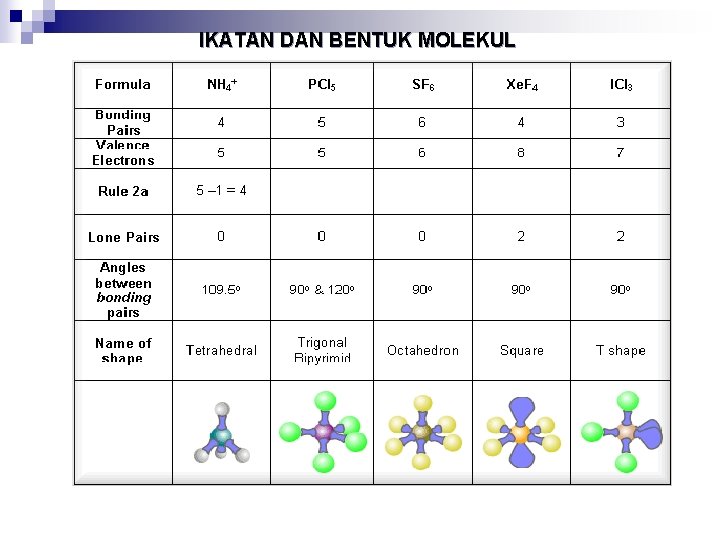
IKATAN DAN BENTUK MOLEKUL
 100 100 100 100 100
100 100 100 100 100 Membangun kerjasama tim (team building)
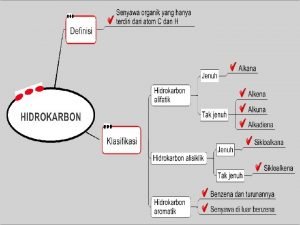
Membangun kerjasama tim (team building) Perbedaan senyawa karbon dan hidrokarbon
Perbedaan senyawa karbon dan hidrokarbon Besarnya modal dalam jutaan rupiah dari 40 perusahaan
Besarnya modal dalam jutaan rupiah dari 40 perusahaan Besarnya modal dalam jutaan rupiah dari 40 perusahaan
Besarnya modal dalam jutaan rupiah dari 40 perusahaan Sifat sifat unsur dan senyawa periode 3
Sifat sifat unsur dan senyawa periode 3 Tabel unsur dan senyawa
Tabel unsur dan senyawa Pengertian unsur senyawa dan campuran
Pengertian unsur senyawa dan campuran Apa yang dimaksud dengan senyawa hidrokarbon? *
Apa yang dimaksud dengan senyawa hidrokarbon? * Apa arti homogen
Apa arti homogen Atom molekul unsur dan senyawa
Atom molekul unsur dan senyawa Senyawa turunan alkana
Senyawa turunan alkana Nomenklatur adalah
Nomenklatur adalah Sebelum pergerakan nasional
Sebelum pergerakan nasional Unsur unsur negara secara klasik
Unsur unsur negara secara klasik Unsur unsur akor
Unsur unsur akor Angka kredit unsur penunjang guru
Angka kredit unsur penunjang guru Unsur unsur logam
Unsur unsur logam Basa padinan trengginas
Basa padinan trengginas Tingkatan manajemen adalah
Tingkatan manajemen adalah Saluran kepemimpinan
Saluran kepemimpinan Hubungan antar unsur lingkaran
Hubungan antar unsur lingkaran Diagonal ruang rumus
Diagonal ruang rumus