Unsur unsur transisi periode keempat Konfigurasi Elektron Unsur
























- Slides: 29

Unsur – unsur transisi periode keempat

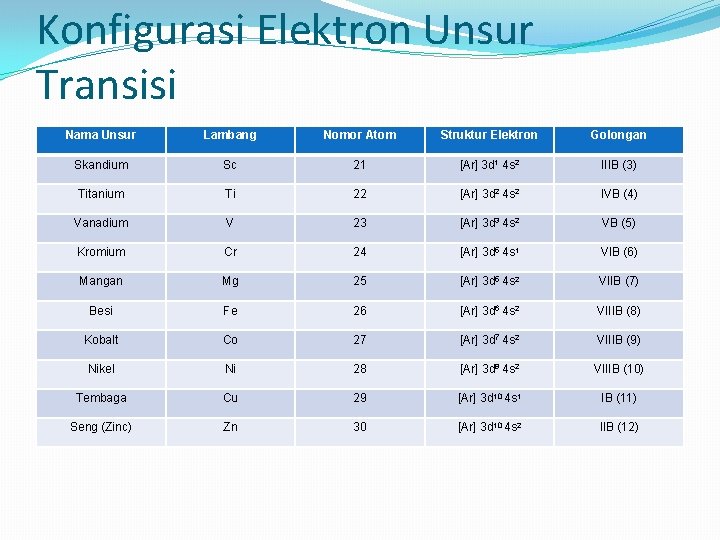
Konfigurasi Elektron Unsur Transisi Nama Unsur Lambang Nomor Atom Struktur Elektron Golongan Skandium Sc 21 [Ar] 3 d 1 4 s 2 IIIB (3) Titanium Ti 22 [Ar] 3 d 2 4 s 2 IVB (4) Vanadium V 23 [Ar] 3 d 3 4 s 2 VB (5) Kromium Cr 24 [Ar] 3 d 5 4 s 1 VIB (6) Mangan Mg 25 [Ar] 3 d 5 4 s 2 VIIB (7) Besi Fe 26 [Ar] 3 d 6 4 s 2 VIIIB (8) Kobalt Co 27 [Ar] 3 d 7 4 s 2 VIIIB (9) Nikel Ni 28 [Ar] 3 d 8 4 s 2 VIIIB (10) Tembaga Cu 29 [Ar] 3 d 10 4 s 1 IB (11) Seng (Zinc) Zn 30 [Ar] 3 d 10 4 s 2 IIB (12)

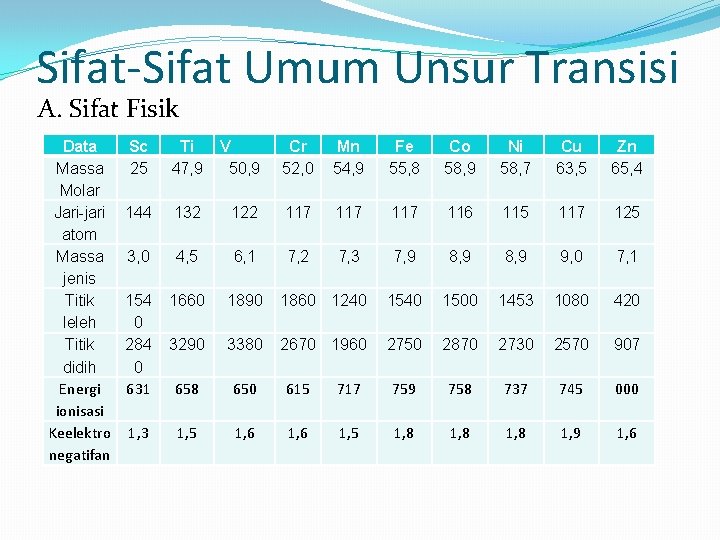
Sifat-Sifat Umum Unsur Transisi A. Sifat Fisik Data Massa Molar Jari-jari atom Massa jenis Titik leleh Titik didih Energi ionisasi Keelektro negatifan Sc 25 Ti 47, 9 V 50, 9 Cr 52, 0 Mn 54, 9 Fe 55, 8 Co 58, 9 Ni 58, 7 Cu 63, 5 Zn 65, 4 144 132 122 117 117 116 115 117 125 3, 0 4, 5 6, 1 7, 2 7, 3 7, 9 8, 9 9, 0 7, 1 154 0 284 0 631 1660 1890 1860 1240 1500 1453 1080 420 3290 3380 2670 1960 2750 2870 2730 2570 907 658 650 615 717 759 758 737 745 000 1, 3 1, 5 1, 6 1, 5 1, 8 1, 9 1, 6

Perubahan jari – jari atom dari Sc ke Zn tidak terlalu besar. Karena pengisian elektron dari Sc sampai Zn masuk pada subkulit 3 d yang merupakan bagian dari kulit ketiga padahal kulit keempat sudah terisi, sehingga pengaruhnya terhadap penambahan jari – jari elektron sangat kecil bahkan kadang – kadang tidak berpengaruh sama sekali. Perubahan energi ionisasi dari Sc sampai Zn tidak terlalu besar seperti halnya pada unsur – unsur golongan utama ( A ) disebabkan oleh konfigurasi elektronya yaitu penambahan elektron dari Sc sampai ke Zn masuk pada kulit ketiga.

B. Sifat Paramagnetik Jika dalam suatu atom, molekul, atau ion terdapat electron yang tidak berpasangan pada orbitalnya, maka spesi tersebut bersifat paramagnetik, artinya ia dapat tertarik atau terinduksi oleh medan magnet. � Sebaliknya, jika semua electron membentuk pasangan spesi itu bersifat diamagnetic (tidak tertarik oleh medan magnet). � Unsur-unsur transisi dan senyawa-senyawa kebanyakan mengandung electron yang tidak berpasangan dalam orbital-orbital subkulit d. akibatnya, sebagian besar unsur transisi dan senyawanya merupakan zat-zat paramagnetic. Makin banyak electron yang tidak berpasangan, makin kuat sifat paramagnetiknya. Unsur-unsur bessi (Fe), Kobalt (Co), dan nikel (Ni) memiliki suatu sifat unik yang disebut ferromagnetic.

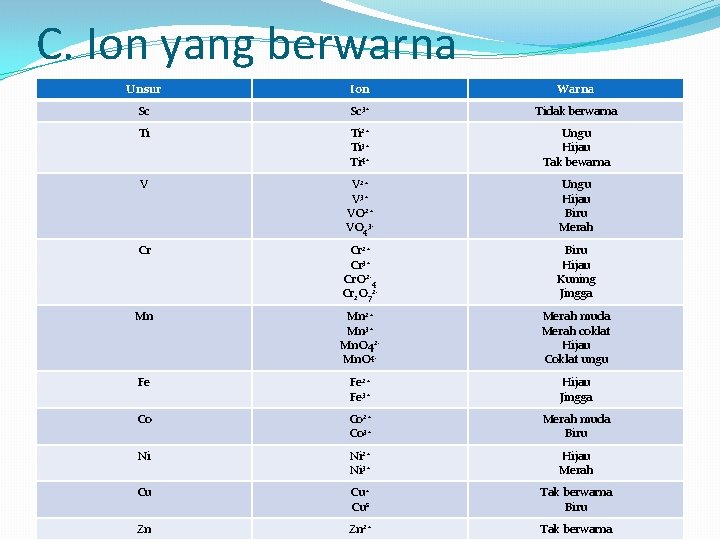
C. Ion yang berwarna Unsur Ion Warna Sc Sc 3+ Tidak berwarna Ti Ti 2+ Ti 3+ Ti 4+ Ungu Hijau Tak bewarna V V 2+ V 3+ VO 2+ VO 43 - Ungu Hijau Biru Merah Cr Cr 2+ Cr 3+ Cr. O 2 -4 Cr 2 O 72 - Biru Hijau Kuning Jingga Mn Mn 2+ Mn 3+ Mn. O 42 Mn. O 4 - Merah muda Merah coklat Hijau Coklat ungu Fe Fe 2+ Fe 3+ Hijau Jingga Co Co 2+ Co 3+ Merah muda Biru Ni Ni 2+ Ni 3+ Hijau Merah Cu Cu+ Cus Tak berwarna Biru Zn Zn 2+ Tak berwarna

Warna disebabkan oleh tingkat energi elektron yang hampir sama. Elektron-elektron dapat bergerak ke tingkat yang lebih tinggi dengan mengabsorpsi sinar tampak yang terlihat oleh mata.

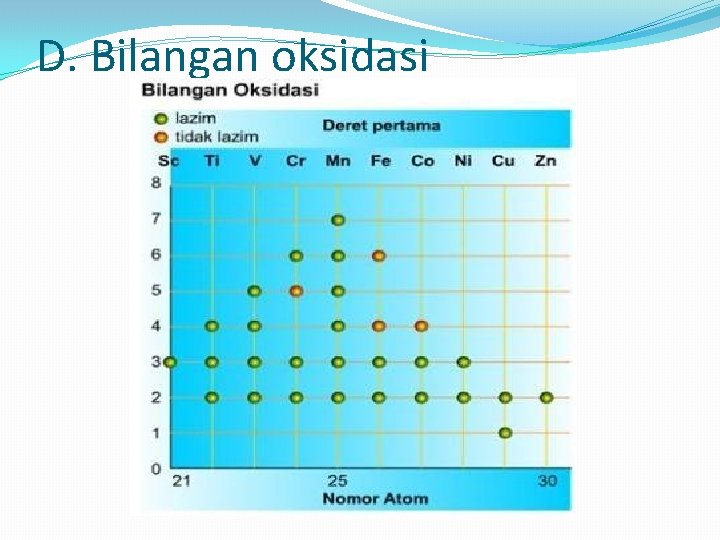
D. Bilangan oksidasi

Unsur transisi memiliki beberapa bilangan oksidasi, keteraturan dapat dikenali. Bilangan oksidasi tertinggi atom yang memiliki lima elektron yakni jumlah orbital d berkaitan dengan keadaan saat semua elektron d (selain elektron s) dikeluarkan. Jadi, dalam kasus skandium dengan konfigurasi elektron (n-1)d 1 ns 2, bilangan oksidasinya 3. Mangan dengan konfigurasi (n-1)d 5 ns 2, akan berbilangan oksidasi maksimum +7. Bila jumlah elektron d melebihi 5, situasinya berubah. Untuk besi Fe dengan konfigurasi elektron (n-1)d 6 ns 2, bilangan oksidasi utamanya adalah +2 dan +3. Sangat jarang ditemui bilangan oksidasi +6. Bilangan oksidasi tertinggi sejumlah logam transisi penting seperti kobal Co, Nikel Ni, tembaga Cu dan zink Zn lebih rendah dari bilangan oksidasi atom yang kehilangan semua elektron (n– 1)d dan ns-nya. Di antara unsur-unsur yang ada dalam golongan yang sama, semakin tinggi bilangan oksidasi semakin penting untuk unsur-unsur pada periode yang lebih besar.

E. Sifat katalis Logam dan senyawanya digunakan sebagai katalis, pada pembuatan ammonia : katalis Fe, pembuatan H 2 SO 4 : katalis V 2 O 5, reaksi organik : katalis logam Nidan Pt. Dalam tubuh kita, ion-ion logam transisi berfungsi sebagai ko-enzim (katalis pembantu enzim). Hidrolisis protein menjadi asam amino dipercepat oleh katalis ion Zn 2+, sintesis hemoglobin memmerlukan katalis ion Cu 2+ dan sebagainya

F. Membentuk senyawa kompleks Ion kompleks merupakan ion yang tersusun dari ion pusat ( atom pusat ) yang dikelilingi oleh molekul atau ion ( disebut ligan. Antara ion pusat dengan ligan terjadi ikatan koodinasi. Jumlah ikatan koordinasi yang terjadi antara ion pusat dengan liga disebut dengan bilangan koordinasi.

Sumber unsur-unsur transisi

Kegunaan unsur-unsur transisi periode keempat a. Skandium digunakan pada lampu intensitas tinggi b. Titanium digunakan pada industri pesawat terbang dan industri kimia. c. Vanadium digunakan untuk membuat per mobil dan sebagai katalis pembuatan belerang d. Kromium digunakan untuk bahan pembuatan baja, nikrom, stanless steel. e. Mangan digunakan untuk bahan pembuatan baja, manganin dalam pembuatan alat listrik dan sebagai alloy mangan-besi atau ferromanganese f. Besi digunakan untuk pembuatan baja, perangkat elektronik, memori komputer, dan pita rekaman. g. Kobalt digunakan untuk membuat aliansi (paduan logam) h. Nikel digunakan untuk melapisi logam supaya tahan karat dan paduan logam i. Tembaga digunakan untuk kabel – kabel, pipi – pipa, kaleng makanan dan untuk alat – alat elektronik j. Seng digunakan sebagai logam pelapis antikarat, paduan logam, pembuatan bahan cat putih, dan antioksidan dalam pembuatan ban mobil.

Sifat umum unsur-unsur transisi

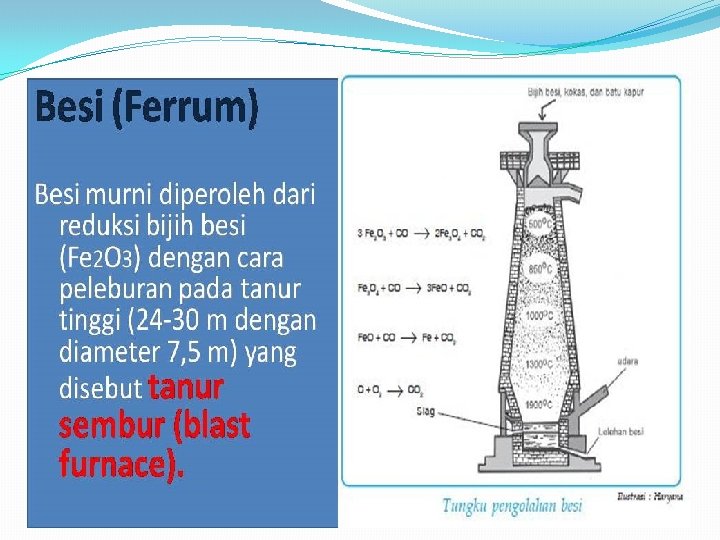
Pengolahan unsur transisi









Senyawa kompleks koordinasi





 Konfigurasi elektron logam transisi
Konfigurasi elektron logam transisi Atom berikut ini yang mempunyai jumlah elektron 32 adalah
Atom berikut ini yang mempunyai jumlah elektron 32 adalah Cara menyingkat konfigurasi elektron
Cara menyingkat konfigurasi elektron Kedudukan elektron dalam atom
Kedudukan elektron dalam atom Konfigurasi elektron mg
Konfigurasi elektron mg Konfigurasi elektron v
Konfigurasi elektron v Konfigurasi elektron
Konfigurasi elektron Konfigurasi elektron
Konfigurasi elektron Pengertian konfigurasi elektron
Pengertian konfigurasi elektron Konfigurasi bilangan
Konfigurasi bilangan Klasifikasi tari
Klasifikasi tari Menurut bohr elektron-elektron dalam atom
Menurut bohr elektron-elektron dalam atom Konfigurasi yg tepat untuk unsur bernomor atom 38 yaitu
Konfigurasi yg tepat untuk unsur bernomor atom 38 yaitu Hukum oktaf dikemukakan oleh . . . . *
Hukum oktaf dikemukakan oleh . . . . * Sifat sifat unsur dan senyawa periode 3
Sifat sifat unsur dan senyawa periode 3 Ikatan kovalen karbon dan klorin
Ikatan kovalen karbon dan klorin Contoh isotop
Contoh isotop Berikut yang bukan merupakan atom isotop adalah
Berikut yang bukan merupakan atom isotop adalah Tahap kupu kupu
Tahap kupu kupu Makna suku kata
Makna suku kata Kakak membuat program menggunakan bahasa generasi keempat
Kakak membuat program menggunakan bahasa generasi keempat Bahasa pemrograman generasi ke 4
Bahasa pemrograman generasi ke 4 Komponen komputer generasi keempat
Komponen komputer generasi keempat Bahasa pemrograman generasi ke 4
Bahasa pemrograman generasi ke 4 Contoh mesin mealy
Contoh mesin mealy Contoh apresiasi seni teater
Contoh apresiasi seni teater Contoh soal matriks peluang transisi
Contoh soal matriks peluang transisi Kemenangan pribadi dan kemenangan publik
Kemenangan pribadi dan kemenangan publik Berdasarkan gambar mutasi yang terjadi adalah
Berdasarkan gambar mutasi yang terjadi adalah Teori transisi kependudukan
Teori transisi kependudukan