UNSUR SENYAWA CAMPURAN l l l l l















- Slides: 16

UNSUR , SENYAWA & CAMPURAN l l l l l Pengertian unsur , contoh & sifatnya. Aturan penamaan unsur menurut IUPAC Pengertian senyawa & contoh Perbandingan unsur & senyawa Pengertian campuran & contoh Perbandingan senyawa & campuran Pemisahan campuran Penggolongan campuran Menentukan kadar zat dalam larutan Contoh soal & penyelesaiannya

PENGERTIAN UNSUR , CONTOH & SIFATNYA Pengertian unsur : Bagian dari materi yang tidak dapat diuraikan lagi menjadi zat-zat lain secara kimia. Contoh : Emas (Au) , Perak (Ar), Platina (Pt) Sifat-sifat : -Unsur yang sama mempunyai sifat kimia yang sama -Unsur di alam diperoleh dalam keadaan bebas (S , N 2) dan dalam bentuk senyawa (H 2 , O 2 )

ATURAN PENAMAAN UNSUR MENURUT IUPAC Untuk menyamakan pendapat maka IUPAC (International Union of Pure Applied Chemistry ) menetapkan aturan penamaan dan lambang unsur baru sebagai berikut : 1. Nama berakhiran dengan um. 2. Nama berdasarkan nomor atomnya. Nomor atom , angka : 0 = nil 1 = un 2 = bi 3 = tri 4 = quad 5 = pent 6 = heks 7 = sept

PENGERTIAN SENYAWA & CONTOH Pengertian : Gabungan lebih dari satu jenis unsur yang mempunyai sifat tunggal. Contoh : 1. AIR (pelarut) Terdiri 2 jenis unsur yaitu ( H 2 & O 2 Sifat air tidak = sifat H 2 dan O 2 Air dapat mengalami peruraian secara Kimia menjadi H 2 dan O 2.

PERBEDAAN UNSUR DAN SENYAWA Unsur Senyawa Unsur sejenis mempunyai sifat kimia yang sama. • Unsur tidak dapat di uraikan lagi secara kimia menjadi unsur lain. • • Gabungan dua jenis atau lebih yang mempunyai sifat baru ( tunggal ) • Secara kimia senyawa dapat di uraikan menjadi senyawa lain

PENGERTIAN CAMPURAN DAN CONTOH Campuran adalah terbentuknya dari dua zat atau lebih yang masih mempunyai sifat zat yang penyusunnya yang tidak sama. Contoh : 1. Homogen (serba sama ) larutan garam, sirup, kecap 2. Heterogen ( serba neka ) Udara , air laut, tanah, pasir, besi

PERBANDINGAN SEYAWA & CAMPURAN l l l Terdiri dari dua unsur atau lebih Dapat di uraikan menjadi unsur penyusunnya dengan cara kimia Sifat baru yang tunggal dari sifat penyusunnya Perbandingan masa zat penyusunnya tertentu & tetap Pembuatannya membebaskan kalor dengan cara kimia l l l Terdiri dari dua zat atau lebih Mudah di uraikan menjadi unsur penyusunnya kembali dengan cara fisis Sifat dari gabungan sifat penyusunnya Perbandingan masa zat penyusun tidak tertentu Pembuatannya memerlukan kalor dengan cara fisis

PENGGOLONGAN CAMPURAN l 1. Homogen (serba sama) contoh : larutan garam sirup, kecap 2. Heterogen (serba neka) contoh : udara, air laut , tanah, pasir besi

Pemisahan campuran l l l Filtrasi (Penyaringan) Memisahkan dua zat yang berbeda ukuran partikelnya Misal: Zat padat dari zat cair Kristalisasi (Penguapan) Memisahkan zat terlarut dari pelarutnya Misal: Memisahkan garam dari larutan garam Destilasi (penyulingan) Pemisahan zat cair berdasarkan perbedaan titik didihnya Misal: Memisahkan bensin dari minyak bumi Kromatografi Peruraian zat warna oleh pelarutnya Misal: Kertas saring pada pemisahan zat warna dengan tinta Elektrolisa

KADAR ZAT DALAM CAMPURAN Untuk menentukan kadar zat didalam campuran digunakan bermacam satuan: 1. 2. Persen (%) Jumlah gram komponen dalam 100 gram campuiran Masa komponen % massa = x 100 % Massa campuran Bagian per sejuta massa (bpj massa) [ppm massa= bermassa komponen dalam sejuta(106) bagian massa campuran] massa komponen bpj (ppm) massa = x 100 % massa campuran Catatan: % massa = ppm massa x 10 -4 ppm massa = % x 104

Hukum perbandingan tetap (proust) Berdasarkan eksperimennya PROUST mengemukakan bahwa “senyawa tersusun atas unsur-unsur dengan prbandingan massa yang tertentu dan tetap” Contohnya: 1. Air tersusun atas massa H dan massa O dengan perbandingan 1 : 8 2. Besi belerang tersusun atas massa Fe dan massa S dengan prbandingan 7 : 4

MENGETAHUI KOMPOSISI UNs. UR DALAM SENYAWA 1. Berapa massa Hidrogen dan massa Oksigen dalam 900 kg air, jika air tersusun atas massa H massa O dengan perbandingan 1 : 8 ? Jawab : massa H : massa O = 1 : 8 massa air = 900 kg massa H = 1 x 900 kg = 100 kg (1+8) massa O = 900 -100 = 800 kg 2. Massa C : massa O dalam karbon dioksida = 3 : 8. Berapa massa Oksigen yang diperlukan untuk membakar 15 gr karbon agar dihasilkan gas karbon dioksida ? Jawab : massa C : massa O = 3 : 8 15 : massa O = 3 : 8 massa O = 8 x 15 gr = 40 gr 3

CAMPURAN Campuran Homogen ( serba sama ) Contoh : larutan garam Sirop, kecap Heterogen ( serba neka ) Contoh : udara, aqir laut Tanah, pasir besi

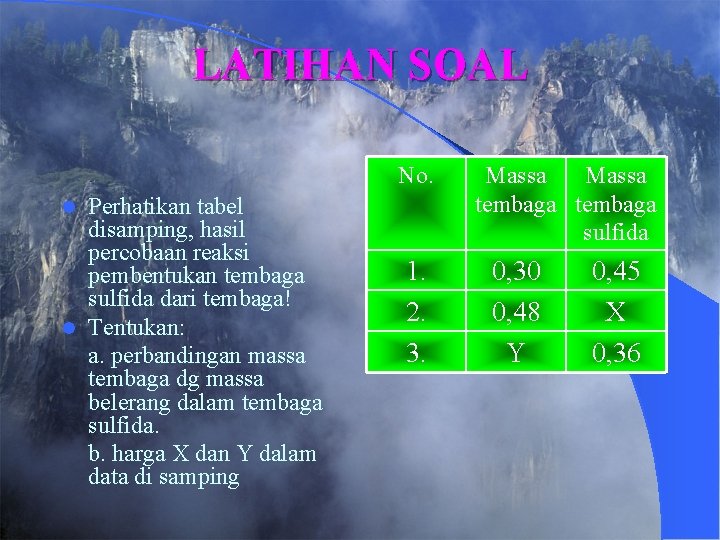
LATIHAN SOAL No. Perhatikan tabel disamping, hasil percobaan reaksi pembentukan tembaga sulfida dari tembaga! l Tentukan: a. perbandingan massa tembaga dg massa belerang dalam tembaga sulfida. b. harga X dan Y dalam data di samping l 1. 2. 3. Massa tembaga sulfida 0, 30 0, 48 Y 0, 45 X 0, 36

SOAL & PENYELESAIANNYA CONTOH l Kelarutan gas CO 2 dalam air pada suhu 20 o. C =0, 5 ppm massa. Ubahlah kelaruitan gas CO 2 tersebut kedalam % massa? l Jawab perubahan ppm massa ke dalam % dapat dihitung sebagai berikut : l % massa = ppm x 10 -4 = 0, 5 x 10 -4 = 0, 00005 Berarti 0. 5 ppm massa = 5 x 10 -5 %

CONTOH SOAL DAN PENYELESAIANNYA l Di dalam 1800 air terdapat 200 gr hidrogen. Berapa % massa hidrogen di dalam air ? Jawab : % massa= massa hidrogen x 100 % massa air = 200 gr x 100 % = 11, 12 % 1800 gr
 Campuran homogen
Campuran homogen Pengertian unsur senyawa dan campuran
Pengertian unsur senyawa dan campuran Perbedaan senyawa hidrokarbon dan senyawa karbon
Perbedaan senyawa hidrokarbon dan senyawa karbon Senyawa hidrokarbon mengandung unsur
Senyawa hidrokarbon mengandung unsur Perbedaan molekul dan campuran
Perbedaan molekul dan campuran Sifat sifat unsur dan senyawa periode 3
Sifat sifat unsur dan senyawa periode 3 Apa perbedaan unsur dan senyawa
Apa perbedaan unsur dan senyawa Ke dalam larutan basa lemah loh ditambahkan padatan garam
Ke dalam larutan basa lemah loh ditambahkan padatan garam Unsur unsur karangan ilmiah
Unsur unsur karangan ilmiah Jika suatu unsur netral mempunyai 2 elektron
Jika suatu unsur netral mempunyai 2 elektron Diagonal ruang balok
Diagonal ruang balok Unsur unsur koperasi
Unsur unsur koperasi Angka kredit anggota pgri
Angka kredit anggota pgri Jelaskan arti wawasan nusantara
Jelaskan arti wawasan nusantara Unsur unsur penilaian kinerja
Unsur unsur penilaian kinerja Unsur unsur prisma segi empat
Unsur unsur prisma segi empat Unsur-unsur
Unsur-unsur